华南理工大学有机化学考前复习重点
有机化学复习 华南理工大学有机化学讲义共32页

55、 为 中 华 之 崛起而 读书。 ——周 恩来
有机化学复习 华南理工大学有机化学 讲义
6
、
露
凝
无
游
氛
,
天
高
风
景
澈
。
7、翩翩新 来燕,双双入我庐 ,先巢故尚在,相 将还旧居。
8
、
Hale Waihona Puke 吁嗟身后
名
,
于
我
若
浮
烟
。
9、 陶渊 明( 约 365年 —427年 ),字 元亮, (又 一说名 潜,字 渊明 )号五 柳先生 ,私 谥“靖 节”, 东晋 末期南 朝宋初 期诗 人、文 学家、 辞赋 家、散
1
0
、
倚
南
窗
以
寄
傲
,
审
容
膝
之
易
安
。
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
华南理工大学大学化学知识点

与元素的分区、周期、族的关系;原子半径的周期性;电 离能的周期性;电子亲和能的周期性;电负性的周期性。 6.理解化学键的本质和类型。 7.掌握价键理论的内容和成键原理,会用价键理论解释共价键的特征。 8.利用杂化轨道理论解释常见分子几何构型。 9.理解分子的极性及判断依据,分子间作用力的类型、特征以及氢键的 本质,会用分子间作用力解释物质性质的变化规律。 10.理解晶体的宏观特性。 11.理解晶体的微观特性,掌握晶体的基本类型和描述晶体的基本参数。 12.掌握晶体的基本类型和各类晶体的特征,能够判断常见物质的晶体类 型。 13.了解物质的其它聚集形态,如非晶体、准晶体、液晶等多种形态。 14.化学反应进度的概念和计算。 15. 热力学第一定律的基本内容。掌握热力学标准态的物理意义和热力 学的一些基本术语。
= 0.799 + 0.059×lg[1.6×10–10]
= 0.221 V
电对中Ag为固体,其浓度[Ag]=1
(3)沉淀对电极电势值的影响
EӨ=0.799 V EӨ=0.221 V
(3)沉淀对电极电势值的影响
E Ө/V
E Ө,
上表中若[氧化型]物质Ag+生成了相同类型的沉淀,沉 淀的Ksp 越小,Ag+ 的平衡浓度也越小,E 值也将变得 越小,Ag+ 的氧化能力降低了,Ag+被稳定了;
(4)配合物的生成对电极电势值的影响
例题 7:EӨ(Ag+/Ag)=0.8 V,
然后根据能斯特方程
华南理工大学有机化学期末复习试卷(含答案)
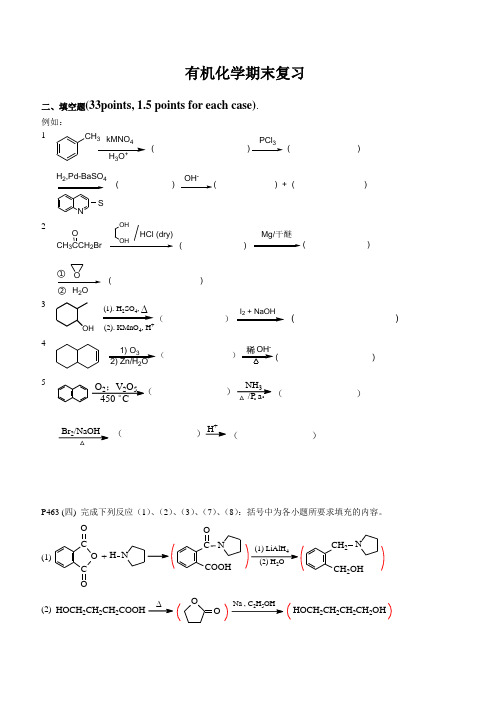
有机化学期末复习二、填空题(33points, 1.5 points for each case). 例如: 1CH 3kMNO43+( )PCl 3( )H 2,Pd-BaSO 4NS( )OH -2CH 3CCH 2BrMg/干醚HCl (dry)OH OHO H 2OO( )( )( )①②3OH(1). H SO ,∆(2). KMnO 4, H+))(41) O 32) Zn/H 2O- )5NH 3/P a Br 2/NaOHH +△△..O 2;V 2O 5 C 。
450( ( )( )( )P463 (四) 完成下列反应(1)、(2)、(3)、(7)、(8):括号中为各小题所要求填充的内容。
(1)C O CO ONH +COOHCON 4(2) H 2OCH 2OHCH 2N(2) HOCH 2CH 2CH 2COOH25∆OOHOCH 2CH 2CH 2CH 2OH(3)CH 2=C COOHCH 3323CH 2=CCOClCH 3CH 2=C COOCH 2CF 3CH 3(7)C NH CO O22COOHNH 2(8)COOHCHOCOClH , Pd-BaSO 3P509,15.15 写出下列季铵碱受热分解时,生成的主要烯烃结构。
P522,15.23 完成下列反应式。
P527,(八) 写出下列反应的最终产物:(1) CH 2ClNaCNLiAlH 4(CH 3CO)2O(CH 2CH 2NHCOCH3)(2)NO Fe, HCl22NO (CH 3)2N )(3)CH 3(CH 2)2CH=CH HBr ROORCN Na CO OH 2O, HO -( CH 3(CH 2)2CH 2CH 2NH 2 )(4)O322N(CH 3)2O)P616,20.2 写出下列反应式中(A )~ (H)的构造式。
三、选择题(反应快慢,鉴别试剂,物质的稳定性,能否发生某种反应等) 例如:P404,11.8 指出下列化合物中,哪个可以进行自身的羟醛缩合。
大学有机化学重点考点

一、系统命名烷烃、烯烃(Z,E命名)、炔烃、醇、醚、酚、酮、羧酸及衍生物、胺、季铵盐及碱等。
烯烃:编号(从靠近双键的一端开始);炔烃:“炔”字放在最后,主链碳数在烯中体现出来。
当从两侧起,双键、叁键处于相同位置时,则应选择使双键的位置较小的编号方式。
芳烃:如果苯环上连接的两个取代烷基不同时,选取最简单碳原子相连的烷基为1位,然后将其它烷基的位次按尽可能小的方向对苯环编号。
二、变化规律有机化合物熔点、沸点的变化规律:芳烃:沸点随相对分子质量的增大而升高。
自由基的稳定性:单原子自由基如CL-,BR- I-取决于电负性和非金属性大小,如越大则越不稳定;有机分子中的自由基稳定性由取代基和分子空间构型决定,如甲基越多越稳定,苯基>CH3->C2H5->NH2->NO2-;空间构型越对称越稳定如:四苯基正碳离子>甲基正碳离子;有电子离域效应的比没有的稳定,如:丙烯基>C2H5-。
碳正离子的稳定性:1.如果连接烷基、H等,由于碳正离子是Sp2杂化,有空的p轨道,会和烷基的C-Hsigma 形成超共轭,进而分散碳正离子的电荷,使之稳定。
所以,连接的烷基越多越稳定,即叔碳正离子>仲碳正离子>伯碳正离子>甲基。
2.如果连接的卤素,以Cl为例,cl的电负性大于c,有吸电子的诱导,同时是2s2 2px2 spy2 2pz,即有未成对电子,有碳正离子是Sp2 杂化,有空的p轨道,cl未成对的电子可以到空轨道上去,则可以分散正电荷,总的效果是使碳正离子更不稳定。
3如果是烯丙型和苄基型的碳正离子,由于p-pai共轭,可以分散电荷,是碳正离子更稳定烯烃及炔烃加氢反应和亲电加成反应速度的变化规律:双键上电子云密度越高则反应越快,即烯烃上若有给电子基团反应迅速,反之电子云密度越低则反应越慢烯烃双键碳原子上连接烷基越多,亲电加成反应的速率越快不同卤代烃亲核取代反应速度的变化规律:伯卤代烃<仲卤代烃<叔卤代烃酚的酸性变化规律:当苯环上带有吸电子基团时,苯酚电离后的苯氧基负离子更稳定,即三硝基苯酚大于二硝基苯酚,大于单硝基苯酚但是必须在邻对位上的,硝基的吸电子性强于卤带基团烷基是供电子基团,使得苯氧基负离子不稳定,难以电离取代基的诱导效应,吸电子基越强,酸性越大。
2024高考化学有机物知识点总结

2024高考化学有机物知识点总结化学是高考理科中的一门重要科目,而有机化学又是化学的重要分支。
掌握好有机化学的知识点对于考取高分至关重要。
下面是对____高考化学有机物知识点的总结,希望对你的复习有所帮助。
第一节烷烃知识点1:烷烃的命名1. 按照碳原子数命名2. 按照分支取代基命名3. 取代基的优先级顺序:取代基个数多的优先级高,相同个数时按字母顺序知识点2:烷烃的性质和反应1. 高熔点、高沸点、不溶于水、与氧气反应有剧烈的燃烧2. 合成醇类:通过卤代烷和水反应生成醇3. 催化裂化制取乙烯:将重质烃在催化剂的作用下分解为轻质烃和乙烯知识点3:烷烃的衍生物1. 烷基:烷烃的一个氢原子被取代基取代2. 卤代烷:烷烃中的一个氢原子被卤素原子取代3. 烷基卤代烷:烷烃中的一个氢原子被卤代烷中的烷基取代第二节烯烃知识点1:烯烃的命名1. 碳原子数多的烯烃命名方法与烷烃相同2. 碳原子数少的烯烃命名方法:前缀+炔烃知识点2:烯烃的性质和反应1. 反应性活泼,容易发生加成反应和聚合反应2. 反应较烷烃活泼,但较炔烃迟钝3. 烯烃的燃烧和加氢反应产生烷烃第三节炔烃知识点1:炔烃的命名1. 碳原子数多的炔烃命名方法与烷烃相同2. 碳原子数少的炔烃命名方法:前缀+炔烃知识点2:炔烃的性质和反应1. 炔烃的燃烧产生大量的热和光2. 炔烃发生卤代反应生成卤代烃3. 炔烃可以通过与水反应生成醇4. 炔烃与卤酸反应生成酸第四节卤代烷知识点1:卤代烷的命名1. 一卤代烷:前缀+卤素原子名+烷2. 多卤代烷:前缀+卤素原子数+烷知识点2:卤代烷的性质和反应1. 反应活泼,容易发生酯化反应、醇化反应等2. 与碱反应:生成对应的醇和碱盐3. 与氨水反应:生成胺类物质第五节醇的基础知识知识点1:醇的命名1. 一元醇命名:前缀+醇2. 多元醇命名:前缀+醇+次级前缀知识点2:醇的性质和反应1. 高沸点、高熔点、易溶于水2. 有醇燃性:在氧气中可燃烧,产生水和二氧化碳3. 醇的酸碱性:可与金属反应生成金属醇盐,可与氢氧化钠反应生成醇盐4. 醇的醚化反应:在酸性条件下,醇可以与醚酸酸化成醚水。
高考有机题必考知识点

高考有机题必考知识点有机化学是高考化学考试中的重点内容,也是考生普遍认为难度较大的一部分。
为了帮助考生更好地复习和应对有机题,下面将列举高考有机题必考的知识点,并进行逐一梳理,以期帮助考生在考试中取得好成绩。
一、有机物命名高考有机题中,通常会涉及有机化合物的命名。
在进行有机物命名时,需要掌握以下几个基本原则:1. 确定主链:找到分子中最长的一条连续的碳链,以该碳链作为主链,并按照碳链上官能团的位置进行编号。
2. 确定官能团:根据分子结构中存在的官能团,进行命名。
常见的官能团有醇、醛、酮、酸等。
3. 选择前缀:根据官能团的种类和位置,选择相应的前缀进行修饰。
4. 选择后缀:根据官能团的种类,选择相应的后缀表示官能团。
5. 确定取代基:如果分子中有取代基,需要对其进行编号和命名。
6. 总结:将以上步骤综合运用,给予有机化合物一个准确、简明的名称。
二、有机反应高考有机题中,也会考察有机反应的特点、类型和具体的反应方程式。
以下为高考有机题中常见的反应类型:1. 加成反应:指多个分子结合形成一个分子的反应。
例如烯烃与卤素的加成反应,生成卤代烷。
反应方程式如下所示:C2H4 + Br2 → C2H4Br22. 消除反应:指一个分子断裂出去形成两个或多个分子的反应。
例如醇的脱水反应,生成烯烃。
反应方程式如下所示:C2H5OH → C2H4 + H2O3. 取代反应:也称为置换反应,指一个原子或基团被另一个原子或基团所取代的反应。
例如烃类的卤代反应,生成卤代烃。
反应方程式如下所示:CH4 + Cl2 → CH3Cl + HCl4. 缩合反应:指两个或多个分子结合形成一个大分子的反应。
例如醛酮的缩合反应,生成β-羟基酮。
反应方程式如下所示: CH3CHO + CH3C OCH3 → CH3C(O)CH2C(O)CH3 + H2O三、有机化合物的性质和应用除了命名和反应,高考有机题还会涉及有机化合物的性质和应用。
以下是一些常见的有机化合物及其性质和应用:1. 烃:烃是由碳和氢组成的化合物,按照分子中碳原子的连接方式可分为直链烃、支链烃和环烃。
有机化学基础复习提纲

有机化学基础复习提纲一、烯烃和炔烃:-C — -C C —1、氧化反应CnH 2n+()O 2nCO 2+nH 2OCnH 2n-2+()O 2nCO 2+(n -1)H 2O②能使溴水和酸性KMnO 4溶液褪色。
2、加成反应:可与H 2 、HX 、 H 2O 、 HCN 加成。
完成下列反应: RCH=CHR /+XRCH CHR /+X 2RCH CHR /+2X与HX 加成时,H 加在含H 较多的C 上。
即马氏规则。
3、加聚反应: nCH 2=CH 2nCH 2=CH-CH=CH 2CH CH + HClnCH 2=CHCl4、结构特点及实验室制取制CH2=CH2的反应原理:同类反应:RCH 2CH 2OHRCH=CH 2 + H 2O制CH CH 的反应原理:同类反应:ZnC 2+2H 2O Zn(OH)2+C 2H 2↑ Mg 2C 3+4H 2O2Mg(OH)2+C 3H 4↑(复分解反应原理,元素化合价不变)原子空间结构特点:与碳碳双键碳直接相连的原子与双键碳在同一个平面上;与碳碳三键直接相连的原子与三键碳在同一条直线上。
5、特殊物质:1,3-丁二烯: CH 2=CH —CH=CH 2 异戊二烯: CH 2=C —CH=CH 2二、苯及其同系物通式:CnH 2n -6 (n ≥6)苯:C 6H 6 正六边形,与苯环直接相连的原子与苯环碳在同一平面内。
性质:1、取代反应:A 、溴代反应:液溴、Fe 作催化剂(或FeBr 3作催化剂)+ Br 2B 、硝化反应:浓HNO 3 浓H 2SO 4 水浴加热+ HNO 3 +3HNO 3注:发生在邻、对位上的取代。
C 、磺化反应:浓硫酸、水浴加热 +H 2SO 4(浓)X 2发生取代反应时,若光照条件则发生在侧链上,若催化条件则发生在苯环上。
+Cl +HCl+Cl 2+HCl2、加成反应(只与H 2 、Cl 2加成) +3H 23、氧化反应:A 、燃烧生成CO 2和H 2OB 、苯不能使酸性KMnO 4溶液褪色,苯的同系物能使KMnO 4/H +褪色,但不能使溴水褪色。
生物化学下册复习提纲重点版(华南理工)

物质代谢(合成代谢、分解代谢):从物质代谢来说,新陈代谢包括分解代谢和合成代谢。
分解代谢——生物大分子通过一系列的酶促反应步骤,转变为教小的、较简单的物质的过程。
合成代谢——生物体利用小分子或大分子的结构元件合成自身生物大分子的过程。
能量代谢:在生物体内,以物质代谢为基础,与物质代谢过程相伴随发生的,是蕴藏在化学物质中的能量转化,统称为能量代谢。
一、名词解释高能磷酸化合物:机体内有许多磷酸化合物,当其磷酰基水解时,释放出大量的自由能。
这类化合物为高能磷酸化合物。
高能键:高能磷酸化合物分子中的酸酐键,能释放出大量自由能,称之为“高能键”。
二、高能磷酸键化合物及其他高能化合物的类型(一)磷氧型1、酰基磷酸化合物(1)乙酰磷酸(2)氨甲酰磷酸(3)1,3-二磷酸甘油酸(4)酰基腺苷酸(5)氨酰腺苷酸2、焦磷酸化合物(1)焦磷酸(2)二磷酸腺苷3、烯醇式磷酸化合物磷酸烯醇式丙酮酸(二)氮磷型胍基磷酸化合物(1)磷酸肌酸(2)磷酸精氨酸(三)硫酯键型活性硫酸基(1)3’-腺苷磷酸5’-磷酰硫酸(2)酰基辅酶A(四)甲硫键型活性甲硫氨酸一、名词解释被动运输:指物质从高浓度的一侧,通过膜运输到低浓度的一侧,物质顺浓度梯度的方向跨膜运输的过程,是不需要消耗代谢能的穿膜运输。
主动运输:指物质逆浓度梯度的穿膜运输过程。
需消耗代谢能,并需专一性的载体蛋白。
协同运输:小分子的跨膜运送大都是通过专一性运送蛋白的作用实现的。
如果只是运输送一种分子由膜的一侧到另一侧,称为单向运输;如果一种物质的运输与另一种物质的运输相关而且方向相同,称为同向运输。
方向相反则称为反向运输,这二者又统称为协同运输。
Na+,K+—泵:Na+、K+-泵实际是分布在膜上的Na+、K+-ATP酶。
通过水解ATP提供的能量主动向外运输Na+,而向内运输K+ 。
每水解1分子ATP,向外运输3个Na+,而向内运输2个K+ 。
Ca+—泵:Ca2+泵即为Ca2+-ATP酶,Ca2+泵主动运送Ca2+到膜内是通过水解ATP提供的能量驱动的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3
(CH3)2C=CHCH3
CH3 R-C = CHCH3
(3)不同活性卤原子被取代的反应。 烯丙基型的卤原子最容易被取代,连接在不饱和碳上的卤原子很难被取代。
卤代烃进行亲核取代反应的同时伴随着消除反应。 P242 卤代烷与AgNO3的EtOH反应活性次序:30>20 >10
(4)卤代烃不同活性氢原子消去的取向反应。 生成哪种主产物,应从主产物的稳定性以及消去的氢的活性上来确定。
芳烃的烷基化及其侧链异构化 NHCOCH3 CH3CH2CH2X NHCOCH3
• 芳环上酰基化反应的应用
AlX3 /△
CH(CH3)2
制备直链烷烃:
O
O
+ CH3CH2CH2CCl AlCl3
CCH2CH2CH3 + HCl
1–苯基–1–丁酮 (86%)
氯甲基化
3
+
(HCHO)3
+
3 HCl
无水ZnCl2 △
7、脂肪醚的合成
RO-Na+ + R’—X R’—OSO2OH
R'--OSO2
ROR’ + NaX ROR’ + NaOSO2OH ROR’ + Na-OSO2
优先不进对攻称取的代环较氧多化的合C物原在子酸:催化下,易于发生具有SN1性质的SN2反应,Nu:
CH3
H+
CH3 C CH2
O
CH3
CH3
OH CH3(CH2)3C CH
烯醇 H
CH3(CH2)3C CH3
金属炔化物的生成及其应用(与NaNH2, RLi, RMgX反应)
HC
NH3(液)
C H + Na NH2
H C C Na + NH3
NaC C Na R Cl NaC C R R Cl R C C R
3、 Diels-Alder反应(双烯合成) 4、芳烃的亲电取代反应(卤代反应、Friedel-Crafts反应、 卤甲基化等)、侧链卤代和氧化
OH
+
K2Cr2O7
稀
H2SO4
△
O
Sarrett试剂
CH3CH=CHCH2OH (C5H5N)2.CrO3/CH2Cl2 CH3CH=CHCOHOOH
或CrO3/丙酮/H2O/H2SO4
Jones试剂 或 C5H5N/CrO3/HCl;CH2Cl2
PCC试剂
或 2C5H5N/H2Cr2O7;CH2Cl2
CH3 R-C-CH2OH
CH3
PCl3 或 SOCl2 /△
CH3 R-C-CH2Cl
CH3
(2)叔卤代烃和β-碳上多支链卤代烃在醇溶液和强碱中加热,都是消除反应。
(CH3)2CCH2CH3
NaCN / EtOH
△
Cl
CH3 R-C-CH2Cl
NaOC2H5/EtOH/△ 或 NaCN /EtOH/△
8、各类有机反应适用条件: 如Grignard试剂的制备条件;Friedel-Crafts反应;cannizarro 以及碘仿反应等的发生条件。 9、各类有机化合物的鉴别方法 如醇、酚、醚、醛酮、胺等的分离鉴别。 Tollens,Fehling试剂;伯仲叔醇,伯仲叔胺等的区分等 10、诱导效应、共轭效应特点及其对化合物性质的影响。
CH2CHCH2CH3 NaOH / EtOH
Cl
△
E2消除:反式共平面消除
CH=CHCH2CH3
XCH2CH=CHCH3
(5)卤离子的交换反应:P241
RCH2Br + NaI
丙酮
SN 2
RCH2I + NaBr
伯卤烃
在丙酮液中与NaI反应的活性: 10 > 20 > 30
格氏试剂的反应
RMgX + HC CR' R'C CMgX
三、完成反应式(每空1分,共24分。 ) 各章节重点反应
1、烯烃的亲电加成反应(马氏规则)、过氧化物效应、 、环氧化反应、α–氢原子的反应
亲电加成:
与卤素加成(用途,Br2/CCl4 鉴别三键与双键的存在) 与HX加成(马氏规则)
反马氏规则:过氧化物效应,与HBr加成 过氧化物:R-O-O-H,R-O-O-R,RCO3H
一 、命名题(每小题1分,共6分)
1、烯烃顺反异构命名 2、多取代苯、多官能团化合物的命名
CH3CH2CH=CHCOOH
3、R/S标记法命名立体异构体
4、醛酮、醇、醚、羧酸、酸酐、酰胺、胺等的命名
CH3OCH2CH3
N,N-二甲基甲酰胺
二、单项选择题(每小题1 分,共20分)
1、自由基、碳正离子,碳负离子稳定性判断。 2、酸碱性比较及影响因素。 3、化合物沸点,水中溶解度比较(氢键的影响)。 4、手性、内消旋体、外消旋体、对映体判断、异同点。 5、芳香性判断。 6、几种基本的反应类型(自由基取代、亲电取代、亲核取代、 亲电加成、亲核加成等)以及反应中间体。 7、各类有机反应活性比较: (1)亲电取代(苯环上卤代、硝化、F-C反应等) (2)亲电加成(烯烃) (3)亲核取代(SN1,SN2) (4)亲核加成(醛酮) (5)D-A反应:环状过渡态
与次卤酸加成(马氏规则,Cl加到含H多的双键碳)
O C C +R C O O H
过氧酸
O
C C + R C OH O
环氧化物 (epoxide)
与水加成
H C
H
C
H H
+
H2O
H2SO4(cat.)
250 °C
CH3CH2OH
催化剂:稀H2SO4, H3PO4,马氏规则
硼氢化பைடு நூலகம்氧化(水解)反应 —制醇
CH3
+
1 2
B2H6
α–氢原子的反应
H CH3 H2O2
OH
H2B H
H CH3 H
HO
(86%)
2、炔烃与水的加成反应、部分加氢
炔烃的水合反应需在硫酸汞的硫酸溶液催化下进行:
(马氏规则, 炔烃加成后发生重排;烯醇式变成酮式)
CH3(CH2)3C CH + H2O
1–己炔
HgSO4 H2SO4
O
H H CO
H(R )
H(R )
H
C
O
回醚流R
C
OMgX
H2O H+
R
C
OH
R
H(R )
H(R )
R
RMgX +
CO R
CH2
醚
CH2 回流
RCH2CH2OMgx
H2O H+
O
RCH2CH2OH
O CO
醚 回流
O
O
RC
OMgX
H2O H+
RC
OH
6、醇的氧化、脱水。 醇羟基被卤代的反应(同卤代烃制法)
3
CH2Cl + 3 H2O
CH2CH3 HC(CH3)2
KMnO4/H+
△
COOH COOH
5、卤代烃的制备方法、与金属有机化合物的反应、消除反应
(1)制备方法:
RCH2OH + HCl
ZnCl2 (无水)/△
RCH2Cl
RCH2OH + NaBr
H2SO4
△
RCH2Br
RCH2Cl + NaI 丙酮 RCH2I
