有机化学复习 华南理工大学有机化学讲义
合集下载
第0讲 实验准备- 华南理工大学有机化学实验讲义

实验室表现 40%
第0章 实 验 准 备Fra bibliotek注意:无因旷课,不
得补作,本次实验成 绩记为0分。
预习报告 20%
实验报告 40%
有机化学实验
第0章 完 End of Part ZERO
第0章 实 验 准 备
谢谢您的认真学习!
前一页
退出
第0章 实 验 准 备
有机化学实验
4.2 实验操作
实验 -自己动手-理想 变成现实
对于初学者,必须首先规规矩矩、认认真真、一丝不苟的 学好实验的操作规程。
在对各种操作已经非常熟练,可以熟能生巧的时候,可以 提出自己的改进意见或想法,经老师批准后,可以改进操 作。没有一成不变理论,也没有一成不变的实验操作。我 本人鼓励大家用于创新,善于创新。
第0章 实 验 准 备
化学实验的安全防护
有机化学实验
第0章 实 验 准 备
防毒
安全用电
防火
安全防护
汞的安全使用
防爆
防灼伤
有机化学实验
仪器的领取与维护
每人在第一次上课时在准备室领取一套玻璃仪器,领取后 应点数,不够需到准备室补齐。 实验过程中应小心使用玻璃仪器,若发生仪器损坏,应及 时到准备室报告并领取新仪器,同时承担部分费用。 每次实验后应清洗干净,并清点仪器交还回准备室,缺损 的需补齐,并承担相应费用。
龙新峰
华南理工大学 化学与化工学院
South China University of Technology School of Chemistry and Chemical
Engineering
Copyright 2014 SCUT
第0章 实 验 准 备
有机化学实验
有机化学复习 华南理工大学有机化学讲义共32页

文 家 。汉 族 ,东 晋 浔阳 柴桑 人 (今 江西 九江 ) 。曾 做过 几 年小 官, 后辞 官 回家 ,从 此 隐居 ,田 园生 活 是陶 渊明 诗 的主 要题 材, 相 关作 品有 《饮 酒 》 、 《 归 园 田 居 》 、 《 桃花 源 记 》 、 《 五 柳先 生 传 》 、 《 归 去来 兮 辞 》 等 。
55、 为 中 华 之 崛起而 读书。 ——周 恩来
有机化学复习 华南理工大学有机化学 讲义
6
、
露
凝
无
游
氛
,
天
高
风
景
澈
。
7、翩翩新 来燕,双双入我庐 ,先巢故尚在,相 将还旧居。
8
、
Hale Waihona Puke 吁嗟身后
名
,
于
我
若
浮
烟
。
9、 陶渊 明( 约 365年 —427年 ),字 元亮, (又 一说名 潜,字 渊明 )号五 柳先生 ,私 谥“靖 节”, 东晋 末期南 朝宋初 期诗 人、文 学家、 辞赋 家、散
1
0
、
倚
南
窗
以
寄
傲
,
审
容
膝
之
易
安
。
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
有机化学复习 华南理工大学有机化学 讲义
6
、
露
凝
无
游
氛
,
天
高
风
景
澈
。
7、翩翩新 来燕,双双入我庐 ,先巢故尚在,相 将还旧居。
8
、
Hale Waihona Puke 吁嗟身后
名
,
于
我
若
浮
烟
。
9、 陶渊 明( 约 365年 —427年 ),字 元亮, (又 一说名 潜,字 渊明 )号五 柳先生 ,私 谥“靖 节”, 东晋 末期南 朝宋初 期诗 人、文 学家、 辞赋 家、散
1
0
、
倚
南
窗
以
寄
傲
,
审
容
膝
之
易
安
。
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
《有机化学》(第四版)华南理工大学课件(共十四章)

H3C
CH3
CC
H
H
C H 3 C H C H C H 3 顺–2–丁烯
2–丁烯
H3C C
H C
H
CH3
反–2–丁烯
反–2–丁烯
顺–2–丁烯 图 3.11 2–丁烯顺反异构体的模型
3.3 烯烃和炔烃的命名
3.3.1 烯基与炔基
C H 2C H
乙烯基 (vinyl)
C H 2C H C H 2 烯丙基(aallllyyllic或group)
一个C-Cσ键和4个C-Hσ键共处同一平面。
构成分子中2个碳4个氢共在一个平面 ,成平面形
分子。
H
H
CC
H H 0.134 nm
H C 。
121
H
。H
118
C H
H
H
C
H
H
图3.4 乙烯的结构
C-Cπ键的形成:垂直于sp2 杂化轨道 所在平面且相互平行的2个p 轨道进行侧面 交盖构成π键。
在π键中,电子云分布在两个C原子 所处平面的上方和下方。
不饱和烃
烯烃 炔烃
含有碳碳重键 的化合物
H H
C
C
H H
H C C H
乙烯
环己烯 乙炔
烯烃的通式:CnH2n 炔烃的通式:CnH2n-2
官能团
CC CC
3.1 烯烃和炔烃的结构
3.1.1 烯烃碳碳双键的组成
基态
激发态
sp2杂化态
2p
2p
2p
电子
跃迁
杂化 sp2
2s
2s
1s
1s
1s
图 3.1 sp2 杂化轨道形成过程示意图
华工有机化学-第九章

1. 醇的工业合成 2. 酚的工业合成 3. 卤代烷或重氮盐的水解 4. 由 Grignard 试剂制备 5. 由烯烃制备 6. 醛、酮、羧酸和羧酸衍生物的还原
有机化学 第九章 醇和酚
12
1. 醇的工业合成
(1) 由合成气合成
CO + 2 H2
CuO-ZnO-Cr2O3 2100~400 ℃ 5~10 MPa
OH NO2
(90%)
此法主要用于硝基酚和氯代酚的生产。
有机化学 第九章 醇和酚 16
(3) 碱熔法(芳基磺化物的亲核取代反应)
SO3H
SO3 H2SO4 ①NaOH, 300℃ ②H3O+
OH
(72%)
CH3
CH3
CH3
此法曾是工业制酚的主要方法, 现用于 其它酚的制备。
SO3H OH
SO3H
OH
一元醇 二元醇 多元醇
R-OH
苯酚 萘酚 蒽酚
2. 酚的分类
一元酚 二元酚 多元酚
4Байду номын сангаас
Ar-OH
有机化学 第九章 醇和酚
醇和酚的命名 (9.1.3)
1. 醇的命名
(a) 普通命名法:用于简单的醇。 烃基的名称 + ―醇”
CH3 CH3
CH3OH
CH2 CHCH2 OH
烯丙醇 (allyl alcohol)
33
2 CH3CH2OH + 2 Na
CH3 2 H3 C C OH + 2 K CH3
2 CH3CH2O Na + H2
CH3 2 H3 C C O K + H2 CH3
NaH, NaNH2, NaOH, KOH
有机化学 第九章 醇和酚
12
1. 醇的工业合成
(1) 由合成气合成
CO + 2 H2
CuO-ZnO-Cr2O3 2100~400 ℃ 5~10 MPa
OH NO2
(90%)
此法主要用于硝基酚和氯代酚的生产。
有机化学 第九章 醇和酚 16
(3) 碱熔法(芳基磺化物的亲核取代反应)
SO3H
SO3 H2SO4 ①NaOH, 300℃ ②H3O+
OH
(72%)
CH3
CH3
CH3
此法曾是工业制酚的主要方法, 现用于 其它酚的制备。
SO3H OH
SO3H
OH
一元醇 二元醇 多元醇
R-OH
苯酚 萘酚 蒽酚
2. 酚的分类
一元酚 二元酚 多元酚
4Байду номын сангаас
Ar-OH
有机化学 第九章 醇和酚
醇和酚的命名 (9.1.3)
1. 醇的命名
(a) 普通命名法:用于简单的醇。 烃基的名称 + ―醇”
CH3 CH3
CH3OH
CH2 CHCH2 OH
烯丙醇 (allyl alcohol)
33
2 CH3CH2OH + 2 Na
CH3 2 H3 C C OH + 2 K CH3
2 CH3CH2O Na + H2
CH3 2 H3 C C O K + H2 CH3
NaH, NaNH2, NaOH, KOH
第6章立体化学 华南理工大学有机化学讲义

(specific rotation)
旋光度;
PB:质量浓度 (g/ml); l:样品管长
6/4/2014 11:17 P度M (dm);
在一定温度和波长条件下, 样品管长度为1dm,样品浓度
为1g・ml-1时测得的旋光度,
是一物理常数.
t:温度;力波长,
钠光:D, 589nm
普6.3手性分子的性质
具有相同的分子构造,但构型不同,互为镜像不能重合的 两种构型的异构体称为对映异构体。
•凡是手性分子,必有互为镜象的构型.分子的手性是存在对 映体的必要和充分条件.
• 一对对映体的构造相同,只是立体结构不同,旦呈镜像关系, 这种立体异构就叫对映异构.如乳酸是手性分子,故有对映 体存在:
6/4/2014 11:17 PM
第六章立体化学
以三维空间研究分子结构和性质的科学
-分子中原子或基团在空间的排列状况 -不同的排列对分子性质的影响
主要内容 ♦立体异构体、旋光性 ♦手性分子和非手性分子、手性碳 ♦对映异构体和非对映异构体 ♦立体结构的表示方法、命名
第六章立体化学
、异构体的分类 ―►碳架异构
f构造异构
高題相顺序分子式,
F Cl
Cl
非手性分子
Br
Q"
Cl Br
两者完 全重合
Br Cl
Cl Br
手性分子是不对称分子;非手性分子是对称分子。
6/4/2014 11:17 PM
6.2手性和对称性
1-氟氟-1-氯甲烷为非手性分子
图6.4 1_氟_1一氯甲烷分子模型示意图
6/4/2014 11:17 PM
6.2手性和对称性
(2)对映异构
6/4/2014 11:17 PM
旋光度;
PB:质量浓度 (g/ml); l:样品管长
6/4/2014 11:17 P度M (dm);
在一定温度和波长条件下, 样品管长度为1dm,样品浓度
为1g・ml-1时测得的旋光度,
是一物理常数.
t:温度;力波长,
钠光:D, 589nm
普6.3手性分子的性质
具有相同的分子构造,但构型不同,互为镜像不能重合的 两种构型的异构体称为对映异构体。
•凡是手性分子,必有互为镜象的构型.分子的手性是存在对 映体的必要和充分条件.
• 一对对映体的构造相同,只是立体结构不同,旦呈镜像关系, 这种立体异构就叫对映异构.如乳酸是手性分子,故有对映 体存在:
6/4/2014 11:17 PM
第六章立体化学
以三维空间研究分子结构和性质的科学
-分子中原子或基团在空间的排列状况 -不同的排列对分子性质的影响
主要内容 ♦立体异构体、旋光性 ♦手性分子和非手性分子、手性碳 ♦对映异构体和非对映异构体 ♦立体结构的表示方法、命名
第六章立体化学
、异构体的分类 ―►碳架异构
f构造异构
高題相顺序分子式,
F Cl
Cl
非手性分子
Br
Q"
Cl Br
两者完 全重合
Br Cl
Cl Br
手性分子是不对称分子;非手性分子是对称分子。
6/4/2014 11:17 PM
6.2手性和对称性
1-氟氟-1-氯甲烷为非手性分子
图6.4 1_氟_1一氯甲烷分子模型示意图
6/4/2014 11:17 PM
6.2手性和对称性
(2)对映异构
6/4/2014 11:17 PM
华南理工大学有机化学第5章-2
30%
69%
1%
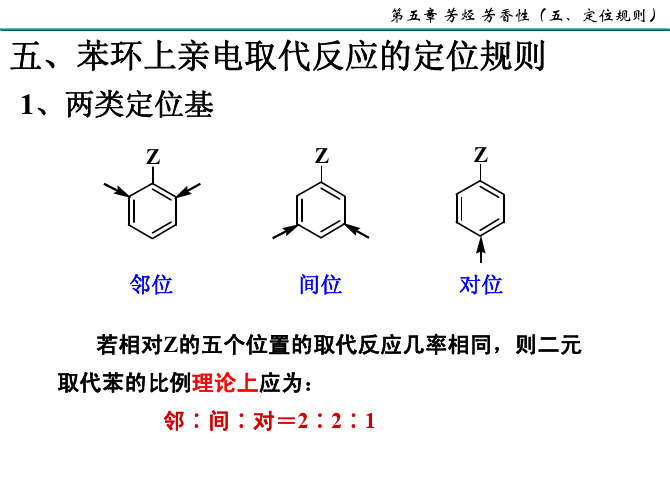
第五章 芳烃 芳香性(五、定位规则)
(2) 第二类定位基(间位定位基)
对苯环有吸电子作用,使苯环钝化,对后引入基团进入苯环 起着间位定位作用的原子或基团,称为间位定位基。 第二类定位基和定位能力 : -CF3 ―N (CH3)3+ > ―NO2 > ―CN > ―SO3H > ―CHO > -COCH3 > ―COOH > ―COOR > ―CONH2 >―NH3+等. 符合下列条件之一的为间位定位基: 1、与苯环直接相连的原子不饱和的基团或原子(-CX3例外)。 2、与苯环直接相连的原子带有正电荷的基团。 3、对苯环有吸电子性能,使苯环钝化的原子或基团。
+
σ
.... 配合 物 . ..+ ..... I
H E
[
H E
NO2
+
Ib
---Ic
+
H E
]
NO2
NO2
NO2
+
NO2
σ
配合物
....... . .+. H E
Ⅱ
[
+
]
H E
Ⅱa
H E
b
---Ⅱ
H E
H E
Ⅱc
NO2
NO2 H E
NO2 H E
+
NO2
+
σ
配合 物
...... . ...+ ..
NHCOCH3
δ
δ
Cl , Br , I δ 烷基C-Hσ键与苯环存在 σ,π-共轭。
H δ H C H δ
δ
第五章 芳烃 芳香性(五、定位规则)
【华南理工考研 有机化学】05 烯烃
ΔHohydrog=-120kJ/mol
21
Xiezx
5.2、烯烃的物理性质
-Lzu
比较烯烃的燃烧热和氢化热,得出不同碳原子数和不同碳 架的烯烃的相对稳定性为:
R2C=CR2 > R2C=CHR > RCH=CHR >RCH=CH2 >CH2=CH2
影响烯烃稳定性的因素: 1。超共轭效应:σ-π共轭 2。键的强度:与成键原子的杂化状态有关
2。醇失水生成的烯烃有顺反异构体时,主要生成E-型产物
3。二者都符合扎依采夫规则;
4。醇脱水反应是可逆的,双键易移位或者发生重排反应;
P2O5 .
24
4
Xiezx
5.3 烯烃的来源和用途
-Lzu
卤代烷和醇发生E1反应的异同点
相同点
*1、3oRX > 2oRX > 1oRX
3oROH > 2oROH > 1oROH
-Lzu
1、烯烃的相对稳定性:
1。测定顺反烯烃在光照或加热平衡转化时各自的含量;
H
CH3
CC
H3C
H
76%
或 hν H3C
CH3
CC
H
H
24%
2。计算两个异构体 的能量;
空间位阻使得顺式能 量较反式低2.8kJ/mol
HH
HC
C
H
H
C CH
HH
HH
HC
C
H
HH CH
C H
20
Xiezx
5.2、烯烃的物理性质
第五章
烯烃(Alkene)和二烯烃
Xiezx
内容
-Lzu
(一)烯烃
5.1、烯烃的概念、结构、和命名
13《有机化学》(第四版)高鸿宾,华南理工大学课件(共十四章)
H2SO4 93%
N
O C
Cl
苯甲酰氯
O 2 (CH3CO)2O + HO
O OH OH O O + CH3COCCH3
OH
O CH3C O + 2 CH3COOH
O
O O CCH3
吡啶
OH + CH3COO OCCH3
水杨酸
阿司匹林
O
酯
醇
O
酯
酯交换反应
H+, 94%
CH2 CH C
OCH3 + CH3CH2CH2CH2OH
本章小结: 1、羧酸衍生物的命名──酰卤和酰胺以所含酰基 结构命名;酸酐、酯是根据来源的酸和醇命 名。 2、羧酸衍生物酰基上的亲核取代反应活性由快到 慢是: 水解 > 醇解 > 氨解 酰卤 > 酸酐 > 酯 > 酰胺 3、酰胺与Br2 / NaOH(或NaOBr)作用发生 Hofmann降解反应,用于合成伯胺。
第十三章 羧酸衍生物(待改写)
13.1 羧酸衍生物的命名 13.2 羧酸衍生物的物理性质 13.3 羧酸衍生物的波谱性质 13.4 羧酸衍生物的化学性质 13.4.1 酰基上的亲核取代反应 (1)水解 (2) 醇解 (3) 氨解 13.4.2 酰基上的亲核取代反应机理 13.4.3 羧酸衍生物的相对反应活性
CH3(CH2)7CH CH(CH2)7COOC2H5
Na,C 2H5OH 50%
油酸乙酯
CH3(CH2)7CH CH(CH2)7CH2OH
油醇
工业上制备不饱和醇的唯一途径 (3) Rosenmund 还原 酰氯 H2 催化剂:Pd–BaSO4 醛
COCl
H2,Pd-BaSO4, 150℃,79% -S N
N
O C
Cl
苯甲酰氯
O 2 (CH3CO)2O + HO
O OH OH O O + CH3COCCH3
OH
O CH3C O + 2 CH3COOH
O
O O CCH3
吡啶
OH + CH3COO OCCH3
水杨酸
阿司匹林
O
酯
醇
O
酯
酯交换反应
H+, 94%
CH2 CH C
OCH3 + CH3CH2CH2CH2OH
本章小结: 1、羧酸衍生物的命名──酰卤和酰胺以所含酰基 结构命名;酸酐、酯是根据来源的酸和醇命 名。 2、羧酸衍生物酰基上的亲核取代反应活性由快到 慢是: 水解 > 醇解 > 氨解 酰卤 > 酸酐 > 酯 > 酰胺 3、酰胺与Br2 / NaOH(或NaOBr)作用发生 Hofmann降解反应,用于合成伯胺。
第十三章 羧酸衍生物(待改写)
13.1 羧酸衍生物的命名 13.2 羧酸衍生物的物理性质 13.3 羧酸衍生物的波谱性质 13.4 羧酸衍生物的化学性质 13.4.1 酰基上的亲核取代反应 (1)水解 (2) 醇解 (3) 氨解 13.4.2 酰基上的亲核取代反应机理 13.4.3 羧酸衍生物的相对反应活性
CH3(CH2)7CH CH(CH2)7COOC2H5
Na,C 2H5OH 50%
油酸乙酯
CH3(CH2)7CH CH(CH2)7CH2OH
油醇
工业上制备不饱和醇的唯一途径 (3) Rosenmund 还原 酰氯 H2 催化剂:Pd–BaSO4 醛
COCl
H2,Pd-BaSO4, 150℃,79% -S N
华南理工大学本科生《有机化学》课件第1章
这种影响沿分子链静电诱导地传递下去:
δδδ δδ
4CH3 3CH2 2CH2
δ
C1 H2
δ
Cl
(-I)
CH3-δCδδH2-δCδH2-Cδ H2-O (+I)
诱导效应产生的原因—成键原子的电负性不同。 诱导效应的传递—逐渐减弱,传递不超过五个原子。
1.4.3 共价键的断裂和有机反应的类型
有机反应:
1.6.1 Brø nsted 酸碱理论
1.6.2 Lewis 酸碱理论 1.6.3 硬软酸碱原理 1.7 有机化合物的分类 1.8 有机化合物的研究程序
1.1 有机化合物和有机化学
有机化合物的组成
基本元素:C 其它元素: H, N, O, X, S, P, Si 等
有机化合物为碳氢化合物及其衍生物
表示组成分子的原子种类和数目
C2H6O
CH3CH2OH CH3OCH3
乙醇 二甲醚
分子结构式 ——表示分子中原子连接的顺序
表示方式: 短线式 缩简式 键线式
H HC H
H
CH3CH2CH2CH3
O
1.4 共价键
有机化合物中典型的化学键:共价键 有机化合物的共同结构特征:共价键结合
1.4.1 共价键的形成 离子键的形成:
与另一个分子带有部分负电荷的一端之间 的吸引作用。
H-Cl H-Cl + -+ -
+ - H-Cl - + Cl-H
极性分子之间的一种相互作用
1.5.2 van der Waals 力 van der Waals (范德华)力:
非极性分子之间存在的吸引力
- + - + - + -+
+ - + - +- + -
极性共价键: 不同的原子成键时,由于原子的电负性
δδδ δδ
4CH3 3CH2 2CH2
δ
C1 H2
δ
Cl
(-I)
CH3-δCδδH2-δCδH2-Cδ H2-O (+I)
诱导效应产生的原因—成键原子的电负性不同。 诱导效应的传递—逐渐减弱,传递不超过五个原子。
1.4.3 共价键的断裂和有机反应的类型
有机反应:
1.6.1 Brø nsted 酸碱理论
1.6.2 Lewis 酸碱理论 1.6.3 硬软酸碱原理 1.7 有机化合物的分类 1.8 有机化合物的研究程序
1.1 有机化合物和有机化学
有机化合物的组成
基本元素:C 其它元素: H, N, O, X, S, P, Si 等
有机化合物为碳氢化合物及其衍生物
表示组成分子的原子种类和数目
C2H6O
CH3CH2OH CH3OCH3
乙醇 二甲醚
分子结构式 ——表示分子中原子连接的顺序
表示方式: 短线式 缩简式 键线式
H HC H
H
CH3CH2CH2CH3
O
1.4 共价键
有机化合物中典型的化学键:共价键 有机化合物的共同结构特征:共价键结合
1.4.1 共价键的形成 离子键的形成:
与另一个分子带有部分负电荷的一端之间 的吸引作用。
H-Cl H-Cl + -+ -
+ - H-Cl - + Cl-H
极性分子之间的一种相互作用
1.5.2 van der Waals 力 van der Waals (范德华)力:
非极性分子之间存在的吸引力
- + - + - + -+
+ - + - +- + -
极性共价键: 不同的原子成键时,由于原子的电负性
有机化学复习华南理工大学有机化学讲义
14.烯烃的环氧化反应。
15.烯炷a-氢的氯代和漠代反应。(烯烃a■氢的卤代与双键加成反应条件不同)
16.金属炔化物的生成及其在增长碳链上的应用。
17.烯烃、炔烃的鉴别方法。
7
第四章二烯烃共轭体系共振论1. 二烯烃的共轭结构及Z, E—命名。2. n-n共轭效应和超共轭效应的定义;n-n共轭与超共轭效 应结构与体系稳定性的关系及其应用。(应用: n-n共轭效应和 超共轭效应与分子结构稳定性的关系、与碳正离子稳定性的关系、与自 由基稳定性的关系上和在反应中间体能量以及反应取向方面上的应用)。3. 二烯炷的双烯合成即Diels-Alder反应及其在合成环状化 合物上的应用。4. 双烯合成反应的活性比较。(双烯体共轭碳上有给电子 基、亲双烯体有吸电子基时双烯合成反应的活性增大)
18
8.醛、酮与Wittig试剂反应及其在定位合成烯烃上的应用。
9.甲基酮的卤仿反应及其在鉴别甲基酮和降低碳链合成上的
酮
应用。 (P399—401)10・醛、酮的羟醛缩合反应在增长碳链上的应用。
11.醛的弱氧化在醛的鉴别和合成不饱和羧酸上的应用。
钊
12.醛、酮在不同条件下的还原(尤其:用金属氢化物还原)
5
第三章 不饱和烃:烯烃和炔烃1. 碳-碳双键、碳-碳三键的组成以及兀键的特性。2. 烯烃、炔烃的命名;烯烃的顺反异构;Z,E-命名法。3. 炔烃的部分加氢(注意区分顺位部分加氢和反位部分加氢的条 件或试剂)。4. 烯炷、快炷的亲电加成及其应用;不同结构的烯烃亲电加成活 性的比较(烯烃中被亲电试剂进攻的不饱和碳上电子密度越高 或越容易生成稳定碳正离子的烯烃,亲电加成活性越大)5. 烯烃亲电加成反应机理。亲电加成历程产生的中间体是什么?6. 亲电加成反应规律(MalKovniKov规律)。7. 烯烃、炔烃与HBr的过氧化物效应加成及其规律。(惟一只 有漠化氢才能与烯煙、炔烃存在过氧化物效应,其它卤化氢不 存在过氧化物效应。)
15.烯炷a-氢的氯代和漠代反应。(烯烃a■氢的卤代与双键加成反应条件不同)
16.金属炔化物的生成及其在增长碳链上的应用。
17.烯烃、炔烃的鉴别方法。
7
第四章二烯烃共轭体系共振论1. 二烯烃的共轭结构及Z, E—命名。2. n-n共轭效应和超共轭效应的定义;n-n共轭与超共轭效 应结构与体系稳定性的关系及其应用。(应用: n-n共轭效应和 超共轭效应与分子结构稳定性的关系、与碳正离子稳定性的关系、与自 由基稳定性的关系上和在反应中间体能量以及反应取向方面上的应用)。3. 二烯炷的双烯合成即Diels-Alder反应及其在合成环状化 合物上的应用。4. 双烯合成反应的活性比较。(双烯体共轭碳上有给电子 基、亲双烯体有吸电子基时双烯合成反应的活性增大)
18
8.醛、酮与Wittig试剂反应及其在定位合成烯烃上的应用。
9.甲基酮的卤仿反应及其在鉴别甲基酮和降低碳链合成上的
酮
应用。 (P399—401)10・醛、酮的羟醛缩合反应在增长碳链上的应用。
11.醛的弱氧化在醛的鉴别和合成不饱和羧酸上的应用。
钊
12.醛、酮在不同条件下的还原(尤其:用金属氢化物还原)
5
第三章 不饱和烃:烯烃和炔烃1. 碳-碳双键、碳-碳三键的组成以及兀键的特性。2. 烯烃、炔烃的命名;烯烃的顺反异构;Z,E-命名法。3. 炔烃的部分加氢(注意区分顺位部分加氢和反位部分加氢的条 件或试剂)。4. 烯炷、快炷的亲电加成及其应用;不同结构的烯烃亲电加成活 性的比较(烯烃中被亲电试剂进攻的不饱和碳上电子密度越高 或越容易生成稳定碳正离子的烯烃,亲电加成活性越大)5. 烯烃亲电加成反应机理。亲电加成历程产生的中间体是什么?6. 亲电加成反应规律(MalKovniKov规律)。7. 烯烃、炔烃与HBr的过氧化物效应加成及其规律。(惟一只 有漠化氢才能与烯煙、炔烃存在过氧化物效应,其它卤化氢不 存在过氧化物效应。)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(旋光方向、比旋光度、化学活性不同,其余均相同)
12
顺反异构顺反异构的判断:
① 有限制C-C键旋转的因素。
② 同碳连有不相同的原子或原子团。
1. 1,2-二氯丙烯有无顺反异构,若有,用Z、E构型命名。
Z-1,2-二氯丙烯
E-1,2-二氯丙烯
2.判断2-甲基-1-氯-1-丙烯有无顺反异构,若有,用Z、E 构型命名。
酮的鉴别和分离。
18
8.醛、酮与Wittig试剂反应及其在定位合成烯烃上的应用。 应9.甲用基。酮(的P3卤99仿—反40应1)及其在鉴别甲基酮和降低戸F酮碳■ 链合成上的 10・醛、酮的羟醛缩合反应在增长碳链上的应用。
11.醛的弱氧化在醛的鉴别和合成不饱和羧酸钊上的应用。
12.醛、酮在不同条件下的还原(尤其:用金属氢化物还原)
制备);酚的制法。
3.醇的物理性质。(注意氢键的形成与物理性质之间的关系)。 4.醇和酚的酸性比较。(尤其比较酚的酸性必须注意:酚羟基
的邻、对位上有吸电子基时酸性加强;酚羟基的间位上有供 电子基时 酸性减弱)。
5.醇醚、酚醚、醇酯、酚酯的生成反应。 6.醇在不同条件下的氧化(P339—341)和脱氢(P341)反 应。(尤
其是弱氧化条件下制备醛酮的反应)
16
7. 卤代烃的生成反应(注意醇与不同氢卤酸反应的活性比 较)。
哪些醇与氢卤酸反应容易发生重排反应生成重排的 卤代炷?醇与哪 些试剂反应不会发生重排反应得到相应的 卤代炷?
8. 六碳以下的醇的鉴别方法。(Lucas试剂) 9. 醇的脱水反应(醇在浓H2SO4中的分子内脱水按El历 程进行,得
c.五元以上环的环烃,无此反应。 注:环烷烃虽可加成但不能被一般氧化剂氧化,如KMnO4。
烯烃8 a. H2SO4,室温下烯烃溶于浓硫酸。(除去烷烃中的烯烃) b. Br2-CCl4溶液,室温下烯烃使其褪色。 c. KMnO4酸性溶液,室温下烯烃使其褪色。 d. 共轭二烯烃除用上述方法外,可加顺丁烯二酸酐在
CH3C=CHCl
2-甲基-1-氯-1-丙烯的构造式为:
CH3
其中一个双键碳上连有相同两个甲基,故没有顺反异构。
13
第七章卤代烃相转移催化反应
1・卤代烃、卤代烯烃、卤代芳烃的系统命名。 2. 卤代烃的制法。 3. 何谓亲核取代反应? (SN2反应中:正电中心碳上正电荷 越集中、
空间阻碍越小,反应活性越大;SN1反应中:越易 生成稳定碳正离子的 卤代烃,SN1反应活性越大)
第五章芳烃芳香性
1. 多取代苯的命名。 2. 何谓亲电取代?亲电取代反应的活性比较一一芳环上电子
密度越高,亲电取代活性愈大。
3. 芳烃可以与哪些试剂进行亲电取代反应?反应活性如何? 磺化反应
是可逆反应,在合成上的应用。烷基化、 酰基化、氯甲基化的特点及应用?
4. 煙侧链上a-碳上的卤代及其与芳环上卤代反应的区别。 5. 芳炷的侧链氧化。(侧链a-碳上有a-H时才被氧化) 6. 邻、对位定位基和间位定位基的区分及其定位活性(定位
2. 共价键断裂方式,在有机反应中常见有哪几类?
其稳定性次序如何?
3. 诱导效应的概念。 4. 酸碱的概念。
4
第二章饱和烃:烷烃和环烷烃
1. 烷烃、脂环烃的命名;。 2. 烷烃发生取代反应是什么历程?(自由基型取代) 3. 烷炷发生取代反应时,卤素的反应活性、选择性;烷炷反 应活性
(不同H被取代活性)及自由基的稳定性。 4. 脂环炷的取代反应。 5. 脂环炷的环的大小与开环加成活性关系。 6. 取代环丙烷的开环加成规律°(P58) 7. 环烯烃的兀键加成与a-氢的卤代反应区别。
的应用。
7.不同结构的胺与亚硝酸反应的区别,及其在鉴别不同胺
上的应用。
21
9. 芳胺环上的卤代在鉴别芳胺上的应用。 10. 降低氨基活性、保护氨基的方法;芳胺环上在氨基邻 位、间位、
对位硝化或引入卤原子的方法。(P5来自5)11. 季铉碱的分解反应及其分解规律(Hofmann规则) 或分解取
向。
12. 重氮化合物和偶氮化合物的区分和命名。 13. 重氮化合物的制法。
O
13.醛、 酮 的Clemmensen还原法和Wolff-Kishner—黄鸣龙
还原法及其应用。
14. Cannizzaro 反应。
19
第十二、十三章 羧酸及羧酸衍生物
1. 羧酸及羧酸衍生物的命名。 2. 羧酸的制法(醇、醛氧化制备;腈水解制备;Grignard试剂与CO2
2. 羧酸的酸性强弱比较及影响因素。
(烯烃a■氢的卤代与双键加成反应条件不同) 16.金属炔化物的生成及其在增D匕 长碳链上的应用。 17.烯烃、炔烃的鉴别方法。 l=i
7
第四章二烯烃共轭体系共振论
1. 二烯烃的共轭结构及Z, E—命名。 2. n-n共轭效应和超共轭效应的定义;n-n共轭与超共轭效 应结构与体
系稳定性的关系及其应用。(应用: n-n共轭效应和 超共轭效应与分子结
。
3. 亲核加成反应活性比较(羰基碳上正电性越明显、空间阻 碍作用越
小,亲核加成反应的活性就越大)。
4. 醛、酮与NaHSOa、与HCN的亲核加成及其应用。
5. 醛、酮与醇的加成反应及其在保护羰基上的应用。 6. 醛、酮与金属有机试剂加成及其在合成上的应用。 7. 醛、酮的鉴别分离方•——与饱和NaHSO3反应 (P388—384)、与氨的衍生的加成缩合(P395—397) 用于醛、
5
第三章 不饱和烃:烯烃和炔烃
1. 碳-碳双键、碳-碳三键的组成以及兀键的特性。
2. 烯烃、炔烃的命名;烯烃的顺反异构;Z,E-命名法。
3. 炔烃的部分加氢(注意区分顺位部分加氢和反位部分加氢的条 件或试剂)。 4. 烯炷、快炷的亲电加成及其应用;不同结构的烯烃亲电加成活 性的比较(烯烃中被亲电试剂进攻的不饱和碳上电子密度越高 或 越容易生成稳定碳正离子的烯烃,亲电加成活性越大) 5. 烯烃亲电加成反应机理。亲电加成历程产生的中间体是什么? 6. 亲电加成反应规律(MalKovniKov规律)。 7. 烯烃、炔烃与HBr的过氧化物效应加成及其规律。(惟一只 有漠化氢才能与烯煙、炔烃存在过氧化物效应,其它卤化氢不 存在过氧化物效应。)
用于合成Grignard试剂?
16. 双键位置对卤原子活泼性的影响(哪些卤代烃的卤原子
是 活泼的?哪些卤代烃的卤原子是不活泼的?原因是什
么?)。
(P272—286)
15
第九章醇和酚
1. 醇和酚的命名。 2. 醇的制法(烯烃水合法、硼氢化一氧化水解法;卤代炷水解
法;Grignard试剂与醛、酮反应;由醛、酮、羧酸酯还原羧■r 8’:
14. 重氮盐的重氮基被氢原子取代(作为去硝基、去氨基 的反应)
及其在反定位规律合成上的应用。
15. 重氮盐的重氮基被羟基、卤原子、氰基取代的反应及 其在合成
上的应用。
16. 重氮化合物的偶合反应。
22
烷烃的鉴别8 a.三元环的环烃,可使Br2-CCl4溶液在室温下褪色。
b.四元环的环烃,在加热条件下可使Br2-CCl4溶液在室温下褪 色。
到重排产物为主;醇在什么条件下的分子内脱 水不发生重排?)。
10. 酚的一元、二元、三元卤代。 11. 酚的鉴别方法。
17
第十^一章醛、酮和醌
1. 醛、酮及其取代衍生物的命名。 2 . 醛 、 酮 的 制 备 方 法 ( 由 伯 、 仲 醇 氧 化 制 醛 酮 P340-341 ; 醇 经 O
ppenauer氧化制备醛、酮P382;羧酸衍生物的还原 制备醛、酮P382)
加热进行双烯合成,实验现象:加入的粉末固体溶解后,产 生晶 体状固体(环状加成产物)。
23
炔烃8 a. Br2-CCl4溶液,室温下快烃使其褪色。但反应速度比烯烃慢。 b. KMnO4酸性溶液,室温下快烃使其褪色。但反应速度比烯 烃 慢。 c. H2O,HgSO4/H2SO4,其与快烃的反应产物醛或酮,再用 鉴别 羰基的方法进行。 d. 属于快烃中的末端快,可用Ag(NH3)2 +或Cu (NHj2+鉴别。
6. 酰胺的脱水在合成腈的应用和Hofmann降解反应及其在降低碳链
合成胺的应用。
20
第十五章有机合氮化合物
1.硝基化合物在酸性条件下的还原;用含硫化合物的还原; 催化加氢
还原。
2.硝基对其邻、对位酚羟基和羧基酸性的影响。 3•胺的命名; 4.胺的制备方法(由腈、酰胺的还原;由酰胺降解;
Gabriel合成法;由硝基化合物还原制备)。 5•胺的结构与其碱性强弱的关系(碱性强弱比较)。 6.胺与酰卤、酸酐的酰基化反应和磺酰化及其在鉴别胺和 分离胺上
4. 卤代炷可与哪些试剂发生亲核取代反应?这些反应各有哪 些应用? 5. 哪些反应可用于卤代炷的鉴别(卤代烃如何鉴别)?各类 卤代炷与 AgNO3-C2H5OH反应速度快慢规律?(硝酸银的氨 溶液能鉴别哪几类
物质?)
6. 亲核取代反应历程(SN2和SN1机理要熟悉)及其特点。 7. 什么叫瓦尔登构型转化?夕卜消旋化? (SN1:外消旋化的 同时构
构稳定性的关系、与碳正离子稳定性的关系、与自 由基稳定性的关系上和 在反应中间体能量以及反应取向方面上的应用)。
3. 二烯炷的双烯合成即Diels-Alder反应及其在合成环状化 合物上的应
用。
4. 双烯合成反应的活性比较。(双烯体共轭碳上有给电子 基、亲双烯
体有吸电子基时双烯合成反应的活性增大)
8
手性碳的化合物是否是手性分子?有手性的化合 物构型与旋光方向是否一 致?手性、旋光性与分子结构有什 么关系?
3. 含一个手性碳旋光物的构型确定和R/S一命名。 4. 对映体、非对映体、外消旋体、内消旋体的定义。 5. 对映体、非对映体、夕卜消旋体、内消旋体、同一物的判断方法。 6. 对映体、非对映体之间的物理性质和化学性质有哪些异同点?
12
顺反异构顺反异构的判断:
① 有限制C-C键旋转的因素。
② 同碳连有不相同的原子或原子团。
1. 1,2-二氯丙烯有无顺反异构,若有,用Z、E构型命名。
Z-1,2-二氯丙烯
E-1,2-二氯丙烯
2.判断2-甲基-1-氯-1-丙烯有无顺反异构,若有,用Z、E 构型命名。
酮的鉴别和分离。
18
8.醛、酮与Wittig试剂反应及其在定位合成烯烃上的应用。 应9.甲用基。酮(的P3卤99仿—反40应1)及其在鉴别甲基酮和降低戸F酮碳■ 链合成上的 10・醛、酮的羟醛缩合反应在增长碳链上的应用。
11.醛的弱氧化在醛的鉴别和合成不饱和羧酸钊上的应用。
12.醛、酮在不同条件下的还原(尤其:用金属氢化物还原)
制备);酚的制法。
3.醇的物理性质。(注意氢键的形成与物理性质之间的关系)。 4.醇和酚的酸性比较。(尤其比较酚的酸性必须注意:酚羟基
的邻、对位上有吸电子基时酸性加强;酚羟基的间位上有供 电子基时 酸性减弱)。
5.醇醚、酚醚、醇酯、酚酯的生成反应。 6.醇在不同条件下的氧化(P339—341)和脱氢(P341)反 应。(尤
其是弱氧化条件下制备醛酮的反应)
16
7. 卤代烃的生成反应(注意醇与不同氢卤酸反应的活性比 较)。
哪些醇与氢卤酸反应容易发生重排反应生成重排的 卤代炷?醇与哪 些试剂反应不会发生重排反应得到相应的 卤代炷?
8. 六碳以下的醇的鉴别方法。(Lucas试剂) 9. 醇的脱水反应(醇在浓H2SO4中的分子内脱水按El历 程进行,得
c.五元以上环的环烃,无此反应。 注:环烷烃虽可加成但不能被一般氧化剂氧化,如KMnO4。
烯烃8 a. H2SO4,室温下烯烃溶于浓硫酸。(除去烷烃中的烯烃) b. Br2-CCl4溶液,室温下烯烃使其褪色。 c. KMnO4酸性溶液,室温下烯烃使其褪色。 d. 共轭二烯烃除用上述方法外,可加顺丁烯二酸酐在
CH3C=CHCl
2-甲基-1-氯-1-丙烯的构造式为:
CH3
其中一个双键碳上连有相同两个甲基,故没有顺反异构。
13
第七章卤代烃相转移催化反应
1・卤代烃、卤代烯烃、卤代芳烃的系统命名。 2. 卤代烃的制法。 3. 何谓亲核取代反应? (SN2反应中:正电中心碳上正电荷 越集中、
空间阻碍越小,反应活性越大;SN1反应中:越易 生成稳定碳正离子的 卤代烃,SN1反应活性越大)
第五章芳烃芳香性
1. 多取代苯的命名。 2. 何谓亲电取代?亲电取代反应的活性比较一一芳环上电子
密度越高,亲电取代活性愈大。
3. 芳烃可以与哪些试剂进行亲电取代反应?反应活性如何? 磺化反应
是可逆反应,在合成上的应用。烷基化、 酰基化、氯甲基化的特点及应用?
4. 煙侧链上a-碳上的卤代及其与芳环上卤代反应的区别。 5. 芳炷的侧链氧化。(侧链a-碳上有a-H时才被氧化) 6. 邻、对位定位基和间位定位基的区分及其定位活性(定位
2. 共价键断裂方式,在有机反应中常见有哪几类?
其稳定性次序如何?
3. 诱导效应的概念。 4. 酸碱的概念。
4
第二章饱和烃:烷烃和环烷烃
1. 烷烃、脂环烃的命名;。 2. 烷烃发生取代反应是什么历程?(自由基型取代) 3. 烷炷发生取代反应时,卤素的反应活性、选择性;烷炷反 应活性
(不同H被取代活性)及自由基的稳定性。 4. 脂环炷的取代反应。 5. 脂环炷的环的大小与开环加成活性关系。 6. 取代环丙烷的开环加成规律°(P58) 7. 环烯烃的兀键加成与a-氢的卤代反应区别。
的应用。
7.不同结构的胺与亚硝酸反应的区别,及其在鉴别不同胺
上的应用。
21
9. 芳胺环上的卤代在鉴别芳胺上的应用。 10. 降低氨基活性、保护氨基的方法;芳胺环上在氨基邻 位、间位、
对位硝化或引入卤原子的方法。(P5来自5)11. 季铉碱的分解反应及其分解规律(Hofmann规则) 或分解取
向。
12. 重氮化合物和偶氮化合物的区分和命名。 13. 重氮化合物的制法。
O
13.醛、 酮 的Clemmensen还原法和Wolff-Kishner—黄鸣龙
还原法及其应用。
14. Cannizzaro 反应。
19
第十二、十三章 羧酸及羧酸衍生物
1. 羧酸及羧酸衍生物的命名。 2. 羧酸的制法(醇、醛氧化制备;腈水解制备;Grignard试剂与CO2
2. 羧酸的酸性强弱比较及影响因素。
(烯烃a■氢的卤代与双键加成反应条件不同) 16.金属炔化物的生成及其在增D匕 长碳链上的应用。 17.烯烃、炔烃的鉴别方法。 l=i
7
第四章二烯烃共轭体系共振论
1. 二烯烃的共轭结构及Z, E—命名。 2. n-n共轭效应和超共轭效应的定义;n-n共轭与超共轭效 应结构与体
系稳定性的关系及其应用。(应用: n-n共轭效应和 超共轭效应与分子结
。
3. 亲核加成反应活性比较(羰基碳上正电性越明显、空间阻 碍作用越
小,亲核加成反应的活性就越大)。
4. 醛、酮与NaHSOa、与HCN的亲核加成及其应用。
5. 醛、酮与醇的加成反应及其在保护羰基上的应用。 6. 醛、酮与金属有机试剂加成及其在合成上的应用。 7. 醛、酮的鉴别分离方•——与饱和NaHSO3反应 (P388—384)、与氨的衍生的加成缩合(P395—397) 用于醛、
5
第三章 不饱和烃:烯烃和炔烃
1. 碳-碳双键、碳-碳三键的组成以及兀键的特性。
2. 烯烃、炔烃的命名;烯烃的顺反异构;Z,E-命名法。
3. 炔烃的部分加氢(注意区分顺位部分加氢和反位部分加氢的条 件或试剂)。 4. 烯炷、快炷的亲电加成及其应用;不同结构的烯烃亲电加成活 性的比较(烯烃中被亲电试剂进攻的不饱和碳上电子密度越高 或 越容易生成稳定碳正离子的烯烃,亲电加成活性越大) 5. 烯烃亲电加成反应机理。亲电加成历程产生的中间体是什么? 6. 亲电加成反应规律(MalKovniKov规律)。 7. 烯烃、炔烃与HBr的过氧化物效应加成及其规律。(惟一只 有漠化氢才能与烯煙、炔烃存在过氧化物效应,其它卤化氢不 存在过氧化物效应。)
用于合成Grignard试剂?
16. 双键位置对卤原子活泼性的影响(哪些卤代烃的卤原子
是 活泼的?哪些卤代烃的卤原子是不活泼的?原因是什
么?)。
(P272—286)
15
第九章醇和酚
1. 醇和酚的命名。 2. 醇的制法(烯烃水合法、硼氢化一氧化水解法;卤代炷水解
法;Grignard试剂与醛、酮反应;由醛、酮、羧酸酯还原羧■r 8’:
14. 重氮盐的重氮基被氢原子取代(作为去硝基、去氨基 的反应)
及其在反定位规律合成上的应用。
15. 重氮盐的重氮基被羟基、卤原子、氰基取代的反应及 其在合成
上的应用。
16. 重氮化合物的偶合反应。
22
烷烃的鉴别8 a.三元环的环烃,可使Br2-CCl4溶液在室温下褪色。
b.四元环的环烃,在加热条件下可使Br2-CCl4溶液在室温下褪 色。
到重排产物为主;醇在什么条件下的分子内脱 水不发生重排?)。
10. 酚的一元、二元、三元卤代。 11. 酚的鉴别方法。
17
第十^一章醛、酮和醌
1. 醛、酮及其取代衍生物的命名。 2 . 醛 、 酮 的 制 备 方 法 ( 由 伯 、 仲 醇 氧 化 制 醛 酮 P340-341 ; 醇 经 O
ppenauer氧化制备醛、酮P382;羧酸衍生物的还原 制备醛、酮P382)
加热进行双烯合成,实验现象:加入的粉末固体溶解后,产 生晶 体状固体(环状加成产物)。
23
炔烃8 a. Br2-CCl4溶液,室温下快烃使其褪色。但反应速度比烯烃慢。 b. KMnO4酸性溶液,室温下快烃使其褪色。但反应速度比烯 烃 慢。 c. H2O,HgSO4/H2SO4,其与快烃的反应产物醛或酮,再用 鉴别 羰基的方法进行。 d. 属于快烃中的末端快,可用Ag(NH3)2 +或Cu (NHj2+鉴别。
6. 酰胺的脱水在合成腈的应用和Hofmann降解反应及其在降低碳链
合成胺的应用。
20
第十五章有机合氮化合物
1.硝基化合物在酸性条件下的还原;用含硫化合物的还原; 催化加氢
还原。
2.硝基对其邻、对位酚羟基和羧基酸性的影响。 3•胺的命名; 4.胺的制备方法(由腈、酰胺的还原;由酰胺降解;
Gabriel合成法;由硝基化合物还原制备)。 5•胺的结构与其碱性强弱的关系(碱性强弱比较)。 6.胺与酰卤、酸酐的酰基化反应和磺酰化及其在鉴别胺和 分离胺上
4. 卤代炷可与哪些试剂发生亲核取代反应?这些反应各有哪 些应用? 5. 哪些反应可用于卤代炷的鉴别(卤代烃如何鉴别)?各类 卤代炷与 AgNO3-C2H5OH反应速度快慢规律?(硝酸银的氨 溶液能鉴别哪几类
物质?)
6. 亲核取代反应历程(SN2和SN1机理要熟悉)及其特点。 7. 什么叫瓦尔登构型转化?夕卜消旋化? (SN1:外消旋化的 同时构
构稳定性的关系、与碳正离子稳定性的关系、与自 由基稳定性的关系上和 在反应中间体能量以及反应取向方面上的应用)。
3. 二烯炷的双烯合成即Diels-Alder反应及其在合成环状化 合物上的应
用。
4. 双烯合成反应的活性比较。(双烯体共轭碳上有给电子 基、亲双烯
体有吸电子基时双烯合成反应的活性增大)
8
手性碳的化合物是否是手性分子?有手性的化合 物构型与旋光方向是否一 致?手性、旋光性与分子结构有什 么关系?
3. 含一个手性碳旋光物的构型确定和R/S一命名。 4. 对映体、非对映体、外消旋体、内消旋体的定义。 5. 对映体、非对映体、夕卜消旋体、内消旋体、同一物的判断方法。 6. 对映体、非对映体之间的物理性质和化学性质有哪些异同点?
