有关于化学方程式的归纳
高中化学化学方程式小归纳

中学化学化学方程式小归纳复习时要以化学学问块、教材章节、方法与技能相结合的方式整合教材。
并按概念和理论与技能的主线形成单元,进展复习。
下面给大家共享一些关于中学化学化学方程式小归纳,盼望对大家有所帮助。
【氢氧化钡】1、氢氧化钡与磷酸在氢氧化钡溶液中滴入少量磷酸,出现白色沉淀:3Ba2++6OH-+2H3PO4=Ba3(PO4)2↓+6H2O在磷酸中滴入少量氢氧化钡溶液,无明显现象:OH-+H3PO4=H2PO4-+H2O2、向NaHSO4溶液中慢慢滴入Ba(OH)2溶液至沉淀完全化学方程式:NaHSO4+Ba(OH)2==H2O+BaSO4↓+NaOH离子方程式:H++SO42-+Ba2++OH-==BaSO4↓+H2O假设向NaHSO4溶液中慢慢滴入Ba(OH)2溶液至中性化学方程式:2NaHSO4+Ba(OH)2==2H2O+BaSO4↓+Na2SO4离子方程式:2H++2SO42-+Ba2++2OH-==2H2O+BaSO4↓+SO42-或2H++SO42-+Ba2++2OH-==2H2O+BaSO4↓假设在中性溶液中接着滴加Ba(OH)2溶液,将看到白色沉淀生成:SO42-+Ba2+==BaSO4↓3、向明矾溶液中慢慢滴入Ba(OH)2溶液使SO42-恰好完全沉淀。
化学方程式:KAl(SO4)2+2Ba(OH)2==2H2O+2BaSO4↓+KAlO2离子方程式:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O假设向Ba(OH)2溶液中慢慢滴入明矾溶液时,当生成的沉淀的物质的量为最大值时,发生以下反响。
化学方程式:KAl(SO4)2+3/2Ba(OH)2=3/2BaSO4↓+Al(OH)3↓+1/2K2SO4离子方程式:2Al3++3SO42-+3Ba2++6OH=3BaSO4↓+2Al(OH)3↓4、氢氧化钡与硫酸氢钠当Ba(OH)2溶液滴入NaHSO4溶液至中性时:2HSO4-+Ba2++2OH-=2H2O+BaSO4↓+SO42-接着滴加Ba(OH)2溶液时,上述反响中的SO42-与Ba2+结合:Ba2++SO42-=BaSO4↓当NaHSO4溶液滴入足量Ba(OH)2溶液中时也出现白色沉淀:H++SO42-+Ba2++OH-=BaSO4↓+H2O【卤族】1、氯化铜和氨水在氯化铜溶液中滴入少量氨水,出现蓝色沉淀:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+在氨水中滴入少量氯化铜溶液,溶液呈深蓝色:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O2、苯酚与溴水在浓溴水中滴入少量苯酚溶液,立刻出现白色沉淀,并可进而转为黄色沉淀。
化学方程式总结

学考方程式归纳1、氯气的工业制法(氯碱工业):2NaCl+2H 2O Cl 2↑+H 2↑+2NaOH2、氯的实验室制法: MnO 2 +4HCl(浓) MnCl 2+Cl 2↑+2H 2O A.离子方程式:3、氯气的性质:A 、金属和氯气的反应:(1)铜丝在氯气中剧烈燃烧(棕色烟):Cu + Cl 2点燃CuCl 2(2)氯气和金属钠反应:2Na + Cl 2点燃2NaCl(3)铁在氯气中剧烈燃烧,产生棕褐色烟:2Fe + 3Cl 2点燃3FeCl 3(4)氢气在氯气中燃烧(苍白色火焰):H 2 + Cl 2点燃2HCl(5)氟气与氢气反应(黑暗处即可爆炸):H 2+F 2=2HF (6)钠在氯气中燃烧,产生白烟:2Na + Cl 2点燃2 NaClB 、氯气与水反应(6)氯气溶于水(新制氯水中含H + 、Cl -、ClO -、OH -、Cl 2、HClO 、H 2O )Cl 2 + H 2O = HCl + HClO B.离子方程式:新制氯水注入盛溴化钠溶液的试管中(7)Cl 2 + 2NaBr = Br 2 + 2NaCl Cl 2 + 2Br - = Br 2 + 2Cl - (8)Cl 2 + 2NaI = 2NaCl + I 2 Cl 2 +2I - =I 2 + 2Cl - (9)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2HClO 2HCl + O 2↑ C 、氯气和碱和的反应:(10)工业制漂白粉的原理:2Ca(OH)2 + 2Cl 2 =Ca(ClO)2 + CaCl 2 + 2H 2O 2Ca(OH)2 +2Cl 2 =2Ca 2++2ClO -+2Cl -+2H 2O (11)漂白粉长期置露在空气中失效的原理:Ca(ClO)2+CO 2+H 2O =CaCO 3↓+2HClO 2HClO HCl + O 2↑ (12)制漂白液(或氯气尾气处理): Cl 2 +2NaOH = NaCl + NaClO + H 2O 二、钠1、钠在空气中燃烧(黄色的火焰):2Na + O 2 Na 2O 22、钠块在空气中变暗 :4Na +O 2=2Na 2O3、Na 2O 在空气中加热(变黄):2Na 2O +O 2 △2Na 2O 24、钠与水反应(浮、熔、游、响、红):2Na + 2H 2O = 2NaOH + H 2 ↑光照 光照 通电电解5、电解熔融NaCl:2NaCl(熔融)====2Na + Cl2↑6、Na从钛、锆、铌等金属的氯化物中置换出金属单质:700-800℃TiCl4 + 4Na ========= Ti + 4NaCl三、Na2O 、Na2O2的相关反应:1、碱性氧化物Na2O与水的反应:Na2O+H2O=2NaOH2、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)2Na2O2+2H2O =4NaOH +O2↑3、碱性氧化物Na2O与CO2的反应Na2O +CO2=Na2CO34、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是:2Na2O2+2CO2=2Na2CO3+O25、Na2O +SO2=Na2SO3Na2O2+SO2=Na2SO46、Na2O +2HCl =2NaCl +H2O四、NaHCO3与Na2CO31、小苏打受热分解:2NaHCO3△Na2CO3+H2O +CO2 ↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH △Na2CO3+H2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO3+NaOH =Na2CO3+H2O HCO3-+OH -=H2O +CO32-4、向NaOH溶液中通入少量CO2 :2NaOH + CO2 = Na2CO3 + H2O5、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O +CO2↑ CO32-+2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O +CO2↑7、(1)Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2 =CaCO3↓+2 NaOHNaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na 2CO 3 +CaCl 2 = CaCO 3↓+2 Na Cl NaHCO 3溶液与CaCl 2 不反应;9、侯氏制碱法:NaCl + NH 3 + CO 2 + H 2O == NaHCO 3 + NH 4Cl2NaHCO 3 △Na 2CO 3 + H 2O +CO 2 ↑五、镁 1、3Mg+N 2Mg 3N 2 2Mg+O 22MgO (Mg 在空气中燃烧的主要反应) 2、2Mg+CO 22MgO+C (金属单质置换出非金属单质典型反应) 3、Mg+2H 2O (热)Mg(OH)2+H 2↑六、铁1、高炉炼铁——工业炼铁相关反应式:C + O 2 ===CO 2点燃高温C + CO 2 === CO高温3CO + Fe 2O 3=== 2Fe + 3CO 2高温CaCO 3 === CaO + CO 2↑高温CaO + SiO 2 ==== CaSiO 32、Fe 在氧气里灼烧:3Fe+2O 2Fe 3O43、铁与硫反应 Fe + S FeS4、铁与氧气反应 3Fe +2O 2 Fe 3O 45、铁在氯气中加热反应 2Fe +3Cl 2 2FeCl 36、高温下铁与水蒸气反应 : 3Fe + 4H 2O (g ) 高温Fe 3O 4 + 4H 2 7、铁的氧化物FeO 、Fe 2O 3 、Fe 3O 4溶于盐酸中: (1)FeO + 2HCl = FeCl 2 + H 2O(2)Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O(3)Fe 3O 4 + 8HCl = FeCl 2 +2FeCl 3 +4H 2O8、Fe(OH)2 、Fe(OH)3 的制备:(1) FeSO 4 + 2NaOH = Fe(OH)2 ↓+Na 2SO 4 Fe 2+ + 2OH - = Fe(OH)2 ↓(2)FeCl 3 + 3NaOH = Fe(OH)3 ↓+3NaCl Fe 3+ + 3OH - = Fe(OH)3 ↓ (3)氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色)C.化学方程式: (4)不稳定性:2Fe(OH)3 △Fe 2O 3 + 3H 2O 9、Fe 2+ 、Fe 3+ 之间的转化:(1)氯化亚铁溶液中通入氯气(或者加氯水):2FeCl 2 + Cl 2 = 2FeCl 3 2 Fe 2+ + Cl 2 = 2 Fe 3+ + 2Cl -(2)氯化铁溶液中加入铁粉:2FeCl3+Fe =3FeCl2 2Fe3++Fe =3Fe2+10、用KSCN检验Fe3+的存在:Fe3++3SCN-= Fe (SCN)3 (血红色溶液)11、D.印刷电路板:十、硅1、工业制单质硅相关反应:SiO2+2C 高温Si +2CO↑(粗硅的制取)Si +2Cl2高温SiCl4SiCl4+2H2高温Si(高纯硅)+4HCl↑2、硅单质与氢氟酸、Si +4HF = SiF4↑+ 2H2↑3、硅单质与NaOH溶液反应:Si + 2NaOH + H2O = Na2SiO3 +2H2↑4、Si及其化合物:5、二氧化硅(1)二氧化硅与氢氧化钠反应SiO2+2NaOH =Na2SiO3+H2O SiO2+2OH -=SiO32-+H2O (2)二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3(3)二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2H2O6、硅酸(H2SiO3)(1)往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓(2)硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3(胶体)(3)硅酸受热分解:H2SiO3△SiO2+H2O(4)工业制玻璃原理:SiO2 + Na2CO3高温Na2SiO3 + CO2↑SiO2 + CaCO3高温Ca SiO3 + CO2↑十一、硫1、硫与非金属:S + O2点燃SO2H2+ S △H2S2、硫与金属:Fe + S △FeS 2Cu + S△Cu2S3、二氧化硫与水反应:SO2+H2O H2SO3 2H2SO3+O2=2H2SO44、二氧化硫与碱反应:SO2+2NaOH=Na2SO3+H2O(少量SO2)SO2+NaOH=NaHSO3(足量SO2)5、二氧化硫与硫化氢气体反应:2H2S +SO2 = 3S↓+ 2H2O6、E.二氧化硫通入氯水中,离子方程式:7、F.SO2通入酸性高锰酸钾溶液中,离子方程式:催化剂8、二氧化硫被O2氧化:2SO2 + O22SO39、三氧化硫与水反应:SO 3 + H 2O = H 2SO 410、三氧化硫与碱反应:SO 3 + Ca(OH)2 = CaSO 4↓ + H 2O 11、硫化氢气体通入氯水:H 2S + 2Cl2==S ↓+2HCl12、工业制硫酸:4FeS 2+11O 22Fe 2O 3+ 8SO 2↑ 2SO 2+O 22SO 3SO 3+H 2O =H 2SO 413、实验室制取SO 2:Na 2SO 3+H 2SO 4(浓)=Na 2SO 4+H 2O+SO 2↑ 14、Cu+2H 2SO 4(浓)CuSO 4+ SO 2↑+2H 2O (也可用于实验室制备SO 2) 15、浓硫酸与木炭反应:C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O有机化学方程式总结甲烷1.甲烷燃烧 2O 2+CH 4CO 2+2H 2O2.甲烷与氯气光照(①→②→③→④)分步 ①CH 4+Cl 2CH 3Cl+HCl ②CH 3Cl+Cl 2CH 2Cl 2+HCl ③CH 2Cl 2+Cl 2CHCl 3+HCl ④CHCl 3+Cl 2CCl 4+HCl3. 甲烷高温分解 CH 4C+2H 24.十六烷裂化:C 16H 34C 8H 18+C 8H 16乙烯1.乙烯燃烧 CH 2=CH 2+3O 22CO 2+2H 2O2.乙烯与溴水反应 CH 2=CH 2+Br 2CH 2BrCH 2Br (1,2-二溴乙烷)3.乙烯与水反应 CH 2=CH 2+H 2OCH 3CH 2OH4.乙烯与氢气、氯气、氟化氢反应 CH 2=CH 2+H 2CH 2CH 3 CH 2=CH 2+Cl 2CH 2ClCH 2Cl5.乙烯反应生成聚乙烯 nCH 2=CH 2 [CH 2 CH 2]n乙烯与氧气反应 2CH 2=CH 2+O 22CH 3CHOCH 2=CH 2+O 2CH 3COOH苯(1)氧化反应(与O 2的反应):2C 6H 6+15O 2 −−→−点燃12CO 2+6H 2O (2)取代反应:光照 点燃点燃光照光照 光照高温催化剂加热、加压催化剂催化剂 催化剂催化剂 催化剂催化剂催化剂十六烷 辛烷 辛烯① 与Br 2的反应:+ Br 2−−→−3FeBr+ HBr② 苯与硝酸: + HO-NO 2浓硫酸 △+ H 2O(3)加成反应用镍做催化剂,苯与氢发生加成反应:+ 3H 2−−→−催化剂乙醇1.乙醇与钠反应 2C 2H 5OH+2N a →2C 2H 5ONa+H 2↑2.乙醇燃烧 C 2H 5OH+3O 22CO 2+3H 2O3.乙醇催化氧化 总式 2C 2H 5OH+O 22CH 3CHO+2H 2O (催化剂为铜或银) 分式 2Cu+O 22CuO 2CuO+2C 2H 5OH 2Cu+2CH 3CHO+2H 2O 乙酸1.乙醛氧化 2CH 3CHO+O 22CH 3COOH 2.乙酸与镁反应 2CH 3COOH+Mg (CH 3COO)2Mg+H 2↑ 3.乙酸与氧化铜反应 2CH 3COOH+CuO(CH 3COO)2Cu+H 2O 4.乙酸与氢氧化钠反应 CH 3COOH+NaOH CH 3COONa+H 2O 5.乙酸与碳酸钠反应 2CH 3COOH+ Na 2CO 32CH 3COONa+H 2O+CO 2↑ 6.乙酸与乙醇反应CH 3CH 2OH+CH 3COOH H SO 24垐垐垐?噲垐垐?△浓CH 3COOCH 2CH 3+H 2O 酯1.乙酸乙酯与水反应 CH 3COOCH 2CH 3+H 2O CH 3CH 2OH+CH 3COOH2.乙酸乙酯与氢氧化钠反应 CH 3COOCH 2CH 3+ NaOH CH 3COONa+ CH 3CH 2OH3.油脂碱性水解:C 17H 35COOCH 2 CH 2—OHC 17H 35COOCH + 3 NaOH 3C 17H 35COONa+ CH —OHC 17H 35COOCH 2 CH 2—OH糖类1.葡萄糖与氧气反应 C 6H 12O 6+6O 26CO 2+6H 2O2.葡萄糖发酵 C 6H 12O 62C 2H 5OH+2CO 2↑酒化酶催化剂△ △△催化剂点燃稀H 2SO 4△ △NO 2 Br。
化学必修1教材中的全部化学方程式分类归纳(7类59个方程式)

一、复分解反应(非氧化还原反应1、酸性氧化物与碱反应生成盐和水①.二氧化硅与氢氧化钠溶液反应SiO 2 + 2NaOH = Na2SiO 3 + H2O ②.三氧化硫与 Ca(OH2溶液反应: SO 3 + Ca(OH2 = CaSO4+H 2O2、碱性氧化物与酸反应生成盐和水①.氧化亚铁与盐酸反应:FeO +2HCl =FeCl 2+H 2O②.氧化铁与盐酸反应:Fe 2O 3 + 6HCl = 2FeCl3 + 3H2O 3、两性氧化物与酸反应生成盐和水Al 2O 3与盐酸反应:Al 2O 3 + 6HCl =2AlCl 3 + 3H2O 4、两性氧化物与碱反应生成盐和水Al 2O 3与氢氧化钠溶液反应:Al 2O 3 + 2NaOH =2NaAlO 2 + H2O 5、酸性氧化物的特殊反应二氧化硅与氢氟酸反应:SiO 2 + 4HF = SiF4↑+ 2H2O6、碱与酸反应生成盐和水①. Al(OH3与盐酸反应:Al(OH3 + 3HCl =AlCl 3 + 3H2O7、盐与酸反应生成新盐和新酸①.硅酸钠与盐酸反应:Na 2SiO 3 + 2HCl = 2NaCl + H2SiO 3↓②.漂白粉长期置露在空气中:Ca(ClO2 + H2O + CO2 = CaCO3↓ + 2HClO 8、盐水解生成新酸和新碱Fe(OH3胶体的制备:FeCl 3+3H 2O 加热 Fe(OH3(胶体+3HCl 9、两性氢氧化物与碱反应生成盐和水Al(OH3与氢氧化钠溶液反应:Al(OH3 + NaOH = NaAlO 2 + 2H2O10、盐与碱反应生成新盐和新碱①.实验室制取氢氧化铝(铝盐溶液加氨水: Al 2(SO4 3 + 6NH3•H 2O =2Al(OH3↓ + 3(NH4 2SO 4 ②.氯化铁与氢氧化钠溶液反应:FeCl 3 + 3NaOH =3NaCl + Fe(OH3↓ (红褐色③.硫酸亚铁与氢氧化钠溶液反应: FeSO 4 + 2NaOH = Na2SO 4 + Fe(OH2↓ (白色④.硝酸铵与氢氧化钠反应:NH 4NO 3 + NaOH 加热NH3↑ + NaNO3 + H2O ⑤.氨气的实验室制取法:2NH 4Cl + Ca(OH2加热CaCl2 + 2H2O + 2NH3↑ ⑥.硫酸铵与氢氧化钠反应:(NH4 2SO 4 + 2NaOH 加热2NH3↑ + Na2SO 4 + 2H2O二、置换反应(氧化还反应1、还原性非金属单质与氧化物反应置换金属单质碳还原氧化铜:2CuO +C 高温2Cu +CO 2↑2、金属单质置换出还原性非金属单质①.金属与水的反应:铁与水蒸气反应:3Fe + 4H2O(g 加热Fe 3O 4 + 4H2↑ 钠与水反应:2Na + 2H2O = 2NaOH + H2↑②.金属与酸的反应:Al 与盐酸反应:2Al +6HCl =2AlCl 3+3H2↑③.两性金属与碱溶液的反应:Al 与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O =2NaAlO 2 + 3H2↑三、属于氧化还原反应的化合反应1、金属与氧气发生的氧化反应①.常温下钠与氧气反应:4Na + O2 = 2Na2O (白色②.钠在空气中燃烧:2Na + O2加热 Na 2O 2(淡黄色③.铁在氧气中燃烧:3Fe +2O 2点燃 Fe 3O 4(黑色2、非金属单质与氧气的氧化反应①.硫的燃烧 S +O 2点燃 SO 2②.氮气与氧气在放电下反应:N 2 + O2放电 2NO3、低价非金属氧化物与氧气的氧化反应①.二氧化硫与氧气反应:2SO 2+O 2催化剂加热2SO 3②.一氧化氮与氧气反应:2NO + O2 = 2NO24、非金属氢化物与氧气的反应氨的催化氧化:4NH 3+5O 2催化剂△4NO +6H 2O5、低价碱的氧化反应氢氧化亚铁被氧化成氢氧化铁:4Fe(OH2 + 2H2O + O2 = 4Fe(OH36、单质与氯气发生的氧化反应①.氯气与金属反应:铁与氯气反应产生棕色烟2Fe + 3Cl2点燃 2FeCl 3铜与氯气反应产生棕黄色烟Cu + Cl2点燃 CuCl 2钠在氯气中燃烧有白烟2Na + Cl2点燃 2NaCl②.氯气与非金属反应:氢气在氯气中燃烧产生苍白色火焰有白雾 H 2+Cl 2加热 2HCl③.氯气与氯化亚铁反应生成氯化铁2FeCl 2 + Cl2 = 2FeCl37、高价铁盐的还原反应FeCl 3溶液与铁粉反应:2FeCl 3 + Fe = 3FeCl2 8、非金属与氢气的化合反应合成氨反应:N 2+3H 2 催化剂高温高压2NH 3四、不属于氧化还原反应的化合反应1、酸性氧化物与碱性氧化物反应生成含氧酸盐①.二氧化硅与氧化钙高温反应生成硅酸钙 SiO 2 + CaO高温 CaSiO3②.三氧化硫与氧化钙反应生成硫酸钙SO 3+CaO =CaSO 42、酸性氧化物与水反应生成含氧酸①.二氧化硫与水反应生成亚硫酸SO 2 + H2O H2SO 3②.三氧化硫与水反应生成硫酸SO 3 + H2O = H2SO 43、氨气与水的化合反应氨气溶于水生成氨水:NH 3 + H2O =NH 3•H 2O4、氨气与酸的化合反应氨气与氯化氢反应生成氯化铵:NH 3 + HCl = NH4Cl五、属于氧化还原反应的分解反应次氯酸光照分解:2HClO 光照2HCl + O2↑ 六、不属于氧化还原反应的分解反应1、铵盐受热分解①氯化铵受热分解:NH 4Cl 加热NH3↑ + HCl↑ ②.碳酸氢氨受热分解: NH 4HCO 3加热NH 3↑ + H2O↑ + CO2↑2、氨水受热分解氨水受热分解:NH 3•H 2O 加热NH 3↑ + H2O 3、不溶性碱受热分解①.氢氧化铁加热分解生成氧化铁和水: 2Fe(OH3 加热 3H 2O+ Fe2O 3②.氢氧化铝加热分解生成氧化铝和水: 2Al(OH3加热 Al 2O 3 + 3H2O七、不属于基本类型的氧化还原反应1、过氧化钠氯气二氧化氮的歧化反应①.过氧化钠与水反应生成氢氧化钠和氧气2Na 2O 2 + 2H2O = 4NaOH + O2↑②.过氧化钠与二氧化碳反应生成碳酸钠和氧气 2Na 2O 2 + 2CO2 = 2Na2CO 3 + O2③.氯气与水反应生成盐酸和次氯酸:Cl 2 + H2O = HCl + HClO④. 氯气与氢氧化钠溶液反应生成氯化纳和次氯酸钠:Cl 2 + 2NaOH = NaCl + NaClO + H2O⑤.氯气与消石灰反应制漂白粉:2Cl 2 + 2Ca(OH2 = CaCl2 + Ca(ClO2 + 2H2O ⑥.二氧化氮与水反应生成硝酸和一氧化氮: 3NO 2 + H2O = 2HNO3 + NO2、氧化性酸的还原反应①.浓硫酸与碳发生的还原反应C + 2H2SO 4(浓加热CO2↑+ 2SO2↑ + 2H2O ②.浓硫酸与铜发生的还原反应Cu + 2H2SO 4(浓加热CuSO 4 + 2H2O + SO2↑ ③.浓硝酸与铜发生的还原反应: Cu + 4HNO3(浓=Cu(NO3 2 + 2H2O + 2NO2↑ ④.稀硝酸与铜发生的还原反应: 3Cu + 8HNO3(稀=3Cu(NO3 2 + 4H2O + 2NO↑ 3、还原性酸的氧化反应氯气的实验室制法:MnO 2+4HCl (浓加热MnCl 2+Cl 2↑ +H 2O 4、高价金属化合物的还原反应: FeCl 3溶液与铜反应:2FeCl 3 + Cu = 2FeCl2+ CuCl 2。
高中化学方程式全部归纳

高中化学方程式全部归纳1、电石上滴加饱和氯化钠溶液(实验室制乙炔)2、苯乙烯发生加聚反应3、乙炔与溴水物质的量1:1 加成反应4、苯的硝化反应5、甘油与足量钠的反应6、乙醇与灼热的氧化铜反应7、苯酚与碳酸钠的反应8、溴乙烷与氢氧化钠醇溶液加热9、在热NaOH 溶液中的水解10、a -羟基丙酸缩聚11 、葡萄糖与新制氢氧化铜浊液混合加热12、与NaOH 溶液反应13、油酸甘油酯酸性条件下水解14、乙炔和丙烯1:1 共聚15、硬脂酸甘油酯皂化反应16、蔗糖水解17、两分子a -羟基丙酸脱水成环18、以水杨酸和乙酸酐制阿司匹林19、草酸使酸性重铬酸钾溶液褪色20、铁和水蒸气反应21、向偏铝酸钠溶液中通入足量CO222、实验室制氨气23、硝酸分解24、C与浓硝酸反应25、电解饱和食盐水26、硫酸铜溶液除去乙炔中的硫化氢27、氢氧化铁与氢碘酸28、高锰酸钾和浓盐酸反应制氯气29、NaOH与少量Ca(HCO3)2溶液反应30、过氧化钠与水反应(单线桥)31、工业上冶炼镁32、碳酸钠溶液呈碱性的原因33、氨气在纯氧中燃烧34、SO2通入氢硫酸35、1molFeBr2 溶液中通入1mol 氯气36、向明矶溶液中滴入Ba(OH)2至AI3+恰好沉淀完全37、三氯化铁溶液中加入硫氰化钾38、实验室制SO239、钠与水反应40、硫与铜反应B1、乙烷与氯气在光照条件下反应2、2-丁烯与氯化氢加成3、甲苯制TNT4、乙炔与水加成5、甲苯与氢气加成6、异戊二烯加聚7、淀粉水解8、油酸甘油酯硬化9、B -羟基丙酸分子内脱水成环10、与稀硫酸溶液反应11、乙二醇和对苯二甲酸缩聚12、软脂酸甘油酯皂化反应13、苯酚与甲醛反应制酚醛树脂14、葡萄糖的催化加氢15、乙二酸二甲酯在酸性条件下水解16、丙醛与新制氢氧化铜浊液混合加热17、在热NaOH 溶液中的水解18、以阿司匹林和NaOH 制可溶性阿司匹林19、草酸使酸性高锰酸钾溶液褪色20、氢氧化铝的电离方程式21、NO2 与水22、铝热反应23、Cu 与浓硝酸反应24、汽车尾气NO、CO 的催化转化25、硫代硫酸钠溶液中加稀硫酸26、铁的吸氧腐蚀及铁锈生成过程27、四氧化三铁与氢碘酸28、SO2 通入硝酸钡溶液出现白色浑浊29、NaOH与足量Ca(HCO3)2溶液反应30、AI3+与足量氢氧化钠溶液反应31、接触法(工业)制硫酸32、氯化铁溶液呈酸性的原因33、浓氨水检验氯气管道泄露34、1moIFeI2 溶液中通入1moI 氯气35、向明矶溶液中滴入Ba(OH)2至SO42-恰好沉淀完全36、少量偏铝酸钠溶液滴到盐酸中37、酸雨的形成38、工业冶炼金属钠39、石灰乳与海水制取氢氧化镁40、氯气通入氢硫酸溶液中C1、甲苯制苯基溴代甲烷2、1,2,3-丁三醇的催化氧化3、乙烯与苯乙烯1:1 共聚4、苯酚与足量钠的反应5、丙醛的催化氧化6、丙烯酸加聚7、麦芽糖水解8、乙二酸和乙二醇脱水成环9、溶液中通入CO210、硬脂酸甘油酯酸性条件下水解11、乙二酸和对苯二甲醇缩聚12、实验室制乙烯13、葡萄糖在酒化酶的作用下发酵成乙醇14、苯酚与浓溴水的反应15、丙醛发生银镜反应16、在热NaOH 溶液中的水解17、甲醇与浓硫酸混合加热反应18、以阿司匹林和NaOH 制可溶性阿司匹林19、SO2 使酸性重铬酸钾溶液褪色20、铁和水蒸气反应21、实验室制氢氧化铝22、NH4HCO3溶液与过量NaOH反应23、实验室制氯气24、稀硝酸除银镜25、SO2使溴水褪色26、制玻璃27、向NaHSO4溶液中逐滴加入Ba(OH)2至刚好沉淀完全28、实验室制备氢氧化铁胶体29、1molFeBr2溶液中通0.2mol氯气30、Cu2O溶于稀硫酸31、S2O32-脱氯32、氨气与水反应显碱性33、向AlCl3 溶液中滴入偏铝酸钠34、除FeCI2 中的FeCI335、硝酸银溶液中逐滴滴氨水36、铝与氢氧化钠溶液反应37、Fe与足量稀硝酸38、碳和浓硫酸39、NO2与NaOH溶液反应40、硫酸铅溶于醋酸溶液D1 、甲苯制对溴甲苯2、乙醇的催化氧化3、纤维素水解4、溴乙烷与氢氧化钠水溶液混合反应5、1,3-丁二烯加聚6、丙烯腈加聚7、乙二醇与甲酸1:2 酯化8、两分子3 -羟基丙酸脱水成环9、葡萄糖与发生银镜反应10、油酸甘油酯酸性条件下水解11、油酸甘油酯硬化12、与NaHCO3 溶液反应13、苯酚钠溶液与二氧化碳的反应14、在热NaOH 溶液中的水解15、 a -羟基丙酸分子内脱水成环16、乙醇与浓硫酸混合加热到140 C17、 3 -羟基丙酸缩聚18、以水杨酸和乙酸酐制阿司匹林19、SO2 使酸性高锰酸钾溶液褪色20、氢氧化铝的电离方程式21、工业合成氨22、镁与CO2 反应23、氨的催化氧化24、铜和浓硫酸25、工业制粗硅26、制水煤气27、工业上冶炼铝28、氯气通入NaOH溶液(单线桥)29、硝酸亚铁溶液中滴入稀硫酸30、1molFeI2 溶液中通0.3mol 氯气31、向醋酸铅[(CH3COO)2Pb溶液中通入H2S气体32、工业上制硝酸33、SO2使紫色石蕊试液变红的原因34、除FeCI3 中的FeCI235、向NH4HSO4溶液中逐滴加入Ba(OH)2至刚好沉淀完全36、Fe与少量稀硝酸37、久置的铜表面生成铜绿38、高炉炼铁39、NO、NO2 尾气一起通入NaOH 溶液40、氯气和水。
(完整版)高中有机化学方程式归纳
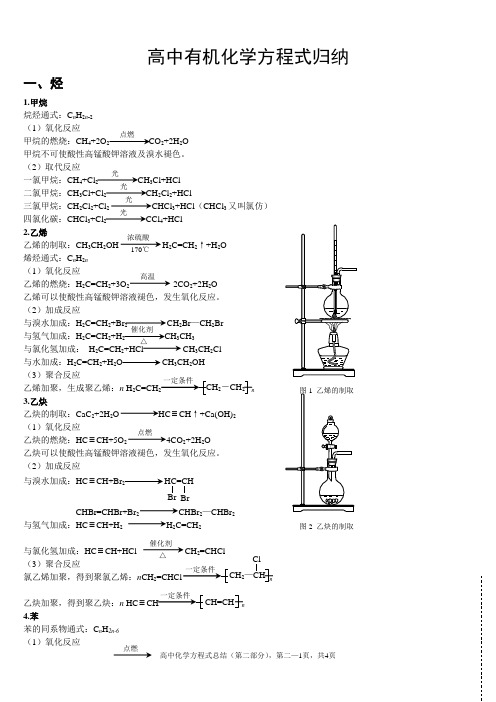
高中有机化学方程式归纳一、烃1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
有机化学方程式归纳

有机化学方程式归纳一、取代反应R-H+X 2R-X+HX CH 4+Cl 2CH 3Cl+HCl CH 3Cl+Cl 2CH 2Cl 2+HCl CH 2Cl 2+Cl 2CHCl 3+HCl CHCl 3+Cl 2CCl 4+HCl+ HO-NO 2NO 2+ H 2O+ Br 2Br + HBrCH 3-CH 2-Br + H 2O CH 3CH 2OH + HBr2CH 3─CH 2OHC 2H 5OC 2H 5 + H 2O二、加成反应CH 2=CH 2 + H 2CH 3─CH 3 CH 2=CH 2 + H 2CH 3─CH 3 CH 2=CH 2+HCl→CH 3─CH 2ClCH 2=CH 2+ H 2OCH 3─CH 2OH CH CH+ H 2CH 2=CH 2 CHCH+ 2H 2 CH 3─CH 3CH CH+HClCH 2=CHCl+ 3H 2R CHO + H 2R ─CH 2OHCH 3CHO + H 2CH 3─CH 2OHOH + 3H2OH (C 17H 33COO)3C 3H 5 + 3H 2(C 17H 35COO)3C 3H 5 三、氧化反应C x H y +(x +4y )O 2−−→−点燃x CO 2+2y H 2O CH 4+2O 2CO 2+2H 2O 2CH 2=CH 2 + O 22CH 3CHO 2C 2H 2+5O 24CO 2+2H 2O 2C 6H 6+15O 212CO 2+6H 2O2CH 3─CH 2OH + O 22CH 3CHO + 2H 2O2CH3CHO + O22CH3COOHRCHO+2Cu(OH)2R─COOH+Cu2O↓+2H2OCH3CHO+ 2Cu(OH)2CH3COOH + Cu2O↓+2H2OCH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+2H2OCH2OH(CHOH)4CHO+2Ag(NH3)2OHCH 2OH(CHOH)4COOH+2Ag+4NH3+H2O四、水解反应CH3-CH2-Br + H2O CH3─CH2OH + HBrRCOOR'+H2O RCOOH+HOR'RCOOR'+ NaOH RCOONa+HOR'CH3COOC2H5 + H2O CH3COOH + C2H5OHCH3COOC2H5 + NaOH CH3COONa + C2H5OH(C17H35COO)3C3H5+3H2O3C17H35COOH+C3H5(OH)3(C17H35COO)3C3H5 +3 NaOH3C17H35COONa+C3H5(OH)3(C6H10O5)n+nH2O nC6H12O6(淀粉)(葡萄糖)C12H22O11+H2O C6H12O6 + C6H12O6(蔗糖)(葡萄糖) (果糖)C12H22O11+H2O2C6H12O6(麦芽糖)(葡萄糖)(C6H10O5)n+nH2O nC6H12O6(纤维素)(葡萄糖)五、酯化反应CH3COOH + HOC2H5CH3COOC2H5 + H2ORCOOH+HOR'RCOOR'+H2OCH3COOH + H18OC2H5CH3CO18OC2H5 + H2O3C17H35COOH+C3H5(OH)3(C17H35COO)3C3H5+3H2O 六、消去反应C n H 2n+1X+NaOHC n H 2n +NaX+H 2OCH 3CH 2Br+NaOHCH 2=CH 2↑+NaBr+H 2OCH 3─CH 2OHCH 2=CH 2+ H 2O七、加聚反应 n CH 2=CH 2−−−→−催化剂[— CH 2—CH 2 ]— n八、缩聚反应nHO-CH 2-CH 2-COOH −−−→−催化剂[— O- CH 2-CH 2 -C ]— n +nH 2O 九、裂化反应CH 4C+2H 2 C 16H 34C 8H 18+C 8H 16 C 8H 18C 4H 10+C 4H 8 C 4H 10C 2H 6+C 2H 4 C 4H 10CH 4+C 3H 6十、置换反应 2CH 3─CH 2OH + 2Na 2CH 3─CH 2ONa + H 2↑2OH + 2Na 2ONa + H 2↑ 2CH 3COOH+2Na2CH 3COONa+H 2↑十一、其它反应OH + NaOHONa + H2OONa + CO2 + H 2OOH + NaHCO 3CH 3COOH+NaOHCH 3COONa+H 2O 2CH 3COOH+CuO(CH 3COO)2Cu+H 2O2CH 3COOH+Na 2CO 32CH 3COONa+CO 2↑+H 2O 有机离子反应2CH 3COOH+Cu(OH)22CH 3COO -+Cu 2++2H 2O2CH 3COOH+CaOCa 2++2CH 3COO -+H 2O2CH 3COOH+Zn Zn 2++H 2↑+2CH 3COO -2CH 3COOH+CaCO 3Ca 2++2CH 3COO -+CO 2↑+H 2OO - + CO 2 + H 2O OH + HCO 3-。
精编九年级化学方程式分类归纳汇总

精编九年级化学方程式分类归纳汇总一.化合反应1.镁带燃烧: 2Mg + O 2 ==== 2MgO2.铁丝燃烧及生锈:3Fe + 2O 2 ==== Fe 3O 4 ;4Fe + 3O 2 ===== 2Fe 2O 3(缓慢氧化)3.铜丝加热及生锈: 2Cu + O 2 === 2CuO ; 2Cu + O 2 + H 2O + CO 2 == Cu 2(OH)2CO 34.铝丝加热或形成氧化膜:4Al + 3O 2 === 2Al 2O 35.氢气燃烧或爆炸: 2H 2 + O 2 === 2H 2O6.碳的燃烧:2C + O 2 ==== 2CO (不完全燃烧);C + O 2 === CO 2(完全燃烧)7.硫的燃烧:S + O 2 === SO 28.磷的燃烧:4P + 5O 2 === 2P 2O 59.二氧化碳被碳还原:C + CO 2 === 2CO10.人工固氮(合成氨):N 2 + 3H 2 ======= 2NH 3 11.生石灰溶于水:CaO + H 2O == Ca(OH)212.二氧化碳溶于水:CO 2 + H 2O == H 2CO 313.二氧化硫溶于水:SO 2 + H 2O == H 2SO 314.二氧化硫在空气中转化为三氧化硫:2SO 2 + O 2 ==== 2SO 315.三氧化硫溶于水:SO 3 + H 2O == H 2SO 416.工业上制盐酸(氢气在氯气中燃烧):H 2 + Cl 2 === 2HCl17.金属钠在氯气中燃烧:2Na + Cl 2 2HCl18.浓盐酸与浓氨水相靠近:NH 3 + HCl == NH 4Cl二.分解反应1.碳酸氢铵(碳铵)受热分解:NH 4HCO 3 NH 3↑+ CO 2↑+ H 2O 2.碱式碳酸铜(铜绿受热分解):Cu 2(OH)2CO 3 2CuO + H 2O + CO 2↑3.加热高锰酸钾制氧气:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑4.二氧化锰催化双氧水制氧气:2H 2O 2 2H 2O + O 2↑5.电解水:2H 2O 2H 2↑+ O 2↑6.碳酸分解:H 2CO 3 == CO 2↑+ H 2O7.碳酸钙高温煅烧分解:CaCO 3 CaO + CO 2↑8.电解熔融状态的氧化铝制取金属铝:2Al 2O 3 4Al + 3O 2↑三.置换反应1 氢气还原金属氧化物:Fe 2O 3 + 3H2 2Fe + 3H 2O ;Fe 3O 4 + 4H 2 3Fe + 4H 2O ; CuO + H 2 Cu + H 2O 2.碳粉还原金属氧化物:2Fe 2O3 + 3C 4Fe + 3CO 2↑;Fe 3O4 + 2C 3Fe + 2CO 2↑; 2CuO + C 2Cu + CO 2↑ 潮湿空气 △ 点燃 点燃 △ 点燃 点燃 点燃 点燃 点燃 高温 高温、高压 催化剂粉尘等 点燃 点燃 === △ ===△ === △ === MnO 2=== 通电 === 高温 === 通电 === 高温 === 高温 === 高温 ===高温 === 高温 === 高温 ===3.制取水煤气:C + H 2O CO + H 24.铝与盐酸、硫酸反应制氢气:2Al + 6HCl == 2AlCl 3 + 3H 2↑;2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑5.镁与盐酸、硫酸反应制氢气:Mg + 2HCl == MgCl 2 + H 2↑;Mg + H 2SO 4 == MgSO 4 + H 2↑6.铁与盐酸、硫酸反应制氢气:Fe + 2HCl == FeCl 2 + H 2↑;Fe + H 2SO 4 == FeSO 4 + H 2↑7.锌与盐酸、硫酸反应制氢气:Zn + 2HCl == ZnCl 2 + H 2↑;Zn + H 2SO 4 == ZnSO 4 + H 2↑8.湿法炼铜法,铁与硫酸铜溶液反应:Fe + CuSO 4 == FeSO 4 + Cu9.铜与硝酸银溶液反应:Cu + 2AgNO 3 == Cu(NO 3)2 + 2Ag10.铝热剂反应:2Al + Fe 2O 3 Al 2O 3 + 2Fe ;8Al + 3Fe 3O 4 4Al 2O 3 + 9Fe11.金属镁与二氧化碳反应:2Mg + CO 2 2MgO + C四.复分解反应:1.酸碱中和反应:HCl + NaOH == NaCl + H 2O ;Cu(OH)2 + H 2SO 4 == CuSO 4 + 2H 2O H 2SO 4 + Ba(OH)2 == BaSO 4↓+ 2H 2O ;Ca(OH)2 + 2HCl == CaCl 2 +2H 2O2.金属氧化物与酸溶液反应:Fe 2O 3 + 6HCl == 2FeCl 3 + 3H 2O ;CuO + H 2SO 4 == CuSO 4 + H 2O MgO + 2HCl == MgCl 2 + H 2O ;Al 2O 3 + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2O3.碳酸盐与酸溶液反应:CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O ;Na 2CO 3 + 2HCl == 2NaCl+ CO 2↑+ H 2O K 2CO 3 + H 2SO 4 == K 2SO 4 + CO 2↑+ H 2O4.盐溶液与碱溶液反应:Na 2CO 3 + Ca(OH)2 == CaCO 3↓+ 2NaOH ;CuSO 4 + 2NaOH== Cu(OH)2↓+Na 2SO 4 CuSO 4 + Ba(OH)2 == BaSO 4↓+ Cu(OH)2↓5.Ag +与Cl -反应:HCl + AgNO 3 == AgCl↓+ HNO 3;NaCl + AgNO 3 == AgCl↓+ NaNO 36.Ba 2+与SO 42-反应:BaCl 2 + CuSO 4 == BaSO 4↓+ CuCl 2;H 2SO 4 + BaCl 2 == BaSO 4↓+ 2HCl7.纯碱与氯化钙溶液反应:Na 2CO 3 + CaCl 2 == CaCO 3↓+ 2NaCl8.铵盐与碱反应产生氨气:NH 4NO 3 + NaOH == NaNO 3 + NH 3↑+ H 2O (NH 4)2SO 4 + Ca(OH)2 == CaSO 4 + 2NH 3↑+ 2H 2O五.其他反应类型:1.一氧化碳还原金属氧化物:Fe 2O 3 + 3CO 2Fe + 3CO 2;Fe 3O 4 + 4CO 3Fe + 4CO 2; CuO + CO Cu + CO 22.非金属氧化物与碱溶液反应:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O ;CO 2 +2NaOH == Na 2CO 3 + H 2O SO 2 +2NaOH == Na 2SO 3 + H 2O3.有机物燃烧:CH 4 + 2O 2 CO 2 + 2H 2O ; C 2H6O + 3O 2 2CO 2 + 3H 2O C 6H 12O 6 + 6O 2 6CO 2 + 6H 2OC x H y O z + (424z y x -+)O 2 xCO 2 + 2y H 2O 4.绿色植物光合作用:6CO 2 + 6H 2O C 6H 12O 6 + 6O 2 高温=== 高温 === 高温 === 高温 === 高温 === 高温 === 点燃 === 点燃 === 点燃 === 点燃 === 光照 === 叶绿素 高温 ===。
化学反应方程式归纳

化学反应方程式归纳1.把钠放入水中的离子反应的化学方程式:↑++=+-+222222H OH Na O H Na2.把过氧化钠放入水中的反应的化学方程式:↑+=+2222422O NaOH O H O Na3.过氧化钠2CO 的反应的化学方程式:232222222O CO Na CO O Na +=+ 4.32CO Na 溶液与石灰水混合:↓+=+33222)(CaCO NaOH CO Na OH Ca5.加热小苏打的化学方程式:O H CO CO Na NaHCO 223232+↑+∆6.镁与2CO 反应的化学方程式:C MgO CO Mg ++222点燃7.把镁放入饱和Cl NH 4溶液中的离子方程式+++↑+⋅=++222324222Mg H O H NH O H NH Mg8.实验室制取3)(OH Al 离子反应方程式:+++↓=⋅+432333)(3NH OH Al O H NH Al9. 把3AlCl 溶液滴入NaOH 溶液中:O H AlO OH Al22324+=+--+10.把NaOH 溶液滴入3AlCl 溶液中: ↓=+-+33)(3OH Al OH Al O H AlO OH OH Al 2232)(+=+--11.32O Al 溶于NaOH 溶液中:O H AlO OH O Al 223222+=+--12.把2CO 通入硅酸钠溶液中:324422322CO Na SiO H O H CO SiO Na +↓=++13.把2CO 通入偏铝酸钠溶液中:33222)(2NaHCO OH Al O H CO NaAlO +↓=++14.把2CO 通入澄清石灰水:O H CaCO OH Ca CO 2322)(+↓=+15.把盐酸滴入偏铝酸钠溶液中至过量:↓+=+32)(OH Al NaCl HCl NaAlO O H Al H OH Al 23333)(+=+++16.盛放碱液的试剂瓶不能用玻璃塞:3222SiO Na NaOH SiO =++H 2O17.C 生成水煤气: 22H CO O H C ++高温18.硅与NaOH 溶液反应的化学方程式: ↑+=++232222H SiO Na O H NaOH Si19.铝与NaOH 溶液反应的化学方程式:↑+=++23232222H NaAlO O H NaOH Al 注意:氢气中氢元素的来源是水,而不是碱基,NaOH 的作用是与生成的Al(OH)3反应,生成水和偏铝酸钠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019有关于化学方程式的归纳复习对于学生进步是很关键的,接下来看看查字典化学网为大家推荐的有关于化学方程式的归纳,会不会对大家起到帮助呢?
一. 物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O4
3. 铜在空气中受热:2Cu + O2加热2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2 O3
5. 氢气中空气中燃烧:2H2 + O2 点燃2H2 O
6. 红磷在空气中燃烧:4P + 5O2 点燃2P2 O5
7. 硫粉在空气中燃烧:S + O2 点燃SO2
8. 碳在氧气中充分燃烧:C + O2 点燃CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2 O
12. 酒精在空气中燃烧:C2 H5OH + 3O2 点燃2CO2 + 3H2 O
二.几个分解反应:
13. 水在直流电的作用下分解:2H2 O 通电2H2 + O2
14. 加热碱式碳酸铜:Cu2 (OH) 2 CO3 加热2CuO + H2 O + CO2
15. 过氧化氢的分解:2H 2O 2MnO 2H 2O+O 2
15. 加热氯酸钾(有少量的二氧化锰):2KClO3加热2KCl + 3O2
16. 加热高锰酸钾:2KMnO4 加热K2 MnO4 + MnO2 + O2
17. 碳酸不稳定而分解:H2 CO3 === H2 O + CO2
18. 高温煅烧石灰石:CaCO3高温CaO + CO2
三.几个氧化还原反应:
19. 氢气还原氧化铜:H2 + CuO加热Cu + H2 O
20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2
21. 焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2
22. 焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe + 2CO2
23. 一氧化碳还原氧化铜:CO+ CuO高温Cu + CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2 O3加热2Fe + 3CO2
25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)
26. 锌和稀硫酸Zn + H2 SO4 = ZnSO 4+ H2
27. 铁和稀硫酸Fe + H2 SO4 = FeSO4 + H2
28. 镁和稀硫酸Mg + H2 SO4 = MgSO4 + H2
29. 铝和稀硫酸2Al +3H2 SO4 = Al2 (SO4) 3 +3H2
30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2
31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2
32. 镁和稀盐酸Mg+ 2HCl === MgCl 2 + H2
33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + H2
(2)金属单质+ 盐(溶液) ------- 另一种金属+ 另一种盐
34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
36. 铜和硝酸汞溶液反应:Cu + Hg(NO3) 2 === Cu(NO3) 2 + Hg (3)碱性氧化物+酸-------- 盐+ 水
37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ===2 FeCl 3+ 3H2O
38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2 (SO4) 3+ 3H2O
39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2 O
40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2 O
41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2 O
(4)酸性氧化物+碱-------- 盐+ 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH) 2 + CO2 ==== CaCO 3+ H2 O
47. 消石灰吸收二氧化硫:Ca(OH) 2 + SO2 ==== CaSO 3+ H2 O (5)酸+ 碱-------- 盐+ 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2 O
49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH) 2 ==== CuCl2 + 2H2 O
51. 盐酸和氢氧化钙反应:2HCl + Ca(OH) 2 ==== CaCl2 + 2H2 O
52. 盐酸和氢氧化铁反应:3HCl + Fe(OH) 3 ==== FeCl3+ 3H2 O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH) 3==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2 SO4 + 2NaOH ==== Na2 SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO 4+ 2KOH ==== K2SO4 + 2H2 O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH) 2 ==== CuSO4 + 2H2 O
57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH) 3==== Fe2 (SO4) 3 + 6H2 O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2 O
(6)酸+ 盐-------- 另一种酸+ 另一种盐
59.大理石与稀盐酸反应:CaCO 3+ 2HCl === CaCl2 + H2 O + CO2
60.碳酸钠与稀盐酸反应: Na2CO 3+ 2HCl === 2NaCl + H2 O + CO2
61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2 O + CO2
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl + HNO3
63.硫酸和碳酸钠反应:Na2CO3 + H2 SO4 === Na2SO4 + H2 O + CO2
64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 + 2HCl (7)碱+ 盐-------- 另一种碱+ 另一种盐
65.氢氧化钠与硫酸铜:2NaOH + CuSO4==== Cu(OH) 2 + Na2 SO4
66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH) 3 + 3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH) 2 + 2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH) 2 + 2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH) 2 + Na2CO3=== CaCO3+ 2NaOH (8)盐+ 盐----- 两种新盐
70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3==== AgCl+ NaNO3
71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4 + 2NaCl
五.其它反应:
72.二氧化碳溶解于水:CO2 + H2O === H2 CO3
73.生石灰溶于水:CaO + H2 O === Ca(OH) 2
74.氧化钠溶于水:Na2 O + H2 O ==== 2NaOH
75.三氧化硫溶于水:SO3 + H2 O ==== H2 SO4
76.硫酸铜晶体受热分解:CuSO45H2 O 加热CuSO4 + 5H2 O
77.无水硫酸铜作干燥剂:CuSO4 + 5H2 O ==== CuSO45H2 O
以上就是查字典化学网为大家提供的化学方程式,大家仔细阅读了吗?加油哦!。
