常用的分离和富集方法习题
分析化学中常用的分离和富集方法

分析化学中常用的分离和富集方法1.蒸馏法:蒸馏是根据溶液中各组分的沸点差异来进行分离的方法。
通过加热混合液体使其汽化,然后再冷凝收集汽化物,从而分离不同沸点的组分。
蒸馏法适用于溶液中的挥发性组分富集和纯化。
2.萃取法:萃取是利用两种或多种不相溶液体的亲和性差异将待分析的组分从混合体系中转移到单一溶剂中的分离方法。
常见的有液液萃取和固相萃取。
萃取法适用于挥发性差异较小的物质分离。
3.结晶法:结晶是根据物质在溶液中的溶解度差异来进行分离的方法。
通过逐渐降低溶解度使其中一种或几种溶质结晶出来,从而实现分离和富集。
结晶法适用于固体组分富集和纯化。
4.洗涤法:洗涤是通过溶解或稀释洗涤剂来将带有目标分子的样品与杂质分离的方法。
洗涤法适用于固态、液态和气态混合物中分离和富集。
5.离子交换法:离子交换是通过离子交换树脂的吸附作用来分离和富集组分的方法。
树脂上的离子可与溶液中的离子发生交换,从而实现目标组分的富集。
离子交换法适用于溶液中离子的分离和富集。
6.气相色谱法:气相色谱是一种利用气相色谱柱对待分析物进行分离的方法。
根据化合物在不同固定相上的吸附特性差异进行分离和富集。
气相色谱法适用于气态和挥发性物质的分离和富集。
7.液相色谱法:液相色谱是一种利用液相色谱柱对待分析物进行分离的方法。
根据待分析物在流动相和固定相之间的分配系数差异进行分离和富集。
液相色谱法适用于液态和溶液中的分离和富集。
8.电泳法:电泳是一种利用电场对待分析物进行分离和富集的方法。
根据待分析物在电场中的迁移速度差异来分离和富集。
电泳法适用于溶液中离子和带电粒子的分离和富集。
以上是常见的分离和富集方法,每一种方法在不同场合的适应性和分离效果各有差异。
在实际应用中,需要根据具体情况选择合适的方法。
不同的分析问题可能需要结合多种方法的优势来达到理想的分析结果。
常用的分离和富集方法习题及答案.

第十章 常用的分离和富集方法习题及答案一、 选择题1、用均匀分配法重结晶BaSO 4(常量组分)和PbSO 4(微量组分),每结晶一次,使BaSO 4析出一半。
已知结晶系数为10,当经10次重结晶时,结晶出的常量组分为原来的百分数[由ny )21(=公式得出]是 A 、6.9761 B 、10241C 、2441D 、66.9712、用非均匀分配法对PbCrO 4(常量组分)和BaCrO 4(微量组分)进行重结晶,每结晶一次,使PbCrO 4析出一半。
已知结晶系数为10,当经10次重结晶时,微量组分析出的百分数[由nx )211(λ-=公式得出]是A 、95.1%B 、85.1%C 、90.1%D 、75.1%3、含0.010gFe 3+的强酸溶液,用乙醚萃取时,已知其分配比为99,则等体积萃取一次后,水相中残存Fe 3+量为A 、0.10mgB 、0.010mgC 、1.0mgD 、1.01mg4、萃取过程的本质可表述为A 、金属离子形成螯合物的过程B 、金属离子形成离子缔合物的过程C 、络合物进入有机相的过程D 、将物质由亲水性转变为疏水性的过程5、用等体积萃取要求进行两次萃取后,其萃取率大于95%,则其分配比必须大于A 、10B 、7C 、3.5D 、26、移取25.00mL 含0.125g I 2的KI 溶液,用25.00mLCCl 4萃取。
平衡后测得水相中含0.00500g I 2,则萃取两次的萃取率是A 、99.8%B 、99.0%C 、98.6%D 、98.0% 7、属阳离子交换树脂是A 、RNH 3OHB 、RNH 2CH 3OHC 、ROHD 、RN(CH 3)3OH8、根据离子的水化规律,判断含Mg 2+,Ca 2+,Ba 2+,Sr 2+离子混合液流过阳离子交换树脂时,最先流出的离子是A 、Ba 2+B 、Mg 2+C 、Sr 2+D 、Ca 2+二、填空题1、离子交换法用于Fe 3+、Al 3+的分离时,先用盐酸处理溶液,使Fe 3+、Al 3+分别以____________形态存在。
第八章分析学中常用的分离和富集方法

第八章分析化学中常用的分离和富集方法在实际工作中,遇到的样品往往含有多种组分,进行测定时常常发生干扰,不仅影响结果的准确度,甚至无法测定,为了消除干扰,比较简单的方法是控制分析条件或加入掩蔽剂。
但很多情况仅此不够,必须把待测组分与干扰组分分离,有时为了测定试样中痕量组分,在进行分离的同时,也进行必要的浓缩和富集。
以保证分析结果的准确度。
对于常量组分的分离和痕量组分的富集,总的要求是分离要完全,即:待测组分的回收率要符合一定要求。
待测组分的回收率:对于常量组分 (>1%) : R T>99% ( 接近 100%)对于微量组分: R T>90%常见的分离方法: 1 .沉淀分离2 .萃取分离3 .离子交换分离4 .色谱分离5 .气浮分离6 .挥发和蒸馏分离第一节沉淀分离法沉淀分离是利用沉淀反应进行分离的方法。
根据难溶化合物的溶解度不同,利用沉淀反应进行分离,在试液中加入适当沉淀剂,使待测组分沉淀出来或将干扰组分沉淀除去。
从而达到分离的目的。
它主要有:无机沉淀剂沉淀分离法有机沉淀剂沉淀分离法共沉淀分离法。
( 还有均相沉淀法 )一、无机沉淀剂沉淀分离法无机沉淀剂沉淀分离法很多,形成沉淀的类型也很多,本书只对M (OH ) n ↓和硫化物沉淀简单介绍.例如: Fe(OH)3,,当 [时,刚析出沉淀时pH ≥ 2.18 ;沉淀完全时pH ≥ 3.51 。
因此,氢氧化物是否能沉淀完全,取决于溶液的酸度。
NaOH Fe(OH)3沉淀剂: NH3·H2O → Mg(OH)2WO3 xH2O 等ZnO 等 SiO2·xH2O两种离子是否能借M(OH)n↓ N(OH)n↓ ( 氢氧化物沉淀 ) 完全分离,取决于它们溶解度的相对大小表 8-1 是假定开始时=0.01mol/L ,残留浓度mol/L( 沉淀完全 ) 时,部分氢氧化物的 pH ( 由 KSP 计算出来的 ), 此数值仅供参考。
4 第四章 环境样品预处理中常用的分离与富集方法-2014

例:用双硫腙-氯仿萃取水中痕量Ag、Cd d、Ni i、Pb b等元 素;用吡咯烷二硫代氨基甲酸铵(APDC)-甲基异丁酮 (MIBK)萃取水中痕量Co、Cr、Cu等元素
13
14
(三)萃取条件的选择 螯合物萃取体系
螯合剂(K稳,分配比) 酸度(低) 萃取剂(相似相容)
离子缔合物萃取体系
萃取剂(
测定方案:取1000mL水,调至微酸性。加入Hg2+,通入H2S 气体,使 与S2+生成HgS沉淀,将Pb2+共沉淀下来,然后用 2mL酸将沉淀溶解测 定(此时Pb2+浓度提高了500倍)。 HgS称为载体或捕集剂。
载体分为无机载体和有机载体两大类 常用的无机载体有Fe(OH)3、 Al(OH)3、 Ga(OH)3、 Mg(OH)2、 MnO(OH)2、硫化物等。 如利用Fe(OH)3分离富集天然水中痕量组分As、Cd、Co、Cr、 Cu、Ni等后用AAS法测定。
吸附能力的强弱 相对分子质量或密度的不同 渗透压的不同 沸点或蒸汽压不同 颗粒或分子大小差别 物质在两种液体中的分配系数不 同 蒸汽压不同 与固定相作用力的不同 物质在不同溶剂中的溶度积不同 在不同溶剂中的溶解度不同 蒸汽压不同 以表面活性剂的浊点现象为基础
气体、液体及可溶的固体 不同相态或相对分离质量相差较大的物质 分子与离子或渗透压不同的物质 各种液体 液-固分离 在两种液相中溶解度差别很大的物质
是否能最大限度地除去影响测定的干扰物 被测组分的回收率是否高 操作是否简便、省时 成本是否低廉 是否影响人体健康及环境 应用范围尽可能广泛,尽量适合各种分析测定方法 是否适用于野外或现场操作
冷冻干燥法 柱色谱 √ 沉淀法 √ 索氏提取法 真空升华法 浊点萃取法
分析化学中常用的分离和富集方法
3 溶于CHCl3
亲水 水合离子的正电性被中 和,亲水的水分子被疏 水有机大分子取代
疏水
8-羟基喹啉
萃取剂
CHCl3
溶剂
3.反萃取
Back extraction
萃取的反过程(将组分从有机溶液中萃取到水溶液中)
如:8-羟基喹啉铝螯合物中加入1mol/L HCl
12
4. 分配系数与分配比 分配系数 partition coefficient HA (w) HA (o)
常用分离方法
沉淀分离法 溶剂萃取分离法
Precipitation Solvent extraction Ion exchange
离子交换分离法
色谱分离法
挥发和蒸馏分离法
Chromatography
Volatilization and distillation
11.3沉淀分离与富集 ——依据溶度积分硫酸盐、卤化物、磷酸盐等 有机沉淀剂:草酸、铜铁试剂、铜试剂、丁二酮肟、苦杏仁酸等
例如常见阳离子的两酸两碱分离
分组 组试剂 Ⅰ HCl Ag Hg (I) (Pb) Ⅱ H2SO4 Ca Sr Ba Pb Ⅲ NH4Cl - NH3 Ⅳ NaOH Ⅴ 可溶组* Na K Zn NH4+
萃取分离法 在含有被分离物质的水溶液中,加入 萃取剂和与水不相混溶的有机溶剂,
震荡,利用物质在两相中的分配不同
的性质,使一些组分进入有机相中, 使另一些组分仍留在水相中,从而达
到分离的目的。
梨形分液漏斗
例:I2的萃取
11.4.1 萃取分离的基本原理
1. 萃取分离的依据 hydrophilic 物质 hydrophobic 亲水性 离子型化合物 极性
化学检验员(高级)练习题及参考答案

化学检验员(高级)练习题及参考答案一、单选题(共67题,每题1分,共67分)1.用高效液相色谱法梯度流脱时不能采用()A、荧光检测器B、紫外/可见检测器C、蒸发光散射检测器D、示差折光检测器正确答案:C2.当置信度为0.95时,测得Al203的μ置信区间为(35.21±0.10)%,其意义是()A、在所测定的数据中有95%在此区间内B、若再进行测定,将有95%的数据落人此区间内C、总体平均值μ落人此区间的概率为0.95D、在此区间内包含μ值的概率为0.95正确答案:D3.基准物质NaCl在使用前预处理方法为( ),再放于干燥器中冷却至室温。
A、在140~150℃烘干至恒重B、在270~300℃灼烧至恒重C、在105~110℃烘干至恒重D、在500~600℃灼烧至恒重正确答案:D4.在pH =5时(lgaY(H)=6.45),用O.Olmol/L的EDTA滴定O.Olmol/L的金属离子,若要求相对误差小于0.1%,则可以滴定的金属离子为()A、Mg2+(lgKMgY=8.7)B、Ca2+(lgKCaY=lO.69)C、Ba2+(lgKBaY=7.86)D、Zn2+(lgKZnY=16.50)正确答案:D5.滴定分析中要求测定结果的误差应()A、没有要求B、等于零C、小于允许误差D、略大于允许误差正确答案:C6.NaOH滴定H3P04以酚酞为指示剂,终点时生成()。
(已知H3P04的各级离解常数:Kal=6.9×l0-3,Ka2 =6.2×l0-8,Ka3=4.8×l0-13)A、Na2HP04B、Na3P04C、NaH2P04D、NaH2P04+Na2HP04正确答案:A7.测汞仪的工作原理是吸收池中的汞原子蒸气对汞灯发出的()nm 紫外光具有选择吸收作用,测定吸光度,即可对试样中的汞进行定量分析。
A、285.2B、253.7C、235.7D、228.8正确答案:B8.邻二氮菲分光光度法测水中微量铁的试样中,参比溶液是采用()。
分离富集作业

1.简述分离的重要性及分离富集技术的发展趋势。
(500字以上,5—10篇文献)
2.什么是回收率、分离因数?分离时对常量组分和痕量组分的回收率、分离因数要求如何P7
3.常用的控制溶液PH的方法有哪些?
4.临界过饱和度的概念
5.均相沉淀法原理的概念
6.共沉淀分离法的概念
7.表面吸附共沉淀痕量组分的选择性服从哪些经验规律
8.典型的混晶的概念
9.某有机酸在乙醚与水中的分配比是 2.50,将5.00g溶于100ml水中形成水溶液
(1)用乙醚萃取三次,每次乙醚用量20ml
(2)用60ml乙醚萃取1次
试分别计算残留在水相中酸的克数
10.课本152页,第4,9题。
分析化学中常用的分离和富集方法

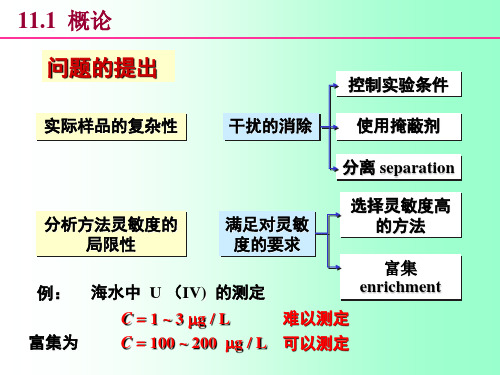
第8章 分析化学中常用的分离和富集方法8.1 概述分离和富集是定量分析化学的重要组成部分。
当分析对象中的共存物质对测定有干扰时,如果采用控制反应条件、掩蔽等方法仍不能消除其干扰时,就要将其分离,然后测定;当待测组分含量低、测定方法灵敏度不足够高时,就要先将微量待测组分富集,然后测定。
分离过程往往也是富集过程。
对分离的要求是分离必须完全,即干扰组分减少到不再干扰的程度;而被测组分在分离过程中的损失要小至可忽略不计的程度。
被测组分在分离过程中的损失,可用回收率来衡量。
1. 回收率(R ) 其定义为:%100⨯==分离前待测组分的质量分离后待测组分的质量R对质量分数为1%以上的待测组分,一般要求R >99.9%;对质量分数为0.01%~1%的待测组分,要求R >99%;质量分数小于0.01%的痕量组分要求R 为90%~95%。
例1. 含有钴与镍离子的混合溶液中,钴与镍的质量均为20.0mg ,用离子交换法分离钴镍后,溶液中余下的钴为0.20mg ,而镍为19.0mg,钴镍的回收率分别为多少?解:%0.10.2020.0 %,0.950.200.19Co Ni ====R R2. 分离因子S A/B分离因子S B/A 等于干扰组分B 的回收率与待测组分A 的回收率的比,可用来表示干扰组分B 与待测组分A 的分离程度。
%100/⨯=ABA B R R SB 的回收率越低,A 的回收率越高,分离因子越小,则A 与B 之间的分离就越完全,干扰消除越彻底。
8.2 沉淀分离法沉淀分离法是一种经典的分离方法,它是利用沉淀反应选择性地沉淀某些离子,而与可溶性的离子分离。
沉淀分离法的主要依据是溶度积原理。
沉淀分离法的主要类型如下表。
8.2.1常量组分的沉淀分离1. 氢氧化物沉淀分离大多数金属离子都能生成氢氧化物沉淀,各种氢氧化物沉淀的溶解度有很大的差别。
因此可以通过控制酸度,改变溶液中的[OH-],以达到选择沉淀分离的目的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常用的分离和富集方法习题
1.试说明定量分离在定量分析中的重要作用。
答:在实际的分析工作中,遇到的样品往往含有各种组分,当进行测定时常常彼此发生干扰。
不仅影响分析结果的准确度,甚至无法进行测定,为了消除干扰,较简单的方法是控制分析条件或采用适当的掩蔽剂,
但在有些情况下,这些方法并不能消除干扰,因此必须把被测元素与干扰组分分离以后才能进行测定。
所以,定量分离是分析化学的主要内容之一。
2.何谓回收率?在回收工作中对回收率要求如何?
答:回收率是用来表示分离效果的物理量,回收率越大,分离效果越好,一般要求R A >90~95%即可。
3.何谓分离率?在分析工作中对分离率的要求如何?
答:分离率表示干扰组分B 与待测组分A 的分离程度,用表示S B/A ,S B/A 越小,则R B 越小,则A 与B 之间的分离就越完全,干扰就消除的越彻底。
通常,对常量待测组分和常量干扰组分,分离率应在0.1%以下;但对微量待测组分和常量干扰组分,则要求分离率小于10-4%。
4.有机沉淀剂和有机共沉淀剂有什么优点。
答:优点:具有较高的选择性,沉淀的溶解度小,沉淀作用比较完全,而且得到的沉淀较纯净。
沉淀通过灼烧即可除去沉淀剂而留下待测定的元素。
5.何谓分配系数、分配比?二者在什么情况下相等?
答:分配系数:是表示在萃取过程中,物质进入有机溶剂的相对大小。
分配比:是该物质在有机溶剂中存在的各种形式的浓度之和与在水中各存在形式的浓度之和的比值,表示该物质在两相中的分配情况。
当溶质在两相中仅存在一种形态时,二者相等。
6.为什么在进行螯合物萃取时控制溶液的酸度十分重要?
答:在萃取过程中,溶液的酸度越小,则被萃取的物质分配比越大,越有利于萃取,但酸度过低则可能引起金属离子的水解,或其他干扰反应发生,应根据不同的金属离子控制适宜的酸度。
7.解释下列各概念:交联度,交换容量,比移值。
答:交联度:在合成离子交换树脂的过程中,将链状聚合物分子相互连接而形成网状结构的过程中,将链状聚合物分子连接而成网状结构的过程称为交联。
交换容量:表示每克干树脂所能交换的相当于一价离子的物质的量。
是表征树脂交换能力大小的特征参数,通常为3~6 mmol/g。
:表示某组分再滤纸上的迁移情况。
比较值R
f
8.在离子交换分离法中,影响离子交换亲和力的主要因素有那些?
答:离子亲和力的大小与离子所带电荷数及它的半径有关,在交换过程中,价态愈高,亲和力越大,对于同价离子其水化半径越大,(阳离子原子序数越大)亲和力越小。
9.柱色谱、纸色谱、薄层色谱和离子交换色谱这几种色谱分离法的固定相和流动相各是什么?试比较它们分离机理的异同。
异同见表:
10.溶液含Fe3+10mg,采用某种萃取剂将它萃入某种有机溶剂中。
若分配比D=99,用等体积有机溶剂分别萃取1次和2次在水溶液中各剩余Fe3+多少毫克?萃取百分率各为多少?
解:
=0.1mg
=0.001mg
11.将一种螯合剂HL 溶解在有机溶剂中,按下面反应从水溶液中萃取金属离子M 2+:
M
2+
(水)
+2HL (有)==ML 2(有)+2H +
(水)
反应平衡常数K=0.010。
取10mL 水溶液,加10mL 含HL0.010mol/L 的有机溶剂萃取M 2+.设水相中的HL 有机相中的M 2+可以忽略不计,且因为M 2+的浓度较小,HL 在有机相中的浓度基本不变。
试计算:(1)当水溶液的pH=3.0时,萃取百分率等于多少?(2)如要求M 2+的萃取百分率为99.9﹪,水溶液的pH 应调至多大?
解:∵
1
1 起始
1-X/2 1-X/2
反应
X 1-X/2 剩余
因为,[M 2+]很小,故,1-X/2=1/2
∴
,X=0.5,萃取百分率=50%
2)同理有,
解得,[H+]=4.47×10-5 mol/L, pH=4.35.
12.用某有机溶剂从100mL含溶质A的水溶液中萃取A。
若每次用20mL有机溶剂,共萃取两次,萃取百分率可达90.0﹪,计算机该取体系的分配比。
解:∵
∴萃取百分率=
D=10.8
=44.5。
若将HB从50.0mL水溶液13.某弱酸HB在水中的Ka=4.2×10-5,在水相与某有机相中的分配系数K
D
中萃取到10.0 mL有机溶液中,试分别计算pH=1.0和pH=5.0时的萃取百分率(假如HB在有机相中仅以HB一种形体存在)。
解:依据题意有:
根据弱酸电离平
14.称取1.500g氢型阳离子交换树脂,以0.09875mol.L-1NaOH50.00mL浸泡24h,使树脂上的H+全部被交换到溶液中。
在用0.1024mol/LHCl标准溶液滴定过量的NaOH,用去24.50mL。
使计算树脂的交换容量。
解:交换容量=)
==
15.称取1.0g氢型阳离子交换树脂,加入100mL含有1.0×10-4mol/LAgNO
3的0.010mol/LHNO
3
溶液,使交换
反应达到平衡。
计算Ag+的分配系数和Ag+被交换到树脂上的百分率各为多少?已知K
Ag/H
=6.7,树脂的交换容量为5.0mmol/g。
解: 在原始溶液中,
因为Ag+的亲和力大于H+,Ag+几乎全部进入树脂相,故有
[H+]=0.010+1.0×10-4=0.0101 mmol/mL 因为 =所以有
故在树指中的Ag+的质量分数为
16.将0.2548gNaCl和KBr的混合物溶于水后通过强酸性阳离子交换树脂,经充分交换后,流出液需用0.1012mol.L-1NaOH35.28mL滴定至终点。
求混合物中NaCl和KBr的质量分数。
解:设混合物中NaCl的物质的量为x mol,KBr的物质的量为y mol。
根据题意,有,
58.44x +119.00y=0.2548 (1)
x + y =0.1012×35.28×10-3 (2)
联立(1)(2)式,解得x=2.808 ×10-3 mol ,y=7.624×10-4 mol 代入下式得
17.用纸色谱法分离混合物中的物质A和B,已知两者的比移值分别为0.45和0.67。
欲使分离后两斑点中心相距3.0cm,问滤纸条至少应长多少厘米?
解:根据题意得
设,原点至斑点中心的距离y, 原点至溶剂前沿的距离为x
∴0.45=y/x (1)
0.67=y+3/x (2)
联立(1)(2)式:
解得: x=13.6cm y=6.1cm
答:滤纸条至少长14厘米。
