以“物质的量”为中心的计算PPT课件
合集下载
物质的量化学计算省公开课一等奖全国示范课微课金奖PPT课件

12/46
12
【解析】本题考查物质量浓度、质量分数之间计算等
知识。
在1 L溶液中:w=
1L cmol L 117g mol 1
1L 1000mL L 1 r g mL 1
= 17c r,B项正确。
1000
w=
=
17V
,C项正确。
17V 22400
13/46
13
答案:A
14/46
14
【解法指点】 在计算溶液物质量浓度(c)、质量
Cu+2H2SO4(浓) △ CuSO4+2H2O+SO2↑
28/46
28
(4) 因为Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=2.2×1020,当溶液pH=8时,c(OH-)=10-6,所以c(Cu2+)= 2.2×10-8;硫酸铜溶液中通入过量H2S气体时反应化 学方程式为:CuSO4+H2S H2SO4+CuS↓,忽略 体积改变,依据原子守恒可知生成硫酸浓度是 0.1 mol·L-1,所以H+浓度是0.2 mol·L-1。
20/46
20
(5) 配制一定体积、一定物质量浓度溶液试验误差主要原 因: ① 称量时引发误差,使所配溶液中溶质物质量浓度偏高 或偏低; ② 用于溶解稀释溶液烧杯未用蒸馏水洗涤,使溶质物质量 降低,致使溶液中溶质物质量浓度偏低; ③ 转移或搅拌溶液时有部分液体溅出,致使溶液中溶质物 质量浓度偏低; ④ 在给容量瓶定容时,仰视读数会使溶液体积增大,致使 溶液中溶质物质量浓度偏低;俯视读数会使溶液体积减小, 致使溶液中溶质物质量浓度偏高。
21/46
21
三、计算方法
(1)化学方程式法
【例4】将22.4 L某气态氮氧化合物与足量灼热铜粉
化学常用计量PPT课件 人教课标版

• 一些引起误差的操作总结如下:
引起误差的操作 砝码生锈 托盘 天平 易潮解的药品 (NaOH等)称量 时间过长 用量筒量取液体溶 质时量筒内有水m 原因 m增大 c(mol/L) 偏大
m减小
减小
偏小
偏小
量筒
用量筒量取液体时 俯视读数m
减小
偏小
9
• 续 表 引起误差的操作
烧杯、 没洗涤烧杯和玻璃棒m 玻璃棒 搅拌时有少量液体溅出m 容量瓶中有少量蒸馏水 定容时,加水超过了刻度 容量瓶 线 定容时,仰视刻度线
16
• 方法指导:阿伏加德罗常数的运用是高考 中一种传统试题,这类题目常考常新,它 涉及的范围广泛,设置的知识点灵活多样 ,可能与物质的结构和元素化合物的性质 等知识综合起来考查,每一个选项都设有 易疏忽的“陷阱”。在解答这类题目时,一 是要认真审题,注意物质的组成和构成微 粒,在使用气体摩尔体积时要检查物质的 状态是否为气体以及是否在标准状况下, 发生化学反应要弄清其产物;二是要落实 好对物质的量与微粒(原子、分子、离子等) 数目、气体体积(标准状.摩尔质量是指单位物质的量的物质所具 有的质量,物质的摩尔质量在数值上等于其微 粒的相对原子质量或相对分子质量。其单位是 克/摩(或 g· mol-1)。 • 4. 单位物质的量 的气体所占的体积叫气 体的摩尔体积,1 mol气体在 。 标准状况(0 ℃、 • 时,所占的体积约为 。物 1标准大气压) 22.4 L 质的量浓度是以单位体积溶液里所含溶质B的 物质的量来表示的溶液浓度的物理量,单位为 mol· L-1。
23
• (1)该问可直接利用物质的量浓度和质量 分数的换算公式求解。
M ( N a O H ) c ( N a O H ) V N a O H w 1 0 0 % m ( N a O H 溶 液 )
物质的量气体摩尔体积PPT课件

解析 (1)①22 g 二氧化碳的物质的量为442g2/mg ol=0.5 mol; ②8 g 氢气的物质的量为2 g8/mg ol=4 mol; ③1.204×1024 个氮气分子的物质的量为6.012.×210042×31m02o4l-1=2 mol,质量为
2 mol×28 g/mol=56 g; ④4 ℃时 18 mL 水,其质量为 18 mL×1 g/mL=18 g,物质的量为181g8/mg ol= 1 mol;
A.1.5NA 2 mol C.3.01×1023 4 mol
Hale Waihona Puke B.1.5NA 32 g D.NA 64 g
【对点练2】 (平均摩尔质量的计算)根据相关量的关系,完成下列填空:
(1)由8 g O2和28 g N2组成的混合气体的平均摩尔质量是________。 (2)在空气中N2、O2、Ar的体积分数分别约为78%、21%、1%,则空气的平均 摩尔质量为________。
同压下,同质量的三种气体,密度和相对分子质量成正比,三种气体密度最小的是
X,故 C 正确;同温同体积气体物质的量之比等于压强之比,Y、Z 气体的压强比 m(Y)
为pp((YZ))=nn((YZ))=Mmr((ZY))=mm( (YZ))··MMrr((YZ))=2×12=4∶1,故 D 错误。 Mr(Z)
解析 (2)1 mol Na2R 中含 2 mol Na+,题目中有 Na+ 0.4 mol,则有 0.2 mol Na2R。 运用公式 M=mn 得mn((NNaa22RR))=01.22.m4 gol=62 g·mol-1。Mr(Na2R)=62,求得 Mr(R) =62-2×23=16。根据 n=Mm,得 n(R)=0.1 mol,则 n(Na2R)=0.1 mol。
2.3物质的量 课件(共28张ppt)高中化学人教版2019高中化学必修一

④集体化 物质的量可以表示多个微粒的特定组合或集合体,如 1 mol NaCl, 0.5 mol H2SO4
判断:
1mol大米 × 1 摩尔氧 × 1 摩尔氧原子 √ 3 摩尔 H2O √ 0.5 摩尔二氧化碳分子 √ 物质的量即是物质的质量,也是物质的数量 × 摩尔是7个基本物理量之一 ×
注意事项:
①专有化 “物质的量”四个字是一个整体,不能拆开,也不能添字。 如不能说成“物质量”或“物质的数量”等
②微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、 电子等,不能表示宏观的物质,如米
③具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧”
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
注意事项:
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数。 (2)不能认为1 mol粒子等于6.02×1023个,也不能认为 6.02×1023就是阿伏加德罗常数 (3)在计算时采用近似值6.02×1023mol-1
一个惊人的数字
这些物质中粒子数目非常庞大,不可能一个一个去数
生活中的计生量活中物品以什么方式计量?
大件物品以单个方式计量
情境引入 生活中物品以什么方式计量?
小件物品按一定的标准打包为一个集合体
微观粒子
物质的量
是国际单位制七个基本物理 量之一。
X个
物理量 长度 时间
物质的量 热力学温度
电流 发光强度
质量
......
8g
C: 12g/mol
2 molC
24g
H2O: 18g/mol 10 molH2O
180g
判断:
1mol大米 × 1 摩尔氧 × 1 摩尔氧原子 √ 3 摩尔 H2O √ 0.5 摩尔二氧化碳分子 √ 物质的量即是物质的质量,也是物质的数量 × 摩尔是7个基本物理量之一 ×
注意事项:
①专有化 “物质的量”四个字是一个整体,不能拆开,也不能添字。 如不能说成“物质量”或“物质的数量”等
②微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、 电子等,不能表示宏观的物质,如米
③具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧”
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
注意事项:
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数。 (2)不能认为1 mol粒子等于6.02×1023个,也不能认为 6.02×1023就是阿伏加德罗常数 (3)在计算时采用近似值6.02×1023mol-1
一个惊人的数字
这些物质中粒子数目非常庞大,不可能一个一个去数
生活中的计生量活中物品以什么方式计量?
大件物品以单个方式计量
情境引入 生活中物品以什么方式计量?
小件物品按一定的标准打包为一个集合体
微观粒子
物质的量
是国际单位制七个基本物理 量之一。
X个
物理量 长度 时间
物质的量 热力学温度
电流 发光强度
质量
......
8g
C: 12g/mol
2 molC
24g
H2O: 18g/mol 10 molH2O
180g
物质的量PPT下载优秀课件1

4
物质
化学式:正化合价总数=|负化合价总数|
电解质溶液:所有阳离子所带正电荷总数 =所有阴离子所带负电荷总数 物料守恒
【 例2】将13.4g KBr和 KCl的混合物溶于水,配成
500mL溶液,通入过量的Cl2,反应后将溶液蒸干得到 11.18g固体,所配溶液中K+、Cl-、Br-物质的量浓度
之比为( A )
电解质溶液:所有阳离子所带负电荷总数
=所有阴离子所带负电荷总数和物料守恒
氧化
还原 反应
单一反应:氧化剂得电子总数=还原 剂失电子总数
多个连续反应:找出化合价在变化前 后真正变化的物质及所反应的量
循遵
离子反应 :等号两边离子所带电荷总数相等
电化学 阳(负)极失电子总数=阴(正)极得电子总数 反应 串联的原电池(电解池),各极上转移电子
物质的量 守恒思想
05.08.2020 1
“物质的量” 是中学化学计算的核心。而守恒法 是化学计算中应用较广的一种方法。根据守恒量的 特征, 守恒法可分为:质量守恒、原子(原子团)守 恒、电子守恒、电荷守恒等。
凡是涉及到物质的量方面的计算,一般都可找到 相应的守恒关系,在很多情况下,都可应用守恒关系 求解。
【 例5】在一定条件下,RO3x-和 F2可以发生如 下反应: RO3x- + F2+ 2OH- = RO4-+ 2F- + H2O, 从而可知在RO3x-中元素R的化合价是( B )
A. +4 B. +5 C. +6 D. +7
13
物质
化 学 变 化
化学 反应
化学式:正化合价总数=|负化合价总数|
A、3∶2∶1
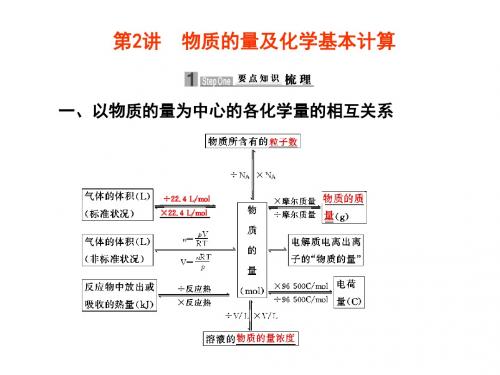
第2讲物质的量及化学基本计算
D项,
正确。
m (a b) g 1 000 ( a b) g/L ,因此只有选项C 3 V V 10 L V
答案 C
考点四
一定物质的量浓度的溶液的配制及误差 分析
【例4】 实验室配制500 mL 0.5 mol/L的NaCl溶 ①把称量的NaCl晶体放入小烧杯中, ②把①所得溶液小心转入500 mL容 ③继续向容量瓶中加蒸馏水至液面距刻度2~3 cm 处,改用胶头滴管小心滴加蒸馏水至溶液凹液面
(填“偏高”、“偏低”或
(5)若实验过程中出现如下情况应如何处理?加蒸
馏水时不慎超过了刻度 面 取。(3)根据c=
n ,V偏小,c V
。向容量 。
瓶中转移溶液时(操作步骤②)溶液流到容量瓶外
解析 (2)为防止仪器的遗漏,可根据步骤进行选
(4)加蒸馏水超过刻度,V偏大,c偏低这种情况
下配制的溶液浓度不是0.5 mol/L,因此要重配。 答案 (1)①②④③⑤ (2)500 mL容量瓶、托盘天
有关阿伏加德罗常数的应用问题,实质上是以 物质的量为中心的各物理量间的换算,需要特别注 1.状态问题,如标准状况下SO3为固态,戊烷为
液态。标准状况下的气体适用气体摩尔体积
(22.4 L/mol),相同状况下的气体适用阿伏加德罗 2.特殊物质的摩尔质量,如D2O、18O2 3.物质分子中的原子个数,如O3、白磷、稀有气 4.某些物质中的化学键,如SiO2、P4、CO2等。
24
如加入足量强碱并加热可得到c mol NH3,则原溶液
中的Al3+离子浓度(mol/L)为
2b c A. 2a
(
D. 2b c
6a
)
B. 2b c
【高中化学】物质的量复习课PPT课件

概念公式 知识网络 浓度配制
例题习题 计算题型
计算技巧
2001.1.9
1
一理清概念体系,重在理解记忆
概念公式 知识网络 浓度配制
1.关系
基本物理量 导出量 摩尔质量
例题习题 计算题型
计算技巧
N n NA
微粒数 物质的量
摩尔体积
m g/mol M n
单位:mol
V Vm , 0 L/mol n
浓度配制 m
×M
N
例题习题
1.下列说法不正确的是( ) 计算题型 A.常温常压下,1摩氦气含有的原子为2NA B.2.3g钠变成钠离子时失去0.1NA个电子 计算技巧 C.1摩水的质量与N 个水分子的质量相等 A D.标准状况下,22.4L甲烷和氢气混合物 所含的分子数为NA 2001.1.9 5
C
全是气体:2A=B+2C+2D,测得产生的 计算技巧 混合气体对氢气的相对密度为d,则A的 相对分子质量是()
2001.1.9
A. 2d B. 2.5d C.5d D.0.8d
7
概念公式 知识网络
二以物质的量为中心建立各物理量 间的关系
ρ
V n
× NA ×V
浓度配制 m
×M
m M M 2 2 .4 ρ n N M1 D M2
2001.1.9 9
概念公式 知识网络
二以物质的量为中心建立各物理量 间的关系
ρ
V n
× NA ×V
5.有关溶液浓度的计算
×Vm
浓度配制 m
×M
例题习题 计算题型
C
m V ρ N CB 1000 ρ ω M C浓 V浓 C稀 V稀 C混 V混 C1 V1 C2 V2
例题习题 计算题型
计算技巧
2001.1.9
1
一理清概念体系,重在理解记忆
概念公式 知识网络 浓度配制
1.关系
基本物理量 导出量 摩尔质量
例题习题 计算题型
计算技巧
N n NA
微粒数 物质的量
摩尔体积
m g/mol M n
单位:mol
V Vm , 0 L/mol n
浓度配制 m
×M
N
例题习题
1.下列说法不正确的是( ) 计算题型 A.常温常压下,1摩氦气含有的原子为2NA B.2.3g钠变成钠离子时失去0.1NA个电子 计算技巧 C.1摩水的质量与N 个水分子的质量相等 A D.标准状况下,22.4L甲烷和氢气混合物 所含的分子数为NA 2001.1.9 5
C
全是气体:2A=B+2C+2D,测得产生的 计算技巧 混合气体对氢气的相对密度为d,则A的 相对分子质量是()
2001.1.9
A. 2d B. 2.5d C.5d D.0.8d
7
概念公式 知识网络
二以物质的量为中心建立各物理量 间的关系
ρ
V n
× NA ×V
浓度配制 m
×M
m M M 2 2 .4 ρ n N M1 D M2
2001.1.9 9
概念公式 知识网络
二以物质的量为中心建立各物理量 间的关系
ρ
V n
× NA ×V
5.有关溶液浓度的计算
×Vm
浓度配制 m
×M
例题习题 计算题型
C
m V ρ N CB 1000 ρ ω M C浓 V浓 C稀 V稀 C混 V混 C1 V1 C2 V2
物质的量完整课件(共39张PPT)

0.2
0.2
0.1
二、摩尔质量
1. 1mol物质的质量 2. 1mol 任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质 量或相对分
子质量相等。
3. 2. 摩尔质量 4. 〔1〕定义:单位物质的量的物质所具有的质量叫做摩尔质量,符号为M。 5. 〔2〕单位:g/mol 6. 〔3〕数值:数值等于该粒子的相对分子〔原子〕质量。
;分子数是
1.204 ×1024
。
〔6〕SO4- 摩尔质量是
,物质的量是
。
96 g/mol
9.6g
3. 物质的质量〔m),物质的量(n),摩尔质量(M)三者之间的关系
n m M
m n N
M
NA
【例题6】24.5gH2SO4 的物质的量是多少?
n (H 2 S4 O )M m ( (H H 2 2 S S4 4 O ) O ) 92 g 8 ./5 4 m g o 0 .2 lm 5ol
〔2〕标准状况下〔0℃,101kPa), 1mol 任何 气体的体积都约占22.4 L/mol。
25℃,101kPa时,气体摩尔体积约为24.5L/mol。
〔3〕计算公式:
V V 注意:
m
n ①22.4L/mol 使用条件:适用气体,且一般指标准状况,即0℃、101kPa。
②
适用对象:必须是气态物质,单一或混合气体均可用。
溶质的单位 溶液的单位
单位
公式
物质的量浓度
溶质的质量分数
mol
g
L
g
mol·L-1
CB
溶质的物质的(n量B) 溶液的体(积 V)
-
wB溶 溶质 液的 的((m m 质 质 B))量 1量 0% 0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3页
返回目录
结束放映
数字媒体资源库
➢2. 技能点拨
第4页
返回目录
结束放映
数字媒体资源库
1.基本公式 分母为基准,物质的量为比值。 n=Mm=NNA=VVm=c·V 溶液 (注意各符号意义及单位) (1()2物)物质质的的量量(n(n)、)、微气粒体数体(N积)、(V物)之质间的的质换量算(m)之间的换算 NVA2L2mN.4o标lL-1·准m=状oln-况(1mo=l)=n(mMoglm)·=mgoVlm-1LV ·mLol-1
涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的 混合物,且体积比为1∶1,则V可能为( )。 A
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
涉及反应→关键数据→极限分析法→计算
【思维启迪】 极限分析法:①若混合物全为CuS,其物质的
量为_0_.1_5__m_o_l,转移电子为_1_.2__m_o_l_;②若混合物全是Cu2S, 其物质的量为_0_.0_7_5__m__o_l ,转移电子为_0_._7_5_m__o_l_。
4NO +
6H2O,当有标准状况下 V L NH3 完全反应时,NH3 的物质的
量为22V.4 mol,转移电子数为252V.4 mol,已知在此反应中转移
电子数为 n,则 n=252V.4×NA,所以,NA=225.V4n,故选 D
➢解析显隐
第12页
返回目录
结束放映
数字媒体资源库
【训练2】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混 合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54 g沉 淀。下列说法不正确的是( D )。 A.该合金中铜与镁的物质的量之比是2∶1 B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L C.NO2和N2O4的混合气体中,NO2的体积分数是80% D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
解析 1 个 C2H4 分子中含共 用电子对数目为 6 对,碳氢键 数目为 4 个,1 个 C3H6 分子 中含共用电子对数目为 9 对, 碳氢键数目为 6 个,则 A 错 误(应该为 3aNA/14);C 项没 有说明氧气的状态;D 项含原 子总数为 3aNA/14,因此选 B。
④ng该氯原子所含的电子数为 17n ____a____。
第6页
返回目录
结束放映
数字媒体资源库
➢3.典例剖析
第7页
返回目录
结束放映
数字媒体资源库
【典例】 一定量的CuS和Cu2S的混合物投入足量的HNO3 中,收集到气体V L(标准状况),向反应后的溶液中(存在
Cu2+和
S)加O24入- 足量NaOH,产生蓝色沉淀,过滤,洗
第17页
返回目录
转 解析
结束放映
数字媒体资源库
【真题 2】(2013·上海,15)NA 代表 阿伏加德罗常数。已知 C2H4 和 C3H6 的混合物的质量为 a
g,则该混合物 ( B )
A.所含共用电子对数目为 (a/7+1)NA
B.所含碳氢键数目为 aNA/7 C.燃烧时消耗的 O2 一定是
33.6a/14 L D.所含原子总数为 aNA/14
结 子质量间的关系;③“强、弱、非”电解质与溶质粒子
归 纳
(分子或离子)数之间的关系,
3.“七个无关”:物质的量、质量、粒子数的多少均与
温度、压强的高低无关;物质的量浓度的大小与所取该
溶液的体积多少无关(但溶质粒子数的多少与溶液体积有
关)。
第10页
返回目录
结束放映
数字媒体资源库
➢4.跟踪训练
第11页
返回目录
结束放映
数字媒体资源库
【训练 1】工业上将氨气和空气的混合气体通过铂-铑合金网
发生氨氧化反应,若有标准状况下 V L 氨气完全反应,并转
移 n 个电子,则阿伏加德罗常数(NA)可表示为( D )。
11.2n A. 4V C. 5n
22.4n D. 5V
解 析 根 据 反 应 的 化 学 方 程 式 4NH3 + 5O2
注意:(1)任何状况下的任何气体均存在一个Vm。 (2)标准状况是指0 ℃、101 kPa,Vm=22.4 L·mol-1。 (3)以上计算公式只能适用于气体,在标准状况下, H2O、SO3、苯、己烷等都不是气体。
第5页
返回目录
结束放映
2.依据化学方程式计算的基本原理
物质的量之比
N2+3H2
2NH3
第8页
返回目录
转 解析
结束放映
数字媒体资源库
围绕“物质的量”为中心计算的三个要领
1.“两个前提”:在应用Vm=22.4 L·mol-1时,一定要 有“标准状况”和“气体状态”两个前提条件(混合气体
也适用)。
2.“三个关系”:①直接构成物质的粒子与间接构成物
总 质的粒子(原子、电子等)间的关系;②摩尔质量与相对分
第一章 化学常用计量
题型探究: 以“物质的量”为中 心的计算
➢ 1.题型分析 ➢ 2.技能点拨 ➢ 3.典例剖析 ➢ 4.跟踪训练 ➢ 5.真题演练
数字媒体资源库
➢1.题型分析
第2页
返回目录
结束放映
数字媒体资源库
题型分析: 考查内容:物质的量、摩尔质量、气体摩尔体积、物
质的量浓度及微粒数目、质量、标准状况下气体的 体积之间的换算,尤其是以阿伏加德罗常数的正误 判断对以上考点进行综合考查。 考查形式:选择题
第13页
返回目录
转 解析
结束放映
数字媒体资源库
➢5.真题演练
第16页
返回目录
结束放映
数字媒体资源库
【真题 1】(2014 上海卷,16)含有砒霜(As2O3)的试样和 锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完 全分解成单质砷和氢气。若砷的质量为 1.50mg,则 ( C ) A.被氧化的砒霜为 1.98mg B.分解产生的氢气为 0.672mL C.和砒霜反应的锌为 3.90mg D.转移的电子总数为 6×10―5NA
1∶3 ∶ 2
气体体积之比
1∶3 ∶ 2
物质的分子数之比 1 ∶ 3 ∶ 2
物质的质量之比 28∶ 6 ∶ 34
数字媒体资源库
计算时注意 上下单位相 同,左右单
位相当
某氯原子的质量是a g,12C原子的质量是b g,用NA表示 阿伏加德罗常数的值。
①该氯原子的相对原子质量为1_2_a_/_b_②m g该氯原子的物 质的量为_m__/(_a_N_A_)_m__ol ③该氯原子的摩尔质量是_a_N_A_g_/_mol
