常见元素的原子序数
27个元素符号记忆口诀

27个元素符号记忆口诀1.氢(H)-原子序数为1,最轻的元素,存在于气态或液态中,常见于水。
2.氦(He)-原子序数为2,无色、无臭、无毒的气体,存在于太阳和其他恒星中,广泛用于气球充气。
3.锂(Li)-原子序数为3,一种银白色金属,用于制造锂离子电池。
4.铍(Be)-原子序数为4,一种灰白色金属,用于制造合金和核反应堆。
5.硼(B)-原子序数为5,一种非金属元素,用于制造玻璃和橡胶。
6.碳(C)-原子序数为6,生命中的基本元素,存在于有机物中,如煤炭和钻石。
7.氮(N)-原子序数为7,一种无色气体,占大气中78%的成分,在肥料和爆炸物的制造中广泛使用。
8.氧(O)-原子序数为8,一种气体,是地壳中最常见的元素之一,在燃烧和呼吸过程中起重要作用。
9.氟(F)-原子序数为9,一种黄绿色气体,广泛用于制造氟化物和氟化氢。
10.氖(Ne)-原子序数为10,一种无色气体,广泛应用于霓虹灯和激光器。
11.钠(Na)-原子序数为11,一种银白色金属,常见于食盐中,对维持体液平衡至关重要。
12.镁(Mg)-原子序数为12,一种银白色金属,存在于地壳和海水中,对植物的生长非常重要。
13.铝(Al)-原子序数为13,一种银白色金属,是常见的建筑材料,易于加工和回收利用。
14.硅(Si)-原子序数为14,一种灰色非金属元素,广泛用于制造计算机芯片和太阳能电池板。
15.磷(P)-原子序数为15,一种非金属元素,是生物体中DNA和RNA的重要构成部分。
16.硫(S)-原子序数为16,一种黄色非金属元素,存在于火山喷发和硫磺矿中。
17.氯(Cl)-原子序数为17,一种黄绿色气体,常用于消毒和制造化学物品。
18.钾(K)-原子序数为19,一种银白色金属,对神经传导和肌肉收缩至关重要。
19.钙(Ca)-原子序数为20,一种银白色金属,与骨骼和牙齿的形成密切相关。
20.钛(Ti)-原子序数为22,一种银灰色金属,用于航空航天和医学器械中。
常见元素的性质特征或结构特征

常见元素的性质特征或结构特征元素是构成物质的基本组成单元,目前已知的元素共有118种。
每种元素都具有独特的性质特征和结构特征。
在这里,我们将讨论一些常见元素的性质特征和结构特征。
1.氢(H):氢是原子序数为1的元素,是宇宙中最丰富的元素之一、它是一种无色、无味、无臭的气体,在标准条件下,它是一种二原子分子,化学符号为H2、氢气具有极低的密度和高燃烧性。
它的原子结构只含有一个质子和一个电子。
2.氧(O):氧是原子序数为8的元素,是地球上最常见的元素之一、氧气是一种无色、无臭的气体,在标准条件下,它处于双原子分子状态O2、氧气是支持燃烧的气体,它是维持呼吸和燃烧的必要气体。
氧原子的电子结构是1s22s22p43.碳(C):碳是原子序数为6的元素,是生命的基础。
它是一种非金属元素,形成多种化合物。
碳具有高的熔点和热导率,是石墨和钻石的主要成分。
它的电子结构是1s22s22p24.氮(N):氮是原子序数为7的元素,是大气中的主要成分之一、它是一种无色、无味的气体,在标准条件下,它以双原子分子状态存在N2、氮在生物体中起着重要的作用,同时也是很多化合物如肥料和炸药的重要组成部分。
氮原子的电子结构是1s22s22p35.铁(Fe):铁是原子序数为26的元素,是地壳中含量第四多的元素。
它是一种金属,常以铁矿石的形式存在。
铁具有良好的导电和导热性能,同时也是一种强磁性材料。
它的电子结构是1s22s22p63s23p64s23d66.金(Au):金是原子序数为79的元素,是一种贵重金属。
它具有黄色,并以其高度的稳定性和可塑性而闻名。
金是一种良好的导电体,广泛用于制作珠宝和电子器件。
它的电子结构是1s22s22p63s23p64s23d104p65s24d105p66s14f145d106p67.氯(Cl):氯是原子序数为17的元素,是一种非金属。
它是一种黄绿色气体,在常温常压下,是以双原子分子状态Cl2存在。
氯具有强烈的腐蚀性和漂白性,在水中能够形成盐酸。
化学元素周期表重要元素及其特性的解读

化学元素周期表重要元素及其特性的解读化学元素周期表是化学家们用来组织和分类所有已知元素的工具。
它由一系列水平排列的横行和垂直排列的竖列组成。
每个元素都有自己独特的原子序数、原子质量和化学性质。
在本文中,将重点介绍一些重要的元素及其特性。
1. 氢 (H):氢是周期表中最简单的元素,其原子序数为1。
它是宇宙中最常见的元素之一,也是构成水的主要成分。
氢气可以燃烧,是强力的燃料。
此外,氢还具有广泛的应用,如在合成氨、制造氢气燃料电池等。
2. 氧 (O):氧是生命中必不可少的元素之一,原子序数为8。
它是空气中最常见的元素,占空气体积的约1/5。
氧是火焰燃烧和许多生物呼吸过程中的关键成分。
此外,氧还可以与其他元素形成氧化物,如水和二氧化碳。
3. 碳 (C):碳是生命的基础,原子序数为6。
它是有机物的主要组成部分,包括蛋白质、脂肪、碳水化合物和核酸。
碳还可以形成多种形态,如钻石和石墨。
碳的特殊性质使得它成为材料科学和纳米技术的研究重点。
4. 氮 (N):氮是空气中的重要元素之一,原子序数为7。
它占空气体积的约78%。
氮在植物生长和动物组织中起着重要作用。
此外,氮还可以与其他元素形成许多有用的化合物,如氨、硝酸和氰化物。
5. 铁 (Fe):铁是人类文明发展史上至关重要的元素之一,原子序数为26。
它是地壳中最常见的金属之一。
铁具有良好的导电性和热传导性,因此广泛应用于制造工业。
铁还是血红蛋白的主要组成部分,负责输送氧气到人体各个器官。
6. 钾 (K):钾是人体内的重要矿物质之一,原子序数为19。
它在维持酸碱平衡和正常肌肉功能方面起着关键作用。
钾还参与神经信号传递和细胞功能调节。
蔬菜、水果和坚果是富含钾的食物。
7. 锌 (Zn):锌是人体所需的微量元素之一,原子序数为30。
它对细胞分裂、免疫功能和蛋白质合成至关重要。
锌还在许多酶反应中充当催化剂。
肉类、海鲜和豆类是富含锌的食物。
8. 黄金 (Au):黄金是一种珍贵金属,原子序数为79。
化学元素周期表及其特性

化学元素周期表及其特性化学元素周期表是一个有序排列的化学元素列表,其中元素按照其原子编号逐渐增加。
通过周期表,我们可以获得关于各种元素的重要信息,包括元素符号、原子序数、原子量以及元素的一些特性。
以下是一些常见的元素特性:1. 元素符号和原子编号元素符号是化学元素的缩写形式,由一个或两个字母组成。
常见的元素符号有H(氢)、O(氧)和Fe(铁)等。
原子编号是元素在周期表中的位置,也称为原子序数。
例如,氧的原子编号是8,铁的原子编号是26。
2. 原子量原子量是一个元素所含有的质子和中子的总数。
它通常以摩尔(mol)为单位表示。
原子量与元素的质量有关,可以用于计算元素的摩尔质量。
例如,氧的原子量为16 g/mol。
3. 化学性质化学性质是描述元素在化学反应中表现出的特性。
不同元素具有不同的化学性质,这些性质决定了元素在反应中的行为。
例如,金属元素具有良好的导电性和延展性,非金属元素则通常呈现不良导电性和脆性。
4. 物理性质物理性质是描述元素在物理过程中的特性。
它包括元素的密度、熔点、沸点等。
这些性质可以帮助我们了解元素的状态变化和物质性质。
例如,水的熔点是0摄氏度,沸点是100摄氏度。
5. 元素分类化学元素可以根据周期表中的位置进行分类。
元素主要分为金属、非金属和半金属三大类。
金属元素位于周期表的左侧和中间部分,具有良好的导电性和热传导性。
非金属元素位于周期表的右侧,通常为脆性、不良导电和导热的。
半金属元素则处于金属和非金属之间。
通过学习周期表及其特性,我们可以更好地了解化学元素的组成和特性,为化学研究和应用提供基础知识。
初中化学常见元素的化学符号和原子序数

初中化学常见元素的化学符号和原子序数在化学领域中,元素是构成物质的基本单位。
元素由一种具有独特物理性质和化学性质的原子组成。
为了便于研究和交流,化学家们用标准符号来表示元素,这些符号我们称之为化学符号。
化学符号由字母或字母的组合构成,每个元素对应一个特定的符号。
1. 氢(Hydrogen)- H,原子序数 1氢是宇宙中最常见的元素之一,在元素周期表中,氢位于第1个位置。
它的化学符号是H,原子序数为1,表示氢原子的核内只有一个质子。
氢在自然界中以分子氢(H2)的形式存在,是化学反应中重要的基础原料之一。
2. 氦(Helium)- He,原子序数 2氦是元素周期表中的第二个元素,化学符号为He,原子序数为2。
氦是一种惰性气体,常用于气球和气体填充物。
氦的原子核内有两个质子和两个中子,这使得氦成为第二轻的元素。
3. 锂(Lithium)- Li,原子序数 3锂是一种碱金属元素,化学符号为Li,原子序数为3。
锂是短周期元素中原子序数最小的元素,具有很高的反应活性。
锂在电池制造、核反应堆冷却剂等领域有广泛应用。
4. 铍(Beryllium)- Be,原子序数 4铍是一种碱土金属元素,化学符号为Be,原子序数为4。
铍具有较高的硬度和强度,因此在航空航天、核工业等领域有广泛应用。
然而,铍具有高度的毒性,对人体健康有害。
5. 碳(Carbon)- C,原子序数 6碳是生命中最基础的元素之一,它在自然界中以多种形式存在,如石墨、金刚石等。
化学符号为C,原子序数为6。
碳是有机化合物的基础,在有机化学中起着重要作用。
6. 氮(Nitrogen)- N,原子序数 7氮是元素周期表中的第7个元素,化学符号为N,原子序数为7。
氮是大气中主要成分之一,它在生命活动中起着重要作用,如构成蛋白质和核酸等生物大分子的组成元素。
7. 氧(Oxygen)- O,原子序数 8氧是元素周期表中的第8个元素,化学符号为O,原子序数为8。
氧是地壳中含量最多的元素,广泛存在于空气、水和地球上的许多物质中。
元素周期表中的规律

元素周期表中的规律一、最外层电子数规律1. 最外层电子数为1的元素:主族(IA族)、副族(IB、VIII族部分等)。
2. 最外层电子数为2的元素:主族(IIA族)、副族(IIB、IIIB、IVB、VIIB 族)、0族(He)、VIII族(26Fe、27Co等)。
3. 最外层电子数在3~7之间的元素一定是主族元素。
4. 最外层电子数为8的元素:0族(He除外)。
二、数目规律1. 元素种类最多的是第IIIB族(32种)。
2. 同周期第IIA族与第IIIA族元素的原子序数之差有以下三种情况:(1)第2、3周期(短周期)相差1;(2)第4、5周期相差11;(3)第6、7周期相差25。
4. 同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA~VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。
三、化合价规律1. 同周期元素主要化合价:最高正价由+1 +7(稀有气体为0价)递变、最低负价由-4 -1递变。
2. 关系式:(1)最高正化合价+|最低负化合价|=8;(2)最高正化合价=主族族序数=最外层电子数=主族价电子数。
3. 除第VIII族元素外,原子序数为奇(偶)数的元素,元素所在族的序数及主要化合价也为奇(偶)数。
四、对角线规律金属与非金属分界线对角(左上角与右下角)的两主族元素性质相似,主要表现在第2、3周期(如Li和Mg、Be和Al、B和Si)。
五、分界线规律位于金属与非金属之间的分界线,右上方的元素为非金属(周期表中的颜色为深绿色),在此可以找到制造农药的元素(如Cl、P等),左下角为金属元素(H除外),分界线两边的元素一般既有金属性,又有非金属性;能与酸和碱反应(如Be、Al等),还可找到制造半导体材料的元素(如Si、Ge等)。
六、金属性、非金属性变化规律1. 同一周期,从左到右(0族除外)金属性减弱,非金属性增强;同一主族,从上到下金属性增强,非金属性减弱。
元素周期表(全面版)
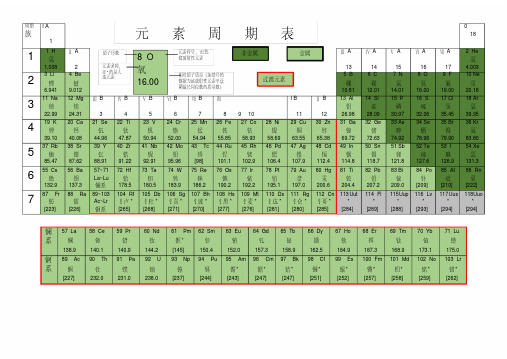
周期族I A1 0181 1 H 氢1.008 Ⅱ A2Ⅲ A13Ⅳ A14Ⅴ A15Ⅵ A16Ⅶ A172 He氦4.0032 3 Li 锂6.941 4 Be铍9.0125 B硼10.816 C碳12.017 N氮14.018 O氧16.009 F氟19.0010 Ne氖20.183 11 Na 钠22.99 12 Mg镁24.31Ⅲ B3Ⅳ B4Ⅴ B5Ⅵ B6Ⅶ B7Ⅷ8 9 10I B11Ⅱ B1213 Al铝26.9814 Si硅28.0915 P磷30.9716 S硫32.0617 Cl氯35.4518 Ar氩39.954 19 K钾39.10 20 Ca钙40.0821 Se钪44.9622 Ti钛47.8723 V钒50.9424 Cr铬52.0025 Mn锰54.9426 Fe铁55.8527 Co钴58.9328 Ni镍58.6929 Cu铜63.5530 Zn锌65.3831 Ga镓69.7232 Ge锗72.6333 As砷74.9234 Se硒78.9635 Br溴79.9036 Kr氪83.805 37 Rb 铷85.47 38 Sr锶87.6239 Y钇88.9140 Zr锆91.2241 Nb铌92.9142 Mo钼95.9643 Tc锝[98]44 Ru钌101.145 Rh铑102.946 Pd钯106.447 Ag银107.948 Cd镉112.449 In铟114.850 Sn锡118.751 Sb锑121.852 Te碲127.653 I碘126.954 Xe氙131.36 55 Cs 铯132.9 56 Ba钡137.357~71La~Lu镧系72 Hf铪178.573 Ta钽180.574 W钨183.975 Re铼186.276 Os锇190.277 Ir铱192.278 Pt铂195.179 Au金197.080 Hg汞200.681 Ti铊204.482 Pb铅207.283 Bi铋209.084 Po钋[209]85 At砹[210]86 Rn氡[222]7 87 Fr钫[223] 88 Ra镭[226]89~103Ac~Lr锕系104 Rf钅卢*[265]105 Db钅杜*[268]106 Sg钅喜*[271]107 Bh钅波*[270]108 Hs钅黑*[277]109 Mt钅麦*[276]110 Ds钅达*[281]111 Rg钅仑*[280]112 Cn钅哥*[285]113Uut*[284]114 Fl*[289]115Uup*[288]116 Lv*[293]117Uus*[294]118Uuo*[294]镧系57 La镧138.958 Ce铈140.159 Pr镨140.960 Nd钕144.261 Pm钷*[145]62 Sm钐150.463 Eu铕152.064 Gd钆157.365 Tb铋158.966 Dy镝162.567 Ho钬164.968 Er铒167.369 Tm铥168.970 Yb镱173.171 Lu镥175.0锕系89 Ac锕[227]90 Th钍232.091 Pa镤231.092 U铀238.093 Np镎[237]94 Pu钚[244]95 Am镅*[243]96 Cm锯*[247]97 Bk锫*[247]98 Cf锎*[251]99 Es锿*[252]100 Fm镄*[257]101 Md钔*[258]102 No锘*[259]103 Lr铹*[262]金属非金属过渡元素8 O氧16.00原子序数元素符号,红色指放射性元素元素名称,注*的是人造元素相对原子质量(加括号的数据为该放射性元素半衰期最长同位数的质量数)元素周期表元素周期表有关知识一、部分酸、碱和盐的溶解性表(室温)说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇水就分解了。
常见元素的摩尔质量表

常见元素的摩尔质量表常见元素的摩尔质量表原子序数、注:期前方序列号不为1、氢H 12、氦He 43、锂Li 74、铍Be 95、硼B 116、碳C 127、氮N 148、氧0 169、氟F 1910、氖Ne 2011、钠Na 2312、镁Mg 2413、铝Al 2714、硅Si 2815、磷P 3116、硫S 3217、氯Cl 35.518、氩Ar 4019、钾K 3921、钙Ca 4022、铬Cr 5223、锰Mn 5524、铁Fe 5625、镍Ni 58.6926、铜Cu 6427、锌Zn 6528、镓Ga 69.723 (129、砷As 7530、硒Se 7931、溴Br 8032、银Ag 10833、镉Cd 112.411 (834、铟In 114.818 (335、锡Sn 118.710 (736、锑Sb 121.760 (137、碘1 12738、铯Cs 13339、钡Ba 137.327 (740、铂Pt 195.084 (941、金Au 196.966 569(442、汞Hg 200.59 (243、镭Re 226_平均摩尔质量M(平?量)=m总/n总M=PVm (P 代表气体密度)例如:C02 H2 CO 的混合气体,同温同压求平均摩尔质量.M=m 总/n 总=M1*a%+M2*b%+M3*c%+ ---------这是阿伏伽德罗定律的变形平均摩尔质量=混合物中各组分的摩尔质量x 该组分的物质的量分数(若是气体组分可以是体积分数)e.g某混合气体只含有氧气和甲烷,在标准状况下,该气体的密度为1.00g/l求该气体中氧气和甲烷的体积比?解:由气体物质的摩尔质量=气体的密度与标准状况下的气体摩尔体积之积,可求出混合气体的平均摩尔质量:M = 1.00g/L X2.4L/mol = 22.4g/mol再由平均摩尔质量计算方法:平均摩尔质量=混合物中各组分的摩尔质量x 该组分的物质的量分数(若是气体组分可以是体积分数)所得的积之和就可以求出其体积比了:设氧气的体积分数为X,则有:32x + 16(1 -x)=22.416x=6.4 x=0.4所以氧气与甲烷的体积比为:0.4 : (1-0.4)=2 : 3.应该更详细了平均摩尔质量常用用于各类气体混合物的比值的求解常见用于十字交叉发的应用例二氧化碳和氧气的平均摩尔质量40,则二者的的额物质的量之比为?CO2 44 840O2 32 4二者的物质的量之比为8 : 4=2 : 1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见元素的原子序数
一、什么是原子序数?
原子序数是指元素周期表中原子核中质子的个数,也是元素的
一种特征性质。
原子序数决定了元素的化学性质和原子的物理性质。
二、常见元素的原子序数
以下是一些常见元素及其对应的原子序数:
1. 氢(H)- 原子序数:1
2. 氦(He)- 原子序数:2
3. 碳(C)- 原子序数:6
4. 氮(N)- 原子序数:7
5. 氧(O)- 原子序数:8
6. 铁(Fe)- 原子序数:26
7. 铜(Cu)- 原子序数:29
8. 铝(Al)- 原子序数:13
9. 铅(Pb)- 原子序数:82
10. 锌(Zn)- 原子序数:30
三、原子序数和元素性质
原子序数对元素的性质有很大的影响。
原子序数越大,元素的
原子质量也越大,通常意味着原子的体积和能级也会增加。
这可能
会导致元素的物理和化学性质发生变化。
例如,氢(H)是原子序数最小的元素,其原子质量较轻,只
有一个质子。
氢在常温下是气体,并且具有极高的可燃性。
相比之下,铅(Pb)是原子序数很大的元素,其原子质量较重,包含82
个质子。
铅是一种金属,具有较高的密度和强度。
原子序数还可以用于区分元素的排列顺序。
元素周期表中,原
子序数递增而元素的性质也会逐渐变化。
通过对比元素的原子序数,可以了解元素的基本特征。
四、原子序数的应用
原子序数的重要性不仅体现在元素的性质上,还在于它与化学反应的关系。
化学反应的类型和方式很大程度上取决于元素的原子序数。
由于原子序数的基本特征,我们可以通过元素的原子序数来推断其可能的价态和化合物的可能形式。
原子序数还与元素的电子结构有关,可以用于预测元素的离子化能力和化学反应的趋势。
总之,原子序数是研究化学和物理的基本概念之一。
了解常见元素的原子序数有助于我们更深入地理解元素的性质与行为。
五、总结
本文介绍了常见元素的原子序数及其在元素性质、物理特性和化学反应中的重要性。
原子序数是研究元素的基本特征之一,通过该特征我们可以理解元素的性质,以及预测元素在化学反应中的行为。
希望本文可以帮助您更全面地了解常见元素的原子序数及其应用。
