硫酸的性质、生产方法和主要设备
浓硫酸制备知识点总结

浓硫酸制备知识点总结一、硫酸的化学性质和用途硫酸(H2SO4),分子式为H2SO4,是一种无色、无臭、有强烈腐蚀性的液体。
硫酸具有强氧化性和酸性,可与金属反应生成氢气,与碱反应生成盐和水。
硫酸是一种非常重要的化工原料,广泛用于化工、冶金、制药、电镀等领域。
在化肥生产中,硫酸可与氨气反应制取硫酸铵,还可用于制取磷酸肥料。
此外,硫酸还是许多有机合成反应的重要催化剂,如合成酯、酮、醇、醚等。
二、浓硫酸的制备方法1. 浓硫酸的制备方法有浓缩法、吸收法、空气介质法等,其中浓缩法是目前应用最广泛的一种方法。
浓硫酸一般采用浓缩硫酸和稀硫酸配制而成,常用的浓硫酸制备方法有浓缩炉法和浸取法。
2. 浓缩炉法:又称为装料法,是将稀硫酸泵入浓硫酸冷却器,冷却后再经过浓缩塔冷却,形成浓硫酸。
这种方法适用于小型设备,但操作比较复杂。
3. 浸取法:是将稀硫酸浸泡在浓硫酸中,使得稀硫酸中的水分蒸发出来,从而得到浓硫酸。
这种方法操作简单,但生产效率较低。
4. 吸收法:是将硫酸汽通过净化塔,接触到浓硫酸上方的盘式蒸馏器或塔底的浓硫酸,通过硫酸吸收硫酸蒸气,形成浓硫酸。
这种方法适用于大型设备,生产效率高。
5. 空气介质法:是通过空气作为介质,将分离出来的浓硫酸和硫酸雾气与空气交换,并将硫酸雾气通过水吸收器,再用冷却器冷却。
这种方法操作简单,但需要较多的空气。
三、浓硫酸的制备过程1. 浓硫酸制备过程包括原料准备、浓硫酸制备和产品净化三个步骤。
2. 原料准备:原料主要包括浓硫酸、稀硫酸和水。
浓硫酸一般采用98%以上的浓硫酸,稀硫酸的浓度在30%到85%之间,水的纯度要求较高。
3. 浓硫酸制备:在浓硫酸制备过程中,首先将浓硫酸或浓硫酸蒸汽与稀硫酸或硫酸雾气进行接触,使得稀硫酸中的水分蒸发,并与浓硫酸混合成为浓硫酸。
接着通过冷却器冷却,得到所需的浓硫酸。
4. 产品净化:浓硫酸制备完成后,需要对产品进行净化处理,以除去溶解在硫酸中的杂质,提高产品纯度。
硫酸的制备及相关标准

硫酸的性能、应用及其制备(1)物性硫酸分子式H2SO4;英文名Sulfuric Acid;相对分子质量98.208。
为无色透明粘稠状液体,能与水和醇相混溶,同时放出大量热。
具有极强的吸水性和氧化性,能使棉布、纸张、木材等脱水碳化。
密度(25℃)为1.84g/ml。
(2)应用超净高纯级硫酸为强酸性清洗、腐蚀剂,在集成电路制作过程中应用最多,主要用于超大规模集成电路工艺技术的生产。
超净高纯级硫酸可与过氧化氢配制使用,残留在基片及相关设备上的有机污染物会对正常生产产生不良的影响,硫酸结合过氧化氢或臭氧可用于在沉积金属前去除基片表面上的有机污染物。
(3)生产工艺路线A.精馏法精馏是利用回流使液体混合物得到高纯度分离的蒸馏方法。
工业硫酸一般是微黄色黏稠液体,内含大量金属杂质离子和二氧化硫、亚硫酸根、有机物等。
工业硫酸在精馏提纯前需进行化学预处理,即在预处理槽中加入适量强氧化剂(高锰酸钾、重铬酸钾等),使硫酸中的还原性杂质氧化成硫酸和二氧化碳,再将处理后的硫酸加入石英精馏塔内进行精馏。
由于金属杂质离子主要以硫酸盐的形式存在,硫酸盐的沸点很高,在精馏的过程中会和蒸馏残液一起留在釜底,可以很容易被除去。
待精馏速度稳定后,收集成品在储罐内,再用微孔滤膜过滤,除去微细固体颗粒杂质,最后在超净工作台内分装成品。
硫酸制备工艺路线示意图见图2-1。
图2-1 硫酸制备工艺路线示意图目前,中国电子级硫酸的生产一般采用精馏法,常压精馏的温度高达330 ℃,对设备材质要求较高;减压精馏的温度为175~190 ℃,压力为1.33~2.67 kPa。
精馏法能耗大,成本高,有些杂质难以除去,产生的废气、酸雾对人体有害,不利于环境保护,只适合于小规模生产。
B.气体吸收法气体吸收法是将提纯后的三氧化硫直接用超纯水或者超纯硫酸吸收,三氧化硫的提纯是产品达标的关键。
首先,向发烟硫酸(硫酸的质量分数为24%~70%)中添加适量的过氧化氢溶液,使其中的二氧化硫(含量应低于10 mg/kg)氧化为三氧化硫,随后将发烟硫酸加入到降膜蒸发器中,在90~130 ℃蒸发,蒸发出来的三氧化硫气体经过除雾器,除去其中夹带的微量硫酸、亚硝酰基硫酸,通入高度纯化的惰性气体,混合后进入吸收塔用电子级超纯水或超纯硫酸直接吸收,冷却后即得到超纯硫酸产品。
(完整版)硫酸的生产工艺

硫酸简介
硫酸,化学式为H2SO4。是一种无色无味油状液体, 是一种高沸点难挥发的强酸,易溶于水,能以任意比 与水混溶。硫酸是基本化学工业中重要产品之一。它 不仅作为许多化工产品的原料,而且还广泛地应用于 其他的国民经济部门。硫酸作为化学六大无机强酸之 一,同时也作为所有酸中最常见的强酸之一,硫酸在 工业生产和人们的日常生活中有着广泛的应用。例如 石油和冶金工业、土壤改良、化肥生产等方面的应用。
●旋风除尘 此方法主要是排出0.1~0.2μm以上的矿尘颗粒。
炉气 炉气
负极
●文氏管洗涤
炉气
水洗净化常用文氏管洗涤
器,文氏管洗涤器是由收
缩管、颈管和放大管三部
炉气
分组成。
●电除尘
电除尘(除雾)器是利用静电引力的 作用,将气流中的尘粒(雾粒)沉析
H2O
排渣
H2O
正极
从而使气体达到净化的目的。
电除尘器
H
298
2453
.30kJ
三、炉气的净化
从沸腾炉焙烧硫铁矿得到的炉气中,除了 SO2 和O2是转化工序所需的有用气体、N2是惰性气体外, 还含有哪些有害物质?
矿尘
As Se H2O+SO3
阻塞管道和设备,增大流体阻力,降 低钒催化剂的活性。
As2O3 SeO2
使钒催化剂中毒
生成硫酸雾
腐蚀设备、管道,降 低钒催化剂的活性。
硫酸铁的焙烧原理
●在500℃以上,硫铁矿首先分解为硫化亚铁和硫蒸气
2FeS2 >500℃ 2FeS+S2
ቤተ መጻሕፍቲ ባይዱ
H
298
295
.68 k J
●硫蒸汽燃烧,生成二氧化硫
S2+2O2
有关硫酸知识点总结

有关硫酸知识点总结硫酸的物理性质硫酸是一种极易溶解于水的化合物,将硫酸加入水中会释放大量热量,因为该反应是放热反应。
硫酸具有极强的酸性,能够与金属反应产生氢气,与碱反应生成盐和水。
硫酸的密度较大,约为1.84g/cm³。
其沸点为337℃,熔点为10℃。
硫酸的化学性质硫酸是一种强酸,对皮肤和粘膜具有腐蚀性。
硫酸与水反应生成大量热量,这种反应特别危险,应当小心操作。
在化工过程中,硫酸通常与其他物质反应生成硫酸盐,如硫酸铜(CuSO4)、硫酸锌(ZnSO4)等。
此外,硫酸还能与醇类、有机酸、酚、胺等有机物发生酯化、烟酸酰化反应,从而生成相应的硫酸酯。
硫酸的生产方法硫酸主要通过三氧化硫(SO3)和水(H2O)的化学反应制备而成。
在现代工业生产中,常用的方法是将硫磺(S)燃烧并加入空气,在催化剂的存在下生成二氧化硫(SO2),然后再使SO2与氧气在催化剂的作用下氧化成为SO3,最后将SO3与水反应,得到硫酸。
另外,还有许多其他的方法可以制备硫酸,如硫磺氧化法、硫矿氧化法、氯碱法等,但这些方法在工业生产中已逐渐被淘汰,因为它们耗能大、产物纯度低,且环境友好性差。
硫酸的应用硫酸是一种重要的工业原料和中间体,广泛用于制造肥料、纸张、皮革、合成纤维、颜料、化肥、炸药、制药、肥皂和清洁剂等产品。
此外,硫酸还被用于电镀、金属清洗、废水处理、石油炼制、电池制造等工业领域。
此外,用硫酸浸渍的金属零件可有效地防锈。
硫酸在农业中也具有重要作用,它是制成硫酸铵、硫酸钙、硫酸镁等含硫肥料的原料。
硫酸还可以用于改良土壤酸性,并作为农药和杀虫剂的成分之一。
硫酸是化工过程中一种重要的催化剂,在聚合物、合成树脂、颜料等化工产品的合成过程中发挥着重要作用。
硫酸的储存硫酸具有强氧化性和腐蚀性,在储存和使用过程中应当特别小心。
储存硫酸的容器应当选用耐腐蚀性好的材料,如玻璃、搪瓷、塑料、橡胶等,避免与金属接触,以免产生剧烈的化学反应。
硫酸生产操作规程1
硫酸生产操作规程1 主题内容与适用范围本标准叙述了以硫精砂为原料,以沸腾焙烧 文、填、电酸洗净化 两转两吸工艺、接触法生产硫酸的生产原理、工艺过程、生产操作和主要工艺指标等内容。
本标准适用于本公司120kt/a 硫酸生产装置。
2 产品说明、原料要求和装置能力2.1 产品特性和用途2.1.1 特性硫酸是三大强酸之一,分子式表示为“H 2SO 4”,分子量为98.08,浓度一般以质量百分比浓度表示。
无水硫酸就是指100%的硫酸,又称纯硫酸,一般为无色无臭、透明的油状液体,也有通过加入填加剂制成固体硫酸。
习惯上将75%以上的硫酸称为浓硫酸。
浓硫酸具有三大化学特性:强氧化性、吸水性和脱水性。
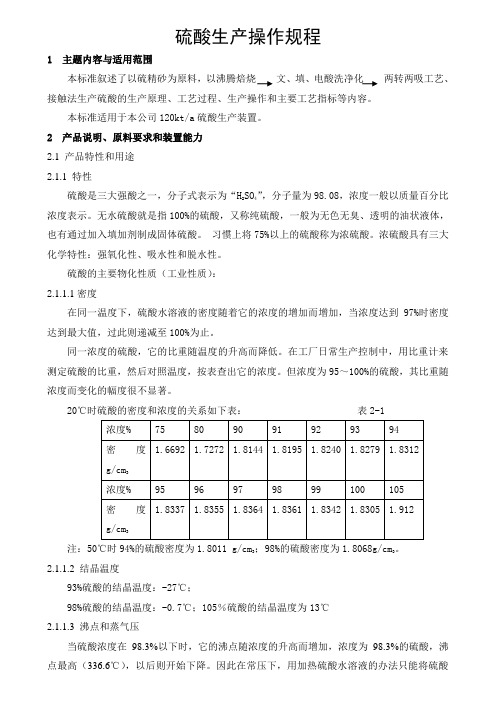
硫酸的主要物化性质(工业性质):2.1.1.1密度在同一温度下,硫酸水溶液的密度随着它的浓度的增加而增加,当浓度达到97%时密度达到最大值,过此则递减至100%为止。
同一浓度的硫酸,它的比重随温度的升高而降低。
在工厂日常生产控制中,用比重计来测定硫酸的比重,然后对照温度,按表查出它的浓度。
但浓度为95~100%的硫酸,其比重随浓度而变化的幅度很不显著。
20℃时硫酸的密度和浓度的关系如下表: 表2-1注:50℃时94%的硫酸密度为1.8011 g/cm 3;98%的硫酸密度为1.8068g/cm 3。
2.1.1.2 结晶温度93%硫酸的结晶温度:-27℃;98%硫酸的结晶温度:-0.7℃;105%硫酸的结晶温度为13℃2.1.1.3 沸点和蒸气压浓度提高至98.3%。
硫酸水溶液上面的总蒸气压,随其浓度的增加而逐渐下降,当浓度增加到98.3%时,蒸气压降至最小值。
硫酸表面的蒸气是由H2O、H2SO4和SO3分子的混合物组成,而水蒸汽压小是硫酸的重要性质。
温度越低、浓度越高,酸液面上的水蒸汽平衡分压也越小,用浓硫酸来干燥气体就是利用了这一性质。
2.1.1.4 稀释热硫酸的溶解热(又叫无限稀释热)为22000卡/摩尔。
由于浓硫酸的稀释热很大,同时由于酸、水比重上的差异,在实验室中稀释浓硫酸时,不能将水倒入硫酸,必须将硫酸慢慢注入水中,同时不断搅拌,以防反应过剧造成酸沫飞溅伤人。
硫酸的生产

二. 用途
硫酸是无机化工、有机化工中用量最大、用途 最广的化工产品。
主要用于生产磷肥(在我国占硫酸总量的6575%);此外还可用于生产无机盐、无机酸、有机 酸、化纤、塑料、农药、颜料、染料、硝化纤 维、TNT、硝化甘油及中间体等;石油、冶金 行业也都大量使用。
我国硫酸的消费情况
第六章 硫酸的生产
三 硫铁矿的沸腾焙烧
(一)基本原理 (二)沸腾焙烧炉的构造 (三)沸腾焙烧工艺流程 (四)电除尘器
第六章 硫酸的生产
(一)硫铁矿沸腾焙烧基本原理
1、流态化概念 2、临界流化速度 3、最大流化速度 4、沸腾炉的气体操作速度 5、沸腾焙烧优缺点
第六章 硫酸的生产
(二)沸腾焙烧炉的构造
❖ 上层:再生区(850-1000℃)
4 Fe3O4+O2==6Fe2O3
第六章 硫酸的生产
➢3、脱砷焙烧(两个阶段)
热分解 4FeAsS==4FeS+As4
2FeS2==2FeS+S2
4FeAsS+4FeS2==8 FeS+ As4S4
氧化 As4+3O2==2As2O3 1/2 S2+O2== SO2
p* (SO3 )
P* (SO2 ) P* (SO3 )
影响因素 温度:T↓,有利!取420-580℃。
压力:P↑,有利!取常压(X转95-98%) 最终转化率:一转一吸97.5-98%
二转二吸99.5%
第六章 硫酸的生产
(二) SO2氧化用催化剂
❖ 1、铂
活性高;价贵,易中毒。
❖ 2、氧化铁 价廉;≥640℃才有活性。
➢ (三)工艺流程图PbS+2PbO==3Pb+SO2 ➢ (四)主要设备图
硫酸工艺设计手册 物化数据篇

硫酸工艺设计手册物化数据篇硫酸是一种重要的化工产品,广泛应用于冶金、化工、轻工、制药、食品加工、环保等各个领域。
硫酸可以通过多种工艺方法进行合成,如铁法、氧化铜法、硝态硫法和硫-氮法等。
其中,最常用的方法是硫-氮法,即通过催化剂催化硫和氨反应得到硫酸。
本手册旨在提供硫酸工艺设计的物化数据,以帮助工程师和研究人员在硫酸生产过程中进行合理的工艺设计和操作。
一、硫酸的基本性质硫酸,化学式为H2SO4,是一种无色透明的液体,无臭,呈酸味。
硫酸是一种强酸,具有强烈的腐蚀性和氧化性。
在常温下,硫酸具有较高的密度(1.84 g/cm³),易挥发,不易溶于烃类溶剂,能溶解许多有机物和无机物,具有很强的腐蚀性和氧化性。
二、硫酸的化学性质硫酸是一种重要的化工原料,具有多种化学性质。
硫酸能与多种物质发生化学反应,包括氧化反应、水解反应、取代反应、酯化反应等。
硫酸还具有催化剂和吸附剂的作用,广泛应用于化工生产中。
三、硫酸的物理性质硫酸具有一系列独特的物理性质,包括密度、粘度、表面张力、介电常数、折射率等。
这些物理性质对硫酸的生产和应用具有重要的影响,需要在硫酸工艺设计过程中加以考虑。
四、硫酸的生产工艺硫-氮法是目前硫酸生产的主要方法,其主要原料为硫、氨和氧。
硫酸工艺设计需考虑反应温度、压力、催化剂种类和用量、反应时间等参数,以获得较高的硫酸纯度和产率。
此外,在硫酸生产过程中还需考虑原料的净化、废气处理、产品分离和纯化等问题。
五、硫酸的应用领域硫酸广泛用于冶金、化工、轻工、制药、食品加工、环保等各个领域。
在冶金工业中,硫酸可用于铁冶炼、矿石浸出、焦化废水处理等;在化工工业中,硫酸可用于有机合成、橡胶加工、染料制备等;在制药工业中,硫酸可用于制备药物原料、调节药物PH值等。
此外,硫酸还可用于酸洗、防腐、造纸、皮革加工等领域。
六、硫酸工艺设计的改进和发展随着工业技术的不断进步,硫酸生产工艺也在不断改进和发展。
传统的硫-氮法已经改进为催化剂选择更广泛、反应条件更温和、装置结构更合理的新型硫-氮法。
硫酸提纯实验报告

硫酸提纯实验报告一、实验目的通过硫酸提纯实验,掌握硫酸提纯的基本方法和操作技巧,了解硫酸的性质及其重要性。
二、实验原理硫酸为无色、无臭的油状液体,具有强酸性、吸湿性、氧化性和腐蚀性。
在工业生产中,硫酸常常由熔硫氧化法制备得到,所以其中不可避免地含有杂质。
提纯硫酸的目的就是除去其中的杂质,使其达到一定的纯度。
硫酸提纯的基本方法有虹吸法和蒸馏法。
虹吸法适用于分离少量杂质,其原理是利用杂质的溶解性不同,通过溶液之间的重力差异或密度差异,实现分层分离。
蒸馏法适用于分离大量杂质,其原理是因为硫酸有较高的沸点(约337),而杂质的沸点较低,所以通过蒸馏原理将杂质与硫酸分离。
三、实验步骤1. 实验前准备:准备所需试剂和仪器设备,包括硫酸、蒸馏装置、容器等。
2. 虹吸法:取一定量的硫酸溶液放入干净的容器中,静置一段时间,等待杂质沉淀。
再使用吸引玻璃棒将上清液慢慢移至另一个干净的容器中,即可得到较为纯净的硫酸溶液。
3. 蒸馏法:将硫酸溶液加热至沸腾,并在装有蒸馏装置的容器中收集蒸馏液。
通过控制温度和收集初始和末端沸点范围内的液体,即可得到较为纯净的硫酸。
四、实验结果与分析经过虹吸法或蒸馏法提纯后的硫酸,可以通过酸碱中和反应进行检验其纯度。
选取所得硫酸溶液加入适量的酸碱指示剂,再滴加NaOH溶液,直至出现颜色变化。
记录所需NaOH的滴定量,即可计算出硫酸的纯度。
五、实验注意事项1. 实验过程中要注意安全操作,佩戴手套和护目镜,避免接触皮肤和眼睛。
2. 虹吸法中要注意虹吸管的位置,以避免杂质的重新混入纯净硫酸。
3. 蒸馏法中要注意加热的温度和时间,避免过热和溢出。
4. 实验后要及时清理反应容器,避免产生酸雾或固体残留。
六、实验结论通过硫酸提纯实验,我们成功掌握了硫酸提纯的基本方法和操作技巧。
通过虹吸法和/或蒸馏法,我们能够提取纯净的硫酸溶液,并通过酸碱滴定可以检验其纯度。
硫酸作为一种重要的化工原料,在工业生产和实验室研究中广泛应用,如用于腐蚀试验、消毒消杀、制备其他化合物等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.中国硫酸工业的发展
1874年,天津机械局三分厂建成中国最早的铅室法装置, 1876年投产,日产硫酸约2t,用于制造无烟火药。
1934年,中国第一座接触法装置在河南巩县兵工厂分厂投产。 1949年以前,中国硫酸最高年产量为 180kt(1942)。1983年硫
酸产量达8.7Mt(不包括台湾省),仅次于美国、苏联,居 世界第三位。1998 年产量为20.495Mt,居第二位。 1951年,研制成功并大量生产钒催化剂,此后还陆续开发了 几种新品种。 1956年,成功地开发了硫铁矿沸腾焙烧技术,并将文氏管洗 涤器用于净化作业。 1966年,建成了两次转化的工业装置,成为较早应用这项新技 术的国家。在热能利用、环境保护、自动控制和装备技术等 方面,也取得了丰硕成果。
硝化法的兴衰 1746年,英国人J.罗巴克在伯明翰建成一座 6ft(lft=0.3048m)见方的铅室,这是世界上第一座铅室法生 产硫酸的工厂。1805年前后,首次出现在铅室之外设置燃烧 炉焚燃硫磺和硝石,使铅室法实现了连续作业。1827年,著 名的法国科学家盖.吕萨克建议在铅室之后设置吸硝塔,用铅 室产品(65%H2SO4)吸收废气中的氮氧化物。1859年,英国 人J.格洛弗又在铅室之前增设脱硝塔,成功地从含硝硫酸中 充分脱除氮氧化物,并使出塔的产品浓度达76%H2SO4。这 两项发明的结合,实现了氮氧化物的循环利用,使铅室法工 艺得以基本完善。
铅室法产品的浓度为 65%H2SO4,塔式法则为76%H2SO4。 在以硫铁矿和冶炼烟气为原料时,产品中还含有多种杂质。
40年代起,染料、化纤、有机合成和石油化工等行业对浓硫 酸和发烟硫酸的需要量迅速增加,许多工业部门对浓硫酸产 品的纯度也提出了更高的要求,因而使接触法逐渐在硫酸工 业中居于主导地位。
硫酸的性质、生产方 法和主要设备
主要内容
概述 硫酸的性质 硫酸的生产方法 硫酸合成的工艺及主要设备
第一章 概述
距现今1000年以前就开始制造硫酸,在公元940年在 波斯炼金术的文章里提到,用绿矾FeSO4·7H2O放在 瓶里煅烧,放出SO3和H2O经冷凝使成为H2SO4 ,产 品粘度大,外观像油,所以称为“矾油”,这个绰 号在一些国家仍在沿用。
1.生产方法 至今,硫酸生产的方法有两种:硝化法和接触法。
①硝化法铅室法
②接触法发塔(展式在起法上来基的础)上相为同原处料:来均生以产FHe2SSO2或N4 SO硫2或磺N2O3作为催 化氧化的催化剂
不同处:催化剂 V2O5
早期的硫酸生产 15世纪后半叶,B.瓦伦丁在其著作中,先 后提到将绿矾与砂共热,以及将硫磺与硝石混合物焚燃的两 种制取硫酸的方法。约1740年,英国人J.沃德首先使用玻璃 器皿从事硫酸生产,器皿的容积达300l。在器皿中间歇地焚 燃硫磺和硝石的混合物,产生的二氧化硫和氮氧化物与氧、 水反应生成硫酸,此即硝化法制硫酸的先导。
后通来过居装上有的铂接粉触或法铂丝的18炽31年热,瓷菲管利制普取斯SO首3(先接以触SO法2和)空。气混合,并 1875年,德国雅各布建成第一座生产发烟硫酸的接触法装置。
1881发起,德国巴决了以硫铁矿为原料进行工业生 产的技术关键。
1913年,巴登苯胺纯碱公司发明了添加碱金属盐的钒催化剂,活性 较好,不易中毒,且价格较低,在工业应 用中显示了优异的成 效。从此,性能不断有所改进的钒催化剂相继涌现,并迅速获得 广泛应用,终于完全取代了铂及其他催化剂。
由于硝化法仅能生产低浓度H2SO4,加上对设备的腐蚀,已 被淘汰。目前主要采用接触法(触媒)。自接触法硫酸生产 工艺出现两转两吸技术来,硫铁矿制酸的工艺基本上没有大 的变化,为沸腾焙烧、电除尘、酸洗净化、电除雾、塔式干 吸、两转两吸。并不断的改进和完善。
联邦德国拜耳公司于1964年率先实现两次转化工艺的应用, 又于1971年建成第一座直径4m的沸腾转化器。
1972年,法国的于吉纳-库尔曼公司建造的第一座以硫磺为 原料的加压法装置投产,操作压力为500kPa,日产 550t(100%H2SO4)。
1974年,瑞士的汽巴-嘉基公司为处理含0.5%~3.0%SO2 的低浓度烟气,开发一种改良的塔式法工艺,并于1979年 在联邦德国建成一套每小时处理10km3焙烧硫化钼矿烟气 (0.8%~1.5%SO2)的工业装置。
当时的接触法装置都使用在较低温度下呈现优良活性的铂催化剂。 但其价格昂贵、容易中毒而丧失活性。为此,早期的接触法装置, 都必须对进入转化工序的气体进行充分的净化。
1906年,美国人F.G.科特雷耳发明高压静电捕集矿尘和酸雾的技术 在接触法工厂获得成功,成为净化技术上的重要突破。
第一次世界大战的爆发,使欧美国家竞相兴建接触法装置,产品 用于炸药的制造。这对接触法的发展颇具影响。
由于庞大的铅室生产效率低、耗铅多和投资高,19世纪后半 期起,不断有人提出各种改进的建议和发明,终于导致以填 充塔代替铅室的多种塔式法装置的问世。
1911年,奥地利人C.奥普尔在赫鲁绍建立了世界上第一套塔 式法装置。1923年,H.彼德森在匈牙利马扎罗瓦尔建成一套 由一个脱硝塔、两个成酸塔和四个吸硝塔组成的七塔式装置, 在酸液循环流程及塔内气液接触方式等方面有所创新,提高 了生产效率。
3.用途
硫酸用途十分广泛。硫酸在大宗生产的化学品中产量居于前 列,是最重要的化工原料之一,素有“工业之母”之称。在 国民经济各部门有着广泛用途。
硫酸最主要的用途是生产化学肥料,用于生产磷酸、重过磷 酸钙、硫铵等,其消耗量占硫酸产量的60%。
硫酸工业进展如下:
装置大型化;
设备结构和材质的改进;
节能和废热利用;
生产的计算机管理;
减少污染物排放,保护环境。
硫酸生产将向增加能量回收、减少排放和降低成本的方向发 展。
第二次世界大战以后,硫酸工业取得了较大的发展。现代 的硫酸生产技术也有显著的进步。
50年代初,联邦德国和美国同时开发成功硫铁矿沸腾焙烧 技术。
