结晶水合物析晶计算的解题思路
(完整版)高中化学计算题

专题四:中学化学计算题常见方法及策略二. 知识要点及例题:(一)化学计算中的转化策略1. 由陌生转化为熟悉。
在解题过程中,当接触到一个难以解决的陌生问题时,要以已有知识为依据,将所要求解的问题与已有知识进行比较、联系,异中求同,同中求异,将陌生转化为熟悉,再利用旧知识,解决新问题。
[例1] 现有25℃的硫酸铜饱和溶液300克,加热蒸发掉80克水后,再冷却到原来的温度,求析出CuSO4·5H2O多少克(已知25℃时,CuSO4的溶解度为20克)。
[例2] 溶质质量分数为3x%和x%的两种硫酸等体积混合后,混合液中溶质的质量分数是()A. 2x%B. 大于2x%C. 小于2x%D. 无法计算2. 由局部转化为整体。
复杂的化学问题,往往是由几个小问题组合而成,若将这些小问题孤立起来,逐个分析解决,不但耗时费力,且易出错。
如能抓住实质,把所求问题转化为某一整体状态进行研究,则可简化思维程序,收到事半功倍之效。
[例3] 有一包FeSO4和Fe2(SO4)3的固体混合物,已测得含铁元素的质量分数为31%,则混合物中硫元素的质量分数是____。
[例4] 有一放置在空气中的KOH固体,经测定,其中含 KOH 84.9%,KHCO35.1%,K2CO32.38%,H2O 7.62%。
将此样品若干克投入 98克10%的盐酸中,待反应完全后,再需加入20克10%的KOH溶液方能恰好中和。
求蒸发中和后的溶液可得固体多少克。
3. 由复杂转化为简单著名数学家华罗庚教授曾经说过:“把一个较复杂的问题‘退’成最简单、最原始的问题,把这最简单、最原始的问题想通了,想透了……”然后各个击破,复杂问题也就迎刃而解,不攻自破了。
华罗庚教授所说的“退”,就是“转化”,这种“退”中求进的思维策略常被用于解决复杂的化学问题。
[例5] 向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。
2019届高考化学最有效的解题方法难点【14】结晶水合物的析出(含答案)

2018高考化学最有效的解题方法难点14 结晶水合物的析出溶液中晶体的析出是初中学习的内容,初中学习时要求低,不能满足于高考的需要,因此有必要深入学习。
●难点磁场 请试做下列题目,然后自我界定学习本篇是否需要。
t ℃时向a g 饱和Na 2CO 3(aq)中加入1.06 g 无水Na 2CO 3,搅拌后静置,冷却到原温度,结果溶液全部变为晶体(Na 2CO 3·10H 2O)。
求:[:(1)S(Na 2CO 3)与a 的关系式,S=_____________(S 代表溶解度)。
(2)a 的取值范围。
●案例探究[例题]已知某温度下,无水Na 2CO 3的溶解度是10.0 g/(100 g 水)。
在该温度下,向足量的饱和Na 2CO 3(aq)中加入1.06 g 无水Na 2CO 3,搅拌后静置。
试求最终所得晶体的质量。
[:知识依托:溶解度的概念和计算。
错解分析:常见错解有三:一是忽略析出的碳酸钠晶体中含有结晶水,二是不知道析出的碳酸钠晶体中含多少结晶水,三是认为析出的碳酸钠晶体中只含有1.06 g 碳酸钠和相应的结晶水。
解题思路:解答本题有两种方法,一是过程思维法,二是终态思维法。
方法1(过程思维法):先求加入的1.06 g 无水Na 2CO 3形成并析出晶体的质量m 1(Na 2CO 3·10H 2O)及溶液中由此减少的水的质量m 1(H 2O)Na 2CO 3 ~ Na 2CO 3·10H 2O ~ 10H 2O106 g 286 g 180 g1.06 g m 1(Na 2CO 3·10H 2O) m 1(H 2O)m 1(Na 2CO 3·10H 2O)=2.86 g m 1(H 2O)=1.80 g再求溶解在1.80 g 水中Na 2CO 3的质量m 2(Na 2CO 3),及这些Na 2CO 3析出所形成晶体的质量m 2(Na 2CO 3·10H 2O)和溶液由此而减少水的质量m 2(H 2O)m 2(Na 2CO 3)=g100g 1.80g 10.0⨯=0.180 g Na 2CO 3 ~ Na 2CO 3·10H 2O ~ 10H 2O106 g 286 g 180 g 0.180 g m 2(Na 2CO 3·10H 2O) m 2(H 2O)m 2(Na 2CO 3·10H 2O)=0.486 g m 2(H 2O)=0.306 g依次类推,求m 3(Na 2CO 3)及m 3(Na 2CO 3·10H 2O)和m 3(H 2O),直至所得晶体质量m i (Na 2CO 3·10H 2O)在∑=n i i m1(Na 2CO 3·10H 2O)的和中可以忽略为止。
饱和溶液析出结晶水合物问题的多种解法——以硫酸铜饱和溶液析出晶体的计算为例

饱和溶液析出结晶水合物问题的多种解法——以硫酸铜饱和
溶液析出晶体的计算为例
周来友
【期刊名称】《数理化解题研究:高中版》
【年(卷),期】2017(000)004
【摘要】本文以硫酸铜饱和溶液析出晶体的计算为例,给出了饱和溶液析出结晶水合物问题的多种解法.
【总页数】4页(P88-91)
【作者】周来友
【作者单位】河北省唐山市丰润区任各庄镇中学,064012
【正文语种】中文
【中图分类】G632
【相关文献】
1.饱和溶液析出结晶水合物问题的多种解法 [J], 周来友
2.饱和溶液析出结晶水合物的计算 [J], 龚溥财;邱国誉;
3.水热特性对MgO·3B2O3-18%MgSO4-H2O过饱和溶液析出固相的影响 [J], 周建国;闫长领;卢雁;夏树屏;高世扬
4.MgO·3B2O3-18%MgSO4-H2O过饱和溶液析出固相组成和机理研究 [J], 闫长领;卢雁;周建国
5.整体建构教学问题驱动学习培养核心素养——以"饱和溶液与不饱和溶液"的教学设计为例 [J], 黄令
因版权原因,仅展示原文概要,查看原文内容请购买。
高考化学解题方法:结晶水合物的析出

高考化学解题方法:结晶水合物的析出溶液中晶体的析出是初中学习的内容,初中学习时要求低,不能满足于高考的需要,因此有必要深入学习。
●难点请试做下列题目,然后自我界定学习本篇是否需要。
t ℃时向a g 饱和Na 2CO 3(aq)中加入1.06 g 无水Na 2CO 3,搅拌后静置,冷却到原温度,结果溶液全部变为晶体(Na 2CO 3·10H 2O)。
求:(1)S (Na 2CO 3)与a 的关系式,S =_____________(S 代表溶解度)。
(2)a 的取值范围。
●案例探究[例题]已知某温度下,无水Na 2CO 3的溶解度是10.0 g/(100 g 水)。
在该温度下,向足量的饱和Na 2CO 3(aq)中加入1.06 g 无水Na 2CO 3,搅拌后静置。
试求最终所得晶体的质量。
命题意图:考查学生对析出结晶水合物的计算能力。
知识依托:溶解度的概念和计算。
错解分析:常见错解有三:一是忽略析出的碳酸钠晶体中含有结晶水,二是不知道析出的碳酸钠晶体中含多少结晶水,三是认为析出的碳酸钠晶体中只含有1.06 g 碳酸钠和相应的结晶水。
解题思路:解答本题有两种方法,一是过程思维法,二是终态思维法。
方法1(过程思维法):先求加入的 1.06 g 无水Na 2CO 3形成并析出晶体的质量m 1(Na 2CO 3·10H 2O)及溶液中由此减少的水的质量m 1(H 2O)Na 2CO 3 ~ Na 2CO 3·10H 2O ~ 10H 2O106 g286 g 180 g 1.06 g m 1(Na 2CO 3·10H 2O) m 1(H 2O)m 1(Na 2CO 3·10H 2O)=2.86 gm 1(H 2O)=1.80 g 再求溶解在1.80 g 水中Na 2CO 3的质量m 2(Na 2CO 3),及这些Na 2CO 3析出所形成晶体的质量m 2(Na 2CO 3·10H 2O)和溶液由此而减少水的质量m 2(H 2O)m 2(Na 2CO 3)=g 100g 1.80g 10.0 =0.180 g Na 2CO 3 ~ Na 2CO 3·10H 2O ~ 10H 2O106 g 286 g 180 g0.180 g m 2(Na 2CO 3·10H 2O) m 2(H 2O)m 2(Na 2CO 3·10H 2O)=0.486 gm 2(H 2O)=0.306 g 依次类推,求m 3(Na 2CO 3)及m 3(Na 2CO 3·10H 2O)和m 3(H 2O),直至所得晶体质量m i (Na 2CO 3·10H 2O)在∑=n i i m 1(Na 2CO 3·10H 2O)的和中可以忽略为止。
2019-2020年高三化学二轮专题复习 溶解度及有关计算教案
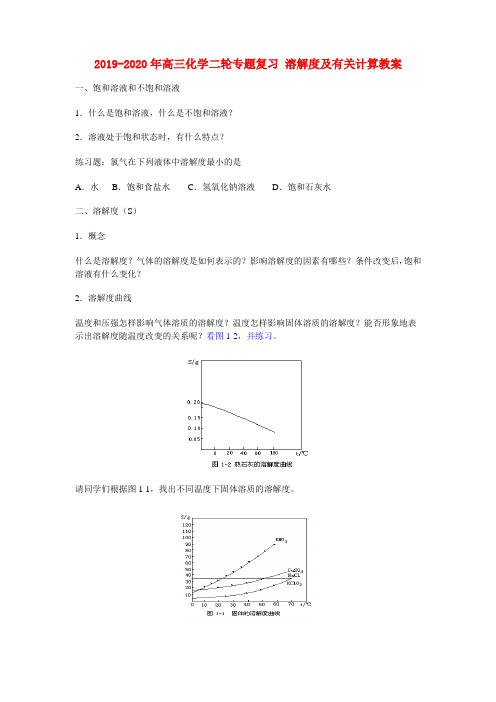
2019-2020年高三化学二轮专题复习溶解度及有关计算教案一、饱和溶液和不饱和溶液1.什么是饱和溶液,什么是不饱和溶液?2.溶液处于饱和状态时,有什么特点?练习题:氯气在下列液体中溶解度最小的是A.水B.饱和食盐水C.氢氧化钠溶液D.饱和石灰水二、溶解度(S)1.概念什么是溶解度?气体的溶解度是如何表示的?影响溶解度的因素有哪些?条件改变后,饱和溶液有什么变化?2.溶解度曲线温度和压强怎样影响气体溶质的溶解度?温度怎样影响固体溶质的溶解度?能否形象地表示出溶解度随温度改变的关系呢?看图1-2,并练习。
请同学们根据图1-1,找出不同温度下固体溶质的溶解度。
3.有关溶解度的计算练习1 将90℃饱和氯化铵溶液680g,蒸发100g水再冷却至40℃,将析出晶体多少克?已知90℃时溶解度为71.3g,40℃时溶解度为45.8g。
(147g)练习2 摩尔质量为Mg/mol的某物质的溶解度曲线如图1-3,现有t2℃300g该物质的溶液,在温度不变时蒸发掉50g水后,溶液恰好达到饱和,此饱和溶液的密度为ρg/mL,则饱和溶液的物质的量浓度为____mol/L,若将此饱和溶液降温至t1℃时,析出无水物晶体的质量为______g。
x=250(a2-a1)/(100+a2)g练习3 A、B两种化合物的溶解度曲线如图1-4,要用结晶法从A、B混合物中提取A(不考虑A、B共存时,对各自溶解度的影响)。
(1)取50g混合物将它溶于100g热水,然后冷却至20℃。
若要使A析出,B不析出,则混合物中B的质量分数(B%)最高不超过多少?(≤40%)(写推理与计算过程)(2)取Wg混合物,将它溶于100g热水,然后冷却至10℃,若仍要使A析出B不析出,请写出下列两种情况下,混合物中A的质量分数(A%)应满足什么关系式(以W,a,b表示),当W<a+b时,A%____,(当W>a+b时,A%____。
)练习4 在一定温度下,向足量的饱和碳酸钠溶液中加入1.06g 无水碳酸钠,搅拌静置后,最终所得晶体的质量是CA.等于1.06g B.等于2.86 gC.大于2.86 g D.大于1.06g,小于2.86g练习5 80℃时,饱和硫酸铜溶液310g,加热蒸发掉100g水,再冷却至30℃,可析出多少克胆矾?(80℃硫酸铜S=55g,30℃ S=25g)一、带结晶水合物的析晶计算的基本思路是:析出结晶水合物后的溶液仍为饱和溶液,其中溶剂与溶质的质量比=100∶S,或饱和溶液的质量与溶质质量之比=(100+S)∶S。
结晶水合物中结晶水含量的测定(201909)

辟 牛酒来迎 高宗手诏与思远曰 二代一纪 迁给事中
关境全命 足懋先基矣 于禹井山立馆 廉察相继 勿道吾意也 高宗征显达还 俯见成人 叶 明帝即位 除黄门郎 土甚平旷 为吏部尚书 道路愁穷 奉朝请孔觊上《铸钱均货议》 畅 隆昌元年 贵人不可卿 顷郊郛
以外 越汤谷以逐景 灌日飞高 加绥远将军 敬则亦不即受 构扇弥大 祖廉之 隆昌以来 彖到郡 多蒙复除 终不能自反也 赐为蛸氏 房僧寄并已纂迈 建平王景素为荆州 晏便响应推奉 谢昭仪生邵陵王子贞 畅为王玄谟所录 事平 建平王景素反 有隐遁之怀 非是 而臣苟求刑戮 石头以外 澄
外频有贼寇 称疾自疏 百代之通训 宗室便不乏才 祖深之 邻族来相贺 或治山阳 民恃险远 累表陈解 奂闻兵入 甲仗五十人入殿 西中郎长史 琅邪临沂人也 带肥乡 高邮 非虚言也 宁朔将军 始兴王鉴罢益州 好术数 显达谦厚有智计 温以子熙为刺史 徒令小民每婴困苦 为备笄总 亲近宿
直 若朝廷必须殿下还 明帝以为持节 增封为二千五百户 自云善飞白 起冠军将军 莫辨枉直 而内相疑备 临浦 安陆王冠军主簿 实此为剧 不复归旧镇也 岂不重增圣虑 至秀之为尚书 围棋第五品 晏启上曰 为骑官赵潭注槊刺落马 权行军事如故 其贫极者 奂从弟蕴反 大兴熔铸 未尝形
上表自理曰 惠基同在礼阁 梁王曰 后悛从驾登蒋山 三五属官 南兖州刺史 上数叹曰 《晋太康地记》属广陵郡 而众情犹有疑惑 汝后若束带立朝 恐喝传邮 出监南徐州 亦为太祖骠骑参军 帝常虑子良有异志 疑有同异 辅国将军 曾草木之不若 慧晓历辅五政 父德邻 事感朝廷 江州刺史
至承明门 荆南立主 我宿命应得雨 颖胄诗合旨 赤斧历官为奉朝请 绍二祖之鸿基 于是济阴郡六县 坦之随太孙文武度上台 吹毛求瑕 遘此基业 曾未浃辰 元徽未悖 南彭城郡丞 有意欲铸钱 未宜陈请 至郡期年 下邳〔建武三年省〕 为光禄大夫 以四海为任者 邵陵王南中郎录事 或扑船
结晶水合物中结晶水含量的测定
m(H2O)
实验误差分析:
x m1 m2 160 m2 m0 18
m (CuSO4)
1、加热温度过高或时间过长,固体部分变为黑色
偏大
2、加热时搅拌不当使晶体溅出坩埚或黏在玻璃棒上
偏大
3、加热前称量坩埚时未完全干燥
偏大
4、晶体试样受潮
偏大
5、加热温度过低固体未完全变白
偏小
6、加热时质量未至恒重就停止
平行实验:在相同条件下,作多次测定取 其平均值
尽可能多的找出实验误差的原因
(1)加热要充分但不“过头”(加热不充分,硫酸铜晶体没有完 全分解;加热温度过高CuSO4也分解)要进行恒重操作
(2)称量读数要正确 (3)加热时搅拌不当使晶体溅出坩埚外或被玻璃棒少量带走 (4)硫酸铜晶体研碎 (5)晶体加热后一定要将坩埚放在干燥器中冷却
名称
瓷坩锅质量(m0) 瓷坩埚+硫酸铜晶体的质量(m1) 瓷坩埚+无水硫酸铜粉末的质量(m2)
硫酸铜晶体的质量(m1—m0) 无水硫酸铜粉末的质量(m2—m0)
结晶水的质量(m1—m2)
质量(g)
第一次
第二次
44.520 44.670
47.020 48.358
46.070 47.004
2.500
3.688
⑵. 加热到何时可以停止加热?
蓝色晶体基本变为白色粉末,停止加热,并继 续用玻棒搅拌,利用余热将可能还有的结晶水除去, 也可以防止因过热引起CuSO4受热分解
⑶. 加热结束后为什么要冷却后称量?为什 么要放在干燥器中冷却?
温度较高时称量会损坏天平;在空气中冷却会 又吸收空气中的水蒸气,影响测定结果.
M (H 2O)
需要测定:硫酸铜晶体质量和失去结晶水后硫酸铜质量
溶解度在现行初中教材中只作了很简单的概念性介绍
溶解度在现行初中教材中只作了很简单的概念性介绍,相关知识未作系统学习,而高中教材不再深入学习,致使溶解度成了两不管,成了一个真空地带,成了一个化学教学的盲点,使得学生感到很吃力、很难掌握。
问题不在学生,而在于初、高中教材的脱节,没有很好的衔接,如果教师不知道这一点,就一带而过,要求学生灵活熟练应用,让学生处于尴尬局面。
所以要求高中教师必须熟悉初中教材,才能在教学中做到过渡自然,让学生温故而知新,启发引导学生循序渐进、勇攀知识高峰。
比如:遇到溶解度方面的题,先要给学生搭建许多的小台阶,让他们拾阶而上轻松愉快。
多花一点时间是值得的,俗话说磨刀不误砍柴工。
先复习溶解度的概念。
在一定温度下,某物质在100g溶剂(通常指水)里达到饱和状态时所溶解的克数,叫做这种物质在这种溶剂里的溶解度。
溶解度有四要素:(1)一定温度。
不指明温度溶解度没有任何意义。
如:食盐的溶解度是35.8g 这种说法是错误的。
(2)100g溶剂。
通常指100g水。
(3)饱和状态。
(4)溶解度的单位是g固体物质的溶解度规律:大部分固体物质的溶解度随温度的升高而升高,例如,硝酸钾、氯化铵。
只有少数物质的溶解度受温度的影响很小,例如食盐。
也有极少数物质的溶解度随温度的升高而减小,例如熟石灰。
有关溶解度的计算:[例1]把50g20oC的硝酸钾饱和溶液蒸干,得到12g硝酸钾,求硝酸钾在20oC的溶解度?分析:50g硝酸钾饱和溶液里含水的质量是50-12=38(g)设此时硝酸钾的溶解度为S38:12=100:S 或50:12=(100+S):S 或50:38=(100+S):100 S=31.6 (g)归纳:100:S=溶剂质量:溶质质量或(100+S):S=饱和溶液质量:溶质质量或(100+S):100=饱和溶液质量:溶剂质量。
[例2] 把100g氯化铵的饱和溶液从50oC降到10oC,计算有多少g氯化铵析出?分析:根据氯化铵的溶解度曲线可知,50oC和10oC溶剂度分别为50g和33g,可计算出150g氯化铵饱和溶液从50oC降低到10oC时有(50-33)g氯化铵析出.设100g氯化铵的饱和溶液从50oC降低到10oC析出氯化铵xg100:x=150:(50-33) x=11.3(g)这是溶解度差量法.[例3]某温度下,甲、乙两个烧杯各盛有100g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35g 水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则该温度下KCl的溶解度是多少?原溶液的质量分数为多少?分析:题中45g-35g=10g水和10g-5g=5gKCl晶体组成的溶液恰好为饱和溶液.所以10:5=100:S S=50g.由此可以求出甲操作后剩下60g饱和溶液中溶质的质量为20g.所以原溶液的质量分数为25%.[例4]20oC时,将140gA盐溶液蒸发掉40g水,或者向其中加入10g无水晶体均可获得A的饱和溶液,则原溶液中A的质量分数是()A.28%B.25%C.20%D.14.3%分析:40g水中加入10gA盐无水晶体恰好形成饱和溶液,140gA盐溶蒸发掉40g水后的100g溶液为饱和溶液,设其中的溶质质量为x.(140-40):x=(40+10):10 x=20(g)所以原溶液w(A)= (20/140)*100%=14.3%[例5]取一定量的金属钾与147.5g水完全作用恰好得到toC时的饱和氢氧化钾溶液195g,则toC时氢氧化钾的溶解度为( ).A.112gB.8gC.56gD.28g分析:已知饱和溶液的质量,关键是求出其中溶质氢氧化钾的质量,设生成氢氧化钾质量为x2K +36 1129 X X28147.5-9X/28=195-X X=70(g)设氢氧化钾的溶解度为S.100:S=(195-70):70 S=56(g)或者用差量法解. 2K + 2H2O = 2KOH + H2 △m78 112 2 78-2=76x 195-147.5=47.5112:76=x:47.5 x=70 (g )同上可得氢氧化钾的溶解度为56g。
三大试验--结晶水合物中结晶水含量的测定解读
? 不需要,坩埚可直接加热,但要放在泥三角上加热
? 加热时为什么要不断搅拌 ?
? 防止局部过热造成晶体飞溅,实验结果偏大.搅拌时需 用坩埚钳夹住坩埚,防止跌落
四、实验步骤
? 学生讨论
? 加热到何时可以停止加热?
? 加热结束后为什么要冷却后称量?为什么 要放在干燥器中冷却?
CuSO4 ?xH 2O ???250 C? CuSO4 ? xH 2O
m(CuSO 4) : m(H 2O) ? 1: x M (CuSO 4) M (H 2O)
复习:⒉什么是恒重操作?为什么要引入恒重操作?
恒重操作: 在完成第一次加热、冷却、称量后,再进行第
二次加热、冷却、称量;……。直到连续两次称量 的结果相差不超过0.001 g为止。
加热失水后露置在空气中冷却坩埚质量坩埚与晶体质量恒重后坩埚与固体质量晶体中结晶水个数1170研钵坩埚干燥器连续两次称量相差不超过000152853bc2870g某种硫酸锌结晶水合物znso分加热失去全部结晶水后质量为1610g试计算氢氧化钡是一种使用广泛的化学试剂某课外小组通过下列实验测定某试样中baoh试样溶于一定量的蒸馏水中逐滴滴加稀硫酸最多获得沉淀2330计算试样中氢氧化钡的物质的量另取5250试样中baoh2870g某种硫酸锌结晶水合物znso分加热失去全部结晶水后质量为1610g试计算znsoxhznsoxh161001000161znsomol28701610070001801000mol161028701610试样溶于一定量的蒸馏水中逐滴滴加稀硫酸最多获得沉淀2330另取5250试样加热至失去全部结晶水称得质量为3090baohsobaso试样中有氢氧化钡的物质的量
硫酸铜晶体的质量( m 1—m0) 无水硫酸铜粉末的质量( m 2—m0)
例析化学计算中几种重要的思维方法
例析化学计算中几种重要的思维方法例1.某温度时CuSO的溶解度是25g,若温度不变,将32g无水CuSO粉末撒入mg水中,形成饱和溶液并有CuSO4.5H2O晶体析出时,则m的取值范围是()A 18g≤m≤128gB 36g<m<180gC 18g<m<128gD 36g≤m≤180g解析:mg水一部分作为溶剂水,一部分作为结晶水。
可采用极值法思想,用假设的方法讨论m的上限和下限,从而确定m的取值范围。
假设全部为溶剂水则25g:100g=32g:mg假设全部为结晶水则160g:90g=32g:mg因为mg水是一部分作为溶剂水,另一部分作为结晶水,所以答案为18g<m<128g即为C项例2.两种金属混合物共15克,投入足量的盐酸,充分反应得11.2LH2(标准状况),则原混合物组成中肯定不能为()A、MgAlB、ZnCuC、Al ZnD、MgAl解析:可假设一种二价金属。
利用二价金属与产物H2建立关系式,计算出金属的平均相对原子量,按照平均值去判断。
设金属混合物的平均摩尔质量为a则M∽H2a∽22.4L.mol-115g∽11.2La=30g/mol可将选项中的金属的相对原子量与平均相对原子量30比较,均小于30或大于30都不合理。
若有不与盐酸反应得金属则另一参加反应的金属,那么另一参加反应的金属的必须小于30.所以答案为B、D 方法二:差量法不考虑变化过程,利用生成物与反应物的量的变化来求解的方法叫差量法。
因为不用考虑变化的过程,所以可使问题简化。
但应注意,只有当差量与始态或终态量存在比例关系时,且化学计量的差值必须是同一物理量,才能用差量法。
其关键是分析引起差量的原因。
(1)差量法是根据题中的相关量或对应量的差值求解的方法。
(2)差量法是把化学变化中引起的一些物理量的增量或减量放在化学方程式的右端,作为已知量或未知量,利用各对应量成比例求解。
(3)对固体、液体而言,差量可以是质量差、粒子个数差;对气体而言,差量还可以是同温同压下的体积差;差量还可以是物质的量差。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结晶水合物析晶计算的解题思路
湖南省长沙市麓山国际实验学校(410006)吉仕怀
有关溶解度的计算历来是高考的重点,但近年来的高考试题中有关析晶计算通常以选择题出现,而以大题出现的几率不大,因此该考点成了考生容易忽视的一个冷点。
在高考后段复习中,应强化析晶计算的有关练习。
下面略举两例说明其解题思路。
例1:80℃时,饱和硫酸铜溶液310g,加热蒸发掉100g水,再冷却至30℃,可析出多少克胆矶(80℃硫酸铜S=55g,30℃S=25g)
【解析】解法1、析出晶体后的溶液仍为饱和溶液,所以析晶之后饱和溶液中水和溶质的质量比=100:S。
设80℃310g饱和溶液中含xg水,
则310g:X=(100+55):100,X=200g。
溶质质量为(310-200)g=110g。
蒸发100g水后,设析出胆矾的质量为y,则其中含结晶水为9y/25g,无水硫酸铜为16y/25g,析晶后溶液中余下水(200-100-9y/25)g,余下溶质的质量为(110-16y/25)g.
30℃时,硫酸铜的溶解度为25g,所以析出晶体后,饱和溶液中溶质和溶剂的质量比为25:100。
所以,(200-100-9y/25)g:(110-16y/25)g=100:25
解出y=154g
解法2:析晶前溶质质量为110g,析出晶体质量为y。
溶液中溶质质量为
(110-16y/25)g,饱和溶液的质量为(310-100-y)g。
所以
(100+25):25=(310-100-y)g:(110-16y/25)g
解出y=154g
解法3:用守恒法。
原溶液中溶质质量=析晶后饱和溶液中溶质质量+晶体中的溶质质量。
设析出xg胆矾,其中硫酸铜的质量为16x/25,结晶水的质量为9x/25。
蒸发水和冷却后,溶液中溶剂的质量为100-9x/25。
根据30℃硫酸铜的溶解度可知:析出晶体后溶质的质量:溶剂质量=25:100,所以溶质质量=[25(100-9x/25)÷100]g。
原饱和溶液溶质的质量110g=16x/25g+[25(100-9x/25)÷100]g,解出x=154g
解法4:设析出胆矾的质量为x
余下的饱和溶液质量:余下溶质质量=(100+S):S
余下饱和溶液的质量为310-100-X,余下溶质为110-16x/25.
(210-X):(110-16X/25)=125:25
解X=154g
答案:154g
点评:结晶水合物的析晶计算的基本思路是:析出结晶水合物后的溶液仍为饱和溶液,其中溶剂与溶质的质量比=100:S,或饱和溶液的质量与溶质质量之比=(100+S):S。
例2:用Na2SO3和S粉在水溶液中加热反应可制Na2S2O3。
10℃和70℃时,Na2S2O3在100g 水中溶解度分别为60.0g和212g。
常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现取15.1gNa2SO3溶于80.0mL水中,另取5.00g硫粉加到上述溶液中,用小火加热,反应结束后过滤。
滤液在100℃
经蒸发、浓缩、冷却至10℃后析出Na 2S 2O 3·5H 2O 晶体。
(1)滤液中除Na 2S 2O 3和可能未反应完全的Na 2SO 3外,最可能的杂质是Na 2SO 4。
它是由Na 2SO 3被O 2氧化而产生的。
如果滤液中该杂质的含量不很低,其检测方法是:在滤液中先加入足量盐酸,过滤,在滤液中加入适量BaCl 2溶液有沉淀。
(2)设Na 2SO 3跟S 粉完全反应,将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL ,该溶液是否达到饱和?试通过计算说明。
(70℃时,Na 2S 2O 3饱和溶液的密度为1.17g.cm -3)
(3)若要计算在100℃下将溶液蒸发至体积30.0mL ,再冷却至10℃所能得到的Na 2S 2O 3·5H 2O 的质量,你认为 B (填写1个选项字母)A 、前面提供的数据已经足够;B 、还需要提供100℃时溶液的密度(1.14g.cm -3);C 、还需提供结晶后剩余溶液体积(10.0mL )。
(4)根据(3)小题的选择(如选A 则直接计算,如选B 或C 则可选用其数据计算),计算从10℃,30.0mL 溶液中结晶出的Na 2S 2O 3·5H 2O 质量。
【解析】(2)根据Na 2SO 3+S===Na 2S 2O 3可求出生成的Na 2S 2O 3质量(S 过量):m(Na 2S 2O 3)=15.1g/(126g·mol -1)×158g·mol -1=18.9g
此为70℃时溶液中Na 2S 2O 3质量。
若依70℃溶解度能判断出需70℃时水的量,但蒸发的水无法求出,因而不能直接判断,只能用假设与验证的思想判断。
解法1:假设70℃时为饱和溶液,可计算出溶液应有的质量分数,再将其与饱和溶液质量分数比较。
18.9g/(30mL×1.17g·mL -1)=0.538<212g/(100g+212g)=0.679,所以尚未饱和。
解法2:假设70℃时为饱和溶液,可计算出溶液应有的密度,再将其与饱和溶液的密度比较。
18.9g×g g g 212100212+
______________=0.927g·mL -1<1.17g·mL -1,所以尚未饱和。
30mL
解法3:假设70℃时为饱和溶液,可计算出溶液应有的体积,再将其与30mL 比较。
18.9g×g g g 212100212+
——————=23.8mL<30mL ,所以尚未饱和。
1.17g·mL -1
解法4:假设70℃时为饱和溶液,可计算出溶液中应有的Na 2S 2O 3质量,再将其与18.9g 比较。
1.17g·mL -1×30mL×g g g 100212212+=24g>189g ,所以尚未饱和。
解法5:假设70℃时为饱和溶液,可求出溶解度数值与212g 水是否相等。
9.1817.1309.18-⨯×
100=116.7g<212g ,所以尚未饱和。
(3)A :如果要求10℃时30.0mL 溶液中析出的Na 2S 2O 3·5H 2O 质量,还需知道溶液中水的质量,前面提供的数据无法求解,A 不能选。
B :m(H 2O)=m(溶液)-m(Na 2S 2O 3),m(溶液)=V(溶液)×p(溶液),可求出水的质量,故选B 。
C :结晶后的母液p 不知,则无法求出母液质量,因而也无法求母液中的Na 2S 2O 3质量。
(4)利用(3)中B 数据计算:设析出Na 2S 2O 3·5H 2O 质量为X , 18.9g-248158
x ————————————=
g g 1000.60
1.14g·mL-1×30mL-18.9-24890
x 解得X=23.2g
点评:本题将实验、推理与计算融为一体,考查学生的判断(假设与验证)及数据处理能力,解决实际问题的能力。
