【复习必备】2020版高考化学一轮复习 全国卷热考微专题(15)酸碱中和滴定原理的拓展应用学案
2020-2021学年度高二化学《酸碱中和滴定》知识点总结以及典例导析

酸碱中和滴定【学习目的】1、掌握酸碱中和滴定的原理;2、初步掌握酸碱中和滴定的方法。
【要点梳理】要点一、中和滴定的原理和方法。
1、定义:用物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的实验方法叫中和滴定法。
2、原理:在中和反响中使用一种物质的量浓度的酸(或碱)溶液与未知物质的量浓度的碱(或酸)溶液完全中和,测出二者所用的体积,根据反响化学方程式中酸、碱物质的量的比求出未知溶液的物质的量浓度。
3、关键:①准确测定参加反响的两种溶液的体积;②准确判断中和反响是否恰好完全反响。
4、指示剂的使用。
①用量不能太多,常用2~3滴,因指示剂本身也是弱酸或弱碱,假设用量过多,会使中和滴定中需要的酸或碱的量增多或减少。
②指示剂的选择。
选择指示剂时,滴定终点前后溶液的颜色改变:颜色变化比照明显。
如强酸与强碱的中和滴定,到达终点时,pH变化范围很大,可用酚酞,也可用甲基橙;强酸滴定弱碱,恰好完全反响时,生成的盐水解使溶液呈酸性,应选择在酸性范围内变色的指示剂——甲基橙;强碱滴定弱酸,恰好完全反响时,生成的盐水解使溶液呈碱性,应选择在碱性范围内变色的指示剂——酚酞。
一般不用石蕊试液,原因是其溶液颜色变化比照不明显,且变色范围较大。
要点二、中和滴定操作。
1、中和滴定的仪器和试剂。
①仪器。
酸式滴定管(不能盛放碱性溶液、水解呈碱性的盐溶液、氢氟酸)、碱式滴定管、铁架台、滴定管夹、烧杯、锥形瓶等。
②试剂。
标准溶液、待测溶液、指示剂、蒸馏水。
2、准备过程。
①滴定管的使用:a.检验酸式滴定管是否漏水(碱式滴定管同样检验)。
b.洗净滴定管后要用标准液润洗2~3次,并排除滴定管尖嘴处的气泡。
c.注入液体:分别将酸、碱反响液参加到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0〞以上2 mL~3 mL处,并将滴定管垂直固定在滴定管夹上。
d.调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴局部充满反响液(假如酸式滴定管尖嘴局部有气泡,应快速放液以赶走气泡;除去碱式滴定管胶管中气泡的方法如下图),并使液面处于某一刻度,准确读取读数并记录。
高三化学上学期第一轮复习酸碱中和滴定

加盟网/
使用木龙骨板材隔墙时,在立撑之间每隔m左右加盯横撑一道。A.0.5~1B.1.2~1.5C.1.7~2D.2.1~2.5 下列不属于门诊病案评估要点的是。A.确诊及时、正确B.查体记录具体、确切C.挂号准确率≥99%D.病史采集准确、完整E.维护病人的知情权和隐私权 含有味蕾的舌乳头有A.丝状乳头B.菌状乳头C.叶状乳头D.以上均含有 病程中梅毒传染性最强的是A.潜伏期B.第Ⅰ期C.第Ⅱ期D.第Ⅲ期E.恢复期 [单选,案例分析题]一急性心梗患者,突然晕厥,心电图为室速160次/分,查血压为80/60nmmHg,脉搏触不清,心音弱,无杂音。本例急性期心肌梗死心电图表现应是A.病理性Q波B.S-T段弓背样抬高,可见病理性Q波C.S-T段水平样压低D.T波高耸,ST段位于基线E.室性心动过速 何谓医患关系? 2007年2月1日,某次列车上来无票乘坐席别,发、到站均相同的军人25人,办理补票业务。A.应按团体旅客B.如持有师(旅)以上单位公函可比照团体旅客C.应按一般旅客D.应按军运运价 对新管模防护层进行清理应彻底。 下列哪项是胃十二指肠溃疡急性穿孔的早期表现()A.上腹部突发剧痛,有明显腹膜刺激征B.呕血、黑便C.寒战、高热D.腹部出现移动性浊音E.肝浊音界缩小和消失 “十二五”规划要求改革开放取得明显进展的重要领域包括。A.财税金融B.要素价格C.科技创新D.第三产业E.垄断行业 不属于真性牙源性肿瘤的为A.牙瘤B.成釉细胞纤维瘤C.成釉细胞瘤D.牙源性纤维瘤E.牙源性钙化上皮瘤 放射自显影的基本原理是。A.利用感光材料能改变物质的密度B.放射能使感光材料分解C.放射性核素使感光材料发光D.利用射线能使感光材料感光E.利用自动探测仪器测量组织中的放射性分布 女性,27岁,因产后少尿、水肿入院,既往有红斑狼疮病史。患者经激素冲击治疗后出现咳嗽、咯鲜血,其咯血原因应首先考虑A.弥漫性肺泡出血B.间质性肺炎C.支气管扩张症D.急性左心衰竭E.肺结核 有毒和刺激性气体放出的操作应在操作。 施工企业提交的履约保函,属于《中华人民共和国担保法》规定的担保A.留置B.保证C.定金D.质押 患者,女性,38岁,左下后牙3天来持续胀痛,有冷热刺激痛,有跳痛,不能咬物。近2个月以来,该牙一直严重食物嵌塞而来我院就诊。最有可能的诊断是()A.牙龈乳头炎B.急性上颌窦炎C.急性根尖周D.三叉神经痛E.急性牙髓炎 索赔利润的款额计算通常按照计算。A.由监理工程师计算报业主确认的利润额B.用承包商总部平均利润百分率C.由承包商与业主双方协商确定的利润率D.采用与原报价单中一致的利润百分率 以下关于工程质量事故报告的叙述,错误的是。A.任何单位和个人均有权利和义务将工程质量事故的情况及时报告有关部门B.公路工程在建项目,施工单位为事故报告单位C.公路工程在建项目,监理单位为事故报告单位D.交付使用的工程,接养单位为事故报告单位 κ/λ比率正常范围是A.0.4~1.2B.1.2~2.4C.2.4~5提出者是A.坎农B.兰格C.阿诺德D.沙赫特E.弗洛伊德 帕金森病PDl型()</br>亨廷顿病()</br>肝豆状核变性病()A.PARKl基因B.EPM2A基因突变C.HD基因出现CAG(多聚谷氨酸)的重复扩展D.SCAl基因CAG三联体扩展异常E.与P类ATP酶基因突变有关 根据白喉棒状杆菌在亚碲酸钾培养基上生长情况和生化反应特点,可将本菌分为三型A.危重型,重型,中间型B.危重型,中间型,轻型C.危重型,重型,轻型D.重型,中间型,轻型E.重型,过渡型,轻型 现场质量检査控制的方法主要有。A.测量B.试验C.观察D.分析E.监理 是使投资组合中债券的到期期限集中于收益曲线的一点。A.两极策略B.子弹式策略C.梯式策略D.以上三种均可 机动车在夜间或者容易发生危险的路段,应当。A.以最高设计车速行驶B.降低速度,谨慎驾驶C.保持现有速度行驶D.以超过规定的最高车速行驶 干粉既能扑救普通固体的表面火灾,又能控制扑救普通固体的内部火灾.A.正确B.错误 人一生经历的突增高峰次数是A.1次B.2次C.3次D.4次E.5次 现代管理学认为,组织架构是由工作任务、工作流程、汇报关系和所组成的一个系统。A.交流渠道B.投诉管理C.风险管理D.财务管理 颈动脉三角间隙内不含有A.颈总动脉B.颈内静脉C.舌咽神经D.迷走神经E.副神经 下列哪一项不是急性肾盂肾炎的感染途径A.血行性感染B.直接蔓延C.淋巴性感染D.上行性感染E.密切接触性感染 男性,52岁,中度肥胖,空腹血糖8mmol/L,餐后1小时血糖12mmol/L,胰岛素基础值50mU/L(正常5~25mU/L),应首选何药A.格列齐特(达美康)B.格列吡嗪(美吡达)C.双胍类D.格列本脲(优降糖)E.格列喹酮(糖适平) 眼球血管膜A.位于眼球最外层B.由疏松结缔组织构成C.富有神经、血管和色素细胞D.由前向后分为虹膜、睫状体、脉络膜E.呈棕黑色 男性,74岁,突发头疼、意识丧失1h,既往有高血压病史。行99Tcm-ECD脑血流断层显像横断层如图,诊断是A.双侧额叶脑梗死B.左侧颞叶脑梗死C.左侧部分顶叶脑梗死D.右侧顶叶脑梗死E.右侧小脑梗死 下列不是青春期主要表现的是A.出现第二次生长突增B.内脏器官体积增大C.淋巴系统逐渐萎缩D.出现第二性征E.心理发育加快 槟榔配木瓜治疗病证是</br>槟榔配木香治疗病证是A.泻痢后重B.水肿胀满C.食积不消D.脚气肿痛E.疟疾寒热 关于地球同步卫星,下列说法不正确的是。A.它一定在赤道上空运行B.它的高度和运动速率各是一个确定值C.它的线速度大于第一宇宙速度D.它的向心加速度小于9.8m/s2 中风与眩晕都可见仆倒,其鉴别要点是有无。A.面色苍白,肢冷汗出B.恶心呕吐,面白汗出C.口歪舌蹇,半身不遂D.眼球震颤,耳鸣耳聋E.头痛 矿业工程注册建造师的执业范围包括。A.矿业工程,包括"煤炭、冶金、建材、化工、有色、铀矿、黄金"七个行业的矿山工程B.地基与基础、土石方、高耸构筑物C.环保、起重设备安装、管道D.公路工程、铁路工程、市政公用工程E.钢结构、爆破与拆除、隧道、窑炉 关于张力性气胸,哪项错误。A.常继发于慢性阻塞性肺疾病或肺结核B.胸腔压力超过大气压C.可使纵隔严重移位,影响心脏血液回流D.必须紧急抽气减压E.一般抽气减压后,胸腔内压力不再上升 证券公司或其分支机构未经批准擅自经营融资融券业务的,可以对直接负责的主管人员和其他直接责任人员给予警告,撤销任职资格或者证券业从业资格,并处以万元以上万元以下的罚款。A.1;10B.2;20C.3;30D.5;50
高考化学一轮复习易错知识点(十五) 酸碱中和滴定及应用

高考化学一轮复习易错知识点(十五)酸碱中和滴定及应用【易错分析】酸碱中和滴定是高中化学最重要的定量实验之一,在科学实验中占重要地位,它的原理和操作方法可以扩展到氧化还原滴定和沉淀滴定,中和滴定原理是熟悉的酸碱中和反应,由于酸碱中和反应与日常生活及实验室工作联系非常密切应用性强,所以常以酸碱中和反应原理为切入点,考查水解平衡和电离平衡理论的运用,其实验操作、仪器使用、指示剂选择、滴定终点判断、误差分析、定量计算等知识既是学习的重点,也是学习的难点。
【错题纠正】例题1、下面是关于酸碱中和滴定实验操作的叙述:①取一锥形瓶,用待测NaOH溶液润洗两次;②在一锥形瓶中加入25.00 mL待测NaOH溶液;③加入几滴石蕊试剂作指示剂;④取一支酸式滴定管,洗涤干净;⑤直接往酸式滴定管中注入标准酸溶液,进行滴定;⑧左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶;⑦两眼注视着滴定管内盐酸液面变化,直至滴定终点。
其中叙述错误..的是()A.④⑥⑦B.①⑤⑥⑦C.③⑤⑦D.①③⑤⑦【解析】锥形瓶不用待测液润洗,①错误;石蕊变色不明显,不易观察颜色,在酸碱中和滴定时不用石蕊作指示剂,③错误;滴定管使用前要用标准酸溶液润洗,⑤错误;滴定过程中眼睛应观察锥形瓶中溶液颜色变化,⑦错误。
【答案】D例题2、实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。
请完成下列填空:(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→________(冷却后)→洗涤(并将洗涤液移入容量瓶)→________→________→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量________g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、_______。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。
高考化学第一轮复习-酸碱中和滴定、胶体

许多分能子集合体或高
分子
不能
巨大数量分子集合体
能
不能
不能
能否透过滤纸
能否透过半透膜
• (2)胶体的提纯——渗析
• 使 分子或通离过子半透膜从胶体里分离的操作 叫做渗析。
• 利用渗析可以除去胶体中的小分子或离子 ,以提纯胶体(并以此了解医学上血液透 析的原理)。
• (3)胶体的应用
• ①石膏、盐卤点豆腐 。 • ②明矾 净水 原理。
• (2)根据指示剂在酸性溶液或碱性溶液中 的颜色变化,可以判断中和反应是否恰好 进行完全。计算盐酸的浓度时,应计算三 次实验的平均值,因三次实验中NaOH标 准液浓度及待测液的体积一样,故只算 NaOH溶液体积的平均值即可。根据碱式 滴定管的构造可知,弯曲其橡胶管即可将 管中的气泡排除。
• 【答案】 (1)①转移 定容 摇匀 ② 0.4 烧杯(或表面皿) 药匙 (2)①最后 一滴NaOH溶液加入,溶液由无色恰好变 成浅红色至半分钟内红色不褪去 ②0.11
• (2)误差分析
• ①分析依据(用一元酸滴定一元碱为例)
• 说明:因c(标准)与V(待测)都是实验时已确 定的数值,无论滴定过程有无不当操作, 计算时都是已确定的值,因此c(待测)的变 化取决于V(标准)的变化,分析误差时要把 握住这一点。
• ②易产生误差的因素归类(用标准溶液滴定 待测溶液)
视线 误 差
(甲)
酸
甲基橙
(甲)
碱
酚酞
(乙)
• 【解析】 酸式滴定管(图甲)盛放酸液, 碱式滴定管(图乙)盛放碱液,为便于观察 ,所选取的指示剂在滴定过程中的颜色一
般由浅色向深色过渡,且要求半分钟不褪 去。用已知浓度的NaOH溶液测定某 H2SO4溶液的浓度时,若将已知浓度的 NaOH溶液盛放在碱式滴定管中,则未知 浓度的H2SO4溶液放入锥形瓶中,选用酚 酞为指示剂,滴定到终点的颜色由无色变 红色;若将已知浓度的NaOH溶液盛放在 锥形瓶中,则未知浓度的H2SO4溶液放入 酸式滴定管中,选用甲基橙为指示剂,滴
2020届高三化学一轮复习酸碱中和滴定和氧化还原滴定(专题训练)

2020届高三化学一轮复习酸碱中和滴定和氧化还原滴定(专题训练)1 / 7 2020届高三化学一轮复习酸碱中和滴定和氧化还原滴定1、(1)选用以下主要仪器和试剂,是否可以达到测定NaOH 溶液浓度的目的?________(填“是”或“否”)。
主要仪器:滴定管锥形瓶烧杯试剂:NaOH 溶液0.1000mol ·L -1盐酸(2)现用物质的量浓度为0.1000mol ·L -1的标准NaOH 溶液去滴定VmL 盐酸的物质的量浓度,请填写下列空白:①用标准NaOH 溶液滴定时,应将标准NaOH 溶液注入________(填“甲”或“乙”)中。
②某学生的操作步骤如下:A .移取20.00mL 待测盐酸注入洁净的锥形瓶中,并加入2~3滴酚酞;B .用标准溶液润洗滴定管2~3次;C .把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;D .取标准NaOH 溶液注入碱式滴定管至“0”刻度以上2~3mL ;E .调节液面至“0”或“0”以下刻度,记下读数;F .把锥形瓶放在滴定管的下面,用标准NaOH 溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是________(填字母)。
上述B 步骤操作的目的是_______________________________________________________ ________________________________________________________________________。
判断到达滴定终点的实验现象是_____________________________________________________________________________________________________________________。
③上图右是碱式滴定管中液面在滴定前后的读数,c(HCl)=________________mol ·L -1。
高中化学一轮复习讲义(解析版):酸碱中和滴定

酸碱中和滴定【学习目标】1. 酸碱中和滴定的实验原理及误差分析2. 氧化还原反应滴定的分析和计算 ◆感知高考1.[2020·浙江1月选考,27]为测定FeC 2O 4·2H 2O(M =180g·mol -1)样品的纯度,用硫酸溶解6.300g 样品,定容至250mL 。
取25.00mL 溶液,用0.1000mol·L -1KMnO 4标准溶液滴定至终点。
重复实验,数据如下:已知:3MnO -4+5FeC 2O 4·2H 2O +24H +===3Mn 2++5Fe 3++10CO 2↑+22H 2O ,假设杂质不参加反应。
该样品中FeC 2O 4·2H 2O 的质量分数是________%(保留小数点后一位);写出简要计算过程:________________________________________________________________________。
【答案】 95.2 0.1000mol·L -1×20.00×10-3L ×53×25025.00×180g·mol-16.300g ×100%≈95.2%【解析】第一次所用标准液为:19.98mL ,第二次所用标准液为22.40-1.26=20.14mL ,第三次所用标准液为:21.56-1.54=20.02mL ,第二次数据偏差较大舍去,所以所用标准液的体积为19.98mL+20.02mL=20.00mL2;根据方程式可知反应中存在数量关系:3MnO 4-~5242FeC O 2H O⋅,所以25mL待测液中所含242FeC O 2H O⋅的物质的量为:1350.1000mol L 20.0010L 3--⋅⨯⨯⨯,质量为13150.1000mol L 20.0010L 180g mol 3---⋅⨯⨯⨯⨯⋅,所以样品中242FeC O 2H O ⋅质量分数为13152500.1000mol L 20.0010L 180g mol 325.00100%95.2%6.300g ---⋅⨯⨯⨯⨯⨯⋅⨯=。
酸碱中和滴定--2024年高考化学一轮复习讲义(学生版)

酸碱中和滴定目录:【内容1酸碱中和滴定实验考点及注意事项】【内容2滴定终点的判断答题模板】【内容3指示剂的选择标准】【内容4酸碱中和滴定误差分析】【内容5滴定实验的拓展与应用--氧化还原滴定和沉淀滴定】知识主线:一、酸碱中和滴定实验1.概念和原理(1)概念:依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法(2)原理:在中和反应中,酸提供的H+与碱提供的OH-之间的物质的量相等即:c(H+)·V酸=c(OH-)·V碱,则c(H+)=c(OH-)·V碱V酸或c(OH-)=c(H+)·V酸V碱(3)实验关键①准确测定参加反应酸、碱的体积②准确判断滴定终点2.主要试剂:标准溶液、待测溶液、指示剂、蒸馏水3.主要仪器及使用(1)仪器:图(A)是酸式滴定管、图B是碱式滴定管、滴定管夹、铁架台、锥形瓶、烧杯、pH计(2)滴定管的认识①构造:滴定管的管身是内径均匀、带有刻度的细长玻璃管,酸式滴定管的下端是玻璃活塞,碱式滴定管的下端是由橡皮管和玻璃球构成的阀②滴定管的使用要求:酸式滴定管不能盛放碱液、水解呈碱性的溶液和氢氟酸,可以呈酸液、氧化性溶液和中性溶液,因为酸性和氧化性物质易腐蚀橡胶管;碱式滴定管不能盛放酸液和强氧化性溶液,可以呈碱液和中性溶液,因为碱性物质易腐蚀玻璃,致使活塞无法打开③规格:滴定管的最小分度是0.1mL ,实验室中常用滴定管的规格有25mL 和50mL 两种④滴定管的读数方法:0刻度在上,从上往下读,读数时取小数点后两位,估读至0.01mL ;如:24.00mL 、23.38mL⑤用途:滴定管主要是用来精确地量取一定体积的液体(3)滴定管的使用方法①检查仪器:使用滴定管前,首先要检查活塞是否漏水检查滴定管是否漏水的方法:向滴定管内加水(对酸式滴定管,要先关闭活塞)至液面在“0”刻度线附近,用滴定管夹将滴定管固定在铁架台上,观察滴定管是否漏水。
高考化学总复习《酸碱中和滴定及曲线》专项复习
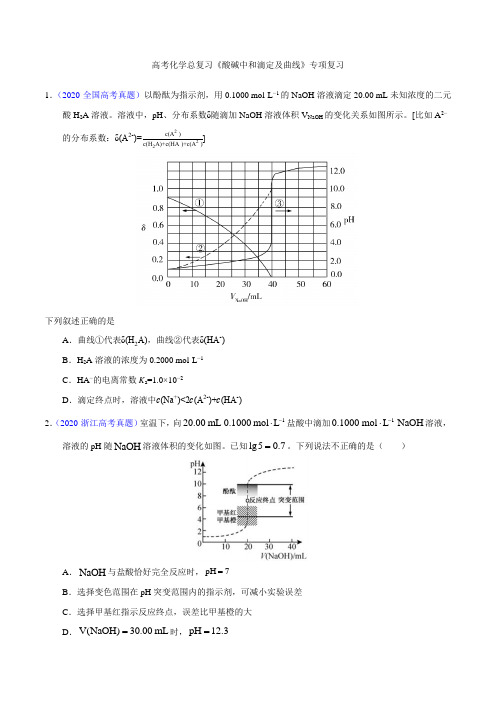
高考化学总复习《酸碱中和滴定及曲线》专项复习1.(2020·全国高考真题)以酚酞为指示剂,用0.1000 mol·L −1的NaOH 溶液滴定20.00 mL 未知浓度的二元酸H 2A 溶液。
溶液中,pH 、分布系数δ随滴加NaOH 溶液体积V NaOH 的变化关系如图所示。
[比如A 2−的分布系数:δ(A 2-)=c(A 2-)c(H 2A)+c(HA -)+c(A 2-)]下列叙述正确的是A .曲线①代表δ(H 2A),曲线②代表δ(HA -)B .H 2A 溶液的浓度为0.2000 mol·L −1C .HA −的电离常数K a =1.0×10−2D .滴定终点时,溶液中c (Na +)<2c (A 2-)+c (HA -)2.(2020·浙江高考真题)室温下,向120.00mL 0.1000mol L -⋅盐酸中滴加10.1000mol L NaOH -⋅溶液,溶液的pH 随NaOH 溶液体积的变化如图。
已知lg50.7=。
下列说法不正确的是( )A .NaOH 与盐酸恰好完全反应时,pH 7=B .选择变色范围在pH 突变范围内的指示剂,可减小实验误差C .选择甲基红指示反应终点,误差比甲基橙的大D .V(NaOH)30.00mL =时,pH 12.3=3.(2020·山东高考真题)25℃时,某混合溶液中()()133CH COOH CH COO 0.1mol L c c --+=⋅,1gc( CH 3COOH)、1gc(CH 3COO -)、lgc(H +)和1gc(OH -)随pH 变化的关系如下图所示。
K a 为CH 3COOH 的电离常数,下列说法正确的是A .O 点时,()()33CH COOH CH COO c c -= B .N 点时,a pH=-lgKC .该体系中,()()()+-13+a 0.1c H c CH COOH =mol L K +c H ⋅ D .pH 由7到14的变化过程中, CH 3COO -的水解程度始终增大4.(2019·全国高考真题)NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H 2A 的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全国卷热考微专题(15)酸碱中和滴定原理的拓展应用中和滴定实验是中学阶段的重要定量实验之一,近几年全国卷侧重考查了该实验的原理及其拓展应用,问题设置主要集中在实验仪器的使用、滴定终点判断、误差的分析、数据的处理计算等方面。
熟练掌握中和滴定的实验操作,并能将相关知识进行灵活迁移应用是解决此类实验问题的关键。
高考命题中,中和滴定原理的拓展应用主要涉及以下两个方面:1.氧化还原滴定法(1)原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质。
(2)实例。
①酸性KMnO4溶液滴定H2C2O4溶液。
原理:2MnO-4+6H++5H2C2O4===10CO2↑+2Mn2++8H2O指示剂:酸性KMnO4溶液本身呈紫色,不用另外选择指示剂,当滴入一滴酸性KMnO4溶液后,溶液恰好由无色变为浅紫色,且半分钟内不恢复原色,说明达到滴定终点。
②Na2S2O3溶液滴定碘液。
原理:2Na2S2O3+I2===Na2S4O6+2NaI。
指示剂:用淀粉作指示剂,当滴入一滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明达到滴定终点。
2.沉淀滴定法(1)概念:沉淀滴定法是利用沉淀反应进行滴定、测量分析的方法。
生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-浓度。
(2)原理:沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。
如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO2-4为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故。
(2017·全国卷Ⅱ)水中的溶解氧是水生生物生存不可缺少的条件。
某课外小组采用碘量法测定学校周边河水中的溶解氧。
实验步骤及测定原理如下:Ⅰ.取样、氧的固定。
用溶解氧瓶采集水样。
记录大气压及水体温度。
将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定。
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O2-3+I2===2I-+S4O2-6)。
回答下列问题:(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是____________________________________________________________________________________________________________。
(2)“氧的固定”中发生反应的化学方程式为____________________________________________________________________________________________________________________________。
(3)Na2S2O3溶液不稳定,使用前需标定。
配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和________;蒸馏水必须经过煮沸,冷却后才能使用,其目的是杀菌、除________及二氧化碳。
(4)取100.00 mL水样经固氧、酸化后,用a mol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为________ mg·L-1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏________(填“高”或“低”)。
解析:(1)取水样时避免扰动水体表面,这样能保证所取水样中溶解氧量与水体中实际溶解氧量基本相同,以减小实验误差。
(2)根据水样与Mn(OH)2碱性悬浊液反应生成MnO(OH)2,可写出固氧的反应为O2+2Mn(OH)2===2MnO(OH)2。
(3)由于Na2S2O3溶液不稳定,使用前需标定,配制该溶液时无需用容量瓶,只需粗略配制,故配制Na2S2O3溶液时,还需要用到的玻璃仪器为量筒;所用蒸馏水必须经过煮沸、冷却后才能使用,这样能除去水中溶解的氧气和CO2,且能杀菌。
(4)根据Ⅱ可知MnO(OH)2能将水样中的I-氧化为I2,滴定过程中用淀粉溶液作指示剂,在滴定终点前I2遇淀粉变蓝,达到滴定终点时,I2完全被消耗,溶液蓝色刚好褪去。
根据关系式O2~2MnO(OH)2~2I2~4Na2S2O3,结合消耗n(Na2S2O3)=a mol·L-1×b×10-3 L=ab×10-3 mol,可求出100.00 mL水样中溶解氧的质量为14ab×10-3mol×32 g·mol-1=8ab×10-3g=8ab mg,则该水样中溶解氧的含量为8ab mg÷0.10000 L=80ab mg·L-1。
(5)滴定完成时,滴定管尖嘴处留有气泡,会导致读取的Na2S2O3标准液体积偏小,根据关系式O2~4Na2S2O3,可知测定的溶解氧的含量偏低。
答案:(1)使测定值与水体中的实际值保持一致,避免产生误差(2)O2+2Mn(OH)2===2MnO(OH)2(3)量筒氧气(4)蓝色刚好褪去80ab(5)低1.利用I2的氧化性可测定钢铁中硫的含量。
做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为______________________________________________________,滴定反应的离子方程式为_____________________________________________________________________________________。
解析:利用淀粉溶液遇碘显蓝色的原理,可选用淀粉溶液作指示剂。
滴定反应的离子方程式为I2+H2SO3+H2O===4H++2I-+SO2-4。
答案:淀粉溶液H2SO3+I2+H2O===4H++SO2-4+2I-2.莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进而测定溶液中Cl-的浓度。
已知:(2)若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是________。
A.NaCl B.BaBr2C.Na2CrO4刚好达到滴定终点时,发生反应的离子方程式为__________________________________________________________________。
解析:(1)根据沉淀滴定法的原理,可知溶液中Ag+和Cl-先反应,Cl-消耗完后再和指示剂反应生成Ag2CrO4砖红色沉淀,由此可知滴定终点时的颜色变化。
(2)当用AgNO3溶液滴定NaSCN溶液时,所选择的指示剂和Ag+反应所生成沉淀的溶解度应大于AgSCN的溶解度,由题给数据可以看出溶解度比AgSCN大的有AgCl和Ag2CrO4,但是由于AgCl是白色沉淀,所以应选择Na2CrO4为指示剂,这样在滴定终点时沉淀的颜色发生明显的变化(白色→砖红色),此时发生反应的离子方程式为2Ag ++CrO2-4===Ag2CrO4↓。
答案:(1)生成砖红色沉淀(2)C 2Ag++CrO2-4===Ag2CrO4↓3.过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水。
某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:(1)移取10.00 mL密度为ρ g·mL-1的过氧化氢溶液至250 mL________(填仪器名称)中,加水稀释至刻度,摇匀。
移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
MnO-4+H2O2+H+===Mn2++H2O+(3)滴定时,将高锰酸钾标准溶液注入________(填“酸式”或“碱式”)滴定管中。
滴定到达终点的现象是_________________________________________________________________________。
(4)重复滴定三次,平均耗用c mol·L-1KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果________(填“偏高”“偏低”或“不变”)。
解析:(1)根据题意应该选用容量瓶。
(2)残缺方程式配平首先应确定缺什么,分析可知缺的是O2,根据电子转移守恒,配平化学方程式。
(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管。
滴定到达终点的现象是滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色。
(4)根据配平的化学方程式计算出过氧化氢的量,最后计算出原过氧化氢溶液中过氧化氢的质量分数为17cV200ρ。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
答案:(1)容量瓶(2)2 5 6 2 8 5 O2(3)酸式滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色(4)17cV200ρ(5)偏高4.利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO2-4+2H+===Cr2O2-7+H2O,Ba2++CrO2-4===BaCrO4↓。
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。
BaCl2溶液的浓度为____________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
解析:“0”刻度位于滴定管的上方。
由题意可得关系式BaCl2~CrO2-4~H+,则有c(BaCl2)×y×10-3L =b mol ·L -1×(V 0-V 1)×10-3 L ,解得c (BaCl 2)=b (V 0-V 1)y mol ·L -1。
