盐酸右美托咪定
盐酸右美托咪定的药理作用与临床应用

盐酸右美托咪定的药理作用与临床应用【摘要】目的:研究盐酸右美托咪定的药理作用与临床应用效果。
方法:对我院2018年12月至2019年12月的300例手术病人进行研究。
根据不同麻醉方式分成各为150例的对照组(咪达唑仑)和观察组(盐酸右美托咪定)。
对比麻醉效果。
结果:观察组Ramsay 镇静评分优于对照组、麻醉维持时间高于对照组、术中血压、心率指标优于对照组。
差异有统计学意义(P<0.05)。
结论:盐酸右美托咪定维持麻醉时间较长,镇静效果好,能够保证术中血压、心率稳定,麻醉效果较好。
【关键词】盐酸右美托咪定;药理作用;麻醉效果术中麻醉效果对手术顺利开展至关重要,盐酸右美托咪定镇静、抗焦虑,能够阻滞交感神经,广泛应用于外科手术、机械通气短期镇静等[1]。
为进一步分析高药物药理作用与临床应用效果,本研究以我院300例手术病人为对象,探究如下:1资料与方法1.1 一般资料对我院2018年12月至2019年12月的300例手术病人进行研究。
根据不同麻醉方式分成各为150例的对照组和观察组。
对照组男77例,女73例,年龄21-80岁,平均51.36±2.61岁。
观察组男74例,女76例,年龄24-85岁,平均年龄51.91±2.92岁。
两组基线资料无显著差异(P>0.05)。
1.2 方法对照组给予咪达唑仑注射液 ( 国药准字H20067040 ,宜昌人福药业有限责任公司)。
麻醉前30至60名肌肉注射,麻醉诱导剂量0.1至0.3mg/kg,注射时间20至30s,药物起效观察时间2min。
老年体弱者者减少剂量,推荐剂量0.025至0.05mg/kg 。
观察组予以盐酸右美托咪定(国药准字H20183149,湖南科伦制药有限公司),药剂量0.2至0.6μg/kg,配置4μg/ml浓度,1μg/kg剂量缓慢静脉滴注,静脉滴注10min。
1.3 观察标准麻醉效果为观察指标,从Ramsay镇静评分、麻醉维持时间、血压、心率四个方面进行评价。
盐酸右美托咪定的理化特性、药效学及临床应用(综述)

盐酸右美托咪定的理化特性、药效学及临床应用(综述)摘要:盐酸右美托咪定是 2-肾上腺素受体激动剂,可作为手术患者气管插管及机械通气时的镇静药物。
临床应用中,为提升临床用药安全,发挥用药效果,需根据盐酸右美托咪定的理化特性、药效学调整药物应用,才可确保用药安全。
本文综述盐酸右美托咪定的理化特性、药效学及临床应用问题。
关键词:理化特性;临床;盐酸右美托咪定;药效学引言盐酸右美托咪定作为一种麻醉辅助药,可明显减少麻醉药和阿片类药用量,减轻气管插管及外科手术刺激的血流动力学反应,降低眼内压,减少麻醉恢复期激动和恶心,发挥临床应用价值【1-4】。
研究盐酸右美托咪定的理化特性、药效学,有助于进一步提升临床应用盐酸右美托咪定的安全性。
具体综述内容如下:1 盐酸右美托咪定药物临床中,盐酸右美托咪定作为相对选择性 2-肾上腺素受体的激动剂,可以发挥对人体的镇静、抗焦虑作用,同时也可以发挥催眠、镇痛的作用【5】。
故此,在临床疾病治疗中常将盐酸右美托咪定,用于麻醉镇静。
2 盐酸右美托咪定的理化特性对于盐酸右美托咪定药物,在理化特性研究中证实,其属异吡唑亚类的激动剂,同可乐定相似,可以完全溶解于水。
盐酸右美托咪定也是美托咪定D-对映异构体, 盐酸右美托咪定相对分子质量为236.7,化学分子式则为C13H16N2?HCI【6】。
并且,盐酸右美托咪定的酸度系数达到7.1 pKa;在pH7.4水中,盐酸右美托咪定的分配系数是2.89。
3 盐酸右美托咪定药效学3.1线性表现盐酸右美托咪定对 2-受体呈高特异性结合,可抑制去甲肾上腺素释放,削弱对血管收缩【7】。
静脉注射后,盐酸右美托咪定的药动学参数,可表现出线性变化趋势,盐酸右美托咪定具有快速分布相,药物临床半衰期是6 min,终端消除的半衰期是2 h,血浆消除速率达到39 L?h-1。
3.2生物转化在临床中,应用盐酸右美托咪定药物,几乎可以完全实现生物转化,能够直接实现葡萄糖醛酸化【8-11】。
盐酸右美托咪定质量标准
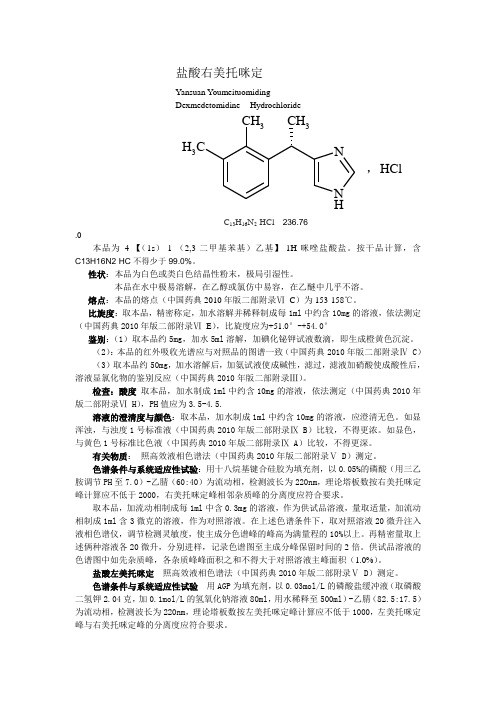
盐酸右美托咪定Yansuan YoumeituomidingDexmedetomidine HydrochlorideNH NCH 3C H 3CH 3C 13H 16N 2·HCl 236.76.0本品为4-【(1s )-1-(2,3-二甲基苯基)乙基】-1H-咪唑盐酸盐。
按干品计算,含C13H16N2·HC 不得少于99.0%。
性状:本品为白色或类白色结晶性粉末,极局引湿性。
本品在水中极易溶解,在乙醇或氯仿中易容,在乙醚中几乎不溶。
熔点:本品的熔点(中国药典2010年版二部附录Ⅵ C )为153-158℃。
比旋度:取本品,精密称定,加水溶解并稀释制成每1ml 中约含10mg 的溶液,依法测定(中国药典2010年版二部附录Ⅵ E ),比旋度应为+51.0°-+54.0°鉴别:(1)取本品约5mg ,加水5ml 溶解,加碘化铋钾试液数滴,即生成橙黄色沉淀。
(2):本品的红外吸收光谱应与对照品的图谱一致(中国药典2010年版二部附录Ⅳ C )(3)取本品约50mg ,加水溶解后,加氨试液使成碱性,滤过,滤液加硝酸使成酸性后,溶液显氯化物的鉴别反应(中国药典2010年版二部附录Ⅲ)。
检查:酸度 取本品,加水制成1ml 中约含10mg 的溶液,依法测定(中国药典2010年版二部附录Ⅵ H ),PH 值应为3.5-4.5.溶液的澄清度与颜色:取本品,加水制成1ml 中约含10mg 的溶液,应澄清无色。
如显浑浊,与浊度1号标准液(中国药典2010年版二部附录Ⅸ B )比较,不得更浓。
如显色,与黄色1号标准比色液(中国药典2010年版二部附录Ⅸ A )比较,不得更深。
有关物质: 照高效液相色谱法(中国药典2010年版二部附录Ⅴ D )测定。
色谱条件与系统适应性试验:用十八烷基键合硅胶为填充剂,以0.05%的磷酸(用三乙胺调节PH 至7.0)-乙腈(60:40)为流动相,检测波长为220nm ,理论塔板数按右美托咪定峰计算应不低于2000,右美托咪定峰相邻杂质峰的分离度应符合要求。
艾贝宁——右美托咪定详细说明书

艾贝宁——右美托咪定详细说明书-CAL-FENGHAI.-(YICAI)-Company One1【药品名称】通用名称:盐酸右美托咪定注射液商品名称:艾贝宁英文名称:Dexmedetomidine Hydrochloride Injection汉语拼音:Yansuan Youmeituomiding Zhusheye【成份】本品主要成份为盐酸右美托咪定,其化学名为:(+)-4-(S)-[1-(2,3-二甲基苯基)乙基]-1H-咪唑盐酸盐。
分子式:C13H16N2·HCl分子量:本品辅料为氯化钠。
【性状】本品为无色或几乎无色的澄明液体。
【适应症】用于行全身麻醉的手术患者气管插管和机械通气时的镇静。
【规格】2ml∶200ug(按右美托咪定计)【用法用量】成人剂量:配成4ug /ml浓度以1ug/kg剂量缓慢静注,输注时间超过10分钟。
本品在给药前必须用%的氯化钠溶液稀释达浓度4ug /ml,可取出2mL本品加入%的氯化钠注射液中形成总的50ml溶液,轻轻摇动使均匀混合。
操作过程中必须始终维持严格的无菌技术。
一般地,静脉用药前应该肉眼检查药品有无颗粒物质和颜色是否改变。
剂量调整:由于可能的药效学相互作用,当本品与其他麻醉剂、镇静剂、安眠药或阿片类药物同时给药时可能需要减少给药剂量(见药物相互作用)。
肝、肾功能损伤的患者和老年患者可能需要考虑减少给药剂量。
药品相容性:因为物理相容性尚不确定,本品不应与血液或血浆通过同一静脉导管同时给予。
当本品与以下药物同时给予时显示不相容:两性霉素B,地西泮。
当本品与以下静脉液体和药物同时给予时已经显示了相容性:%的氯化钠水溶液,5%的葡萄糖水溶液。
已经证实一些类型的天然橡胶可能吸收本品,建议使用合成的或有涂层的橡胶垫给药装置。
【不良反应】由于临床试验是在多种不同情况下进行的,因此一种药物在临床试验中观察到的不良反应发生率不能与另一种药物进行直接比较,而且可能无法反映实际临床应用中观察到的不良反应情况。
盐酸右美托咪定

盐酸右美托咪定目录基本信息性状适应症规格用法用量不良反应禁忌注意事项编辑本段基本信息盐酸右美托嘧啶是α2-肾上腺素受体激动剂,其化学名为:(+)-4-(S)-[1-(2,3-二甲基苯基)乙基]-1H-咪唑盐酸盐。
分子式:C13H16N2?HCl 分子量:236.7 【通用名称】盐酸右美托嘧啶注射液【商品名称】艾贝宁英文名称:Dexmedetomidine Hydrochloride Injection 汉语拼音:Yansuan Youmeituomiding Zhusheye 【成份】本品主要成份为盐酸右美托嘧啶,其化学名为:(+)-4-(S)-[1-(2,3-二甲基苯基)乙基]-1H-咪唑盐酸盐。
分子式:C13H16N2?HCl 分子量:236.7 本品辅料为氯化钠。
编辑本段性状本品为无色或几乎无色的澄明液体。
编辑本段适应症用于行全身麻醉的手术患者气管插管和机械通气时的镇静。
编辑本段规格2ml?200ug(按右美托咪定计)编辑本段用法用量成人剂量:配成4ug /ml浓度以1ug/kg剂量缓慢静注,输注时间超过10分钟。
本品在给药前必须用0.9%的氯化钠溶液稀释达浓度4ug /ml,可取出2mL本品加入48ml0.9%的氯化钠注射液中形成总的50ml溶液,轻轻摇动使均匀混合。
操作过程中必须始终维持严格的无菌技术。
一般地,静脉用药前应该肉眼检查药品有无颗粒物质和颜色是否改变。
剂量调整: 由于可能的药效学相互作用,当本品与其他麻醉剂、镇静剂、安眠药或阿片类药物同时给药时可能需要减少给药剂量(见药物相互作用)。
肝、肾功能损伤的患者和老年患者可能需要考虑减少给药剂量。
药品相容性: 因为物理相容性尚不确定,本品不应与血液或血浆通过同一静脉导管同时给予。
当本品与以下药物同时给予时显示不相容:两性霉素B,地西泮。
当本品与以下静脉液体和药物同时给予时已经显示了相容性:0.9%的氯化钠水溶液,5%的葡萄糖水溶液。
艾贝宁-右美托咪定详细使用说明

表2:发生率>2%的不良反应——程序镇静的受试人群
身体系统/
Precedex
安慰剂
不良反应
糖
精神症状
激越、混乱、妄想、幻觉、幻想
红细胞异常
贫血
肾脏疾病
血液尿素氮增加、少尿
呼吸系统
呼吸暂停、支气管痉挛、呼吸困难、高碳酸血症、通气不足、缺氧、
肺充血
皮肤及附属器
出汗增加
血管
出血
视觉障碍
闪光幻觉、视觉异常
禁忌】 对本品及其成份过敏者禁用。
【注意事项】
本品只能由专业人士在具备医疗监护设备的条件下使用。 由于本品的已知药理作用, 患者输 注本品时应该进行连续监测。
分子式:C13H16N2·HCl
分子量:236.7
本品辅料为氯化钠。
【性状】
本品为无色或几乎无色的澄明液体。
【适应症】
用于行全身麻醉的手术患者气管插管和机械通气时的镇静。
【规格】
2ml∶200ug(按右美托咪定计)
【用法用量】
成人剂量:配成4ug /ml浓度以1ug/kg剂量缓慢静注,输注时间超过10分钟。 本品在给药前必须用0.9%的氯化钠溶液稀释达浓度4ug /ml,可取出2mL本品加入48ml0.9%的氯化钠注射液中形成总的50ml溶液,轻轻摇动使均匀混合。操作过程中必须 始终维持严格的无菌技术。
般地,静脉用药前应该肉眼检查药品有无颗粒物质和颜色是否改变。
剂量调整:
由于可能的药效学相互作用, 当本品与其他麻醉剂、 镇静剂、 安眠药或阿片类药物同时给药 时可能需要减少给药剂量(见药物相互作用)。
盐酸右美托咪定注射液 说明书

盐酸右美托咪定注射液停搏。
有报道血压过低和心动过缓与本品灌输有关。
如果需要医药救治,治疗可能包括减少或停止本品输注,增加静脉液体的流速,抬高下肢,以及使用升高血压的药物。
因为本品有可能加剧迷走神经刺激引起的心动过缓,临床医生应该做好干预的准备。
应该考虑静脉给予抗胆碱能药物(例如,格隆溴铵、阿托品)来减轻迷走神经的紧张性。
在临床试验中,阿托品或格隆溴铵在治疗本品引起的大多数心动过缓事件中有效。
然而,在一些有明显的心血管功能不良的患者中,要求更进一步的急救手段。
当对有晚期心脏传导阻滞和/或严重的心室功能不全的患者给予本品时应该小心谨慎。
因为本品降低了交感神经系统活性,在血容量过低、糖尿病或慢性高血压以及老年患者中可能预期会发生更多的血压过低和/或心动过缓。
当给予其他血管扩张剂或负性频率作用药物时,同时给予本品可能有附加的药效影响,应该谨慎给药。
暂时性高血压出现暂时性高血压主要在负荷剂量期间观察到,与本品的外围血管收缩作用有关。
暂时性高血压通常不需要治疗,然而降低负荷输注速度可能是理想的。
觉醒力一些给予本品的患者当受到刺激时可观察到是觉醒的和警觉的。
在没有其他临床体征和症状的情况下,仅此一项不应该被认为是缺乏疗效的证据。
停药症状重症监护室的镇静:如果本品给药超过24小时并且突然停止,可能导致与报道的另一种α2肾上腺素药可乐定相似的停药症状。
这些症状包括紧张、激动和头疼,伴随或跟随着血压迅速的升高和血浆中儿茶酚胺浓度的升高。
程序镇静:短期输注本品(<6小时)停药后未出现停药症状。
肝脏损伤由于右美托咪定的清除率随着肝脏损伤的严重程度下降,对于肝脏功能损伤的患者应该考虑降低剂量。
依赖性右美托咪定在人体中的潜在依赖性还没有研究。
然而,由于在啮齿动物和灵长类动物中的研究已经证明右美托咪定与可乐定具有相似的药理学作用,突然中止本品可能产生可乐定样的停药症状。
【孕妇及哺乳期妇女用药】在孕妇未进行充分良好的临床研究。
右美说明书

不良反应
最常见的包括低血压、高血压、恶心、心率减慢、发热、呕吐、缺氧、心动过速和贫血。
制剂
注射剂:每支2ml,每毫升含本品100μg
盐酸右美托咪定
药品名称
(包括商品名、通用名)
盐酸右美托咪定
用法用量
本品须个案给药可借助一种可控制的输液装置以达到理想的临床疗效。成人病人一般在初始10min静脉滴入剂量为1μg/kg,随后的维持剂量为0.2~0.7μg/(kg·h),其维持的滴注速率应根据所需要的镇静水平、心率、血压等变化随时调整。
药理作用
本品为选择性肾上腺素α2受体激动剂,具有明显的镇静作用。而对α1受体作用较弱。手术中使用本品可降低麻醉剂用量,改善心血管系统的稳定性。动物试验使用中剂量(10~300mg/kg)慢速iv只显示α2受体的选择性,而大剂量(≥1000mg/kg)慢速或快速iv可同时观察到α1和α2受体的作用。其作用的特异性还表现在不与下列物质结合或作用:腺苷(A1,A2),β1-β2,组胺(H1,H2,H3),蕈毒碱(M1,M2,M3),5-羧色胺(5-HT1,5-HT2,5-HT3),多巴胺(D1,D2),色胺GABA(A,B),μ,δ和κ型阿片和苯二氮卓受体。健康志愿者(n=10)在推荐剂量内[0.2~0.7mg/(kgh)]iv后呼吸频率和氧饱和度保持正常,未见到呼吸抑制的现象。本品的药理活性有:(1)交感神经抑制:本品可致因浆去甲肾上腺素(NE)呈剂量依赖性下降。本品12.5μg剂量iv可使血浆NE浓度下降50%,而以75μg剂量则下降905。同样地,以1.5μg/kg剂量的im则使血NE下降85%。这种交感神经抑制作用在注射选择性α2受体拮抗剂atipamezole后可完全逆转,血浆NE浓度恢复正常甚至更高。(2)心血管:快速iv本品可引起血压的短暂性上升,可能是由于作用于外周血管平滑肌α2受体而使血管收缩。而im本品(0.5~1.5μg/kg)可使血压逐步下降,持续时间4~5h。术前im本品(0.5~1.0μg/μkg)可减低心率和血压的上升,在刮宫术病人中的术后变化非常轻微。同样,与im氧可酮(0.13mg/kg)或安慰剂对照,术前im本品(1.2μg/kg或2.4μg/kg)可减轻喉镜检查,气管插管和妇立科腹腔镜检查的心血管反应。(3)镇静:本品的主要药理作用是镇静。iv本品(0.5和1.0μg/kg)可在5min内呈现镇静作用,达峰时间为15min,并可持续1.5和2h。本品的镇静作用可被选择性α2受体拮抗剂atipamezole完全逆转。(4)麻醉:术前用本品(0.33~1.0μg/kg iv或0.5~1.5μg/kg im)可减少硫喷妥的用量。同样,本品(0.3~0.6μg/kg iv或2.5μg/kg im)可降低异书报费醚浓度和芬太尼的用量,并维持腹部子宫切除术中所要求的麻醉深度。其他的药理活性还包括止痛及抑制内分泌等作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐酸右美托咪定目录基本信息性状适应症规格用法用量不良反应禁忌注意事项编辑本段基本信息盐酸右美托嘧啶是α2-肾上腺素受体激动剂,其化学名为:(+)-4-(S)-[1-(2,3-二甲基苯基)乙基]-1H-咪唑盐酸盐。
分子式:C13H16N2?HCl 分子量:236.7 【通用名称】盐酸右美托嘧啶注射液【商品名称】艾贝宁英文名称:Dexmedetomidine Hydrochloride Injection 汉语拼音:Yansuan Youmeituomiding Zhusheye 【成份】本品主要成份为盐酸右美托嘧啶,其化学名为:(+)-4-(S)-[1-(2,3-二甲基苯基)乙基]-1H-咪唑盐酸盐。
分子式:C13H16N2?HCl 分子量:236.7 本品辅料为氯化钠。
编辑本段性状本品为无色或几乎无色的澄明液体。
编辑本段适应症用于行全身麻醉的手术患者气管插管和机械通气时的镇静。
编辑本段规格2ml?200ug(按右美托咪定计)编辑本段用法用量成人剂量:配成4ug /ml浓度以1ug/kg剂量缓慢静注,输注时间超过10分钟。
本品在给药前必须用0.9%的氯化钠溶液稀释达浓度4ug /ml,可取出2mL本品加入48ml0.9%的氯化钠注射液中形成总的50ml溶液,轻轻摇动使均匀混合。
操作过程中必须始终维持严格的无菌技术。
一般地,静脉用药前应该肉眼检查药品有无颗粒物质和颜色是否改变。
剂量调整: 由于可能的药效学相互作用,当本品与其他麻醉剂、镇静剂、安眠药或阿片类药物同时给药时可能需要减少给药剂量(见药物相互作用)。
肝、肾功能损伤的患者和老年患者可能需要考虑减少给药剂量。
药品相容性: 因为物理相容性尚不确定,本品不应与血液或血浆通过同一静脉导管同时给予。
当本品与以下药物同时给予时显示不相容:两性霉素B,地西泮。
当本品与以下静脉液体和药物同时给予时已经显示了相容性:0.9%的氯化钠水溶液,5%的葡萄糖水溶液。
已经证实一些类型的天然橡胶可能吸收本品,建议使用合成的或有涂层的橡胶垫给药装置。
编辑本段不良反应由于临床试验是在多种不同情况下进行的,因此一种药物在临床试验中观察到的不良反应发生率不能与另一种药物进行直接比较,而且可能无法反映实际临床应用中观察到的不良反应情况。
国外研究报道使用盐酸右美托咪定注射液与以下严重不良反应有关: l 低血压、心动过缓及窦性停搏(见注意事项) l 暂时性高血压(见注意事项) 国外研究报道与治疗相关的发生率大于2%的最常见不良反应为低血压、心动过缓及口干。
以下(包括上市后情况)为国外临床研究中发生的不良反应情况: 重症监护室(ICU)的镇静不良反应信息来源于重症监护室的1007例患者接受持续输注盐酸右美托咪定注射液(Precedex)镇静的试验。
平均总剂量为7.4 ug /kg (范围: 0.8~84.1),每小时平均剂量为0.5 mg /kg/hr (范围: 0.1~6.0),平均输注时间为15.9小时 (范围: 0.2~157.2)。
试验人群在17至88岁之间,43%?65岁,男性占77%,93%为高加索人。
表1为发生率>2%的药物不良反应。
最常见的不良反应为低血压、心动过缓及口干。
盐酸右美托咪定注射液是由Orion Pharma(芬兰)公司和Abott(美国)公司合作研制开发的α2-肾上腺素受体激动剂,于2000年3月在美国首次上市,2004年1月在日本上市。
本品为α2-肾上腺素受体激动剂美托咪定的右旋异构体,与美托咪定相比,本品对中枢α2-肾上腺素受体激动的选择性更强,且半衰期短,用量很小,临床上适用于重症监护治疗期间开始插管和使用呼吸机病人的镇静。
本品上市剂型为注射剂,2mL透明小瓶或透明安瓿装,游离碱浓度为0.1ug/mL。
盐酸右美托咪定注射液在国外已经上市,我国也已生产,现江苏新晨医药有限公司正在销售这一药品。
右美托咪定为美托咪定的活性右旋异构体,具有抗交感、镇静和镇痛的作用,与美托咪定相比,本品对中枢α2-肾上腺素受体激动的选择性更强,对α2-肾上腺素受体是可乐定的8倍。
在介导本品的主要药理和治疗效应中,α2A受体亚型起着重要作用,α2A受体存在于突触前和突触后,主要涉及抑制去甲肾上腺素的释放和神经元的兴奋。
本品通过激动突触前膜α2受体,抑制了去甲肾上腺素的释放,并终止了疼痛信号的传导;通过激动突触后膜受体,右美托咪定抑制了交感神经活性从而引起血压和心率的下降;与脊髓内的α2受体结合产生镇痛作用时,可导致镇静及焦虑缓解。
本品还能降低麻醉剂的用药剂量,改善手术中血液动力学的稳定性和降低心肌局部缺血的发生率。
本品在美国应用5年多的临床经验表明,盐酸右美托咪定可产生稳定的镇定和觉醒作用,对重症病人的生理及心理方面的需求有独特的协同作用,可明显减少诱导麻醉所需的麻醉剂用量;术前给予本品可减少术前和术后的阿片或非阿片类止痛剂的用量,这一特性对于麻醉和重症监护有重要的意义;还可以促进儿茶酚胺血流动力学的稳定性,有效减轻气管插管、手术应激和麻醉及恢复早期血流动力学应答。
表1:发生率>2%的不良反应——重症监护室镇静的受试人群身体系统全部随机治疗安慰丙泊/PrecedexPrecedexN = 798 不良反应治疗剂酚 N = 1007N = N =400 188 n (%) n (%) n (%) n (%)血管方面 248 (25%) 123 191 (24%) 101 (13%) 48 25 低血压 (12%) (12(13 高血压%) %)76 7(19(4%%) )胃肠道反应 90 (9%) 35 73 (9%) 22 (3%) 26 36 20恶心 (4%) 34 (3%) (3%) (9%(11口干 ) %)呕吐4 1(1%(1%) )21 6(5%(3%) )心脏方面 52 (5%) 44 36 (5%) 37 (5%) 15 10 0心动过缓 (4%) 20 (2%) (2%) 6 (1%) 4 (1%) (3%14心房颤动 6 (1%) 4 (0%) ) (7%心动过速 13 )窦性心动过(3%2速室) (1%性心动过速17 )(4%4) (2%2 )(1%9) (5%3 )(1%)全身性及给35 (4%) 19 31 (4%) 16 (2%) 14 15 8 药部位症状 (2%) 17 (2%) (2%) 2 (0%) (4%(4%发热 4 (0%) ) )高烧 12 0寒战 (3%4外周性水肿) (2%13 )(3%4) (2%2 )(1%)代谢及营养31 (3%) 17 22 (3%) 15 (2%) 7 9 9障碍血(2%) 7 (1%) (1%) 5 (1%) (2%(5%容量减少 6 (1%) ) )高血糖 7 5低血钙 (2%(3%酸中毒) )0 44 (2%(1%)) 4(2%)呼吸、胸部29 (3%) 23 23 (3%) 16 (2%) 13 13 12及纵隔障碍 (2%) 16 (2%) (2%) 9 (1%) 4 (1%) (3%(6% 肺不张 9 (1%) 4 (0%) ) )胸膜渗漏 4 12缺氧 (1%(6%肺水肿 ) )喘鸣8 5(2%(3%) )3 5(1%(3%) )1 4(0%(2%) )精神症状 20 (2%) 16 (2%) 11 1 激越(3%(1%) ) 血液及淋巴19 (2%) 18 (2%) 7 4 系统障碍 (2%(2%贫血) )损伤、中毒15 (2%) 13 (2%) 10 7 及并发症 (3%(4%给药后出血) )观察排6 (1%) 6 (1%) 0 4 尿量减少(2%)程序镇静: 不良反应信息源自于两项程序镇静的试验,这两项试验中共有318例患者接受了盐酸右美托咪定注射液(Precedex)治疗。
平均总剂量为1.6 ug /kg (范围: 0.5~6.7),每小时平均剂量为1.3 ug /kg/hr (范围: 0.3~6.1),平均输注时间为1.5小时 (范围: 0.1~6.2)。
试验人群在18至93岁之间,30%的患者?65岁,男性占52%,61%为高加索人。
表2为发生率>2%的药物不良反应。
最常见的不良反应为低血压、心动过缓及口干。
表的脚注为生命体征指标报告为不良反应的预先设定标准。
两项试验中患者呼吸速率下降和缺氧的发生率在Precedex给药组和对照组均相似。
表2:发生率>2%的不良反应——程序镇静的受试人群PrecedexN = 318 身体系统不良反应安慰剂 /N = 113 n (%) n (%)血管方面低血压 173 (54%) 41 (13%) 34 (30%) 1高血压27 (24%)呼吸、胸部及纵隔障碍 117 (37%) 7 (2%) 5 (2%) 36 (32%)呼吸抑制缺氧 3 (3%) 5呼吸缓慢5 (4%)心脏方面心动过缓 45 (14%) 17 (5%) 4 (4%) 3心动过速19 (17%) 4胃肠道反应恶心 10 (3%) 8 (3%) 2 (2%)口干1 (1%)1、低血压的绝对和相对定义为:收缩压<80 mmHg 或比试验药物输注前值低30%以下,或舒张压<50 mmHg。
2、高血压的绝对和相对定义为:收缩压>180 mmHg或比试验药物输注前值高30%以上,或舒张压>100 mmHg。
3、心动过缓的绝对和相对定义为每分钟心跳次数<40或比输注前值低30%以下。
4、心动过速的绝对和相对定义为每分钟心跳次数>120或比输注前值高30%以上。
5、呼吸抑制的绝对和相对定义为呼吸频率<每分钟8次或比基线下降了25%以上。
6、缺氧的绝对和相对定义为SpO2 <90%或比基线减少了10%。
上市后情况: 下列不良反应是盐酸右美托咪定注射液(Precedex)获准上市后观察到的。
由于这些不良反应是由样本人数尚不明确的用药人群自发报告的,因此不能确切的估计其发生频率或确定不良反应与药物的因果关系。
低血压和心动过缓是Precedex 获准上市后最常见的不良反应。
表3: Precedex上市后出现的不良反应身体系统首选项全身发热、高烧、血容量减少、浅麻醉、疼痛、僵硬心血管系统总体情血压波动、心脏病、高血压、低血压、心肌梗塞( 况)中枢及外周神经系统头晕、头痛、神经痛、神经炎、言语障碍、抽搐胃肠道系统腹痛、腹泻、呕吐、恶心心率和节律障碍心律不齐、室律不齐、心动过缓、缺氧、房室传导阻滞、心跳停止、期外收缩、心房纤维颤动、心脏传导阻滞、波倒置、T心动过速、室上性心动过速、室性心动过速肝胆系统病症谷氨酰转肽酶增加、肝功能异常、血胆红素过多、丙氨酸转γ-氨酶、天冬氨酸氨基转移酶代谢及营养障碍酸中毒、呼吸性酸中毒、高钾血症、碱性磷酸酯酶增加、口渴、低血糖精神症状激越、混乱、妄想、幻觉、幻想红细胞异常贫血肾脏疾病血液尿素氮增加、少尿呼吸系统呼吸暂停、支气管痉挛、呼吸困难、高碳酸血症、通气不足、缺氧、肺充血皮肤及附属器出汗增加血管出血视觉障碍闪光幻觉、视觉异常编辑本段禁忌对本品及其成份过敏者禁用。
