物理化学实验数据处理
物理化学实验中常用的数据处理软件及在化学中常见应用方法

物理化学实验中常用的数据处理软件及在化学中常见应用方法随着计算机技术的不断发展,数据处理软件在物理化学实验中的应用越来越普遍。
这些软件可以帮助实验人员处理实验数据,提高实验效率和准确度。
本文将介绍几种常用的数据处理软件及在化学中常见的应用方法。
一、常用的数据处理软件1. ExcelExcel是微软公司开发的一款电子表格软件,广泛应用于各个领域。
在物理化学实验中,Excel可以用来制作数据图表、计算平均值和标准偏差、进行线性回归等。
对于数据量较小的实验,Excel是一个简单易用的数据处理工具。
2. OriginOrigin是一款专业的科学数据分析和绘图软件,主要应用于科学研究、工程设计和教学等领域。
在物理化学实验中,Origin可以用来制作各种类型的图表、进行数据拟合和统计分析等。
Origin的功能非常强大,但学习起来也比较复杂。
3. MatlabMatlab是一款用于数学计算、数据分析和可视化的软件,被广泛应用于科学研究、工程设计和金融分析等领域。
在物理化学实验中,Matlab可以用来进行数据处理、信号处理和图像处理等。
Matlab的功能非常强大,但学习起来也比较困难。
二、在化学中的应用方法1. 数据图表的制作在物理化学实验中,数据图表是非常重要的,可以帮助实验人员更直观地了解实验结果。
在Excel中,可以选择不同的图表类型,如折线图、柱状图、散点图等,来展示实验数据。
在Origin中,可以制作更复杂的图表,如等高线图、三维图等,以展示更多的信息。
在Matlab中,可以利用其强大的绘图功能,制作各种复杂的图表。
2. 数据拟合和统计分析在物理化学实验中,常常需要对实验数据进行拟合和统计分析。
在Excel中,可以使用函数进行线性回归、非线性拟合和数据统计等。
在Origin中,可以使用各种拟合和统计分析工具,如最小二乘法拟合、方差分析等。
在Matlab中,可以使用其强大的数学计算和统计分析功能,进行各种数据拟合和统计分析。
物理化学实验报告-水、正丙醇双液系汽液平衡相图的测定

水-正丙醇双液系汽液平衡相图的测定摘要:本实验以水-正丙醇的双液体系为例,对双液系的气液平衡进行研究。
实验中通过测定不同正丙醇浓度百分比的折光率,绘制双液系气液平衡相图,并确定其最低恒沸点温度及其组成。
关键词:双液系汽液平衡相图最低恒沸混合物折光率The Determination of Vapor-Liquid Equilibrium Phase Diagram of Water & n-Propyl Alcohol SystemAbstract: In this experiment, we use water & n-propyl alcohol system for example to research the balance of binary-liquid system. We measure the refractive of these solutions and then find out the composition from a composition-refractive index of the standard samples. We draw the Phase diagram of this binary-liquid system by using the data, and the lowest constant-boiling mixture with its boiling point is unmistakable on this graph.Key words: binary-liquid system, Vapor-liquid equilibrium diagram, Lowest constant-boiling mixture, fractionation1. 序言在常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例相互溶解,则称完全互溶双液体系;若只能部分互溶,则称部分互溶双液体系。
教案物理化学实验热力学实验与数据处理

教案物理化学实验热力学实验与数据处理教案:物理化学实验-热力学实验与数据处理一、实验目的本实验旨在通过测量物质在不同温度下的热力学性质,掌握热力学实验的基本原理和实验方法,并学习数据处理和结果分析的基本技巧。
二、实验仪器与试剂1. 实验仪器:- 恒温水浴- 热电偶温度计- 热电偶电压测量仪- 温度控制器2. 试剂:- 实验样品(可根据实际情况自行选择)三、实验步骤1. 实验前准备:- 根据实验需要准备好试样,并将其保持在恒温条件下,确保其达到与实验环境相同的温度。
- 确保热电偶温度计、热电偶电压测量仪和温度控制器工作正常,并校准仪器。
2. 实验过程:1) 将试样放在恒温水浴中,待其温度稳定后,记录下初始温度并作为实验过程的起始温度。
2) 开始记录实验过程中试样的温度变化,并按实验计划逐渐改变温度。
可通过调节水浴温度或加入冷热介质来实现。
3) 在每个温度点上,等待试样温度稳定后,使用热电偶温度计测量试样的温度,并利用热电偶电压测量仪记录下相应的电压值。
4) 循环步骤3,直至完成全部预定温度点的测量。
3. 数据处理1) 温度与电压的记录数据可以通过电脑软件自动采集,也可以手动记录在表格中。
2) 根据热力学理论和实验结果,绘制温度与电压的曲线图。
可以使用Excel等软件进行数据处理和绘图。
3) 利用实验数据和绘制的曲线,可以计算出试样的热容量、热导率等热力学参数。
4) 将实验结果进行分析和讨论,与理论知识进行比较,得出结论并提出可能的误差来源和改进措施。
四、实验注意事项1. 实验操作时要注意安全,遵守实验室的相关规定。
2. 实验前准备工作要做到位,确保仪器和试剂的状态良好。
3. 实验过程中要严格控制温度变化的速度,以保证实验数据的准确性。
4. 在记录数据时要认真仔细,确保数据的准确性和完整性。
五、实验结果与讨论根据实验所得数据和绘制的曲线,我们可以得出试样的热容量、热导率等热力学参数。
通过与理论知识进行比较,我们可以评价实验结果的准确性,并分析可能存在的误差来源。
物理化学-表面张力及表面吸附量的测定-175
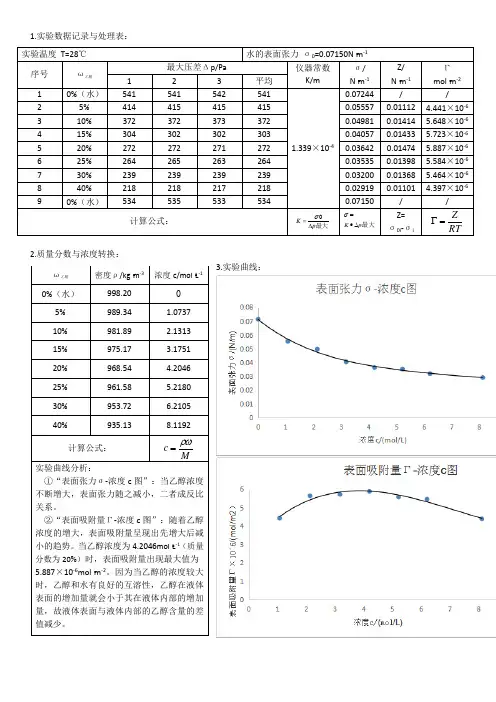
1.实验数据记录与处理表:2.质量分数与浓度转换:3.实验曲线:实验温度 T=28℃ 水的表面张力 σ0=0.07150N ▪m -1序号 ω乙醇 最大压差Δp/Pa仪器常数K/mσ/ N ▪m -1 Z/ N ▪m -1 Γmol ▪m -2 1 2 3 平均 1 0%(水) 541 541 542 541 1.339×10-40.07244 //2 5% 414 415 415 415 0.05557 0.01112 4.441×10-63 10% 372 372 373 372 0.04981 0.01414 5.648×10-6 4 15% 304 302 302 303 0.040570.01433 5.723×10-6 5 20% 272 272 271 272 0.03642 0.014745.887×10-66 25% 264 265 263 264 0.03535 0.01398 5.584×10-67 30% 239 239 239 239 0.03200 0.01368 5.464×10-6 8 40% 218 218 217 218 0.02919 0.01101 4.397×10-6 90%(水)5345355335340.07150/ /计算公式:最大p K ∆=σ最大p K ∆•=σZ= σ0i -σiRTZ=Γ ω乙醇 密度ρ/kg ▪m -3浓度c/mol ▪L -10%(水) 998.20 05% 989.34 1.0737 10% 981.89 2.1313 15% 975.17 3.1751 20% 968.54 4.2046 25% 961.58 5.2180 30% 953.72 6.2105 40%935.138.1192计算公式:Mc ρω=实验曲线分析:①“表面张力σ-浓度c 图”:当乙醇浓度不断增大,表面张力随之减小,二者成反比关系。
物理化学实验——液体饱和蒸汽压的测定数据处理

物理化学实验——液体饱和蒸汽压的测定数据处理
测定液体饱和蒸汽压的实验数据处理通常需要使用查表法或曲线拟合法来计算。
以下是其中的两种方法:
1. 查表法:
首先,根据实验所用的液体种类和温度范围选择相应的饱和蒸汽压表(如Clausius-Clapeyron方程的饱和蒸汽压表)。
然后,通过实验测得的温度数据,在该表中查找对应的饱和蒸汽压值。
2. 曲线拟合法:
如果没有现成的饱和蒸汽压表可用,可以使用曲线拟合方法来计算。
首先,将实验测得的温度和相应的压力数据绘制成散点图。
然后,根据实验测得的数据点,选择适当的函数形式进行曲线拟合,例如可以使用Clausius-Clapeyron方程来拟合。
通过拟合得到的函数,可以根据给定的温度值来计算对应的饱和蒸汽压值。
无论使用哪种方法,确保在数据处理过程中考虑到实验误差和准确度。
物理化学实验报告

物理化学实验报告篇一:物理化学------各个实验实验报告参考1燃烧热的的测定一、实验目的1.通过萘和蔗糖的燃烧热的测定,掌握有关热化学实验的一般知识和测量技术。
了解氧弹式热计的原理、构造和使用方法。
2.了解恒压燃烧热与恒容燃烧热的差别和相互关系。
3.学会应用图解法校正温度改变值。
二、实验原理燃烧热是指1mol物质完全燃烧时所放出的热量,在恒容条件下测得的燃烧热为恒容燃烧热(QV),恒压条件下测得燃烧热为恒压燃烧热(Qp)。
若把参加反应的气体和生成气体视为理想气体,则Qp?QV??nRT。
若测得Qp或QV中的任一个,就可根据此式乘出另一个。
化学反应热效应(包括燃烧热)常用恒压热效应(Qp)表示。
在盛有定量水的容器中,放入装有一定量样品和样体的密闭氧弹,然后使样品完全燃烧,放出热量使水和仪器升温,若仪器中水量为W(g),仪器热容W?,燃烧前后温度为t0和tn,则m(g)物质燃烧热QV?(Cw?w’)t(n?t0。
若水的比热容)C =1。
摩尔质量为M的物质。
其摩尔燃烧热为QMV??m(W?W?)(tn?t0),热容W?可用已知燃烧热的标准物质(苯甲酸,QV=26.434J?g?1)来标定。
将其放入量热计中,燃烧测其始末速度,求W?。
一般因每次水量相同,可作为一个定量来处理。
QMV?m(tn?t0) 三.实验步骤1热容W?的测定1)检查压片用的钢模,用电子天平称约0.8g苯甲酸,倒入模具,讲样品压片,除去样品表面碎屑,取一段棉线,在精密天平上分别称量样品和棉线的质量,并记录。
2)拧开氧弹盖,擦净内壁及电极接线柱,用万用表检查两电极是了解燃烧热的定义,水当量的含义。
压片要压实,注意不要混用压片机。
否通路,将称好的棉线绕加热丝两圈后放入坩埚底部,并将样品片压,在棉线上旋紧弹盖,并再次检查电极是否通路,将氧弹放在充氧架上,拉动扳手充氧。
充毕,再次检查电极。
3)将氧弹放入热量计内桶,称取适量水,倒入量热计内桶,水量以没氧弹盖为宜,接好电极,盖上盖子,打开搅拌开关,开始微机操作。
物理化学实验报告 - 乙酸乙酯皂化反应动力学
北京理工大学
物理化学实验报告
乙酸乙酯皂化反应动力学
班级:
实验日期:2013-4-27
一、实验目的
1)了解二级反应的特点。
答:该物理性质需要满足以下条件:
(1)易于测量,并能用数值表示;
(2)该性质在一定环境条件下是稳定的;
(3)该物理性质和反应物、产物的浓度之间有一个明确的推导公式。
1009
0.4406
2520.0
919
0.333
993
0.415
分别做25℃、35℃下以 对t作图得到如下图像:
从图像上可以看出来 与t呈现反相关,符合 的基本趋势,故接下来做25℃、35℃下以 对 的图像,并进行直线拟合,图像如下:
25℃ - 图像
35℃下 - 图像
可见 、 呈现线性关系。并且: 。故可以求得
七、思考题
1)在本实验中,使用DDSJ-308型电导率议测量溶液的电导率,可以不进行电极常数的校正,为什么?
答:因为本实验中,计算 值和 值时所需的数据都是等时间间距下测量的电导率值的拟合直线斜率,它只与等时间间距下电导率的差值有关。不进行常数校正,在等时间间距下测量到的电导率数据都有着相同的系统误差,而不会改变不同时间下电导率数据的差值。所以本实验无需进行电极常数的校正。
4) 用25ml移液管移取25ml NaOH溶液于50ml容量瓶中,定容待用。
k0测量
1)取一部分稀释的NaOH于洁净干燥的叉形管直管中,将用稀释的NaOH润洗后的电导电极放入叉形管直管中,在恒温槽中恒温10min,读取电导率。保留叉形管中溶液,用于35℃测量k0。
利用Excel软件处理物理化学实验数据
利用Excel软件处理物理化学实验数据摘要:用Excel2007软件处理电导法测定表面活性剂临界胶束浓度实验数据为例,探讨利用Excel软件处理物理化学实验数据的具体操作过程及方法,加强化学及化工专业学生在本科阶段灵活运用计算机软件处理物理化学实验数据的能力。
关键词:Excel2007软件;物理化学实验;数据处理测定表面活性剂十二烷基硫酸钠临界胶束浓度的方法多样,可以由学生自行组队设计实验方案并实践,笔者所在小组选用电导法,本文主要介绍实验数据的处理,故不对实验方案及原理一一介绍。
试验后发现实验数据繁多,计算量较大,且需要作图分析,同组内实验结果大相径庭,并由于人为主观因素过剩,导致实验结果与查找文献后的数据相差较大,需要更为准确而严谨的手段进行实验数据分析。
利用Excel软件对物理实验数据进行列表整理、运算以及作图分析,不仅能够大大缩短处理实验数据耗费的时间,更能减少手动处理实验数据所带来的误差,使实验结果更为准确而清晰明了,学生应在本科阶段熟练掌握并能够灵活运用于学科数据问题的处理当中。
一数据列表根据实验要求可知,该实验首先需要测得所用电导率仪的电导池系数。
查文献[1]可知25℃时1mol·dm-3氯化钾水溶液的电导率为11.19S·m-1,实验中测得1mol·dm-3KCl水溶液的电导为12.28mS,可求得电导池系数为0.911m-1。
再将所有实验数据归类,总有样品体积、试液浓度、电导读数、电导池系数、电导率、摩尔电导率和浓度平方。
然后将数据对应填入,以防数据丢失。
电导法测定表面活性剂临界胶束浓度数据如图1所示。
二数据运算在Excel中进行运算主要有数据合并和数据库函数的应用两种。
以图1中浓度的平方根计算来说,可以选择函数计算:选中G4单元格,选择【公式】栏,然后点击【插入函数】,在搜索函数中输入“平方”,按【Enter】或点击【转到】,软件会自动推荐相关函数,仔细比较后选择正确的函数【SQRT】,即返回数值的平方根,在函数参数框【Number】中输入B5的数据或选中B5单元格就可以得到结果。
物化实验教案上
化学与化工学院实验课程教案物理化学实验实验一数据处理及温度的测量与控制技术一、实验目的要求1.熟悉物理化学实验的特点,掌握数据记录与处理的常用方法和技巧;学会误差分析和处理。
2.了解不同类型的温度计,理解温度计的测温原理;学会如何校正温度计;。
3.熟悉常用的控温方法和装置。
二、实验重点与难点:1. 实验重点:物理化学实验的特点及特殊要求;讲清如何进行数据处理,尤其是用作图法处理数据的技巧;如何进行温度计的校正。
2. 实验难点:强调作图的注意事项和技巧。
三、实验教学方法与手段:1. 实验教学方法本次实验以讲授为主,再通过多媒体演示相结合的教学方法完成教学任务。
2. 教学手段本次内容较多,加上偶的专业分析化学课时偏少,数据处理的一般方法及数据误差分析的知识缺乏,强调学生预习相关内容;利用多媒体演示,强调关键操作和注意事项。
四、仪器与试剂仪器:不同类型的温度计五、实验讲授内容1. 物理化学实验目的与要求2. 误差分析及处理1)误差种类2)为什么测量结果都带有误差?完成某项测量必须要有测量仪器、测量方法和测量人员。
这三方面都可能使测量产生差。
所以,任何测量结果都带有误差。
3)产生误差的原因(1) 仪器误差;(2) 安装调整误差,如水银柱高、滴定管垂直否等;(3) 人为误差,如视差,读数过早或过迟等;(4) 方法误差(又称理论误差)。
间接测量时,由于间接测量函数本身就是一个近似公式,存在一定的近似误差,这种误差称为间接测量误差;(5) 环境误差,由于周围环境等因素使仪器内部工作状态改变而引起的误差,习惯上称为环境误差。
3. 数据记录与处理的一般方法1)数据记录基本原则2)数据处理方法列表法作图法特点:直观,极大点,极小点,拐点,转折点,线性关系,曲线关系,周期性,这些特征都容易发现。
求微商、积分,内插、外推也方便。
外推要小心!!!作图技术:图纸(直角坐标纸,半对数或对数纸,三角坐标纸等) 坐标不一定从零开始。
物化生报考的实验数据处理注意事项
物化生报考的实验数据处理注意事项在物化生相关领域的研究中,进行实验是不可或缺的一环。
而在进行实验时,数据的准确性和处理方式的科学性和规范性至关重要。
本文将介绍物化生报考中实验数据处理的一些注意事项,以帮助同学们更好地进行科学研究和数据分析。
一、数据采集与记录在实验过程中,准确地采集和记录数据是保证实验结果正确性的前提。
以下是一些数据采集和记录的注意事项:1. 选择合适的数据记录方式:可以使用实验笔记本、电子表格、数据采集软件等多种方式记录数据,根据实际情况选择合适的方式,并确保记录的数据完整、准确。
2. 确定合适的数据采集频率:根据实验的特点和需要,确定数据采集的频率。
有些实验需要高频率的数据采集,而有些实验则可以进行较为稀疏的采集。
3. 检查数据记录的准确性:在记录数据之后,应该及时检查数据的准确性。
可以通过反复核对、计算数据之间的关联性、与已知结果的对比等方式来验证数据的准确性。
二、数据处理与分析实验数据处理与分析是研究工作中不可或缺的环节,以下是一些需要注意的事项:1. 数据预处理:在进行数据分析之前,需要对数据进行预处理,包括数据清洗、去除异常值、处理缺失值等。
确保数据的可靠性和一致性,排除可能的误差。
2. 选择合适的统计方法:根据实验数据的特点和研究问题的要求,选择合适的统计方法进行数据分析。
常见的统计方法包括描述统计分析、方差分析、回归分析等。
3. 结果可视化:为了更好地展示和传达实验结果,可以使用图表、图像等方式对数据进行可视化。
通过直观的图形和图像,使得数据分析结果更易于理解和解释。
4. 数据处理的记录和描述:对于数据处理的过程和方法,应该进行详细的记录和描述。
这有助于他人重现实验结果和验证分析方法的科学性。
三、数据的解释与讨论在对实验数据进行解释和讨论时,需注意以下事项:1. 结果的客观性和科学性:在解释实验数据时,需要保持客观,不要主观臆断和误导性解释。
应该基于数据的统计分析结果和科学原理进行解释。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学实验数据处理
实验一 电极的制备及电池电动势的测定与应用
一、实验数据记录
二、数据处理
1饱和甘汞电极电动势的温度校正
)298/(1061.72415.0/4-⨯-=-K T V SCE ϕ
15.273+=t T t 组成饱和甘汞电极的KCl 溶液的温度,℃。
2测定温度下锌、铜电极电动势的计算 1) 测定温度下锌电极电势的计算
Zn Zn SCE Hg Zn E /2)(+-=-ϕϕ平均值 )(/2平均值Hg Zn SCE Zn Zn E --=∴+ϕϕ
2) 测定温度下铜电极电势的计算
SCE Cu Cu Hg Cu E ϕϕ-=+-/2)(平均值 S C E Hg Cu Cu Cu E ϕϕ+=∴-+)(/2平均值
3) 测定温度下标准锌电极电极电势的计算
++
+
+±++=+=2222ln 2)(ln 2/2//Zn Zn
Zn Zn Zn Zn Zn m F RT Zn F RT γϕαϕϕθ
θ +++
±-=∴222ln 2//Zn Zn Zn Zn
Zn m F
RT γϕϕθ(±γ参见附录五表V-5-30,11.02-⋅=+l mol m Zn ) 4) 测定温度下标准铜电极电极电势的计算
++
+
+±++=+=2222ln 2)(ln 2/2//Cu Cu
Cu Cu Cu Cu Cu m F RT Cu F RT γϕαϕϕθ
θ
+++
±-=∴222ln 2//Cu Cu Cu Cu
Cu m F
RT γϕϕθ(±γ参见附录五表V-5-30,11.02-⋅=+l mol m Cu ) 2 298K 时锌、铜电极标准电极电势的计算 1)锌电极标准电极电势的计算
)298/(000016.0)298(/)(//22-⨯-=+
+K T K V T Zn
Zn Zn Zn θθϕϕ )298/(000016.0/)()298(//22-⨯+=∴++
K T V T K Zn
Zn Zn Zn θ
θϕϕ 1)铜电极标准电极电势的计算
2
6//)298/(1031.0)298/(0001.0)298(/)(22-⨯+-⨯+=-+
+K T K T K V T Cu
Cu Cu Cu θθϕϕ 2
6//)298/(1031.0)298/(0001.0)()298(22-⨯+-⨯-=∴-+
+K T K T T K Cu
Cu Cu Cu θθϕϕ 15.273+=t T t 组成相应电极的电解质溶液的温度,℃。
参考数值:V K Zn Zn 7627.0)298(/2-=+θϕ,V K Cu
Cu 3419.0)298(/2=∴+
θ
ϕ。
3 铜-锌原电池理论电动势的计算
铜电极的理论电极电势计算:
2
6/)298/(1031.0)298/(0001.03419.0/)(2-⨯+-⨯+=-+
K T K T V T Cu
Cu
θϕ ++
+
±+=222ln 2)(//Cu Cu
Cu Cu
Cu
m F
RT
T γϕϕθ 锌电极的理论电极电势计算:
)298/(000016.07627.0/)(/2-⨯--=+
K T V T Zn
Zn
θ
ϕ
++
+
±+=222ln 2)(//Zn Zn
Zn Zn
Zn
m F
RT
T γϕϕθ 铜-锌原电池理论电动势的计算:Zn Zn Zn Cu Cu Zn E //22++-=-ϕϕ 误差计算:%100)
(⨯-=
--Cu
Zn Cu Zn E E E Error 平均
实验二 溶液法测定极性分子偶极矩
一、实验数据记录
1. 首先算出实验温度时两种纯液体的密度。
(实验温度用温度计直接测出,密度可由软件计算)或采用下式计算:
2
63469.0109110.11063255.1)(t t CCl t ⨯-⨯-=--ρ
3926352309.610405.0102710.11093932.0)(t t t H COOC CH t ⨯-⨯-⨯-=---ρ
,t 为测量温度℃,密度单位:g/ml
2. 计算测量温度下CCl 4介电常数εCCl4、真空电容C 0和仪器分布电容C d 。
)20(0020.0238.2)(4--=t CCl ε
1
)(404--=
CCl C C C CCl ε空测
测,1
)()(444--=
CCl C CCl C C CCl d εε测
空测
3. 计算每个溶液的电容值及介电常数
d C C C -=测量溶液,0
C C 溶液
溶液=
ε 4.作图分别由斜率求算γβα,,。
)1(24
x CCl αεε+=溶液,)1(24
x CCl βρρ+=溶液,)1(24
x n n CCl γ+=溶液
5. 由课本166页II-31-7式及II-31-11计算∞2P ,。
∞
2R 由II-31-13计算523H COOC CH 的分子
偶极矩。
理论值为: m C ⋅⨯--31
1030.687.5
实验三 粘度法测定水溶性高聚物相对分子质量
二、作图。
三、计算大分子的分子量
两直线相交处约为255.15。
即[η]=255.15,[η]=KM α α=0.79,K=3.8×10-3cm 3g -1,得M=1288670=1.289×106。
实验四 电导法测定乙酸乙酯皂化反应的速率常数
一、数据记录
室温: ℃ 大气压力: pa κ0 (30℃) 。
κ0 (40℃) 。
1.将t ,κt 数据列表。
240
2502602702800
0.0005
0.001
0.0015
2. 以)((/)(0∞--κκκκt t c 对时间t 作图,可两条直线。
3.由直线的斜率分别计算两个温度下的速率常数k 和反应半衰期t 1/2。
4.由两温度下的速率常数,按Arrhenius 公式,计算乙酸乙酯皂化反应的活化能。
实验五 丙酮碘化反应速率方程的确定
1、 数据记录
2计算εb
lg =-==
A A T bc b c
εε 3计算反应速率
用表中数据以A 对时间作图,求得四条直线,各直线斜率为⎛⎫
⎪⎝⎭
dc b dt ε.用斜率分别计算反应速率r 1,r 2,r 3,r 4.
根据上式可计算出α、β、γ。
4、建立丙酮碘化反应速率方程式
A
12
lg()lg =
B r r n m
5、分别计算1、2、3、和4 号瓶中丙酮和酸的初始浓度,再根据上式计算四种不同初始浓度(配好的各容量瓶中组分的浓度)的反应速率常数,求其平均值。
332
1
1CH COCH HCl I r k C C C αβγ
=
⋅⋅,依次得到k 2,k 3,k 4,求取平均值。
实验六 溶液表面张力的测定-最大泡压法
1以纯水测量结果计算K ’值,纯水表面张力可查表得到(计算时要注意单位,测量值单位为KPa )
1
111
' '=∆=
∆K p K p σσ
2计算各种浓度溶液的σ值:
'n n
K p σ=∆
3作σ-c 图,并在图上取10个点,分别做出切线,并求得对应的斜率d dc T
σ⎛⎫
⎪⎝⎭。
四、根据公式 求的不同浓度下的吸附量,作出c -Γ图,
d dc T
c ΓRT σ⎛⎫=- ⎪⎝⎭
c/Г
根据公式
∞
∞+=k ΓΓc Γc 1
可知,直线斜率为1Γ∞;使用公式1B L σ∞=Γ计算分子截面积B σ。
实验七 醋酸在活性炭上的吸附
1. 计算各瓶中醋酸的起始浓度C 0,平衡浓度C 及吸附量Г(mol·kg -1)。
注意起始浓度C 0不是原始醋酸的浓度
0c v c v v ⋅=
+原始醋酸醋酸水
,
2 以吸附量Г对平衡浓度C 作等温线 3作C/Г-C 图,并求出Г∞和常数K
所有点应拟合为一直线,直线斜率为1/Г∞,直线截距为1/Г∞K 。
4.由Г∞计算活性炭的比表面积。
