无机化学各章节第五章答案(新)
张祖德《无机化学习题》及答案第五章

第五章答案1. (1) 3.8×10−17 mol·dm−3(2) 3.58×10−2 mol·dm−3(3) 3.3×10−3 mol·dm−32. 2.90×10−703. (1) 1.34×10−4 mol·dm−3(2) 1.8×10−7 mol·dm−3(3) 1.8×10−5 mol·dm−34. FeS能溶于1.00 mol·dm−3的盐酸中,HgS则不溶。
5. 1.19×10−46. [Ag+]=[Cl−]=1.3×10−5 mol·dm−3[Ba2+]=[SO42−]=1.3×10−5 mol·dm−37. 4.9×10−108. 无CaSO4沉淀产生,有BaSO4沉淀产生。
9. (1) 3.8×10−4 mol·dm−3(2) 不相等。
因为F-离子的存在,大大减少了Sr2+的存在,增加了CO32-的存在。
10. 平衡时无PbBr2固体存在。
11. 7.3×10−412. 无ZnS沉淀,有CuS沉淀。
[H+]=0.32 mol·dm−3[Zn2+]=0.01 mol·dm−3[Cu2+]=3.74×10−15 mol·dm−313. (1) 52.7 mg/100 cm3(2) 7.0×10−4 mol·dm−314. (1) 无CdS沉淀,(2) 有CdS沉淀。
15. (1) pH=1.08(2) 有CaC2O4沉淀,第一种沉淀后不会有BaC2O4沉淀。
16. (1) 有Mg(OH)2沉淀。
(2) 加入12.8 g NH4Cl(s)。
17. (1) 1.84×10−14 mol·dm−3(2) 5.8×10−11 mol·dm−318. [Ag+]=2.4×10−5 mol·dm−3[MoO42−]=4.6×10−2 mol·dm−319. 111 mL20. (1) [SO42−]=1.8×10−5 mol·dm−3(2) 18%(3) 2.16×10−3 mol 21. [Sr2+]=8.7×10−4 mol·dm−3[Ba2+]=1.7×10−6 mol·dm−3[SO42−]=8.7×10−4 mol·dm−322. (1) AgCl先沉淀(2) [Cl−]=4.03×10−5 mol·dm−3(3) 7.15×10−4 g23. 95.6 %24. (1) 3.67 (2) 6.3925. 无BaF2沉淀产生26. 无AgAc沉淀产生27.28. −1.37 < pH ≤ 1.3329. 1.06 g30. [Br−]=3.0×10−5 mol·dm−3[I−]=4.8×10−9 mol·dm−331. 1.0×10−5 mol·dm−332. 3.0×10−1033. 1.7 g34. [Ag+]=1.0×10−8 mol·dm−3[Cl−]=0.017 mol·dm−3[Br−]=5.0×10−5 mol·dm−3[Na+]=0.067 mol·dm−3[NO3−]=0.05 mol·dm−335. [Ag+]=0.0053 mol·dm−3[Cl−]=3.2×10−8 mol·dm−3[Ba2+]=5.6×10−7 mol·dm−3[SO42−]=0.0027 mol·dm−336. 有ZnS和NiS沉淀37. 0.35 g·dm−338. 无FeS沉淀产生39. [Ba2+]=1.4×10−8 mol·dm−3[SO42−]=1.3×10−4 mol·dm−3[Sr2+]=6.0×10−3 mol·dm−3[CrO42−]=6.0×10−3 mol·dm−340. [Ag+]=1.3×10−11 mol·dm−3[Cl−]=1.4×10−2 mol·dm−3[I−]=6.4×10−6 mol·dm−3[Tl+]=1.4×10−2 mol·dm−341. [I−]=1.0×10−8 mol·dm−342. [Ag+]=4.3×10−10 mol·dm−3[NO2−]=1.1×10−4 mol·dm−343. (1) K=5.88×10−3(2) K=1.18×104对于同种类型的难溶电解质,在某种离子浓度相近时,K sp大的沉淀可以转化成K sp小的沉淀。
《无机化学》第6版-张天蓝主编-课后习题答案

《无机化学》第6版张天蓝主编课后习题答案第一章原子结构1、υ=∆E/h=(2.034⨯10-18 J) / (6.626⨯10-34 J⋅s)=3.070⨯1015 /s; λ=hc/∆E= (6.626⨯10-34 J⋅s ⨯2.998⨯108 m/s ) / (2.034⨯10-18 J)= 9.766⨯10-8 m2、∆υ≥ h/2πm∆x = (6.626⨯10-34 kg⋅m2/s) / (2⨯3.14⨯9.11⨯10-31 kg⨯1⨯10-10m)=1.16⨯106 m/s。
其中1 J=1(kg⋅m2)/s2, h=6.626⨯10-34 (kg⋅m2)/s3、(1) λ=h/p=h/mυ=(6.626⨯10-34 kg⋅m2/s) / (0.010 kg⨯1.0⨯103 m/s)=6.626⨯10-35 m,此波长太小,可忽略;(2)∆υ≈h/4πm∆υ =(6.626⨯10-34 kg⋅m2/s) / (4⨯3.14⨯0.010 kg⨯1.0⨯10-3 m/s)= 5.27⨯10-30 m,如此小的位置不确定完全可以忽略,即能准确测定。
4、He+只有1个电子,与H原子一样,轨道的能量只由主量子数决定,因此3s与3p轨道能量相等。
而在多电子原子中,由于存在电子的屏蔽效应,轨道的能量由n和l决定,故Ar+中的3s与3p轨道能量不相等。
5、代表n=3、l=2、m=0,即3d z2轨道。
6、(1)不合理,因为l只能小于n;(2)不合理,因为l=0时m只能等于0;(3)不合理,因为l只能取小于n的值;(4)合理7、(1)≥3;(2)4≥l≥1;(3)m=08、14Si:1s22s22p63s23p2,或[Ne] 3s23p2;23V:1s22s22p63s23p63d34s2,或[Ar]3d34s2;40Zr:1s22s22p63s23p63d104s24p64d25s2,或[Kr]4d25s2;Mo:1s22s22p63s23p63d104s24p64d55s1,或[Kr]4d55s1;79Au:421s22s22p63s23p63d104s24p64d104f145s25p65d106s1,或[Xe]4f145d106s1;9、3s2:第三周期、IIA族、s区,最高氧化值为II;4s24p1:第四周期、IIIA 族、p区,最高氧化值为III;3d54s2:第四周期、VIIB族、d区,最高氧化值为VII;4d105s2:第五周期、IIB族、ds区,最高氧化值为II;10、(1)33元素核外电子组态:1s22s22p63s23p63d104s24p3或[Ar]3d10s24p3,失去3个电子生成离子的核外电子组态为:1s22s22p63s23p63d104s2或[Ar]3d104s2,属第四周期,V A族;(2)47元素核外电子组态:1s22s22p63s23p63d104s24p64d05s1或[Kr]4d105s1,失去1个电子生成离子的核外电子组态为:1s22s22p63s23p63d104s24p64d10或[Kr]4d10,属第五周期,I B族;(3)53元素核外电子组态:1s22s22p63s23p63d104s24p64d105s25p5或[Kr]4d105s25p5,得到1个电子生成离子的核外电子组态为:1s22s22p63s23p63d104s24p64d105s25p6或[Kr]4d105s25p6,属第五周期,VII A族。
无机化学第五章习题参考答案
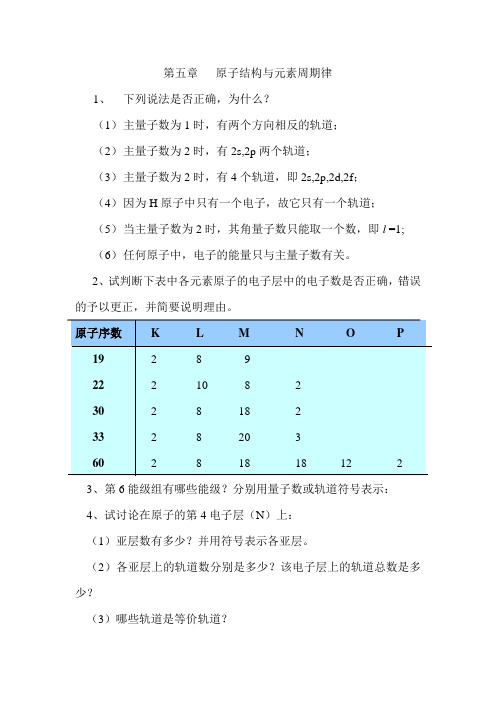
第五章原子结构与元素周期律1、下列说法是否正确,为什么?(1)主量子数为1时,有两个方向相反的轨道;(2)主量子数为2时,有2s,2p两个轨道;(3)主量子数为2时,有4个轨道,即2s,2p,2d,2f;(4)因为H原子中只有一个电子,故它只有一个轨道;(5)当主量子数为2时,其角量子数只能取一个数,即l =1;(6)任何原子中,电子的能量只与主量子数有关。
2、试判断下表中各元素原子的电子层中的电子数是否正确,错误的予以更正,并简要说明理由。
3、第6能级组有哪些能级?分别用量子数或轨道符号表示:4、试讨论在原子的第4电子层(N)上:(1)亚层数有多少?并用符号表示各亚层。
(2)各亚层上的轨道数分别是多少?该电子层上的轨道总数是多少?(3)哪些轨道是等价轨道?5、写出与下列量子数相应的各类轨道符号,并写出其在近似能级图中的前后能级所对应的符号:(1)n=2, l=1(2) n=3, l =2(3) n=4, l =0(4) n=4, l =36、在下列各项中,填入合适的量子数:(1)n=?, l=2, m=0, m s=±1/2(2)n=2, l=?, m=-1, m s=±1/2(3)n=4, l=?, m=+2, m s=±1/2(4)n=3, l=0, m=?, m s=±1/27、指出下列假设的电子运动状态(依次为n,l,m, m s),哪几种不可能存在?为什么?(1)3,2,+2,+1/2 (2)2, 2, -2, +1/2(3)2, 0, +1, -1/2 (4) 2, -1, 0, +1/2(5) 4, 3, -1, 18、原子吸收能量由基态变成激发态时,通常是最外层电子向更高的能级跃迁。
试指出下列原子的电子排布中,哪些属于基态或激发态,哪些是错误的。
(1)1s2 2s2 2p1(2)1s2 2s2 2p62d1(3) 1s22s22p43s1(4) 1s2 2s4 2p29、写出原子序数为45,52,79各元素的原子核外电子排布式及其价层电子构型。
北师大《无机化学》第四版习题答案5

北师大《无机化学》第四版习题答案5第五章化学热力学基础5-1 从手册中查出常用试剂浓硫酸、浓盐酸、浓硝酸、浓氨水的密度和质量分数计算它们的(体积)物质的量浓度和质量摩尔浓度。
解:经查阅: p(HCl)=1.19g/ml w(HCl)=37.23%p(H2SO4)=1.83g/ml w(H2SO4)=98%p(HNO3)=1.42g/ml w(HNO3)=69.80%p(NH3.H2O)=0.9g/ml w(NH3.H2O)=26%由公式c=pw/M可得:c(HCl)=12 mol·L–1c(H2SO4)=18.3mol·L–1c(HNO3)=15.7 mol·L–1 c (NH3.H2O)=13.8 mol·L–1设1㎏水中含溶质n mol,则由w=m/(m+1000)(m为溶质质量)可得:m (HCl)=16.2 mol/㎏m(H2SO4)=500 mol/㎏m(HNO3)=36.69 mol/㎏m (NH3.H2O)= 20.67 mol/㎏5-2 从手册查出常温下的饱和水蒸气压,计算当时相对湿度为40%时,水蒸气压多大。
解:在298K下,P(饱和水蒸气压)=3.167Kpa,P(不饱和)/P(饱和)=40%,则P(不饱和)/P(饱和)=40%×P(饱和)=0.4×3.167=1.2668 Kpa答:水蒸气压为1.2668 Kpa.5-3化学实验中经常用蒸馏水冲洗已用自来水洗净的烧杯。
设洗净烧杯残留“水”为1mL,试计算,用30mL蒸馏水洗1次和2次,烧杯中残留的“自来水的浓度”分别多大?解:再用自来水洗之后,烧杯中自来水为1ml之后,加入30ml 蒸馏水,一共为31ml 水,自来水占1/31,倒掉后又倒1ml,故自来水浓度为1/31。
若第一次加入的蒸馏水倒掉之后,1ml中含1/31ml的自来水;再加入30ml蒸馏水,一共为31ml水,自来水占1/312=1/963 所以倒掉后自来水占1/312=1/9635-4 计算15℃,97kPa下15g氯气的体积。
中级无机化学1-5章年习题答案

无机化学习题参考答案第一章1.4.解:〔1〕H 2O 22C〔2〕S 2O 32- 3v C 〔3〕N 2O (N -N -O 方式) v C ∞〔4〕Hg 2Cl 2h D ∞〔5〕H 2C=C=CH 2 2d D 〔6〕UOF 4 C 5v 〔7〕BF 4-d T 〔8〕SClF 54v C〔9〕反-Pt(NH 3)2Cl 22h D〔10〕PtCl 3(C 2H 4)- 2v C1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
〔BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃〕2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3CH 3PF F H 3CH 3B BH 3F 3(该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和〔6配位〕,失去Lewis 酸性4. 吸水后失效 的AlCl 3有什么方法可以脱水?因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。
〔只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用复原氯化法制备,这就不是脱水方法了〕。
第二章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期〔分裂能小〕第六周期〔分裂能大〕P Ni ClP ClClCl P Ptrans cis四面体构型 平面四方形构型〔两种构型〕 只有一种结构 〔P 代表PPh 3〕2.2 解 〔1〕MA 2B 4〔2〕MA 3B 3M A ABB M ABA BM ABAB M A AA Btrans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v μ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+33Htrans cisCo(en)(NH3)2Cl2+3Cl333NHNH33trans(1) trans(2)cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
无机化学习题解答第五章

第五章氧化-还原反应无机化学习题解答(5)思考题1.什么是氧化数如何计算分子或离子中元素的氧化数氧化数是某一原子真实或模拟的带电数。
若某一原子并非真实得到若失去电子而带电荷,可以认为得到与之键合的电负性小于它的原子的电子或给予与之键合的电负性大于它的原子电子,然后计算出来的带电情况叫氧化数。
已知其他原子的氧化数,求某一原子的氧化数时可用代数和的方法,中性分子总带电数为零;离子总带电数为离子的电荷。
2.指出下列分子、化学式或离子中划线元素的氧化数:As2O3 KO2 NH4+ Cr2O72- Na2S2O3 Na2O2 CrO5 Na2PtCl6 N2H2 Na2S52.As2O3 +3,KO2 +1,NH4+ -3,Cr2O72-+3,Na2S2O3 +2,Na2O2 -1,CrO5 +10,Na2PtCl6 +4,N2H2 -1,Na2S5 -2/5,3.举例说明下列概念的区别和联系:⑴氧化和氧化产物⑵还原和还原产物⑶电极反应和原电池反应⑷电极电势和电动势3.⑴氧化是失去电子氧化数升高,所得氧化态较高产物即为氧化产物。
⑵还原是得到电子氧化数降低,所得氧化态较较产物即为还原产物。
⑶在某个电极上发生的反应为电极反应,分为正极的还原反应和负极的氧化反应,总反应为原电池反应。
⑷固体电极材料与所接触的溶液间的电势差即为该原电池的电极电势。
两电极构成原电池时两电极间的电势差为该原电池的电动势。
4.指出下列反应中何者为氧化剂,它的还原产物是什么何者为还原剂,它的氧化产物是什么⑴2FeCl3+Cu→FeCl2+CuCl2⑵Cu+CuCl2+4HCl→2H2[CuCl3]⑶Cu2O+H2SO4→Cu+CuSO4+H2O4.⑴氧化剂:FeCl3,还原产物:FeCl2,还原剂:Cu,氧化产物:CuCl2。
⑵氧化剂:CuCl2,还原产物:2H2[CuCl3],还原剂:Cu,氧化产物:2H2[CuCl3]。
⑶氧化剂:Cu2O,还原产物:Cu,还原剂:Cu2O,氧化产物:CuSO4。
高等无机化学课后习题答案第5章

第五章1.解释过渡金属的有机金属化合物的结构与金属d电子组态的关系:d6组态的有机金属化合物常采取六配位八面体结构;d8组态的采取五配位四方锥或三角双锥结构;d10组态的采取四配位四面体结构,并举出一些实例。
(提示:根据18电子规则)(P191)答:过渡金属有机金属化合物满足有效原子序数规则,即金属的全部电子数与所有配体提供的σ 电子的总和恰好等于金属所在周期中稀有气体的原子序数。
如果只考虑价层电子,那么金属价电子数加上配体σ 电子数的总和等于18 的分子是稳定的,即18 电子规则。
这一规则反映了过渡金属原子用它的5 个nd 轨道,一个(n+1)s 轨道和3个(n+1)p 轨道总共9个价轨道最大程度地成键,在每个价轨道中可容纳一对自旋相反的电子,共计18个电子形成稳定结构。
对于d6组态,其配位数为(18-6)/2 = 6 ,所以多采取六配位八面体结构,如[V(CO)6]-和Cr(CO)6等;对于d8组态,其配位数为(18-8)/2 = 5 ,所以采取五配位四方锥或三角双锥结构,如Fe(CO)5等;对于d10组态,其配位数为(18-10)/2= 4 ,所以采取四配位四面体结构,如Ni(CO)4等。
2.解释以下羰基伸缩振动频率的变化:[V(CO)6]-Cr(CO)5[Mn(CO)6]+cm-l1860 2000 2090答:配位化合物离子所带的电荷对νCO有影响,如上边的等电子系列中,负电荷增加,反馈作用增强,C≡O键削弱,使νCO 下降;反之正电荷阻止电173子从金属移向CO 的空轨道,反馈作用减弱,造成νCO 增加。
4.根据下列红外光谱图判断羰基的类型。
答:CO的不同配位方式可以通过红外光谱鉴定,已知中性分子中M-CO端基的CO伸缩振动频率在1900~2150cm-1范围内,而与正常双键性质相应的“酮式”CO,即μ2-桥基CO 的伸缩振动频率降低到1750~1850cm -1范围内,叁桥的μ3-CO 具有更低的伸缩振动频率。
无机及分析化学课后习题第五章答案

一、选择题1.氢气与下列物质反应中,氢气不作为还原剂的是( )A. 单质硫B. 金属锂C. 四氯化钛D. 乙烯解:选B 。
氢原子与碱金属结合生成金属氢化物,氢原子能得到电子,是作为氧化剂参与反应。
2.下列各组物质可共存于同一溶液中的是( )A. NH 4+ , H 2PO 4-, K + , Cl -, PO 43-B. Pb 2+ , NO 3-, Na + , SO 42-C. Al(OH) 3, Cl -, NH 4+, NH 3·H 2OD. Sn 2+ , H + , Cr 2O 72- , K +, Cl -解:选A 。
选项B 中Pb 2+,SO 42-能够生成沉淀PbSO 4; 选项C 中,强电解质的存在,会促进Al(OH) 3的凝聚。
选项D 中Sn 2+ 与Cr 2O 72-在H +下会发生氧化还原反应。
只有A 中各离子不会发生反应,能够稳定存在。
3.下列叙述正确的是( )A. 22O H 分子构型为直线形B. 22O H 既有氧化性又有还原性C. 22O H 的水溶液很稳定D. 22O H 与722O Cr K 的酸性溶液反应生成稳定的5CrO解:选B 。
22O H 分子中存在过氧链—O —O —,过氧链在相当于书本的书脊位置上,而两个氢原子在半展开的两页纸面位置上,所以22O H 分子构型不是直线形。
22O H 的水溶液不稳定,遇杂质易分解。
22O H 与722O Cr K 的酸性溶液反应生成3Cr +。
22O H 中O 的氧化态居中,所以既22O H 既有氧化性又有还原性。
4.地方性甲状腺肿大引起的原因是( )A. 氟过多B. 碘过多C. 碘不足D. 维生素不足解:选C 。
碘缺乏是地方性甲状腺肿大的主要原因。
5.要配制+2Fe 的标准溶液,最好的方法是将( )A. 硫酸亚铁铵溶于水B. 2FeCl 溶于水C. 铁钉溶于稀酸D. 3FeCl 溶液与铁屑反应解:选D 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章 习题5-2用质子理论判断下列物质哪些是酸?并写出它的共轭碱。
哪些是碱?也写出它的共轭酸。
其中哪些既是酸又是碱?H 2PO 4-,CO 32-,NH 3,NO 3-,H 2O ,HSO 4-,HS -,HCl解:酸HCl ,HSO 4- 碱CO 32-,NO 3-, 既是酸又是碱NH 3,H 2PO 4-,H 2O ,HS -, 5-3氨水是一弱碱,当氨水浓度为0.200 mol .L -1时,NH 3H 2O 的离解度α为0.946%,问当浓度为0.100 mol .L -1时NH 3H 2O 时电离度α为多少?解:222211ααθc c K a == %423.010.0%)946.0(02.0222112=⨯==c c αα 5-4 0.01 mol ⋅L -1 HAc 溶液的解离度为4.2%,求同一温度下,HAc 的解离常数和溶液的pH值。
解:5221076.1%)2.4(01.0-⨯=⨯==αθc K a∵{θc c /}﹒)(HAc K a θ=0.01×1.76×10-5>61.1210-,{θc c /}/)(HAc K a θ=0.01/1.76×10-5>81.210∴θc H c /)(+=θθc c K a /=01.01076.15⨯⨯-=4.2×10-3 pH=2.385-5水溶液中,强酸与强碱反应的离子反应式为 H + + OH -= H 2O , 反应的标准平衡常数Kθ=θwK 1; 强酸与弱一元碱反应的离子反应式为 B -+ H + = HB , 反应的标准平衡常数K θ=θ)(1HB a K , 弱一元酸与强碱反应的离子反应式为 HB +OH -= B -+ H 2O , 反应的标准平衡常数K θ=θθwHB a K K )( ; 弱一元酸与弱一元碱反应的离子反应式为HA + B - = A -+HB , 反应的标准平衡常数K θ=θθ)()(HB a HA a K K 。
5-6写出下列化合物水溶液的PBE :(1) H 3PO 4 (2) Na 2HPO 4 (3) Na 2S (4)NH 4H 2PO 4 (5) Na 2C 2O 4 (6) NH 4Ac (7) HCl+HAc (8)NaOH+NH 3解:(1) H 3PO 4 c (H +)= c (OH -)+c (H 2PO 4-) + 2 c (HPO 42-)+ 3 c (PO 43-)(2) Na 2HPO 4 c (H +) + c (H 2PO 4-) +2 c (H 3PO 4) = c (OH -) + c (PO 43-) (3) Na 2S c (H +)= c (OH -) - c (HS -)- 2 c (H 2S)(4) NH 4H 2PO 4 c (H +) = c (OH -) + c (NH 3 H 2O) + c (HPO 42-)+2 c (PO 43-) - c (H 3PO 4) (5) Na 2C 2O 4 c (H +)= c (OH -)- c (HC 2O 4-) - 2 c (H 2C 2O 4) (6) NH 4Ac c (H +) = c (OH -) + c (NH 3 H 2O) - c (HAc)(7) HCl+HAc c (H +)= c (OH -) + c (Cl -) + c (Ac -) (8) NaOH+NH 3 c (H +) = c (OH -) -c (NH 4+)- c (Na +) 5-7 求下列各弱酸或弱碱的共轭碱或共轭酸的θb p K 或θa p K 。
(1)柠檬酸C 6H 8O 7 123θθθa a a (p 3.13,p 4.76,p 6.40)K K K = ==解:柠檬酸H 3A 的共轭碱为H 2A - ,其θθ114a b pK pK -==14-3.13=10.87(2)HCOOH θa (p 3.75)K =解:HCOOH 的共轭碱为COOH - θθa b pK pK -=14=14-3.75=10.25(3)HC 2O 4- 12θθ224a a (H C O p 1.25,p 4.27)K K = =的解: HC 2O 4-是两性物质,其共轭酸H 2C 2O 4 的 25.11==θθa a pK pK其共轭碱C 2O 42-的73.927.414142=-=-=θθa b pK pK(4)PO 43- 123θθθ34a a a (H PO p 2.16,p 7.21,p 12.32)K K K = ==的解:PO 43-的共轭酸为HPO 42-,其32.123==θθa a pK pK(5)苯胺 θb(p 9.34)K = 解:苯胺256NH H C 的共轭酸为+356NH H C ,其66.434.914=-=θa pK5-8柠檬汁是一种酸性最强的果汁,pH=1.92。
计算柠檬汁中柠檬酸各种型体的浓度c (H 3Cit)、c (H 2Cit -)、c (HCit 2-) 与柠檬酸根浓度c (Cit 3-)的比值各为多少?解:设柠檬酸为H 3A H 3A= H ++ H 2A - θ1a K H 2A -= H ++ HA 2- θ2a KHA 2-= H ++ A 3- θ3a K)()(33-A c A H c =θθθ3213)}({a a a K K K H c ⋅⋅+=754392.1101.41068.1101.7)10(----⨯⨯⨯⨯⨯=3.55×10 8)()(32--A c A H c =θθ322)}({a a K K H c ⋅+=75292.1101.41068.1)10(---⨯⨯⨯=2.1×10 7)()(32--A c HA c =θ3)(a K H c +=792.1101.410--⨯=2.93×10 45-9计算下列水溶液的pH 值。
(1)0.010 mol ⋅L -1NaOH (2)0.050 mol ⋅L -1HAc (3)0.10 mol ⋅L -1KCN (4)0.10 mol ⋅L -1NH 4Ac (5)饱和H 2CO 3溶液(0.04 mol ⋅L -1) (6)0.10 mol ⋅L -1NaHS 解:(1)θc OH c /)(-= 0.010 mol ⋅L -1 pH=12.00 (2){θc c /}/)(HAc K a θ=0.050/1.7×10-5>81.210∴θc H c /)(+=θθc c K a /=05.0107.15⨯⨯-=9.2×10-4 pH=3.04(3))(HCN K a θ=6.2×10-10 )(-CN K b θ=θw K /)(HCN K a θ=1.6×10-5∵{θc c /}/θb K (CN) = 0.10/1.6×10-5>81.210∴θc OH c /)(-=θθc c K b /=10.0106.15⨯⨯-=1.26×10-3pOH=2.90, pH=11.10(4)θc H c /)(+=θθ21a a K K =)()(4HAc K NH K a a θθ+=5514107.1108.110---⨯⨯⨯ =9.72×10-8 pH=7.01(5)∵θ1a K ( H 2CO 3) /θ2a K ( H 2CO 3)=4.5×10-7 / 4.7×10-11≈410 ∴可忽略第二步电离,又∵θθ1/a K c c =7105.404.0-⨯>81.210 θc H c /)(+=θθc c K a /1=04.0105.47⨯⨯-=1.34×10-4 pH=3.87 (6)pH=)(2121θθa a pK pK +=)90.1297.6(21+= 9.94 或: θc H c /)(+=θθ21a a K K =)()(2S H K HS K a a θθ-=)()(2122S H K S H K a a θθ=713101.1103.1--⨯⨯⨯ =1.20×10-10 pH=9.925-10计算0.10 mol·L -1的Na 2S 水溶液的pH 及c (S 2-)、c (HS -)和c (H 2S) 。
解:S 2-为二元离子碱,θ1b K =θθ)(22S H a wK K =1514101.7100.1--⨯⨯ = 1.41,θ2b K =θθ)(12S H a wK K =714103.1100.1--⨯⨯ = 7.7×10-8∵θ1b K /θ2b K =1.41/7.7×10-8>410 ∴可忽略第二步电离,又∵{θc c /}﹒θ1b K= 0.10×1.41>61.1210-,θθ1/b K c c =41.110.0<81.210 ∴可用一元二次求根式求解,即θc OH c /)(-=2/)(4)(21211θθθθcS Na c K K K b b b ⋅++-=210.041.14)41.1(41.12⨯⨯++-=0.09376,即)(-OH c =0.09376mol ·L -1,pH=12.97S 2-+ H 2O = OH -+ HS-eq c / mol ·L -1 0.10 -)(-OH c )(-OH c )(-OH c c ( HS -) = c (OH -) = 9.4×10-2mol/ L , c ( S 2-) = 0.10 - 9.4×10-2 = 6.0×10-3mol/ L 。
c (H 2S) =θ2b K = 7.7×10-8mol/ L5-11将等体积 0.040 mol·L -1的苯胺(C 6H 5NH 2 )水溶液与0.040 mol·L -1的HNO 3水溶液混合,计算所得混合溶液的pH 。
已知θb K (C 6H 5NH 2)=4.6×10-10 。
解:C 6H 5NH 2+ HNO 3= C 6H 5NH 3++ NO 3-,等体积混合c (C 6H 5NH 3+)=0.020mol ·L -1C 6H 5NH 3+是一元弱酸,θaK =θθbw K K =1014106.4100.1--⨯⨯=2.2×10-5,{θc c /}﹒θaK =0.020×2.2×10-5>61.1210-θθaK c c /=5102.2020.0-⨯>81.210θc H c /)(+=θθc c K a /⋅=020.0102.25⨯⨯-=6.63×10-4,即)(+H c =6.63×10-4 mol ·L -1, pH=3.185-12欲配制pH = 9.20的NH 4+-NH 3缓冲溶液500 mL ,若使缓冲溶液中c (NH 3) = 1.0 mol·L -1 ,则需加入多少克固体(NH 4)2SO 4和15 mol·L -1浓氨水多少毫升? 解:设应加入m 克(NH 4)2SO 4pOH = 14 – pH = 14.00 – 9.20 = 4.80 据缓冲溶液pH 计算公式: pOH = p K θb (NH 3) - lgθθc NH c c NH c /)(/)(43+lgθθc NH c c NH c /)(/)(43+= p K θb (NH 3) – pOH =4.75-4.80 = -0.05θθc NH c c NH c /)(/)(43+=0.89 即θcNH c /)(0.14+=0.89 )(4+NH c =1.12 mol/ L 因 (NH 4)2SO 4 ~ 2NH 4+ 所以 n ((NH 4)2SO 4 ) = n (NH 4+ )/2 所以m[(NH 4)2SO 4]= n {(NH 4)2SO 4}M {(NH 4)2SO 4}=13225.012.1⨯⨯=36.96g 根据氨水稀释前后物质的量不变,有v(浓氨水) =033.0155.00.1=⨯ 3 L=33.3 mL5-13欲配制250mL pH=5.0的缓冲溶液,问在125mL1.0 mol ⋅L -1NaAc 溶液中应加多少6.0mol ⋅L -1的HAc 和多少水?解:设应加入v(HAc)L 6.0 mol ⋅L -1的HAcpH = pK θa (HAc) - lg θθc Ac c c HAc c /)(/)(-lg θθc Ac c c HAc c /)(/)(-= pK θa (HAc) - pH = 4.77 - 5.0 = -0.23 θθcAc c c HAc c /)(/)(-= 0.59 又因为:L mol Ac c /5.025.0125.00.1)(=⨯=-所以: L mol Ac c HAc c /295.05.059.0)(59.0)(=⨯=⨯=-L mol Ac c HAc c /295.05.059.0)(59.0)(=⨯=⨯=-根据HAc 稀释前后物质的量不变,有6×V(HAc)=0.295×0.25 所以v(HAc) =0.295×0.25/6 =0.012L v(水) =250-125-12=113mL5-14下列多元酸或混合酸的溶液能否被准确进行分步滴定或分别滴定?(1)0.1mol ⋅L -1 H 2C 2O 4; (2)0.1 mol ⋅L -1 H 2S ; (3)0.1 mol ⋅L -1 柠檬酸; (4)0.1 mol ⋅L -1 酒石酸; (1)0.1mol ⋅L -1 H 2C 2O 4(θ1a K =5.6×10-2,θ2a K =5.4×10-5)解∵θ1a K =5.6×10-2>710-, {θc c /}﹒θ2a K =0.05×5.4×10-5>810-, 但θ1a K /θ2a K =5.6×10-2/5.4×10-5<410 ∴只能被滴定到第二终点。
