胶体金的制备
胶体金法各种方法法原理

胶体金法各种方法法原理胶体金(colloidal gold)是一种常见的纳米材料,广泛应用于生物医学、光电子学以及化学分析等领域。
胶体金法则是制备胶体金纳米颗粒的一种常用方法,它包括了各种不同的制备方法。
本文将详细介绍胶体金法的各种方法和原理。
一、胶体金法的概述胶体金法是指利用化学还原或还原剂将金离子还原成金原子并使其聚集形成胶体金颗粒的过程。
胶体金颗粒具有良好的可控性和活性,可以通过调节制备条件来控制其形状、尺寸和表面性质,便于在各个领域的应用中发挥优越性能。
二、化学还原法化学还原法是制备胶体金的一种常见方法。
其原理是通过将金离子与还原剂反应,使金离子还原为金原子,形成胶体金颗粒。
常用的还原剂有氨水、柠檬酸等。
这种方法制备的胶体金颗粒形状和尺寸较均匀,可以通过调节还原剂浓度、反应时间和温度等参数来控制颗粒的大小和形状。
三、光化学法光化学法是一种利用光照射来控制胶体金纳米颗粒形成的方法。
在该方法中,金离子在紫外光照射下被激发产生自由电子,然后与还原剂发生反应,形成胶体金颗粒。
这种方法具有反应速度快、颗粒形状可调控等优点。
光化学法的适应范围广,可以制备不同形状和尺寸的胶体金颗粒。
四、微乳液法微乳液法是一种利用乳化剂将金离子包裹在微乳液中,通过还原剂将金离子还原为金原子,最终生成胶体金颗粒的方法。
微乳液具有稳定性好、溶剂消耗少等特点,在胶体金制备中广泛应用。
该方法不受金离子浓度的限制,能够制备出较大尺寸的胶体金颗粒。
五、溶胶-凝胶法溶胶-凝胶法是一种将金离子逐渐转化为胶体金的方法。
首先,将金离子转化为胶态溶胶,然后通过加热或干燥使其凝胶,最终形成胶体金凝胶。
该方法可以制备出较大尺寸的胶体金颗粒,也可用于制备具有复杂结构的胶体金材料。
六、电化学法电化学法是一种利用电化学反应制备胶体金的方法。
在电化学细胞中,金阳极上的金离子被还原为金原子,并在阴极表面聚集形成胶体金颗粒。
该方法具有较高的纯度和良好的控制性能,可用于制备高质量的胶体金。
胶体金的制备

胶体金的制备胶体金的制备根据不同的制备方法,可以制备出直径1-500nm的胶体金粒子,但做为免疫标记探针,其直径应在3-30nm 范围内。
在氯化金(HAuCl4)水溶液中加入还原剂使之还原并聚积形成胶体金粒子。
使用不同种类、不同剂量的还原剂,可以控制所产生的粒子大小。
即粒子大小取决于反应溶液中最初还原试剂和还原核的数量。
还原剂浓度越高,核浓度也越高,氯化金的还原也就从更多的还原中心开始,因此产生的胶体金粒子数量越多,但体积也越小。
粒子直径每增加一倍,数量减少为原来的1/8。
以柠檬酸钠和单宁酸做还原剂,能够制备大小相对一致、直径3~16nm的胶体金。
因此一般胶体金探针均使用该方法进行。
但该方法制备的胶体金粒子直径范围较窄,而且残留的多聚单宁酸残基往往干扰某些蛋白与金粒子的结合。
此时在溶液中添加0.1~0.2%的H2O2能够去除这些残基。
双标记或制备5-10 nm的胶体金时建议使用该方法。
利用柠檬酸为还原剂,可以制备12~150 nm直径的胶体金。
但制备大体积的胶体金时,胶体金粒子的误差也同时增加。
因此做单标记时,建议使用该方法制备12-16 nm直径的胶体金。
除了上述方法外,也可以用磷作为还原剂来制备5 nm的胶体金,它避免了单宁酸残基的问题,但所形成的金粒子体积变化较大。
磷易燃且有毒,制备的残液需进一步处理,故该方法已经很少使用。
氯化金极易吸湿,故一般均以小剂量密封保存(0.5g或1g),因此在配制氯化金溶液时一次配完,暂时不用的可以用1.5 ml试管分装为1 ml保存(-20℃)。
注意各种玻璃器皿一定要洗净并用双蒸水多次冲洗,有条件时可硅化处理(1%双氯硅烷/氯仿浸泡1小时,烘干)。
配制各种试剂时均使用双蒸水,随后再用0.22 um微孔滤膜过滤后使用。
三角瓶可反复多次使用,不用时应密封保存,以防污染。
制备好的胶体金保存寿命较长,可4℃保存6个月以上或室温下保存1-2个月。
当出现明显悬浮物或沉淀后表示已不可再用。
胶体金(纳米金Gold Nanoparticles)的制备步骤和注意事项

胶体金(纳米金Gold Nanoparticles)的详细制备步骤和注意事项胶体金的制备一般采用还原法,常用的还原剂有柠檬酸钠、鞣酸、抗坏血酸、白磷、硼氢化钠等。
下面介绍最常用的制备方法及注意事项。
1、玻璃容器的清洁:玻璃表面少量的污染会干扰胶体金颗粒的生成,一切玻璃容器应绝对清洁,用前经过酸洗、硅化。
硅化过程一般是将玻璃容器浸泡于5%二氯二甲硅烷的氯仿溶液中1分钟,室温干燥后蒸馏水冲洗,再干燥备用。
专用的清洁器皿以第一次生成的胶体金稳定其表面,弃去后以双蒸馏水淋洗,可代替硅化处理。
2、试剂、水质和环境:氯金酸极易吸潮,对金属有强烈的腐蚀性,不能使用金属药匙,避免接触天平称盘。
其1%水溶液在4℃可稳定数月不变。
实验用水一般用双蒸馏水。
实验室中的尘粒要尽量减少,否则实验的结果将缺乏重复性。
金颗粒容易吸附于电极上使之堵塞,故不能用pH电极测定金溶液的pH值。
为了使溶液pH值不发生改变,应选用缓冲容量足够大的缓冲系统,一般采用柠檬酸磷酸盐(pH3~5.8)、Tris-HCL (pH5.8~8.3)和硼酸氢氧化钠(pH8.5~10.3)等缓冲系统。
但应注意不应使缓冲液浓度过高而使金溶胶自凝。
3、柠檬酸三钠还原法制备金溶胶:取0.01%氯金酸水溶液100ml 加热至沸,搅动下准确加入1%柠檬酸三钠水溶液0.7ml,金黄色的氯金酸水溶液在2分钟内变为紫红色,继续煮沸15分钟,冷却后以蒸馏水恢复到原体积,如此制备的金溶胶其可见光区最高吸收峰在535nm,A1cm/535=1.12。
金溶胶的光散射性与溶胶颗粒的大小密切相关,一旦颗粒大小发生变化,光散射也随之发生变异,产生肉眼可见的显著的颜色变化,这就是金溶胶用于免疫沉淀或称免疫凝集试验的基础。
金溶胶颗粒的直径和制备时加入的柠檬酸三钠量是密切相关的,保持其他条件恒定,仅改变加入的柠檬酸三钠量,可制得不同颜色的金溶胶,也就是不同粒径的金溶胶,见附表。
附表100 ml 氯金酸中柠檬酸三钠的加入量对金溶胶粒径的影响1%柠檬酸三钠ml 0.30 0.45 0.70 1.00 1.50 2.00金溶胶颜色蓝灰紫灰紫红红橙红橙吸收峰(nm) 220 240 535 525 522 518径粒(nm) 147 97.5 71.5 41 24.5 154、柠檬酸三钠-鞣酸混合还原剂:用此混合还原剂可以得到比较满意的金溶胶,操作方法如下:取4ml1%柠檬酸三钠(Na3C6H5O7.2H2O),加入0~5ml1%鞣酸,0~5ml 25mmo/L K2CO2(体积与鞣酸加入量相等),以双蒸馏水补至溶液最终体积为20ml,加热至60℃取1ml1%的HAuCl4,加于79ml双蒸馏水中,水浴加热至60℃,然后迅速将上述柠檬酸-鞣酸溶液加入,于此温度下保持一定时间,待溶液颜色变成深红色(约需0.5~1小时)后,将溶液加热至沸腾,保持沸腾5分钟即可。
胶体金的制备方法

胶体金的制备方法胶体金是一种具有尺寸在1到100纳米范围内的纳米材料,具有良好的稳定性和光学特性。
它在生物医学、电子学和光学等领域中有着广泛的应用。
在本文中,我将介绍几种常见的制备胶体金的方法。
1.湿法还原法湿法还原法是一种较为常见的制备胶体金的方法。
首先,将对金离子具有还原能力的化合物如柠檬酸、乳酸、氯化亚锡溶解在溶剂中,调节溶液的ph值。
然后,向该溶液中加入氯金酸(HAuCl4)并搅拌,利用还原剂将金离子还原为金颗粒。
最后,通过离心或过滤的方式将胶体金分离出来。
2.滴定法滴定法是一种简单而有效的制备胶体金的方法。
首先,将一定浓度的氯金酸(HAuCl4)溶解在溶剂中,并加入少量的还原剂,如氢氯酸或异硫脲。
接下来,使用滴定管将还原剂溶液滴加入氯金酸溶液中。
滴加过程中,溶液的颜色逐渐由黄色变为红色,直到达到滴定点。
在滴定过程中,还原剂将金离子还原为金纳米颗粒。
3.还原法还原法是一种通过还原剂直接将氯金酸还原为金颗粒的方法。
在制备中,首先将氯金酸溶解在溶剂中,并加入一定浓度的还原剂,如硼氢化钠(NaBH4)或乳酸铺盖。
接下来,向该溶液中滴加还原剂溶液,溶液的颜色会逐渐转变为红色。
当滴加过程停止后,胶体金制备完成。
4.光化学法光化学法是一种利用光能进行胶体金制备的方法。
在制备中,首先将氯金酸溶解在溶剂中,并加入表面活性剂如十六烷基三甲基溴化铵(CTAB)。
接下来,向该溶液中加入光敏剂如染料丙酮酸(AA),并进行紫外光照射。
在光照射的作用下,金离子将被还原为金纳米颗粒。
上述方法是一些常见的制备胶体金的方法,它们各有优劣。
在具体选择时,需根据实际需求和实验条件来确定最适合的方法。
胶体金的制备方法还在不断发展中,有些新的制备方法如微乳液法和微流控法也被广泛应用。
希望本文对您有所帮助。
胶体金法使用方法

胶体金法使用方法胶体金法是一种利用胶体金作为信号增强剂的分析方法。
胶体金颗粒具有较小的尺寸、高度结构可控性、良好的离散性和比表面积等特点,使其成为生物、化学、医学、环境等多个领域研究的热点。
一、胶体金的制备胶体金的制备是胶体金法的第一步。
可以通过乳液法、还原法、微乳液法等不同的方法制备胶体金。
其中最常用且操作简单的方法是还原法。
1.材料准备:0.02%HAuCl4溶液、0.01MKCN溶液、0.1MNH4OH溶液。
2.反应操作:(1)将100mL的0.02%HAuCl4溶液倒入烧杯中;(2)在快速搅拌的同时缓慢加入0.01MKCN溶液,使溶液保持颜色不变;(3)继续快速搅拌,并缓慢滴加0.1MNH4OH溶液,使溶液由黄色变为红色;(4)继续搅拌,加热至70-80℃恒温反应30分钟;(5)关闭加热,继续搅拌冷却至室温。
二、胶体金的表征制备好的胶体金颗粒需要进一步表征其形貌、粒径和分散性等。
常见的表征方法有透射电子显微镜(TEM)、紫外可见光谱(UV-vis)和动态光散射(DLS)等。
1.TEM观察(1)将制备好的胶体金溶液滴在碳膜上,自然风干;(2)使用TEM对样品进行观察,并通过软件对颗粒进行形貌和大小分析。
2. UV-vis光谱测定(1)取胶体金溶液,使用纳米级石英池进行测量;(2) 使用紫外-可见分光光度计扫描波长范围为400-800 nm;(3)记录吸光度值和峰位。
3.DLS粒径分析(1)将胶体金溶液使用适当稀释后,使用DLS仪器测试;(2)通过光散射自相关函数得出胶体金颗粒的尺寸分布和平均粒径。
三、胶体金的应用胶体金在生物医学、环境监测、化学分析等领域有着广泛的应用。
1.生物医学领域(1)生物传感器:胶体金可以与生物分子结合,通过改变颗粒的形貌或表面等特性实现对生物分子的检测。
(2)免疫检测:利用胶体金标记的抗体或抗原可以进行免疫检测,如ELISA。
(3)药物递送:胶体金作为药物递送系统的载体,可以实现药物的靶向输送和控释。
胶体金的制备
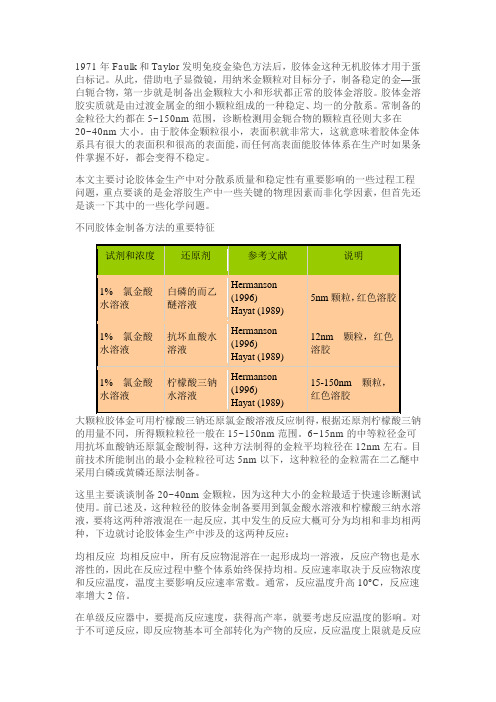
1971年Faulk和Taylor发明免疫金染色方法后,胶体金这种无机胶体才用于蛋白标记。
从此,借助电子显微镜,用纳米金颗粒对目标分子,制备稳定的金—蛋白轭合物,第一步就是制备出金颗粒大小和形状都正常的胶体金溶胶。
胶体金溶胶实质就是由过渡金属金的细小颗粒组成的一种稳定、均一的分散系。
常制备的金粒径大约都在5~150nm范围,诊断检测用金轭合物的颗粒直径则大多在20~40nm大小。
由于胶体金颗粒很小,表面积就非常大,这就意味着胶体金体系具有很大的表面积和很高的表面能,而任何高表面能胶体体系在生产时如果条件掌握不好,都会变得不稳定。
本文主要讨论胶体金生产中对分散系质量和稳定性有重要影响的一些过程工程问题,重点要谈的是金溶胶生产中一些关键的物理因素而非化学因素,但首先还是谈一下其中的一些化学问题。
不同胶体金制备方法的重要特征器材质的最高可耐受温度,就是反应器的建造温度,但对于可逆反应,温度效应则比较复杂,因为反应速度和平衡转化率都受温度影响,反应时两者必须兼顾。
对于可逆吸热反应,反应速度和平衡转化率随温度升高而增大,大量生产时常采用尽可能高的温度。
然而对于吸热可逆反应,温度升高,平衡转化率下降,反应速度却增大。
为解决这个矛盾,获得最大的反应速度和最大的转化率,通常反应过程中要变温。
传导因子如传热、传质等在均相反应中对反应动力学影响不大。
非均相反应在非均相反应体系中往往不止一相物质,反应可以在气-液、液-液、气-固、液-固、气-液-固、液-液-固或其它相态间进行,这里所讲的固相物质可以是催化剂,也可是反应物。
均相反应那些简单的控制措施对于非均相反应并不适用,除了浓度和温度外,反应物的物理相变可能在非均相反应中对反应影响极大。
氯金酸水溶液和柠檬酸三钠水溶液的反应很有趣,反应初始时是均相反应,但一分钟内反应混合物即变成了非均相,这种从均相到非均相的转变非常迅速,因此胶体的制备过程很难有效监控。
因为反应很快就已经结束,因此即使反应中发现产品不均一,操作者也根本没时间采取必要的纠偏措施。
第三节胶体金的制备方法

第三节胶体金的制备方法胶体金是一种纳米尺度的金颗粒悬浮于溶液中的胶体系统。
由于其独特的光学、电学和化学性质,胶体金在生物医学、材料科学等领域中具有广泛的应用。
本节将介绍胶体金的制备方法。
一、化学还原法化学还原法是制备胶体金的常用方法之一,通常使用水溶液中的金盐(如氯金酸盐)作为前驱体,在还原剂的作用下将金离子还原为金原子,形成胶体金。
常用的还原剂包括硼氢化钠、乙醇、维生素C等。
该方法制备的胶体金尺寸较小,粒径均匀分散,适用于大规模生产。
二、光化学法光化学法是利用光敏化合物的光解过程来制备胶体金的方法。
通常使用光敏化合物(如硝酸银)和还原剂(如柠檬酸)混合溶液,在紫外光照射下,光敏化合物发生光解反应,还原剂进一步还原产生胶体金。
该方法制备的胶体金尺寸可调控,适用于制备不同尺寸的金颗粒。
三、化学合成法化学合成法是将金离子还原为金原子,并在特定条件下控制金原子的凝聚形成胶体金颗粒。
常用的化学合成方法包括沉淀法、水热法、微乳液法等。
沉淀法将金盐与还原剂反应后,通过控制pH值、温度等条件,使金原子凝聚形成胶体金颗粒。
水热法则通过高温高压条件下金离子的还原和凝聚形成胶体金。
微乳液法则利用表面活性剂的作用,在水油两相界面形成微乳液,通过控制条件和加入还原剂,使金离子还原成金原子,形成胶体金颗粒。
四、生物法生物法是利用生物体或其产物参与胶体金的制备过程。
常用的方法包括植物提取物和微生物发酵。
植物提取物中含有诸多的活性物质,如多酚、酚类化合物等,可作为还原剂和稳定剂来制备胶体金。
微生物发酵则是利用微生物代谢产生的酶对金盐进行还原,形成胶体金。
胶体金的制备方法有多种途径,根据不同的需求可以选择合适的方法。
化学还原法是最常用的方法,具有制备简单、成本低等优点。
光化学法和化学合成法能够得到具有较窄粒径分布的胶体金颗粒,适用于需要粒径可调控的研究和应用。
生物法则是一种绿色环保的制备方法,适用于一些特殊需求的情况。
总之,不同的制备方法适用于不同的实际需求,科研人员和工程师可以根据自身需求选择合适的制备方法来获得高质量的胶体金。
胶体金(collaurum; colloidal gold)制备方法

胶体金(collaurum; colloidal gold)制备方法胶体金的制备一般采用还原法,常用的还原剂有柠檬酸钠、鞣酸、抗坏血酸、白磷、硼氢化钠等。
根据不同的还原剂可以制备大小不同的胶体金颗粒。
常用来制备胶体金颗粒的方法如下。
1、枸橼酸三钠还原法(1)10nm胶体金粒的制备:取0.01%HAuCl4水溶液100ml,加入1%枸橼酸三钠水溶液3ml,加热煮沸30min,冷却至4℃,溶液呈红色。
(2)15nm胶体金颗粒的制备:取0.01%HAuCl4水溶液100ml,加入1%枸橼酸三钠水溶液2ml,加热煮沸15min~30min,直至颜色变红。
冷却后加入0.1Mol/L K2CO30.5ml,混匀即可。
(3)15nm、18nm~20nm、30nm或50nm胶体金颗粒的制备:取0.01%HA uCl4水溶液100ml,加热煮沸。
根据需要迅速加入1%枸橼酸三钠水溶液4ml、2.5ml、1ml或0.75ml,继续煮沸约5min,出现橙红色。
这样制成的胶体金颗粒则分别为15nm、 18~20nm、30nm和50nm.2、鞣酸-枸橼酸钠还原法A液:1%HAuCl4水溶液1ml加入79ml双馏水中混匀。
B液:1%枸橼酸三钠4ml,1%鞣酸0.7ml,0.1Mol/L K2CO3液0.2ml,混合,加入双馏水至20ml.将A液、B液分别加热至60℃,在电磁搅拌下迅速将B液加入A液中,溶液变蓝,继续加热搅拌至溶液变成亮红色。
此法制得的金颗粒的直径为5nm.如需要制备其它直径的金颗粒,则按表15-1所列的数字调整鞣酸及K2CO3的用量。
表1鞣酸-枸橼酸钠还原法试剂配制表金粒直径(nm)A液B液1%HAuCl4双馏水1%枸橼酸三钠0.1Mol/LK2CO31%鞣酸双馏水517940.200.7015.101017940.0250.1015.8751517940.00250.0115.98753、柠檬酸三钠还原法制备金溶胶取0、01%氯金酸水溶液100ml 加热至沸,搅动下准确加入1%柠檬酸三钠水溶液 0.7ml,金黄色的氯金酸水溶液在2分钟内变为紫红色,继续煮沸15分钟,冷却后以蒸馏水恢复到原体积,如此制备的金溶胶其可见光区最高吸收峰在535nm,A1cm / 535 = 1.12 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胶体金免疫标记技术培训班
技术资料
胡东维洪健徐颖
浙江大学
2001年10月
一、胶体金的制备
根据不同的制备方法,可以制备出直径1-500nm的胶体金粒子,但做为免疫标记探针,其直径应在3-30nm范围内。
在氯化金(HAuCl4)水溶液中加入还原剂使之还原并聚积形成胶体金粒子。使用不同种类、不同剂量的还原剂,可以控制所产生的粒子大小。即粒子大小取决于反应溶液中最初还原试剂和还原核的数量。还原剂浓度越高,核浓度也越高,氯化金的还原也就从更多的还原中心开始,因此产生的胶体金粒子数量越多,但体积也越小。粒子直径每增加一倍,数量减少为原来的1/8。
注意:
(1)由于使用试剂质量及其它方面可能存在的误差,以及制备过程中的其它问题,胶体金粒子的大小及一致性与理论值可能有偏差,因此,在制备完成后必须进行镜检。如出现粒子体积偏差太大,粒子凝聚,粒子边缘不清晰等问题,须重新制备。
(2)胶体金溶液最好保存在4℃冰箱中;也可保存在室温下,一般可保存1-2个月。但决不可保存在0℃以下,否则金粒子发生凝聚。
利用柠檬酸为还原剂,可以制备12~150nm直径的胶体金。但制备大体积的胶体金时,胶体金粒子的误差也同时增加。因此做单标记时,建议使用该方法制备12-16nm直径的胶体金。
除了上述方法外,也可以用磷作为还原剂来制备5nm的胶体金,它避免了单宁酸残基的问题,但所形成的金粒子体积变化较大。磷易燃且有毒,制备的残液需进一步处理,故该方法已经很少使用。
氯化金极易吸湿,故一般均以小剂量密封保存(0.5g或1g),因此在配制氯化金溶液时一次配完,暂时不用的可以用1.5 ml试管分装为1ml保存(-20℃)。注意各种玻璃器皿一定要洗净并用双蒸水多次冲洗,有条件时可硅化处理(1%双氯硅烷/氯仿浸泡1小时,烘干)。配制各种试剂时均使用双蒸水,随后再用0.22m微孔滤膜过滤后使用。三角瓶可反复多次使用,不用时应密封保存,以防污染。
(3)室温下轻轻摇匀15min,然后加热沸腾并保持5min,自然冷却。
3、柠檬酸三钠法制备12-30nm胶体金(Frens, 1973)
(1)取250ml三角瓶一个,加100ml双蒸水及1ml1%氯化金,加热沸腾;
(2) 取不同量的1%柠檬酸钠加入上述溶液中。混匀,再保持沸腾30min,溶液颜色首先变黑,再逐渐变红,粒子体积较小时,溶液呈桔红色,而粒子体积较大时,则颜色偏向紫色。
当蛋白前处理完成后,接着要确定胶体金与蛋白结合的最佳pH值。对于理化性质不确定的蛋白这一步尤为重要。过量的蛋白与不同pH值得胶体金结合后,只有某一特定pH值能够形成结合最稳定的探针。在高浓度电解质(如NaCl)作用下不会凝聚。不同蛋白的适宜pH范围的宽窄大不相同。一般选择最小适宜pH值为最佳pH值。但有些探针的实际情况并不完全如此,最稳定发探针并不完全代表活性最好。这要靠实验验证。
以柠檬酸钠和单宁酸做还原剂,能够制备大小相对一致、直径3~16nm的胶体金。因此一般胶体金探针均使用该方法进行。但该方法制备的胶体金粒子直径范围较窄,而且残留的多聚单宁酸残基往往干扰某些蛋白与金粒子的结合。此时在溶液中添加0.1~0.2%的H2O2能够去除这些残基。双标记或制备5-10nm的胶体金时建议使用该方法。
胶体金探针所用蛋白必须要经过前处理,其目的在于(1)去除高浓度的盐分,高浓度的盐分往往干扰蛋白与胶体金的吸附结合,或导致胶体金粒子的凝聚,这一步往往采用低浓度缓冲液中进行。(2)使蛋白分子尽量分散为单体,冻干蛋白或高浓度蛋白溶液中蛋白分子往往凝聚为多聚体大分子,可同时与多个胶体金粒子结合,影响标记的灵敏度和定量分析。(3)使蛋白具有适当的分子量。蛋白分子量过小(30kD),形成的蛋白复合体往往是不稳定,可短时间内失活。而分子量过大时,被认为影响探针的灵敏度,特别是已知蛋白的结构与活性中心的情况下,去除对活性武影响的结构部分是提高标记灵敏度,延长探针寿命(防止凝集)的有效办法。把分子量过小的蛋白与其它蛋白(如BSA,牛血清蛋白等)结合后,能制备出稳定性更佳的探针。
二、蛋白-金复合体的制备
一般认为胶体金粒子表面为一层AuCl2,因此,粒子表面带有负电荷,这种负电荷粒子之间相互排斥,形成稳定悬浮的胶体金溶液。
金颗粒表面可以包被一层生物大分子(如蛋白)来稳定和保护这些粒子,以免受外来电解质的影响而相互凝聚在一起。胶体金粒子对蛋白的吸附作用取决于pH值,这是因蛋白的净电荷取决于溶液的pH值,在pH=pI时为中性。由于在pH=pI时蛋白溶解度最小,因此这时它水化程度最小,最溶液吸附到疏水的金粒子表面。但在实际的胶体金探针制备中,一般胶体金调整为pH=PI+0.5,这样蛋白带正电,有利于结合更稳定。
制备好的胶体金保存寿命较长,可4℃保存6个月以上或室温下保存1-2个月。当出现明显悬浮物或沉淀后表示已不可再用。但无论无何,在保存较长时间后应进行镜检,如出现大量胶体金粒子凝集,说明已经过期。
1、单宁酸/柠檬酸钠法制备3~16nm胶体金
(1)取一250 ml三角瓶,加入79ml双蒸水和1ml 1%氯化金,预热至60~70℃。
(2)取一50ml烧杯,加入4 ml 1%柠檬酸钠,然后根据所制备金粒子体积大小加入不同用量的单宁酸及等量的25mM K2CO3。预热至60~70℃。K2CO3的作用是保持溶液的中性pH。因此如果单宁酸的量少于0.5ml时,对pH的影响不大,K2CO3可以省略。
(3)将上两种溶液迅速混合并充分混匀,加热至沸并保温10分钟。自然冷却。
柠檬酸钠(ml)
单宁酸(l)
胶体金(nm)
4
5000
3
4
2000
4
4
500
6
4
120
8
4
70
10
4
10
16取250 ml三角瓶一个,加79ml双蒸水,1 ml 1%氯化金,并用0.25M K2CO3将溶液调至中性(pH7.0)。
(2)取0.2ml饱和磷/乙醚溶液加到1.5ml试管中,再加0.8ml乙醚,混匀。取0.7ml加入溶液(1)中(磷有毒且易燃,操作请带手套,多余的磷溶液用CuSO4进行中和)。
