培养基配制原始记录(成品)
微生物实验室规范指导原则

三、培养基的贮藏
商品化培养基应根据使用说明书上的要 求进行储存。
所采用的保藏和运输条件应使培养基最 低限度失去水分并提供机械保护。
自配培养基应标记培养基的名称、批号、 配置日期并在验证的条件下储存。
1、不得储藏在高压菌器中。
2 、制备好的培养基应保存在2~25℃、 避光的环境。
3 、保存于密闭容器中,可防止水分流失 以延长保存时间。
试验结果的判断
一、影响试验结果的因素 ⑴活微生物 ⑵受到外界影响因素较
实验结果分析与评价
1、对实验结果进行充分的分析和全面的评 价是十分重要的。
分析内容
⑴实验室环境 ⑵抽样区的防护条件 ⑶样品本身对微生物是否具毒性 ⑷实验操作是否规范
2、如果依据分析调查结果发现,试验
全过程中任何一个环节有错误,可判实 验结果无效,如果需要,重新抽样复试.
谢谢,再见!
4、培养基的有效期-是指已通过促生长 试验的培养基在整个有效期内均需符合 这些相应的标准。
5、对配制培养基的过程作详细的记录。
常用菌种管理和保存
菌种的保存
微生物实验过程中,实验菌株可能是最 敏感的,因为它们的生物活性和特性依 赖于合适的试验操作和贮藏条件。
菌种的保存和处理
1、实验室菌种的处理和保藏的程序应标 准化,使尽可能减少菌种污染和生长特性 的改变。
微生物实验室规范指导原则
影响药品微生物的检验结果的因素
1、实验人员在取样或试验过程中污染微生 微。
2 、生物学分析方法本身的误差。 3 、样品中或环境中微生物分布不均匀等因
素在药品检验中,为保证微生物试验数据 的可靠性和重现性,药品微生物实验室必 须使用经验证的检测方法并按良好的实验 室规范指导试验。
乳酸菌检验原始记录

乳酸菌检验原始记录(平板计数法)4结果表述1 .若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g(m1)样品中菌落总数结果。
2 .若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(1)计算。
N= --------------------(.+o.ι%)d式中:N一一样品中菌落数;ΣC——平板(含适宜范围菌落数的平板)菌落数之和;nι一一第一稀释度(低稀释倍数)平板个数;n2一一第二稀释度(高稀释倍数)平板个数;d——稀释因子(第一稀释度)。
3 .若所有稀释度的平板上菌落数均大于300CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
4 .若所有稀释度的平板菌落数均小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
5 .若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
6 .若所有稀释度的平板菌落数均不在30CFU-300CFU之间,其中一部分小于30CFU或大于300CFU时,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
计算过程:方法复核日期报告1 .菌落总数小于Ioe)CFU时,按“四舍五入”原则修约,以整数报告。
2 .菌落总数大于或等于100CFU时,第3位数字采用“四舍五入”原则修约后,采用前2位数字,后面用。
代替位数;也可用10的指数形式来表示,按“四舍五人”原则修约后,采用两位有效数字。
3 .称重取样以CFU/g为单位报告,体积取样以CF∪∕m1为单位报告。
报告人报告日期复核人。
微生物实验室规范指导原则

谢谢,再见!
试验结果的判断
一、影响试验结果的因素 ⑴活微生物 ⑵受到外界影响因素较
实验结果分析与评价
1、对实验结果进行充分的分析和全面的评 价是十分重要的。
分析内容
⑴实验室环境 ⑵抽样区的防护条件 ⑶样品本身对微生物是否具毒性 ⑷实验操作是否规范
2、如果依据分析调查结果发现,试验
全过程中任何一个环节有错误,可判实 验结果无效,如果需要,重新抽样复试.
重要的仪器设备,应由专人负责,保证
其运行状态正常和受控,同时应有相应 的备用设备以保证试验菌株和微生物培 养的连续性.
3、对于一些容易污染微生物的仪器设 备 、无菌器具应有明确标识及标准的操 作规程。
记录
规范化管理 记录档案将充分证明试验规范化和检验结 果的真实性。包括以下几个方面: 1、试验人员 2、试验设备 3、培养基及稀释液 4 、试验操作程序
无菌室布局
无菌室应远离交通干道、厕所及污染区,应
选上、下水道及其他安装适宜的位置。无菌室的 配套设施包括洗刷、培养基配制、消毒灭菌、灭 菌物品存放和传输、培养间、结果观察、试验菌 实验和办公室等,要集中,减少污染,便于管理 和使用。
微生物实验室的规划
实验室应划分成洁净区、无菌区和培养区 等。
药品微生物检验的实验室应符合《中国药典》无 菌检查、微生物限度检查试验环境的要求
4、培养基的有效期-是指已通过促生长 试验的培养基在整个有效期内均需符合 这些相应的标准。
5、对配制培养基的过程作详细的记录。
常用菌种管理和保存
菌种的保存
微生物实验过程中,实验菌株可能是最 敏感的,因为它们的生物活性和特性依 赖于合适的试验操作和贮藏条件。
菌种的保存和处理
1、实验室菌种的处理和保藏的程序应标 准化,使尽可能减少菌种污染和生长特性 的改变。
培养基配制原始记录

培养基配制原始记录日期:_________实验室:_________培养基名称:_________配制人:_________复核人:_________实验室设备和试剂:1.电子天平2.pH计3.明胶粉4.葡萄糖5.维生素B16.纯水步骤:1.准备工作:a.清洗实验室设备,确保干净无菌。
b.准备所需试剂,确保其纯度和质量。
c.检查实验室设备的工作状态。
2.配制明胶溶液:a.称取10克明胶粉。
b.加入1000毫升蒸馏水,搅拌溶解。
c.用0.2微米的过滤器过滤溶液,以除去杂质。
d.得到pH为7.4的明胶溶液。
3.配制葡萄糖溶液:a.称取10克葡萄糖。
b.加入1000毫升蒸馏水,搅拌溶解。
c.用0.2微米的过滤器过滤溶液,以除去杂质。
d.得到pH为7.2的葡萄糖溶液。
4.维生素B1配制:a.取1克维生素B1b.加入100毫升蒸馏水,搅拌溶解。
c.用0.2微米的过滤器过滤溶液,以除去杂质。
d.得到维生素B1水溶液。
5.配制培养基:a.取明胶溶液10毫升,葡萄糖溶液10毫升,维生素B1水溶液1毫升,加入1000毫升蒸馏水,搅拌混合。
b.用0.2微米的过滤器过滤溶液,以除去杂质。
c.得到最终pH为7.0的培养基。
6.复核记录:a.复核人核对实验室设备和试剂的使用情况和质量。
b.复核人核对培养基配制的步骤和结果,确保无误。
备注:-配制过程中所有操作需在无菌条件下进行。
-配制得到的培养基应保存在无菌密封容器中,避免阳光直射。
-配制的培养基需在规定时间内使用,避免菌落污染。
-配制记录需保存至少3个月作为备案。
微生物检验记录表
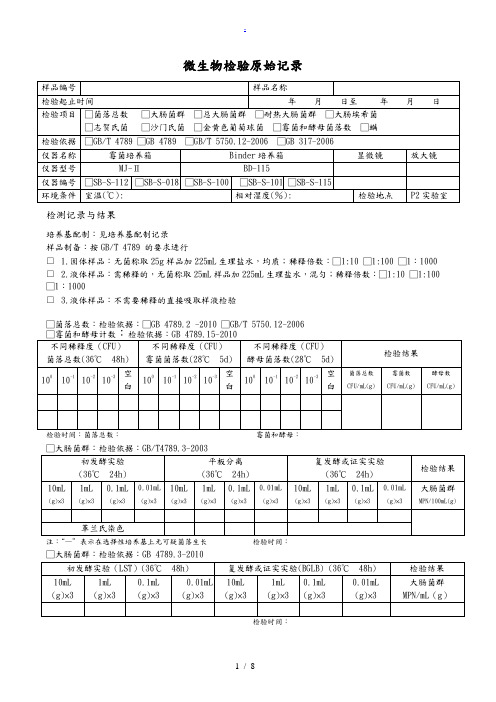
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
检验时间:
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
培养基和试剂技术性验收原始记录

培养基和试剂技术性验收原始记录
生产厂商
编号/批号
生产日期
有效期
数量
接收日期
接收文件 感官判断
□企业文件 □合格证明 □外包装完整 □粉末 □均匀 □色泽 □其他
检测日期
技术验收 □GB 4789.28-2013
判断依据 □
□标识清楚 □密封完好
□颗粒
□液态
□选择性 □非选择性
对照GB 4789.28-2013表E
备注
检验员:
复核:
□固体培养基 培养基类型 □液体培养基
□试剂 □其他
目标菌:
划16线G= 形状: 直径: □稠密 □稀疏
验收结果 非目标菌:
划6线G= 形状: 直径: □稠密 □稀疏
标准限值 G1≥6 G2≤1
验收结论
不合格 处理方法
□合格 □不合格
目测浊度值: □0 澄清 □1 略浊 □2 混浊 □接种生长良好
目测浊度值: □0 澄清 □1 略浊 □2 混浊 □接种生长良好
培养基的配制
介质准备1准备水介质大多是水,水质的好坏直接影响到介质的质量。
根据waymouth标准,水的电阻应为200万欧姆双蒸或三蒸可满足使用条件。
2中等有两种媒介,自然的和人工的。
实验室一般采用RPMI-1640粉末介质,由双蒸汽或三蒸汽水配制而成。
当NaHCO3(或HCl)的pH值调整到7.2-7.4时,如果pH值高于7.6或远低于6.8,大多数细胞将无法生长。
RPMI-1640不耐高压灭菌,使用前需用0.22μm孔隙过滤器过滤。
三。
血清培养常用小牛血清(或胎牛血清)。
血清不能高压灭菌。
血清应在56°C的冰箱中消毒30分钟。
在制备过程中,其含量取决于培养细胞的类型和时间,通常为10-15%。
由于血清成分的复杂性和控制条件的困难,可以选择无血清培养基。
4抗生素为了防止培养过程中的细菌污染,可以在培养基中加入适当的抗生素。
一般剂量与组织培养相同:卡那霉素100单位/ml,或双抗青霉素100单位/ml,链霉素100μg/ml。
5植物血凝素(PHA)非增殖细胞不能产生染色体,如人外周血淋巴细胞,但在PHA的作用下,可刺激其转化为淋巴细胞,进入体外有丝分裂。
培养后有丝分裂高峰分别为44~48h和68~72h。
PHA有两个重要成分:粘多糖和蛋白质。
粘多糖促进有丝分裂和蛋白质聚集。
PHA激活的细胞数量随着PHA浓度的增加而增加,直至所有具有免疫功能的细胞被激活但是,如果PHA浓度过高,会引起凝集。
基本制备方法介质配方的选择在不同的作品中,同一介质的配方往往不同。
因此,除采用标准方法外,还应严格按照其规定进行制备。
一般情况下,应尽可能收集、比较和核对相关信息,然后根据使用目的进行选择,并记录其来源。
培养基配制记录每种培养基的制备应记录在案,包括培养基的名称、配方和来源,以及各种成分的商标。
应复制最终pH值、灭菌温度和时间、制备日期和制备者。
原始记录应保存备查。
重复记录应与准备好的介质一起保存,以防混淆。
称取中等分量的配料必须准确称量介质的成分,并注意防止混淆。
微生物检测原始记录表(无菌检查)
标准菌种名称及编号
代数 菌液浓度(CFU/mL)
标准菌种名称及编号
代数
菌液浓度(CFU/mL)
培养基性能检查
方法适用性试验
供试品无菌检查
金黄色葡萄球菌 ATCC6538
3
□大肠埃希氏菌
培养周期(天)
1
FT ( 33℃ )
金黄色葡萄球菌
-
1
2
-
无菌试验用真菌培 养基( 23℃)
白色念珠菌 1 -
2
-
无菌试验用真菌培养基(白色念珠菌+ 供试品)
+
+
+
+
+
/
/
生长良好
无菌试验用真菌培养基(
)
/
/
/
无菌试验用真菌培养基(
)
/
/
/
FT(
*** )
--------------
/
/
无菌生长
FT (金黄色葡萄球菌+供试品)
+++++
/
/
生长良好
FT (
)
/
/
/
FT (
)
/
/
/阴性对照组ຫໍສະໝຸດ 果:阴性阳性对照组结果:阳性
受控编号: 检验日期
委托单编号 检测项目
培养基试剂批号 仪器及编号 样品前处理
测试菌种
测试项目
培养基性能检验
培养基无菌检查 阴性对照组
(0.85%无菌生理盐 水)
阳性对照组 (金黄色葡萄球菌)
供试品组
测试成立判断条件 中和剂配方 备注
微生物检测原始记录表(无菌检查)
微生物检验记录表
微生物检验原始记录样品编号样品名称检验起止时间年月日至年月日检验项目□菌落总数□大肠菌群□总大肠菌群□耐热大肠菌群□大肠埃希菌□志贺氏菌□沙门氏菌□金黄色葡萄球菌□霉菌和酵母菌落数□螨检验依据□ GB/T 4789□ GB 4789□GB/T 5750.12-2006□ GB 317-2006仪器名称霉菌培养箱Binder培养箱显微镜放大镜仪器型号MJ-ⅡBD-115仪器编号□ SB-S-112□SB-S-018□ SB-S-100 □ SB-S-101 □ SB-S-115环境条件室温 ( ℃):相对湿度 ( %):检验地点P2 实验室检测记录与结果培养基配制:见培养基配制记录样品制备:按 GB/T 4789的要求进行□ 1. 固体样品:无菌称取25g 样品加 225mL生理盐水,均质;稀释倍数:□1:10□ 1:100 □ 1:1000□ 2. 液体样品:需稀释的,无菌称取25mL样品加 225mL生理盐水,混匀;稀释倍数:□ 1:10□ 1:100□1: 1000□ 3. 液体样品:不需要稀释的直接吸取样液检验□菌落总数:检验依据:□GB 4789.2 -2010 □ GB/T 5750.12-2006□霉菌和酵母计数:检验依据: GB 4789.15-2010不同稀释度( CFU)不同稀释度( CFU)不同稀释度( CFU)菌落总数 (36 ℃ 48h)霉菌菌落数 (28 ℃ 5d)检验结果酵母菌落数 (28 ℃ 5d)10010-110-210-3空10010-1 10-210-3空10010-110-210-3空白白白菌落总数霉菌数酵母数CFU/mL(g)CFU/mL(g)CFU/mL(g)检验时间:菌落总数:霉菌和酵母:□大肠菌群:检验依据:GB/T4789.3-2003初发酵实验平板分离复发酵或证实实验检验结果(36 ℃ 24h)(36 ℃ 24h)(36 ℃ 24h)10mL1mL0.1mL0.01mL10mL1mL0.1mL0.01mL10mL1mL0.1mL0.01mL大肠菌群(g) × 3(g) ×3(g) ×3(g) × 3(g) ×3(g) × 3(g) × 3(g) ×3(g) ×3(g) ×3(g) ×3(g) ×3MPN/100mL(g)革兰氏染色注:“—”表示在选择性培养基上无可疑菌落生长检验时间:□大肠菌群:检验依据:GB 4789.3-2010初发酵实验( LST) (36 ℃ 48h)复发酵或证实实验 (BGLB) (36℃ 48h)检验结果10mL1mL0.1mL0.01mL10mL1mL0.1mL0.01mL大肠菌群(g) × 3(g) × 3(g) × 3(g) × 3(g) × 3(g) × 3(g) × 3(g) × 3MPN/mL( g)检验时间:□总大肠菌群:检验依据: GB/T 5750.12-2006初发酵 (36 ℃ 24h)平板分离 (36℃ 24h)证实实验 (36℃ 24h)检验结果报告结果10mL1mL0.1mL10mL1mL0.1mL10mL1mL0.1mL大肠菌群大肠菌群×5× 5× 5× 5×5× 5× 5×5×5MPN/100mL MPN/100mL革兰氏染色注:“—”表示在选择性培养基上无可疑菌落生长检验时间:□耐热大肠菌群:检验依据: GB/T 5750.12-2006初发酵 (36 ℃ 24h)EC (44.5 ℃ 24h)证实实验 (44.5 ℃ 24h)检验结果报告结果10mL1mL0.1mL10mL1mL0.1mL10mL1mL0.1mL耐热大肠菌群耐热大肠菌群× 5× 5× 5× 5× 5× 5× 5× 5×5MPN/100mL MPN/100mL注:“—”表示在选择性培养基上无可疑菌落生长检验时间:□大肠埃希氏菌:检验依据:GB/T 5750.12-2006初发酵实验 (36 ℃ 24h)EC-MUG(44.5℃ 24h)( 紫外灯 366mn)检验结果报告结果10mL1mL0.1mL10mL1mL0.1mL大肠埃希氏菌大肠埃希氏菌× 5× 5× 5×5× 5× 5MPN/100mL MPN/100mL检验时间:□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌检验依据:□ GB 4789.4-2010 □ GB 4789.5-2012 □ GB 4789.10-2010被检致病菌增菌液培养温度 ( ℃) 时间 (h)选择性培养基菌落特征沙门氏菌□ BPW368~ 18--------------------------□ SC368~ 24□BS □HE □XLD□ TTB428~ 24□BS □HE □XLD志贺氏菌□ 志贺氏菌増菌肉汤41.5 ±1 16 ~20 厌氧培养□XLD □MAC □显色金黄色葡萄球菌□ 7.5 %Nacl 肉汤368~ 24□B-P □血平板注:“—”表示在选择性培养基上无可疑菌落生长检验时间:三糖铁吲哚赖氨酸脱羟酶尿素酶氰化钾甘露醇山梨醇ONPG血清学鉴定沙门氏菌三糖铁半固体营养琼脂尿素懒氨酸脱羟酶 ODC 水杨苷七叶苷西蒙氏柠檬酸盐葡萄糖铵粘液酸盐氧化酶革兰氏染色血清学鉴定志贺氏菌革兰氏染色镜检血浆凝固酶试验金黄色葡萄球菌沙门氏菌志贺氏菌金黄色葡萄球菌检验结果注: ODC:鸟氨酸脱羟酶K :产碱,培养基变紫红色;A:产酸,培养基变黄色;+:阳性;—:阴性□螨:检验依据GB 317.4-.10-2006取样量( g)结果检测人:复核人:检品名称样品来源培养基及批号供试品溶液制备检验项目培养时间菌落数平均值结果检验项目供试品阳性对照阴性对照结果检验项目供试品微生物限度检验记录(复合膜)批号检品编号检验日期报告日期胰酪大豆胨琼脂培养基沙氏葡萄糖琼脂培养基胰酪大豆胨液体培养基麦康凯液体培养基麦康凯琼脂培养基甘露醇氯化钠琼脂培养基pH7.0 氯化钠 -蛋白胨缓冲液溴化十六烷基三甲铵琼脂培养基取供试品,用开孔面积为20cm2的消毒过的金属模板压在内层面上,将无菌棉签用氯化钠注射液稍蘸湿,在板孔范围内擦抹 5 次,换 1 支棉签再擦抹 5 次,每个位置 2 支棉签共擦抹10 次,共擦抹 5 个位置100cm2。
培养基的制备实验报告
培养基的制备实验报告篇一:《培养基的制备与消毒灭菌》实验报告《培养基的制备与消毒灭菌》实验报告实验目的1.学习和掌握配制培养基(以牛肉膏蛋白胨培养基的配制为例)的一般方法和原理。
2.了解消毒和灭菌的原理,掌握常用灭菌方法的操作步骤。
实验原理培养基是人工配制的适合微生物生长繁殖或积累代谢产物的营养基质,用以培养、分离、鉴定、保存各种微生物或积累代谢产物。
在自然界中.微生物种类繁多,营养类型多样,加之实验和研究的目的不同,所以培养基的种类很多。
但是,不同种类的培养基中,一般应含有水分、碳源、氮源、能源、无机盐、生长因素等。
不同微生物对PH要求不一样.雷菌和酵母的培养基的pH一般是偏酸性的,而细菌和放线菌的培养基的pH一般为中性或微碱性的(嗜碱细菌和嗜酸细菌例外)。
所以配制培养基时,都要根据不同微生物的要求将培养基的pH调到合适的范围。
此外,由于配制培养的各类营养物质和容器等含有各种微生物,因此,已配制好的培养基必须立即灭菌.如果来不及灭菌,应暂存冰箱内,以防止其中的微生物生长繁殖而消耗养分和改变培养的酸碱度所带来不利的影响。
高压蒸气灭菌是将持灭菌的物品放在一个密闭的加压灭菌锅内,通过加热,使灭菌锅套间的水沸腾而产生蒸气。
待水蒸气急剧地将锅内的冷空气从排气阀中驱尽,然后关闭排气阀.继续加热,此时由于蒸气不能道出,而增加了灭菌器内的压力,从而使沸点增高,得到高于100℃的温度。
导致菌体蛋白质凝固变性而达到灭菌的目的。
牛肉膏蛋白胨培养基是一种应用最广泛和最普通的细菌基础培养基,有时又称为普通培养基。
由于这种培养基中含有一般细菌生长繁殖所需要的最基本的营养物质,所以可供作微生物生长繁殖之用。
基础培养基含有牛肉膏、蛋白胨和NaCl。
其中牛肉膏为微生物提供碳源、能源、磷酸盐和维生素,蛋白胨主要提供氮源和维生素,而NaCl提供无机盐。
在配制固体培养基时还要加入一定量琼脂作凝固剂,琼脂在常用浓度下96℃时溶化,实际应用时,一般在沸水浴中或下而垫以石棉网煮沸溶化,以免琼脂烧焦。
