涉及晶胞的有关计算
晶体密度、空间利用率的通用计算方法
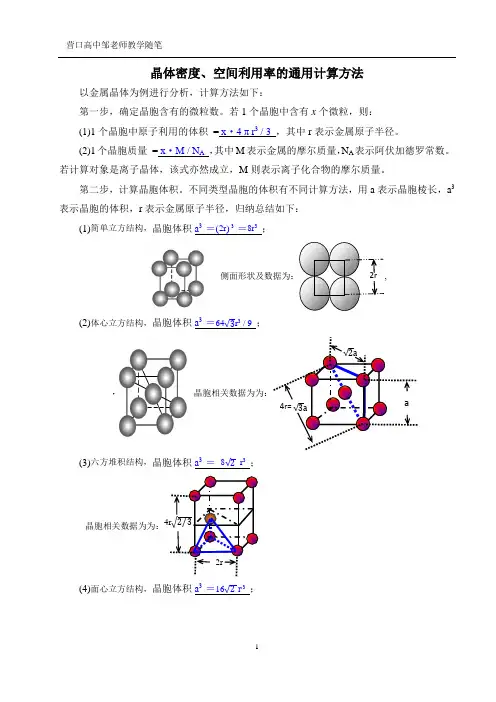
晶体密度、空间利用率的通用计算方法以金属晶体为例进行分析,计算方法如下:第一步,确定晶胞含有的微粒数。
若1个晶胞中含有x 个微粒,则: (1)1个晶胞中原子利用的体积 = x ·4 π r 3 / 3 ,其中r 表示金属原子半径。
(2)1个晶胞质量 = x ·M / N A ,其中M 表示金属的摩尔质量,N A 表示阿伏加德罗常数。
若计算对象是离子晶体,该式亦然成立,M 则表示离子化合物的摩尔质量。
第二步,计算晶胞体积。
不同类型晶胞的体积有不同计算方法,用a 表示晶胞棱长,a 3表示晶胞的体积,r 表示金属原子半径,归纳总结如下:(1)简单立方结构,晶胞体积a 3 =(2r ) 3 =8r 3 ;侧面形状及数据为:,(2)体心立方结构,晶胞体积a 3 =64√3r 3 / 9 ;(3)六方堆积结构,晶胞体积a 3 = 8√2 r 3 ;晶胞相关数据为为:(4)面心立方结构,晶胞体积a 3 =16√2 r 3 ;a√2a√3a4r= 2r(1)有关晶体密度的计算通用关系式:x·M /N A=ρ·a3,依据是晶体密度等于晶胞密度,具体计算时把各类型晶胞的体积,代入关系式即可,下式亦同。
(2)有关空间利用率的计算通用关系式:x·4 πr3 / 3=w%·a3,其中w% 表示晶胞空间利用率。
注意事项:(1)在实际计算时要注意长度单位换算,晶胞棱长及原子半径单位常用pm,而密度中的体体积单位常用(cm)3,存在换算关系1pm=10-10cm。
(2)若计算离子晶体密度,方法大同小异,需要综合考虑阴、阳离子半径来求晶胞体积。
常见金属晶胞结构与性质归纳一览表:。
3.1.2晶胞的有关计算++课件

长a;金的密度钾的密度ρ。
①立方体对角线=4r
体 心 立
棱长 a 4r 3
方
②密度
紧
密
堆
积
2.如图是Fe单质的晶胞模型。已知晶体密度为d g·cm-3,铁原子的半径为__4_3_×__3__d_1·_1N_2A__ _×__1_0_7 _nm(用含有d、NA的代数式表示)。
知识梳理
3. 配位数的计算
二、晶胞中粒子配位数计算
5.硅化镁是一种窄带隙n型半导体材料,在光电子器件、能源 器件、激光、半导体制造等领域具有重要应用前景。硅化镁 的晶胞参数a=0.639 1 nm,属于面心立方晶胞,结构如图所 示。Si原子的配位数为__8___。
根据晶胞结构,以面心Si原子为基准,同一晶胞内等距离且最近的Mg原子有4个, 紧邻晶胞还有4个Mg原子,共8个,故Si原子的配位数为8。
1 1/2 水平1/4 竖1/3 1/6
体心 1 面心 1/2 棱边 水平1/4 竖1/6 顶点 1/12
知识梳理
2. 晶胞边长、粒子间距、晶体密度的计算
知识梳理 晶体(晶胞)密度计算 (立方晶胞)
(1)思维流程
(2)计算公式
①先确定一个晶胞中微粒个数N(均摊法)
②再确定一个晶胞中微粒的总质量
③最后求晶胞的密度
配位数
一个粒子周围最邻近且等距离的的粒子数称为配位数
离子晶体的配位数: 指一个离子周围最接近且等距离的异种电性离子的数目。
简单立方:配位数为6
面心立方:配位数为12
体心立方:配位数为8
离子晶体的配位数 以NaCl晶体为例
①找一个与其他粒子连接情况最清晰的粒子,如右图中 心的黑球(Cl-)。 ②数一下与该粒子周围距离最近的粒子数,如右图标数 字的面心白球(Na+)。确定Cl-的配位数为6,同样方法 可确定Na+的配位数也为6。
有关晶体的各类计算

有关晶体的各类计算晶体是由原子、分子或离子按照一定的规则排列组成的固体物质。
晶体的结构和性质可以通过各种计算方法进行研究和预测。
本文将介绍晶体的各类计算方法,包括晶胞参数计算、电子结构计算和晶格动力学计算等。
一、晶胞参数计算方法晶胞参数是描述晶体结构的基本参数,包括晶胞长度、晶胞角度等。
晶胞参数计算方法主要分为实验方法和理论方法两类。
1.实验方法:通过实验手段确定晶胞参数,包括X射线衍射、中子衍射、电子衍射等技术。
这些技术可以通过测量晶体的衍射角度和强度,来反推晶体的晶胞参数。
例如,通过X射线衍射技术可以得到晶胞的长度和角度信息,然后利用几何学和晶体学理论进行分析计算。
2. 理论方法:通过理论计算手段预测晶胞参数,包括密度泛函理论(DFT)、分子力学方法、量子力学方法等。
这些方法可以从晶胞的能量最小化和最优结构寻找中确定晶胞参数。
密度泛函理论是一种基于电子密度的计算方法,可以通过求解Kohn-Sham方程得到晶体的基态电子结构和晶胞参数。
分子力学方法则将晶体中的原子看作经典力学粒子,通过经典力学力场计算得到晶体的能量和结构。
二、电子结构计算方法电子结构是指描述晶体中电子的运动状态和能量分布的理论框架。
电子结构计算方法可以通过计算分子轨道、能带结构和态密度等参数来描述晶体的电子性质。
1. 密度泛函理论(DFT):DFT是一种基于电子密度的计算方法,可以精确计算晶胞中的电子结构和物理性质。
DFT方法通过求解Kohn-Sham 方程,得到晶体的基态电子密度和能量。
然后可以通过电子密度计算组态关联能、原子电荷分布、态密度和光谱等电子性质指标。
2. 分子轨道方法:分子轨道方法将晶体中的电子看作在分子轨道上运动,通过求解电子的分子轨道波函数,可以得到晶体的基态电子结构和反应性。
常用的分子轨道方法有Hückel方法、扩展Hückel方法、Hartree-Fock方法等。
这些方法对于大尺寸的晶体模型计算较耗时,但适用于分子结构的预测和反应物和产物的性质计算。
晶胞中的数学知识与计算

顶点投影------仍在顶点 面心投影-----在面心或棱上 体心投影-----面心
顶点投影------仍在顶点 体心投影-----面心
晶胞延体对角线方向投影图特征总结
金刚石晶胞图
金刚石体对角线方向投影图
6个顶点投影------在大六边形顶点 3个面心+3个小体心投影(另3个面心在3个小体心背后遮挡)-----在小六边形间隔3个顶点上 2个顶点+1个小体心投影-----在六边形中心(1个小体心+1个顶点被遮挡)
金刚石晶胞图
金刚石坐标轴方向投影图
金刚石体对角线方向投影图
黄金晶胞图
面心立方坐标轴方向投影图 面心立方体对角线方向投影图
铁晶胞图
体心立方坐标轴方向投影图 体心立方体对角线方向投影图
晶胞延坐标轴方向投影图特征总结
顶点投影------仍在顶点 面心投影-----在面心或棱上 小体心投影-----小正方形面心2、黄金晶胞图来自原子相切关系 配位数12
面心立方晶胞原子半径求法、空间占有率求解
1、根据面对角线求r球: 2、空间占有率=V球总/V立方体
3、铁晶胞图
原子相切关系 配位数8
体心立方晶胞原子半径求法、空间占有率求解
1、根据体对角线求r球: 2、空间占有率=V球总/V立方体
三、常见晶胞中原子投影:
晶胞中的数学知识与计算
一、晶胞中原子常见位置分析:
原子常见位置 顶点 面心 棱心
大体心 小体心
两种常见小体心位置关系
二、常见晶胞原子相切关系及空间利用率计算:
1、金刚石晶胞图
原子相切关系 配位数4
金刚石型晶胞原子半径求法、空间占有率求解
1、根据体对角线求r球: 2、空间占有率=V球总/V立方体
晶胞计算专题

3
V晶胞 s 2h 2
3r2 2 2 6 r 8 3
Байду номын сангаас
2r3
空间利用率= V微粒100%
V晶胞
2 4 r3
3 100% 8 2r3
=74%
【堆积方式及性质小结】
堆积方式 晶胞类型 空间利 配位数 用率
实例
简单立方 简单立方 堆积 体心立方 体心立方 密堆积 六方最密 六方 堆积 面心立方 面心立方 最密堆积
晶胞计算 ---密度、空间利用率
1.会计算晶胞中的粒子数 2.掌握晶胞中各线段的关系,结合数学 思想解决密度和空间占有率计算的问题
立方晶胞中各线段之间的关系如下:
V=a3
一、晶胞密度的求算 1、已知金属金是面心立方最密堆积,金原 子半径为r cm,计算:金晶胞棱长;金的密 度。 ①面对角线 = 4r
52% 68% 74% 74%
6
Po
8
Na、K、Fe
12 Mg、Zn、Ti 12 Cu、Ag、Au
练习:已知铜晶胞是面心立方晶胞,该晶胞的边 长为3.6210-10m,每一个铜原子的质量为 1.05510-25kg ,试回答下列问题:
(1)一个晶胞中“实际”拥有的铜原子数是多少? (2)该晶胞的体积是多大? (3)利用以上结果计算金属铜的密度。
4 58.5g
mol1 N A (2acm)3
mol1
29.25 a3 NA
g cm3
5.如图所示,CsCl晶体中最近的Cs+之间距 离为s阿伏加德罗常数为NA摩尔质量为M
求晶体的密度
二、 晶胞中空间利用率的计算
微粒数×1个微粒体积
空间利用率=
晶胞体积
(1)简单立方:
高中化学选择性必修二 第3章 微专题五 晶胞的有关计算

晶胞所含粒子的体积
晶胞的空间利用率= 晶胞的体积
×100%。
例 (1)镧系合金是稀土系储氢合金的典型代表, 由荷兰菲利浦实验室首先研制出来。它的最大优 点是容易活化。其晶胞结构如图所示: 则它的化学式为__L_a_N_i_5 _。
解析 根据晶胞结构图可知,晶面上的原子为2个晶胞所共有,顶角上 的原子为6个晶胞所共有,内部的原子为整个晶胞所共有,所以晶胞中 La原子个数为3,Ni原子个数为15,则镧系合金的化学式为LaNi5。
123
3.金属钾、铜的晶体的晶胞结构如图(请先判断对应的图)所示,钾、铜两 种晶体晶胞中金属原子的配位数之比为_2_∶__3_。金属钾的晶胞中,若设该 晶胞的密度为a,阿伏加德罗常数的值为NA,钾原子的摩尔质量为M,则
3
3 2M 表示钾原子半径的计算式为__4____a_N_A__。
123
解析 钾采用体心立方密堆积,铜采用面心立方最密堆积,故 A 为钾晶体晶胞,
(2)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位
置,如图为Ge单晶的晶胞,其中原子坐标参数A 为(0,0,0); B为(12,0,12);C为(12,12,0)。 则D原子的坐标参数为_(_14_,__14_,__14_) _。
解析 对照晶胞图示、坐标系以及A、B、C点坐标,选A点为参照点,
3
C.
2NA ρM
cm
3
M D. 8ρNA cm源自123解析 设该立方体晶胞的边长为 a cm,依题意可知:NMAa×3 4=ρ,解得 a
3
= ρ4NMA,而在晶胞中每个 Na+和与之等距且最近的钠离子之间的距离为
2 2a
cm,故
B
项正确。
晶胞的相关计算
晶胞的有关计算:体积、微粒数、晶体密度一、如何利用晶胞参数计算晶胞体积?平行六面体的几何特征可用边长关系和夹角关系确定。
布拉维晶胞的边长与夹角叫做晶胞参数。
共有7种不同几何特征的三维晶胞,称为布拉维系,它们的名称、英文名称、符号及几何特征如下:立方cubic(c)a=b=c,α=β=γ=90°,(只有一个晶胞参数a)四方tetragonal(t)a=b≠c,α=β=γ=90°,(有2个晶胞参数a 和c)六方hexagonal(h)a=b≠c,α=β=90°,γ=120°,(有2个晶胞参数a 和c)正交orthorhombic(o)a≠b≠c,α=γ=90°,(有3个晶胞参数a,b 和c)单斜monoclinic(m)a≠b≠c,α=γ=90°,β≠90°,(有4个晶胞参数a,b,c 和β) 三斜anorthic(a)a≠b≠c,α≠β≠γ,(有6个晶胞参数a,b,c,α,β和γ)菱方rhombohedral(R)a=b=c,α=β=γ≠90°,(有2个晶胞参数a 和α)六方a^2Xcsin120正交V=abc单斜V=abcsin β三斜V=abc(1-cos2α-cos2β-cos2γ+2cos αcos βcos γ)菱方V=a^3(1-3cos2α+2(cos α)^3)二、均摊法---计算晶胞中的粒子数位于晶胞顶点的微粒,实际提供给晶胞的只有1/8;位于晶胞棱边的微粒,实际提供给晶胞的只有1/4;位于晶胞面心的微粒,实际提供给晶胞的只有1/2;位于晶胞中心的微粒,实际提供给晶胞的只有1.三、晶胞的密度计算1) 利用晶胞参数可计算晶胞体积(V),根据相对分子质量(M)、晶胞中粒子数(Z)和阿伏伽德罗NA ,可计算晶体的密度ρ:V N MZ A =ρ。
晶胞的有关计算
M Z NA V
注意:单位的换算
V-晶胞体积 M-相对分子质量 Z-晶胞中粒子数 NA-阿伏伽德罗常数
例3、金晶体的晶胞是面心立方晶胞,金原子的 直径为d,用NA表示阿伏加德罗常数,M表示金 的摩尔质量。
(1)一个晶胞的体积是多少?
2d
(2)金晶体的密度是多少?
各面对角线上的三个球两两相切
a
(1)设晶胞边长为a,则有a2+a2=(2d)2,即a= 2d
___ pm(列出计算式即可)。(已知D是S,E是Zn) 2 3 4 97 1010
2 NA
(5)空间利用率的计算
空间利用率:指构成晶体的微粒在整个晶体空间中所
占有的体积百分比。
空间利用率
=
球体积 晶胞体积 100%
例5:计算体心立方晶胞中金属原子的空间利用率。
2 4 r3 2 4 ( 3 a)3
祝同学们: 祝学同习学进们步:!金榜题金名榜!题名!
再 见 再见
÷(565.76×10-10cm)3=
g•cm-3。
(6)晶胞有两个基本要素:①原子坐标参数,表示
晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,
其中原子坐标参数A为(0,0,0);B为( ,0, );
C为 ( , ,0 )。则D原子的坐标参数为
(4)原子坐标参数的确定
。 ( 1 ,1,1) 44 4
练习1:
原子D与E所形成化合物晶体的 晶胞如图所示。
① 在该晶胞中,E的配位数为__4____。
② 原子坐标参数可表示晶胞内部各原子的相对位置。 右图晶胞中,原子坐标参数a为(0,0,0);b为( ,0, )
C为( , ,0 )。则d原子的坐标参数为(__0__,___,__)。
例谈有关晶胞的计算类型与方法
例谈有关晶胞的计算类型与方法晶胞是微小的三维结构,由像水晶一样的互相连接的各种原子构成,它们可以存储和传递信息,并帮助我们更好地理解世界。
此外,晶胞的计算功能可以用于支持研究和应用。
近年来,随着计算机科学与技术的发展,晶体计算类型与方法在科学和工程领域得到越来越多的关注。
一、晶体计算类型晶体计算是指使用原子加成等晶体力学的方法来研究微细的物理和化学系统的计算方法,晶体计算类型可以分为两大类:传统的晶体计算和新型的晶体计算。
1、传统的晶体计算传统的晶体计算通常采用分子动力学,量子化学和其他类似技术来描述晶体结构,以及晶体与环境之间的相互作用。
可视化技术也被用于模拟晶体结构,以及对晶体结构进行力学分析。
2、新型的晶体计算新型的晶体计算利用高性能计算和现代网络技术,将大规模非结构化数据和高效率算法结合,从而实现更大范围的晶体计算。
目前,这种新型的晶体计算正在迅速发展,不仅在科学与工程领域有着广泛的应用,同时也可用于解决相关技术问题。
二、晶胞计算方法晶胞计算主要分为三种方法:第一种是基于现实的结构模拟,例如分子动力学、量子化学和原子加成等;第二种是基于经典物理学方法,例如电阻网络模型;第三种是基于数学模型对系统进行建模,例如计算力学模型,以及诸如熵、温度、压力和化学势等物理参数的模型。
1、基于现实的结构模拟现实的结构模拟是指使用分子动力学、量子化学和其他力学模型,去实现晶胞内部细胞结构的准确模拟;通过使用计算机模拟系统,可以实时地模拟晶胞中各种参数,并准确地预测该晶胞中分子和原子结构的运动和变化趋势。
2、基于经典物理学方法经典物理学方法是指使用电阻网络模型进行计算,这种模型可以基于晶胞内部的拓扑结构,以及晶胞与外界环境的相互作用,来逼近晶胞的特性。
3、基于数学模型的晶胞计算数学模型的晶胞计算是指利用计算力学模型,结合各种物理参数,如熵、温度、压力和化学势,来构建晶胞结构的一种计算方式。
该方法可以准确地描述晶胞在环境条件下的各种变化,从而更好地理解晶胞的功能。
有关晶胞计算
右图是石英晶 体平面示意图(它实 际上是立体的网状结 构),其中硅、氧原 子数之比为____.
例 2:
1:2
例 3:
如图直线交点处 的圆圈为NaCl晶体中 Na+或Cl-所处位置, 晶体中,每个Na+周 围与它最接近的且距 离相等的Na+个数为: ____ 12
例 4:
金刚石晶体中 含有共价键形成的 C原子环,其中最 小的C环上有_____ 6 个C原子。
巩固练习三:
已知晶体的基本单元 是由12个硼原子构成的 (如右图),每个顶点上 有一个硼原子,每个硼原 子形成的化学键完全相同, 通过观察图形和推算,可 知此基本结构单元是一个 20 正____面体。
巩固练习四:
某晶胞结 构如图所示, 晶胞中各微粒 个数分别为: 3 铜________ 个 2 钡________ 1 个 钇________ 个
晶胞中金属原子数目的计算方法(平均值)
顶点算1/8
棱算1/4
面心算1/2
体心算1
已知铜晶胞是面心立方晶胞,该晶胞的边长为 3.6210-10m,每一个铜原子的质量为 1.05510-25kg ,试回答下列问题: (1)一个晶胞中“实际”拥有的铜原子数是多少? (2)该晶胞的体积是多大? (3)利用以上结果计算金属铜的密度。 解:(1)8 1/8+6 1/2=4 (2)V=a3=(3.6210-10m)3=4.74 10-29m3 4 1.05510-25kg 4.74 10-29m3
巩固练习二:
已知晶体硼的基本结构 单元是由硼原子组成的正二 十面体,如图所示:其中有 二十个等边三角形的面和一 定数目的顶点,每个顶点为 一个硼原子,试通过观察分 析右图回答:此基本结构单 30 个硼原子构成,有 元是由___ 12 个B-B化学键,相邻B-B ___ 0 60 键的键角为 ____.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
涉及晶胞的有关计算
晶胞作为晶体结构的基本单元,具有“无隙并置”,可平移的特征。
通过对晶胞上占有的粒子数、晶胞体积的计算,结合阿伏伽德罗常数可以把微观的晶胞和
宏观的物质的有关性质密度、摩尔质量联系起来。
从99年高考出现NiO晶胞与晶体密度关系计算以来,涉及晶胞的计算在高中化学教学中一直被作为一个重点,而且在计算的设计上变化层出。
例:晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。
NaCl晶体结构如图所示。
已知Fe
x
O晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。
测知Fe
x
O晶体密度ρ=5.71g/cm3,晶胞边长a = 4.28×10-10m。
(铁相对原子质量为55.9,氧相对原子质量为16)求:
(1)Fe
x
O中x值(精确至0.01)为_____________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为___________。
(3)此晶体化学式为___________。
解析:要计算x的值实际就是计算Fe x O的摩尔质量。
假定有1molFe x O晶体,求出1mol晶体质量即可解决问题。
题目条件中有晶体密度,如果求出1mol晶体的体积,体积乘以密度就是质量。
这样问题就转化为求1mol晶体的体积了。
1mol Fe x O晶体含有N A个O2- ,一个晶胞上占有4个O2-,所以1mol晶体含有N A/4个晶胞。
每个晶胞的体积V = a 3 = (4.28×10-8cm)3,因此1mol晶体的体积就是
N A ×(4.28×10-8cm)3/4。
1mol晶体质量为m =ρ.(N
A
/4).V = 5.71g/cm3×(N
A
/4)
×(4.28×10-8cm)3 = 67.4g。
x =(67.4-16)/56 = 0.92 。
(3)小题的答案就可以表示为Fe
0.92
O 。
(2)小题是纯数学计算,设Fe2+、Fe3+分别为m、n个,根据化合物中正负化合价代数和为0建立方程组:m+n=0.92 ; 2m+3n=2就可以求出相应的数值。
这种类型的计算通常涉及宏观晶体的密度、摩尔质量与阿伏伽德罗常数和微观的晶胞边长、晶胞粒子的半径。
例1.右图是金属铁晶体结构的示意图:
已知:金属铁的密度为7.8 g·cm-3。
求:铁原子的半径。
例2.图乙为一个金属铜的晶胞,请完成以下各题。
(1)该晶胞“实际占有”铜原子数个。
(2)此晶胞立方体边长为a cm, Cu的相对原子质量为64,金属铜的密度为ρg/cm3,则阿伏伽德罗常数为(用a、ρ表示)。
解决这类题型的基本方法大致是这样:
(1)根据晶胞结构计算晶胞上占有的粒子数目、晶胞的边长、晶胞体积。
这类题型的基本特征是:有晶胞结构。
首先分析晶胞上占有的粒子的数目,晶胞的边长与晶胞粒子半径的关系,计算晶胞体积。
晶胞采用不同的堆积方式导致晶胞上占有的粒子数目和晶胞的边长不同。
例1中晶胞采用体心堆积,晶胞上占有粒子数为2;例2中晶胞采用面心堆积,晶胞占有粒子数位4。
例1中晶胞体对角线上的三个粒子相切,体对角线长度等于晶胞粒子半径的4倍;例2中晶胞采用面心堆积,面对角线长度是晶胞粒子半径的4倍。
假定晶胞粒子的半径为r,例1中晶胞边长为a.则a2 + 2a2 = (4r)2. a=4 r/√3 .例2中晶胞的边长为a=2√2 r .晶胞体积分别为:64r3/3√3、16√2 r3 .
(2)假定有1mol 晶体,根据晶体的化学式确定1mol晶体中粒子数目,结合一个晶胞上占有的粒子数,计算1mol 晶体中晶胞的数目。
例1中1mol晶体含有的晶胞为N A/2个;例2中1mol 晶体含有的晶胞为N A/4个。
(3)根据已知条件建立等式关系。
例1中已知条件晶体密度为7.8 g·cm-3,隐含条件是铁的摩尔质量为56g/mol,则1mol晶体体积为56/7.8 cm3。
建立等式关系56/7.8 =( N A/2)×(64r3/3√3).计算出r数值。
例2中已知条件Cu相对原子质量为64,密度为ρg/cm3,则1mol 晶体体积为64/ρcm3. 建立等式关系为64/ρcm3 =(N A/4)×(16√2 r3).求出N A表达式。
此类问题的关键在于如何利用N A将宏观晶体和微观的晶胞建立起联系。
一般建立等式关系是1mol晶体的宏观体积与从微观晶胞计算的体积的等式关系。
很多时候题目中的条件是不充足的,要假定有1mol 晶体,然后进行相关计算。
练习:
1.已知CsCl 晶体的密度为ρg cm /3,N A 为阿伏加德罗常数,相邻的两个Cs +的
核间距为a cm ,如图所示,则CsCl 的摩尔质量可以表示为( )
A .
B .N a A ··ρ36
C .43
·ρ·a N A D .N a A ··ρ38 .2.如图所示,食盐晶体是由钠离子(图中的“●”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列。
已知食盐的密度是 2.2g ·cm —3,阿伏加德罗常数6.02×1023mol —1。
在食盐晶体中两个距离最近的钠离子中心间的距离最接近于 ( )
A .3.0×10—8cm
B .3.5×10—8cm
C .4.0×10—8cm
D .5.0×10—8cm
3.某离子晶体晶胞结构如下图所示,x 位于立方体的顶点,Y 位于立方体中心。
试分析:
(1)晶体中每个Y 同时吸引着__________个X ,每个x 同时吸引着__________个Y ,该晶体的化学式为__________ 。
(2)设该晶体的摩尔质量为M g ·mol -1,晶体密度为ρ·cm -3,阿伏加德罗常数为N A ,则晶体中两个相邻的X 原子间的距离为 。
4、如图是CsCl 晶体的晶胞(晶体中最小的重复单元)已知晶体中2个最近的Cs+核间距离为acm ,氯化铯的相对分子质量为M ,NA 为阿佛加德罗常数,则CsCl 晶体的密度为(单位:克/cm3)
A 、8M/a3NA
B 、a3M/8NA
C 、M/a3NA
D 、a3M/NA
答案为(1.245×10—8cm )
5. 右图是金属铝晶体结构的示意图
已知:金属铝的密度为2.7g·cm-3。
求:紧邻的铝原子的半径。
答案为(1.43×10—8cm )。
