液相色谱公式
液相色谱法定量分析与案例分享

液相色谱法定量分析与案例分享
定量分析是在定性分析的基础上,需要纯物质作为标准样品。
液相色谱的定量是相对的定量方法,即:由已知的标准样品推算出被测样品的量。
液相色谱法定量的依据
被测组分的量(W)与响应值(A)(峰高或峰面积)成正比,W=f×A。
定量校正因子(f):是定量计算公式的比例常数,其物理意义时单位响应值(峰面积)所代表的被测组分的量。
由已知标准样品的量和其响应值可以求得定量校正因子。
测定未知组分的响应值,通过定量校正因子即可求得该组分的量。
定量分析常用术语:
样品(sample):含有带测物,供色谱分析的溶液。
分为标样和未知样。
标样(standard):浓度已知的纯品。
未知样(unknow):浓度待测的混合物。
样品量(sampleweight):待测样品的原始称样量。
稀释度(dilution):未知样的稀释倍数。
组分(componance):欲做定量分析的色谱峰,即含量未知的被测物。
组分的量(amount):被测物质的含量(或浓度)。
积分(integerity):由计算机对色谱峰进行的峰面积测量的计算过程。
校正曲线(calibrationcurve):组分含量对响应值的线性曲线,由已知量的标准物建立,用于测定待测物的未知含量。
常用的定量方法
1外标法
标准曲线法,分为外标法和内标法。
外标法在液相色谱中用的最多。
内标法准确但是麻烦,在标准方法中用的最多。
液相色谱仪性能指标剖析

液相色谱仪性能指标剖析液相色谱仪(HPLC)是一种高效、高灵敏度、高分辨率的分析仪器,广泛应用于药物分析、环境监测、食品安全等领域。
液相色谱仪的性能指标对于保证分析结果的准确性和可靠性非常重要。
本文将从分辨力、灵敏度、精密度、线性范围和重复性等方面剖析液相色谱仪的性能指标。
1.分辨力:分辨力是液相色谱仪衡量分离效果的重要参数。
它取决于柱填充材料、流动相和分析条件等因素。
分辨力越高,样品组分的相互干扰越小,分离结果越好。
分辨力的计算公式为R=2(t2−t1)/(t1+t2),其中R为分辨力,t1和t2为两个峰的保留时间,w1和w2为两个峰的峰宽。
专业的液相色谱仪的分辨力可达到几千到几万。
2.灵敏度:液相色谱仪的灵敏度是指仪器对于微量样品的检测能力。
它取决于检测器的性能和信噪比。
最常用的检测器为紫外(UV)检测器,但对于一些不具有紫外吸收的化合物,需要采用荧光、电化学或质谱等检测器。
灵敏度的提高可以通过改变检测器的光学路径、调整检测器的灵敏度和信噪比等方式来实现。
3.精密度:精密度是液相色谱仪测量结果的重复性和一致性的度量。
它取决于流量控制的准确性、柱温的稳定性和植物样品制备等因素。
常用的评价指标包括峰面积的相对标准偏差(RSD)和保留时间的RSD。
优秀的液相色谱仪应该能够提供低于1%的精密度。
4.线性范围:线性范围是指仪器对于待测物浓度的线性响应范围。
线性范围的宽窄影响分析结果的可靠性和准确性。
液相色谱仪的线性范围通常在一个数量级内,而一些先进的仪器可以达到更宽的线性范围。
线性范围可以通过逐步稀释标准溶液并测量其响应来确定。
5.重复性:重复性是指液相色谱仪在相同条件下重复测量同一样品的能力。
这包括重复样品分析的重现性和在同一分析条件下测试多次的重现性。
重复性可以通过测试多个样品并计算其平均值和相对标准偏差来评价。
总结起来,液相色谱仪的性能指标包括分辨力、灵敏度、精密度、线性范围和重复性。
这些指标对于保证分析结果的准确性、可靠性和重复性非常重要。
药品高效液相含量计算公式 -回复

药品高效液相含量计算公式 -回复
回复:
药品高效液相含量计算公式通常用于确定药物溶液或混合物中的活性成分的浓度。
这个公式基于高效液相色谱技术,通过分析样品中的吸收峰面积来计算目标物质的含量。
一般来说,药品高效液相含量计算公式可以表示为以下形式:
含量(mg/mL)= (吸光度 × 溶液稀释倍数 × 分析物溶液中目标物质浓度)/ 标准
曲线斜率
在这个计算公式中,吸光度代表分析物在特定波长下的吸收强度,溶液稀释倍数指的是将原始样品溶液稀释后的倍数,目标物质浓度是指标准曲线上对应吸光
度的浓度值,而标准曲线斜率则是通过测量一系列已知浓度的标准溶液所得到。
为了使用这个公式进行药品高效液相含量计算,首先需要建立一条标准曲线。
常见的做法是制备一系列浓度不同、已知含量的标准溶液,并在相同条件下使用高效液相色谱仪以得到吸光度与浓度之间的关系。
然后,我们可以通过测量待测样
品的吸光度,带入公式中的各个参数,计算出目标物质的含量。
需要注意的是,药品高效液相含量计算公式是基于一系列前提条件和假设,如分析条件的稳定性、吸光度与浓度之间的线性关系等。
因此,在进行计算时应遵循相应的实验方法和标准操作流程,以保证计算结果的准确性和可靠性。
总之,药品高效液相含量计算公式是一种用于测定药物溶液或混合物中目标物质含量的数学模型。
通过合理选择实验条件、建立标准曲线和准确测量样品的吸光度,我们可以利用这个公式来快速、准确地计算药品中目标物质的含量,从而为药物研究和质量控制提供实验数据支持。
液相色谱计算公式

液相色谱计算公式
液相色谱(Liquid Chromatography,简称LC)的计算公式包括保留时间和保留率的计算公式。
1.保留时间(Retention Time)的计算公式:
保留时间是指化合物在液相色谱柱中停留的时间,它是液相色谱中最常用的性能参数之一。
保留时间(t_R)的计算公式为:
t_R = t_m - t_0
其中,t_m表示化合物在色谱柱中出现的时间,称为终点时间(即化合物在色谱柱中运行的总时间);
t_0表示无保留物(即溶剂前端)出现的时间,称为起点时间(即样品注入柱后到出现第一个色谱峰的时间)。
2.保留率(Retention Factor)的计算公式:
保留率是指化合物在色谱柱中停留时间与无保留物停留时间之比,用于评估化合物在液相色谱中的保留能力。
保留率(k)的计算公式为:
k = (t_R - t_0) / t_0
其中,t_R表示化合物的保留时间,t_0表示无保留物的保留时间。
在实际的液相色谱分析中,需要根据所使用的色谱柱、流动相组
成和流速等参数来选择适当的计算公式和相应的数值,以获得准确的
结果。
另外,液相色谱还有其他常用的计算公式,如峰面积的计算公式、分离度的计算公式等,这些公式可以用于进一步量化和评估色谱分离
效果和样品组成。
高效液相色谱 拖尾因子

高效液相色谱拖尾因子
高效液相色谱(HPLC)中的拖尾因子(tailing factor,T)是一个重要的参数,用于衡量色谱峰的对称性。
它也被称为对称因子或不对称因子。
拖尾因子T的计算公式为:T = W0.05h/2d1。
其中,W0.05h 为0.05峰高处的峰宽,d1为峰极大至峰前沿之间的距离。
在高效液相色谱分析中,拖尾因子T应在0.95~1.05的范围内。
这个范围是根据实际应用的需要设定的,以使色谱峰的对称性在可接受的范围内。
如果T不在这个范围内,可能需要对色谱条件进行调整,例如改变流动相的组成、流速、柱温等,以改善色谱峰的对称性。
另外,也可以通过配制不同浓度的对照品溶液,加入规定量的内标溶液,注样3次,计算平均校正因子,来评估色谱峰的对称性。
这种方法可以更准确地反映色谱峰的形状和对称性。
高效液相色谱法的计算方法

高效液相色谱法的计算方法高效液相色谱法是用高压输液泵将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,经进样阀注入供试品,由流动相带入柱内,在柱内各成分被分离后,依次进入检测器,色谱信号由记录仪或积分仪记录。
1、对仪器的一般要求所用的仪器为高效液相色谱仪。
色谱柱的填料和流动相的组分应按各品种项下的规定。
常用的色谱柱填料有硅胶和化学键合硅胶。
后者以十八烷基硅烷键合硅胶最为常用,辛基键合硅胶次之,氰基或氨基键合硅胶也有使用;离子交换填料,用于离子交换色谱;凝胶或玻璃微球等,用于分子排阻色谱等。
注样量一般为数微升。
除另有规定外,柱温为室温,检测器为紫外吸收检测器。
在用紫外吸收检测器时,所用流动相应符合紫外分光光度法(附录ⅣA)项下对溶剂的要求。
正文中各品种项下规定的条件除固定相种类、流动相组分、检测器类型不得任意改变外,其余如色谱柱内径、长度、固定相牌号、载体粒度、流动相流速、混合流动相各组分的比例、柱温、进样量、检测器的灵敏度等,均可适当改变,以适应具体品种并达到系统适用性试验的要求。
一般色谱图约于20分钟内记录完毕。
2、系统适用性试验按各品种项下要求对仪器进行适用性试验,即用规定的对照品对仪器进行试验和调整,应达到规定的要求;或规定分析状态下色谱柱的最小理论板数、分离度和拖尾因子。
(1) 色谱柱的理论板数(N,用于定量表示色谱柱的分离效率,简称柱效)。
在选定的条件下,注入供试品溶液或各品种项下规定的内标物质溶液,记录色谱图,量出供试品主成分或内标物质峰的保留时间tR(以分钟或长度计,下同,但应取相同单位)和半高峰宽(W h/2),按n=5.54(t R/W h/2)2计算色谱柱的理论板数,如果测得理论板数低于各品种项下规定的最小理论板数,应改变色谱柱的某些条件(如柱长、载体性能、色谱柱充填的优劣等),使理论板数达到要求。
液相色谱之线性关系考察(标准曲线)
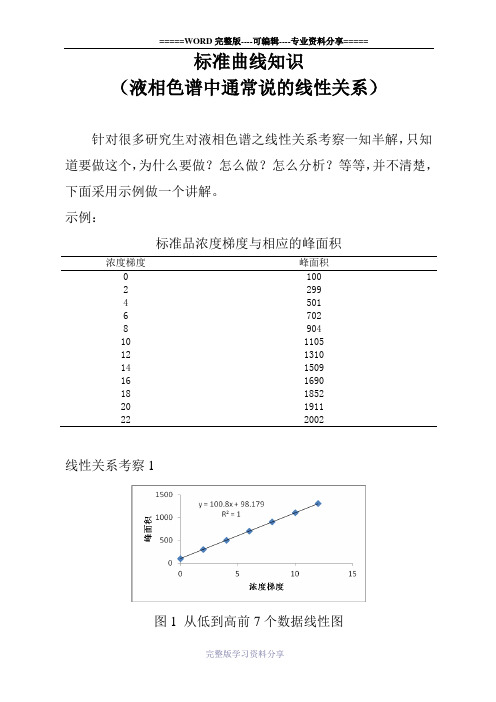
标准曲线知识(液相色谱中通常说的线性关系)针对很多研究生对液相色谱之线性关系考察一知半解,只知道要做这个,为什么要做?怎么做?怎么分析?等等,并不清楚,下面采用示例做一个讲解。
示例:标准品浓度梯度与相应的峰面积浓度梯度峰面积0 1002 2994 5016 7028 90410 110512 131014 150916 169018 185220 191122 2002线性关系考察1图1 从低到高前7个数据线性图从低到高前8个数据线性图线性关系考察3从低到高前9个数据线性图线性关系考察4从低到高前10个数据线性图从低到高前11个数据线性图线性关系考察6、图6 从低到高前12个数据线性图以上6个图均是基于表中数据所做的线性关系图。
解说:1.图6中的公式y = 90.642x + 160.03:X指浓度,Y指在某液相条件下,当浓度为X时的峰面积,他们的关系满足y = 90.642x + 160.03这个公式。
当X为0时(空白)峰面积为160.03,为1时峰面积为160.03+90.642,依此类推。
R²指相关系数,即浓度与峰面积的相关性,即峰面积是否随浓度的增加而增加,如果浓度增加1倍,峰面积也增加1倍,则他们完全相关;如果峰面积与浓度的增加没有规律,则他们不相关。
R²在0~1之间,为0时完全不相关,为1时完全相关,越高,相关性越高,方法越好。
一般来说,液相线性关系要满足4个9,即R²≥0.9999,有些特别难测的,可以为0.999。
2.以上6个图显示,图1至图3较好的满足了线性关系,但随着浓度的增加,线性关系破坏(图4至图6),浓度的增加,并没有使峰面积增加相应的倍数。
说明一个问题,仪器测量是有一个浓度范围的(所有仪器都一样),超过一定范围,线性关系就不存在了,浓度与峰面积之间失去了其相关性,所测数据用线性关系来衡量就会不准确。
PS:液相色谱的外标法(外标一点和标准曲线法)均是基于线性关系来计算的,外标一点法计算方法为样品浓度(X样)/标准品浓度(X标)=样品峰面积(Y样)/标准品峰面积(Y标),当标准品浓度X标及2个峰面积Y样和Y标都知道时,就可算出样品浓度X样,但线性关系不存在时,外标法就不准确了。
化验室计算公式归纳总结

化验室计算公式概括总结1.原料药〔按乏味品计算〕计算式:m测样量百分含量= m取样量〔1-水分%〕100%2.容量剖析法直接滴定法〔计算公式之一〕供试品〔%〕 =V F T100% m sC实测F- 浓度校订因子.F=C规定〔表示滴定液的实测浓度是规定浓度的多少倍〕V-滴定体积〔 ml 〕T —滴定度 . 每 ml滴定液相当于被测组分的mg数。
例:非那西丁含量丈量:精细称取本品,加稀盐酸回流 1 小时后,放冷,用亚硝酸钠滴定液〔 mol/L 〕滴定,用去 ml 。
每 1 ml 亚硝酸钠滴定液〔 mol/L 〕相当于的 C10H13O2N。
计算非那西丁含量丈量:百分含量〔%〕 =百分含量〔%〕 =V F T100%m s20100%99.72% 1000直接滴定法计算公式之二供试品〔%〕 =( V 样V空) F Tm s100%例 2:取焦亚硫酸钠本品约,精细称定,置碘瓶中,精细加碘滴定液〔 mol/L 〕50ml,密塞,振摇溶解后,加盐酸 1ml, 用硫代硫酸钠〔 mol/L 〕滴定液滴定。
至近终点时,加淀粉指示液 2 ml ,持续滴定至蓝色消逝;并将滴定结果用空白试验校订。
每 1 ml 碘滴定液〔 mol/L 〕相当于Na2S2O3 .计算公式 :百分含量〔%〕 =(V样 V空) F T100% m s节余滴定法〔计算公式之一〕供试品〔%〕 =(V空V样)FTm s100%V空—滴准时,供试品耗费滴定液的体积〔ml〕V样—滴准时,空白耗费滴定液的体积〔ml〕F- 浓度校订因子 .F= m s供试品的质量C实测C规定例:精细称取青霉素钾供试品,按药典规定用节余碱量法测定含量。
先参加氢氧化钠溶液〔 mol/L 〕 ml ,回滴时耗费 mol/L 的盐酸液 ml ,空白试验耗费 mol/L 的盐酸液 ml 。
求供试品的含量,每 1 ml 盐酸液〔 mol/L 〕相当于的青霉素钾。
百分含量〔%〕=(V空 V样) F Tm s100%〔〕青霉素钾%100% 98.54%0.4021 1000例:微晶纤维素的含量测定:取本品约,精细称定,置锥形瓶中,加水25 ml ,精密加重铬酸钾溶液〔取基准重铬酸钾,加水适当是溶解并稀释至20 ml 〕 50ml ,混匀,当心加硫酸 100ml ,快速加热至沸,放冷至室温,移至250ml 的饿容量瓶中,加水稀释至刻度,摇匀,精细量取 50 ml ,加邻二氮菲指示液 3 滴,用硫酸亚铁铵滴定液〔 mol/L 〕滴定,并将滴定的结果用空白试验校订。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1
愈高[1]
[4] 石俊敏,管佳,张庆文等,超高效液相色谱在药物分析中的应用[J],药物
分析杂志,2008(9):1583-1588
液—液分配色谱法
(Liquid-liquid Partition Chromatography)及化学键合相色谱(Chemically Bonded Phase Chromatography)流动相和固定相都是液体。
流动相与固定相之间应互不相溶(极性不同,避免固定液流失),有一个明显的分界面。
当试样进入色谱柱,溶质在两相间进行分配。
达到平衡时,服从于高效液相色谱计算公式:
高效液相色谱计算公式
式中,cs—溶质在固定相中浓度;cm--溶质在流动相中的浓度;Vs—固定相的体积;Vm—流动相的体积。
LLPC与GPC有相似之处,即分离的顺序取决于K,K大的组分保留值大;但也有不同之处,GPC中,流动相对K影响不大,LLPC流动相对K影响较大。
a.正相液—液分配色谱法(Normal Phase liquid Chromatography): 流动相的极性小于固定液的极性。
b.反相液—液分配色谱法(Reverse Phase liquid Chromatography): 流动相的极性大于固定液的极性。
c.液—液分配色谱法的缺点:尽管流动相与固定相的极性要求完全不同,但固定液在流动相中仍有微量溶解;流动相通过色谱柱时的机械冲击力,会造成固定液流失。
上世纪70年代末发展的化学键合固定相(见后),可克服上述缺点。
现在应用很广泛(70~80%)。
液—固色谱法
流动相为液体,固定相为吸附剂(如硅胶、氧化铝等)。
这是根据物质吸附作用的不同来进行分离的。
其作用机制是:当试样进入色谱柱时,溶质分子(X) 和溶剂分子(S)对吸附剂表面活性中心发生竞争吸附(未进样时,所有的吸附剂活性中心吸附的是S),可表示如下:Xm nSa ====== Xa nSm
式中:Xm--流动相中的溶质分子;Sa--固定相中的溶剂分子;Xa--固定相中的溶质分子;Sm--流动相中的溶剂分子。
当吸附竞争反应达平衡时:
K=[Xa][Sm]/[Xm][Sa]
式中:K为吸附平衡常数。
[讨论:K越大,保留值越大。
]
相对平均偏差(relative average deviation):平均偏差在测量值的平均值中所占的百分数。
相对标准偏差(RSD,relativestandarddeviation)就是指:标准偏差与计算结果算术平均值的比值,。
