氯化铜的颜色
碱式氯化铜化学式

碱式氯化铜化学式碱式氯化铜的化学式为Cu2(OH)3Cl,它是一种由铜、氢氧化物和氯化物组成的化合物。
由于铜元素的存在,碱式氯化铜具有良好的导电性和催化性能,广泛应用于工业和实验室中。
下面将从其物理性质、化学性质和应用方面进行介绍。
一、物理性质。
1.外观和颜色:碱式氯化铜是一种淡绿色固体,具有非常细密的结构。
2.热稳定性:在常态下,碱式氯化铜的热稳定性一般。
但当在氧化性环境中,碱式氯化铜的热稳定性会降低,容易受到氧化,从而失去其特性。
3.溶解性:碱式氯化铜能够在水中溶解。
当然了,碱式氯化铜在碱性或酸性环境下溶解性大不同。
在酸性环境下,碱式氯化铜溶解的较快。
而在碱性环境下,则很难溶解。
二、化学性质。
1.物理性质:碱式氯化铜有多种结构形式,物理性质也会因结构的不同有所差异。
2.氧化还原性:碱式氯化铜含有铜元素,因此具有较强的氧化还原性。
它在一定条件下可以发生氧化反应,例如和浓硝酸反应时,会释放出氧气。
3.催化剂:碱式氯化铜可以作为一种重要的催化剂,参与多种有机反应或气相反应。
而且碱式氯化铜比铜氧化物还有更高的催化活性。
三、应用方面。
1.计算机元件:碱式氯化铜有很高的导电性,因此常被用来制造电子元件,如计算机中的集成电路等。
2.催化剂:碱式氯化铜在体系中作为催化剂的应用广泛,如在合成甲酸酯时,碱式氯化铜可以作为催化剂,促进反应进行。
3.电器设备:碱式氯化铜添加到电器设备中,可以起到减少环境电磁波的作用,保护电器设备,增强电磁兼容性。
总之,碱式氯化铜具有多种物理化学性质和广泛的应用价值,在工业和实验室中得到了广泛应用。
氯化铜晶体

氯化铜晶体
【英文名称】Copper(II) Chloride
【分子式】CuCl2
【分子量】134.45
【CAS号】7447-39-4
【物理性质】黄色或棕色固体,mp 620 ℃,d 3.386 g/cm3,二水合氯化铜为蓝色粉末或晶体,mp 100℃,d 2.51 g/cm3。
无水氯化铜溶于水、醇、丙酮。
二水合氯化铜溶于水、甲醇、乙醇,在丙酮和乙酸乙酯中部分溶解,微溶于乙醚。
【制备和商品】国内外试剂公司均有销售,商品化试剂有无水氯化铜、水合氯化铜以及吸附在氧化铝上的含30%氯化铜试剂。
【注意事项】具有吸湿性,应保存在阴凉干燥处。
在有机合成中,氯化铜可以作为氯化试剂、氧化试剂和路易斯酸试剂。
氯化铜是一个对多种官能团化合物有效的氯化试剂,能实现羰基化合物的α-氯化反应。
该反应通常在含有氯化锂的极性溶剂中进行。
使用丁醛在甲醇溶剂反应时,可以得到α-氯代缩醛。
智能手机用于氯化铜溶液颜色变化的实验探究

智能手机用于氯化铜溶液颜色变化的实验探究作者:卢运许燕红覃稔来源:《化学教学》2019年第08期摘要:用智能手机设计的简易色度仪对氯化铜溶液在不同浓度、不同温度以及存在其他无色离子的情况下的颜色进行探究,将颜色反映在图像的RGB值上。
结果显示,拍摄得到的氯化铜溶液颜色图像的RGB值与氯化铜溶液的浓度和温度成线性关系;氯化铜稀溶液呈蓝色,氯化铜浓溶液呈绿色,浓度1.2mol/L为氯化铜溶液颜色由蓝色系变成绿色系的理论变色浓度;氯化铜稀溶液温度升高时,颜色将由蓝色变成绿色;加入Cl-离子,溶液绿色加深,加入Na+、NO ;-3、 NH ;+4等无关离子溶液颜色不变。
关键词:氯化铜; 溶液颜色; 图像RGB值; 智能手机; 实验探究文章编号: 1005-6629(2019)8-0080-05 ; ; ; ; ; ;中图分类号: G633.8 ; ; ; ; ; ;文献标识码: B1 ;问题的提出在浙教版初中化学教材“探究酸的性质”[1]中介紹了“探究稀盐酸和稀硫酸与金属氧化物(氧化铜)的反应”的实验。
该实验在实际教学中进行分组实验后,要求学生填写观察到的实验现象与结论。
探究稀硫酸与氧化铜反应时,所有学生得到的实验现象几乎都是“黑色粉末逐渐消失溶液由无色变成蓝色”;但是探究稀盐酸与氧化铜反应时,部分学生得到的实验现象为“黑色粉末逐渐消失,溶液由无色变成蓝色”,而部分学生得到的实验现象却是“黑色粉末逐渐消失,溶液由无色变成绿色”。
对同一实验同样的实验步骤,出现两种不同的实验结论,其背后的影响因素及其变色规律有待通过实验进行探究。
对于氯化铜溶液颜色的探究,传统的实验方法通常是配制一定的不同浓度的氯化铜溶液,在相同温度下观察其颜色,并在此基础上找出其变色规律;在探究温度对氯化铜溶液颜色的影响时,通常是配制相同浓度的氯化铜溶液,在不同温度下观察其颜色。
这种实验方法由于实验器材和条件的限制,加上肉眼对颜色的视觉判断存在较大误差,未能从定量的角度研究问题,得到的实验结果往往缺乏可信度,因此,寻找一种更为科学可靠的实验方式,是得出可信度更高的实验结论的关键。
化学试剂的颜色

溶液:1.一般为无色2.含铜离子的溶液:二价铜离子呈蓝色或者蓝绿色,而氯化铜浓溶液,硝酸铜浓溶液呈绿色:通常,铜离子Cu2+在水溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的,水合铜离子呈蓝色,所以我们常见的铜盐溶液大多呈蓝色。
而在氯化铜的溶液中,不仅有水合铜离子[Cu(H2O)4]2+,还有氯离子Cl-与铜离子结合形成的四氯合铜络离子[CuCl4]2-,该离子的颜色为黄色。
根据光学原理我们知道,蓝色和黄色的混合色为绿色,这就是为什么我们常见的一般浓度的氯化铜溶液呈绿色的原因。
如果我们向氯化铜溶液中加水,则溶液中氯离子浓度变小,水合铜离子相对增多,溶液主要呈现水合铜离子的颜色(蓝色)。
所以我们见到的氯化铜稀溶液一般呈蓝色。
同样道理,在硝酸跟铜的反应中,稀硝酸与铜反应所得的溶液呈蓝色,而浓硝酸与铜反应所得溶液呈绿色。
这是因为,浓硝酸与铜反应时,产生大量的二氧化氮气体,二氧化氮溶解在溶液中呈黄色,二氧化氮的黄色跟水合铜离子的蓝色混合就出现了我们看到的绿色。
3.含铁离子的溶液:水合铁离子呈浅紫色,若有水解,则为黄色;水合亚铁离子呈浅绿色4.含锰离子的溶液:水合锰离子:肉红色高锰酸根离子:紫红色锰酸根离子:绿高锰酸根离子紫红色锰酸根离子绿色二价锰离子淡粉色四价锰(二氧化锰)黑色5.其他离子:重铬酸根离子橙色铬酸根离子黄色粉末一般为白色1.单质绝大少数单质:雪白色。
Cu 紫红 O2 无 Au 黄 S 黄 B 黄或黑 F2 淡黄绿C(石墨黑 Cl2 黄绿 C(金刚石)无 Br2 红棕 Si 灰黑 I2 紫黑 H2 无有数气体无 P 白、黄、红棕。
2.氢化物 LiH等金属氢化物:白; NH3等非金属氢化物:无。
3.氧化物大少数非金属氧化物:无;次要破例: NO2 棕红 N2O5和P2O5 白 N2O3 暗蓝 ClO2 黄大少数主族金属的氧化物:白次要破例: Na2O2 浅黄 PbO 黄 K2O 黄 Pb3O4 红 K2O2 橙 Rb2O 亮黄Rb2O2 棕 Cs2O 橙红 Cs2O2 黄大少数过渡元素氧化物有颜色: MnO 绿 CuO 黑 MnO2黑 Ag2O 棕黑FeO 黑 ZnO 白 Fe3O4 黑 Hg2O 黑 Fe2O3 红棕 HgO 红或黄 Cu2O 红V2O5 橙沉淀:1.一般为白色2.含铜离子的沉淀为蓝色3.含铁离子的沉淀为红褐色。
一些特殊物质的颜色

一些特殊物质的颜色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)蓝色:CuSO4•5H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、液态固态O2(淡蓝色)红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)黄色:硫磺(单质S)、含Fe3+ 的溶液(棕黄色)绿色:FeSO4•7H2O、含Fe2+ 的溶液(浅绿色)无色气体:N2、CO2、CO、O2、H2、CH4有色气体:Cl2(黄绿色)、NO2(红棕色)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2有臭鸡蛋气味:H2S常见一些变化的判断:①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl (就这两种物质)②蓝色沉淀:Cu(OH)2、CuCO3③红褐色沉淀:Fe(OH)3Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐,如碳酸钙(白色)、碳酸钡(白色)⑤沉淀能溶于酸但没气体放出的:不溶的碱6,能溶于盐酸或稀HNO3的白色沉淀有CaCO3,BaCO3;不溶于稀HNO3的白色沉淀,有AgCl、BaSO4肯定是找题眼也就是突破口一般找到了突破口这个题就可以顺势做下来了。
比如遇到无色刺激性气味之类的肯定是氨气,让石灰水变浑肯定是CO2,黄色溶液是氯化铁,浅绿色的是氯化亚铁,蓝色的是硫酸铜或氯化铜(有时候也说氯化铜是蓝绿色的)。
不溶解的沉淀是氯化银,硫酸钡;溶解的是碳酸钡,碳酸钙。
红褐色沉淀是氢氧化铁,蓝色沉淀是氢氧化铜。
、找到了题眼,就可以顺着那条线,根据方程式的反应物啊,条件啊之类的推断出整个题中的物质。
做这种题,周密的思维是必须的,因为有时候两种物质不共存,这是通过大量的训练才能培养出来的白色沉淀有碳酸钙,氢氧化镁,硫酸钡,氯化银,碳酸钡。
红色固体单质有磷(初中阶段很少考),铜(一般都指铜)。
黑色粉末有氧化铜,二氧化锰,炭粉。
氯化铜的理化性质和危险特性表

标识
中文名:氯化铜
危险货物编号:83503
英文名:Copperchloride
UN编号:2802
分子式:CuCl2
分子量:134.44
CAS号:7447-39-4
理化性质
外观与性状
黄棕色吸湿性粉末。
熔点(℃)
498(分解)
相对密度(Leabharlann =1)3.386沸点(℃)
993(转变为氯化亚铜)
①皮肤接触:脱去污染的衣着,用大量流动清水冲洗。②眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。③吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。④食入:用0.1%亚铁氰化钾洗胃。给饮牛奶或蛋清。就医。
燃烧爆炸危险性
燃烧性
不燃
燃烧分解物
氯化氢、氧化铜。
灭火方法
消防人员必须穿全身耐酸碱消防服。灭火时尽可能将容器从火场移至空旷处。然后根据着火原因选择适当灭火剂灭火。
闪点(℃)
/
爆炸上限%(v%):
/
自燃温度(℃)
/
爆炸下限%(v%):
/
危险特性
本身不能燃烧。遇钾、钠剧烈反应。受高热分解产生有毒的腐蚀性烟气。具有腐蚀性。
建规火险分级
戊
稳定性
稳定
聚合危害
不聚合
禁忌物
钠、钾、潮湿空气。
储运条件
与泄漏处理
储运条件:①储存注意事项:储存于阴凉、通风的库房。远离火种、热源。防止阳光直射。包装必须密封,切勿受潮。应与钠、钾、食用化学品等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。②运输注意事项:起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与活性金属、活性金属、食用化学品等混装混运。运输时运输车辆应配备泄漏应急处理设备。运输途中应防曝晒、雨淋,防高温。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。泄漏处理:隔离泄漏污染区,限制出入。建议应急处理人员戴防尘口罩,穿防腐防毒服。不要直接接触泄漏物。小量泄漏:用洁净的铲子收集于干燥、洁净、有盖的容器中。大量泄漏:收集回收或运至废物处理场所处置。
氯化铜的理化性质和危险特性(表-)
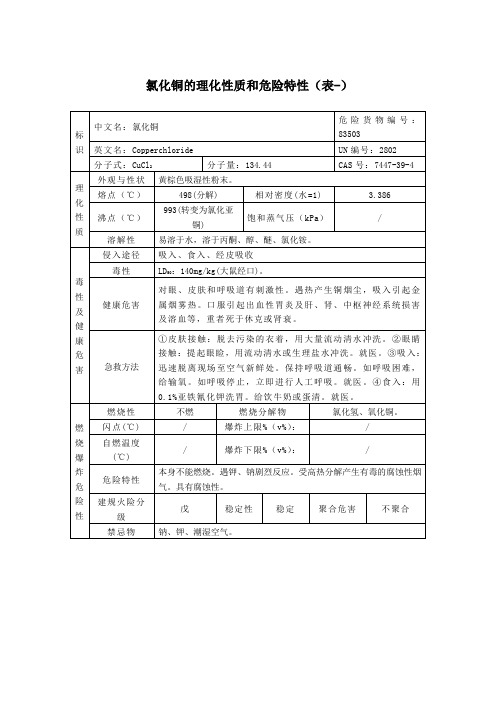
溶解性
易溶于水,溶于丙酮、醇、醚、氯化铵。
毒性及健康危害
侵入途径
吸入、食入、经皮吸收
毒性
LD50:140mg/kg(大鼠经口)。
健康危害
对眼、皮肤和呼吸道有刺激性。遇热产生铜烟尘,吸入引起金属烟雾热。口服引起出血性胃炎及肝、肾、中枢神经系统损害及溶血等,重者死于休克或肾衰。
急救方法
①皮肤接触:脱去污染的衣着,用大量流动清水冲洗。②眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。③吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。④食入:用0.1%亚铁氰化钾洗胃。给饮牛奶或蛋清。就医。
灭火方法
消防人员必须穿全身耐酸碱消防服。灭火时尽可能将容器从火场移至空旷处。然后根据着火原因选择适当灭火剂灭火。
燃烧爆炸危险性
燃烧性
不燃
燃烧分解物
氯化氢、氧化铜。
闪点(℃)
/
爆炸上限%(v%):
/
自燃温度(℃)
/
爆炸下限%(v%):
/
危险特性
本身不能燃烧。遇钾、钠剧烈反应。受高热分解产生有毒的腐蚀性烟气。具有腐蚀性。
建规火险分级
戊
稳定性
稳定
聚合危害
不聚合
禁忌物
钠、钾、潮湿空气。
储运条件
与泄漏处理
储运条件:①储存注意事项:储存于阴凉、通风的库房。远离火种、热源。防止阳光直射。包装必须密封,切勿受潮。应与钠、钾、食用化学品等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。②运输注意事项:起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与活性金属、活性金属、食用化学品等混装混运。运输时运输车辆应配备泄漏应急处理设备。运输途中应防曝晒、雨淋,防高温。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。泄漏处理:隔离泄漏污染区,限制出入。建议应急处理人员戴防尘口罩,穿防腐防毒服。不要直接接触泄漏物。小量泄漏:用洁净的铲子收集于干燥、洁净、有盖的容器中。大量泄漏:收集回收或运至废物处理场所处置。
焰色反应实验报告

焰色反应实验报告焰色反应实验报告引言:焰色反应是一种常见的化学实验方法,通过观察物质在燃烧时所产生的颜色变化,可以初步判断该物质中所含的金属元素。
本次实验旨在通过焰色反应,探究不同金属离子在燃烧时所产生的特定颜色及其原理。
实验材料与方法:实验所需材料包括:盐酸、硝酸、硫酸、氯化钠、氯化钾、氯化钡、氯化铜、氯化锶、氯化钴、氯化钡等。
实验步骤如下:1. 将每种金属盐溶解于盐酸、硝酸和硫酸中,制备成10%浓度的溶液。
2. 在实验室安全条件下,取少量溶液倒入石英坩埚中。
3. 用酒精灯将溶液加热至燃烧状态,观察产生的火焰颜色。
4. 将实验结果记录下来,进行分析和总结。
实验结果与讨论:在实验过程中,我们观察到不同金属盐燃烧时产生了不同的火焰颜色。
以下是我们实验结果的总结:1. 氯化钠:产生明亮的黄色火焰。
2. 氯化钾:产生紫色火焰。
3. 氯化钡:产生明亮的绿色火焰。
4. 氯化铜:产生明亮的蓝绿色火焰。
5. 氯化锶:产生明亮的红色火焰。
6. 氯化钴:产生粉红色火焰。
通过对实验结果的观察和分析,我们可以得出以下结论:1. 火焰颜色的产生是由金属离子的激发态电子跃迁所引起的。
当金属盐燃烧时,金属离子被激发到高能级,随后电子从高能级跃迁回低能级时,会释放出特定波长的光,形成特定的颜色。
2. 氯化钠的黄色火焰是由钠离子的电子跃迁引起的。
钠离子的激发态电子跃迁产生的光波长在可见光谱范围内,因此我们能够看到明亮的黄色火焰。
3. 氯化钾的紫色火焰是由钾离子的电子跃迁引起的。
钾离子的激发态电子跃迁产生的光波长较短,超出了人眼可见的紫外光谱范围,但我们可以通过荧光屏或摄像机来观察到紫色的火焰。
4. 氯化钡的绿色火焰是由钡离子的电子跃迁引起的。
钡离子的激发态电子跃迁产生的光波长在可见光谱范围内,因此我们能够看到明亮的绿色火焰。
5. 氯化铜的蓝绿色火焰是由铜离子的电子跃迁引起的。
铜离子的激发态电子跃迁产生的光波长在可见光谱范围内,因此我们能够看到明亮的蓝绿色火焰。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸铜溶液显蓝色,氯化铜溶液为绿色。
为什么同为铜盐, 但颜色不同?
如果仅仅用酸根离子不同作理由来解释,是不足以服人的。
要透彻解释应该从Cu2+的络离子说起。
Cu2+有配位数2、4、6的络离子。
在胆矾CuSO4·5H2O中,CuSO4·5H2O的化学式也可以写成[Cu(H2O)4]SO4·H2O。
胆矾呈蓝色是因为[Cu(H2O)4]2+呈蓝色。
CuSO4·5H2O溶于水后,
[Cu(H2O)4]2+存在于溶液中,若溶于过量水,还会形成
[Cu(H2O)6]2+,无论[Cu(H2O)4]2+还是[Cu(H2O)6]2+络离子,都是蓝色的,所以硫酸铜溶液呈蓝色。
无水氯化铜呈棕黄色,常以(CuCl2)n的形式存在,溶于少量水时形成[Cu(H2O)4]2+和[CuCl4]2-络离子:
(CuCl2)2+4H2O==[Cu(H2O)4]2++[CuCl4]2-
[Cu(H2O)4]2+显蓝色,[CuCl4]2-显绿色,它们共存时的混合色则为绿色,所以浓的CuCl2溶液显绿色。
稀释时由于水增加,电离平衡向右移动,[CuCl4]2-离子减少,[Cu(H2O)4]2+离子增加,绿色向蓝色变化。
当溶液相当稀时,几乎均为[Cu(H2O)4]2+,[CuCl4]2-很少,所以显蓝色。
