仪器分析实验内容(一)-推荐下载
仪器分析实验内容(一)

邻二氮菲分光光度法测定试样中的微量铁一、实验目的1.掌握邻二氮菲分光光度法测定微量铁的方法原理2.熟悉绘制吸收曲线的方法,正确选择测定波长3.学会制作标准曲线的方法4.通过邻二氮菲分光光度法测定微量铁,掌握721型分光光度计的正确使用方法,并了解此仪器的主要构造。
二、实验原理邻二氮菲(phen )和Fe 2+在pH3~9的溶液中,生成一种稳定的橙红色络合物Fe(phen)2+3,其lg K =21.3,ε508=1.1×104 L·mol -1·cm -1,铁含量在0.1~6μg·mL -1范围内遵守比尔定律。
显色前需用盐酸羟胺或抗坏血酸将Fe 3+全部还原为Fe 2+,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。
有关反应如下:HCl OH NH 2Fe 223⋅++ ==== 22N Fe 2++↑+ 2H 2O + 4H + + 2Cl - N N Fe 2++ 3NN Fe 32+用分光光度法测定物质的含量,一般采用标准曲线法,即配制一系列浓度的标准溶液,在实验条件下依次测量各标准溶液的吸光度A ,以溶液的浓度C 为横坐标,相应的吸光度A 为纵坐标,绘制标准曲线。
在同样实验条件下,测定待测溶液的吸光度Ax ,根据测得吸光度值Ax 从标准曲线上查出相应的浓度值Cx ,即可计算试样中被测物质的质量浓度。
三、仪器和试剂1.仪器 721型分光光度计,1 cm 比色皿。
2.试剂(1)100 µg ·mL -1铁标准储备溶液。
(2)100 g ·L -1盐酸羟胺水溶液。
用时现配。
(3)0.1% 邻二氮菲水溶液。
避光保存,溶液颜色变暗时即不能使用。
(4)pH=5.0的乙酸-乙酸钠溶液。
四、实验步骤1.显色标准溶液的配制 在序号为1~6的6只50 mL 容量瓶中,用吸量管分别加入0,0.4,0.8,1.2,1.6,2.0 mL 铁标准使用液(含铁约100µg·mL -1),分别加入1.00 mL 100 g ·L-1盐酸羟胺溶液,摇匀后放置2 min ,再各加入5.0 mL 乙酸-乙酸钠溶液,3.00 mL 0.1% 邻二氮菲溶液,以水稀释至刻度,摇匀。
仪器分析实验报告全集

实验一(1)气相色谱-质谱联用仪的基础操作班别:11环科二学号:3111007390姓名:蔡辉东一、实验目的:1. 了解气相色谱-质谱联用仪的基础操作;2. 学习正确执行仪器的开机、关机;3. 参观资源综合利用与清洁生产重点实验室。
二、实验原理:1. 气相色谱-质谱联用仪的调谐目的:采用标准物质全氟三丁胺(FC-43)对质谱仪的质量指示进行校正;对质谱参数进行优化,以实现最好的峰形和分辨率;消除质量歧视;2. EI离子源可获得特征谱图以表征组分分子结构,目前有大量的有机物标准质谱图。
由计算机自动将未知质谱图处理成归一化棒状质谱图,按一定的检索方法与谱库中的标准谱图进行比较,计算它们的相似性指数(匹配度),把最相似的谱图化合物最为未知组分的鉴定结果,并按照相似性指数大小顺序,列出其名称、相对分子质量、分子式等以供分析参考。
三、仪器与试剂:仪器:气相色谱-质谱联用仪(美国安捷伦,型号7890A-5975C)试剂:全氟三丁胺标准品、高纯氦气四、实验步骤:1.打开氦气(纯度99.999%以上)瓶开关;打开UPS电源;打开打印机电源;启动联机电脑后打开气相色谱仪电源开关;2.待气相色谱仪自检完成后,打开质谱仪电源开关。
若质谱长时间未使用,真空仓侧门已打开,开质谱电源时需用手轻按真空仓侧门1min,以利于抽真空。
3.开机约1.5小时后打开工作站预热;待开机约2小时,检查真空度合格后,进入调谐菜单,点击自动调谐,进行调谐。
4.待调谐完毕,进入仪器操作界面,建立方法,进行定性分析(苯系物的GC-MS定性分析)5.分析完关机。
进入view菜单,点击“诊断”后,进入“真空”菜单,点击“Vent”,等Vent 结束后(≥50分钟),同时气相色谱仪进样口温度降至80℃以下后,退出工作站,依次关闭气相色谱仪、质谱仪和气瓶开关,关闭UPS电源开关。
五、注意事项:1. 必须严格按操作手册规定顺序进行开、关机程序;2. 仪器通过调谐后才能进行样品分析;3. 谱库检索结果并非定性分析的唯一方法,匹配度大小只表示可能性大小。
仪器分析实验内容

邻二氮菲分光光度法测定试样中的微量铁一、实验目的1.掌握邻二氮菲分光光度法测定微量铁的方法原理2.熟悉绘制吸收曲线的方法,正确选择测定波长3.学会制作标准曲线的方法4.通过邻二氮菲分光光度法测定微量铁,掌握721型分光光度计的正确使用方法,并了解此仪器的主要构造。
二、实验原理邻二氮菲(phen )和Fe 2+在pH3~9的溶液中,生成一种稳定的橙红色络合物Fe(phen)2+3,其lg K =21.3,κ508=1.1×104 L ·mol -1·cm -1,铁含量在0.1~6μg ·mL -1范围内遵守比尔定律。
显色前需用盐酸羟胺或抗坏血酸将Fe 3+全部还原为Fe 2+,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。
有关反应如下: HCl OH NH 2Fe 223⋅++ ==== 22N Fe 2++↑+ 2H 2O + 4H + + 2Cl - N N Fe 2++ 3NN Fe 32+用分光光度法测定物质的含量,一般采用标准曲线法,即配制一系列浓度的标准溶液,在实验条件下依次测量各标准溶液的吸光度A ,以溶液的浓度C 为横坐标,相应的吸光度A 为纵坐标,绘制标准曲线。
在同样实验条件下,测定待测溶液的吸光度Ax ,根据测得吸光度值Ax 从标准曲线上查出相应的浓度值Cx ,即可计算试样中被测物质的质量浓度。
三、仪器和试剂1.仪器 721型分光光度计,1 cm 比色皿。
2.试剂(1)100 µg ·mL -1铁标准储备溶液,10 µg ·mL -1铁标准使用液。
(2)100 g ·L -1盐酸羟胺水溶液。
用时现配。
(3)0.1% 邻二氮菲水溶液。
避光保存,溶液颜色变暗时即不能使用。
(4)1.0 mol ·L -1乙酸钠溶液。
四、实验步骤1.显色标准溶液的配制 在序号为1~6的6只50 mL 容量瓶中,用吸量管分别加入0,2.0,4.0,6.0,8.0,10.0 mL 铁标准使用液(含铁10µg ·mL -1),分别加入1.00 mL 100 g ·L-1盐酸羟胺溶液,摇匀后放置2 min ,再各加入5.0 mL 1.0 mol ·L -1乙酸钠溶液,3.00 mL 0.1%邻二氮菲溶液,以水稀释至刻度,摇匀。
现代仪器分析实验报告
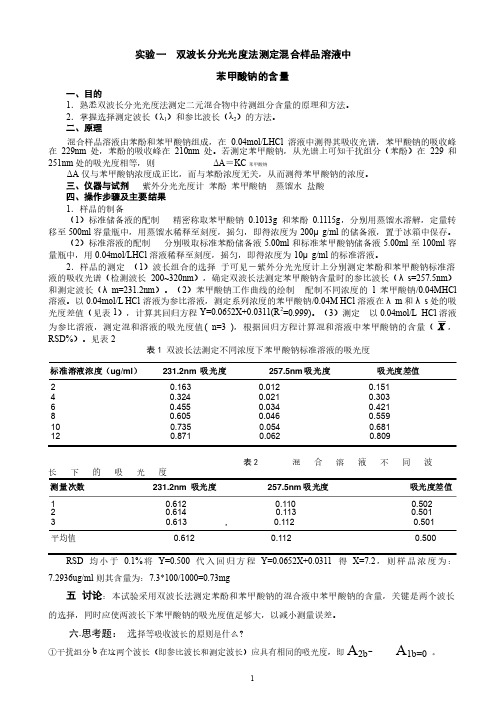
实验一 双波长分光光度法测定混合样品溶液中苯甲酸钠的含量一、目的1.熟悉双波长分光光度法测定二元混合物中待测组分含量的原理和方法。
.熟悉双波长分光光度法测定二元混合物中待测组分含量的原理和方法。
2.掌握选择测定波长(λ1)和参比波长(λ2)的方法。
)的方法。
二、原理混合样品溶液由苯酚和苯甲酸钠组成,在0.04mol/LHCl 溶液中测得其吸收光谱,苯甲酸钠的吸收峰在229nm 处,苯酚的吸收峰在210nm 处。
若测定苯甲酸钠,从光谱上可知干扰组分(苯酚)在229和251nm 处的吸光度相等,则处的吸光度相等,则ΔA =KC 苯甲酸钠 ΔA 仅与苯甲酸钠浓度成正比,而与苯酚浓度无关,从而测得苯甲酸钠的浓度。
三、仪器与试剂 紫外分光光度计紫外分光光度计 苯酚苯酚 苯甲酸钠苯甲酸钠 蒸馏水蒸馏水 盐酸盐酸 四、操作步骤及主要结果1.样品的制备.样品的制备(1)标准储备液的配制)标准储备液的配制精密称取苯甲酸钠0.1013g 和苯酚0.1115g ,分别用蒸馏水溶解,定量转移至500ml 容量瓶中,用蒸馏水稀释至刻度,摇匀,即得浓度为200μg/ml 的储备液,置于冰箱中保存。
的储备液,置于冰箱中保存。
(2)标准溶液的配制)标准溶液的配制分别吸取标准苯酚储备液5.00ml 和标准苯甲酸钠储备液5.00ml 至100ml 容量瓶中,用0.04mol/LHCl 溶液稀释至刻度,摇匀,即得浓度为10μg/ml 的标准溶液。
的标准溶液。
2.样品的测定.样品的测定 (1)波长组合的选择)波长组合的选择于可见-紫外分光光度计上分别测定苯酚和苯甲酸钠标准溶液的吸收光谱(检测波长200~320nm ),确定双波长法测定苯甲酸钠含量时的参比波长(λs=257.5nm )和测定波长(λm=231.2nm )。
(2)苯甲酸钠工作曲线的绘制)苯甲酸钠工作曲线的绘制配制不同浓度的l 苯甲酸钠/0.04MHCl 溶液。
以0.04mol/L HCl 溶液为参比溶液,测定系列浓度的苯甲酸钠/0.04M HCl 溶液在λm 和λs 处的吸光度差值(见表1),计算其回归方程Y=0.0652X+0.0311(R 2=0.999)。
《仪器分析实验》PPT课件

实验内容
归一化法测定混合芳烃中各组分的百分 含量。
面积外标法定量测定气体中甲苯含量
.
11
归一化法
气相色谱中,把所有出峰组分含量之和以百分之百计算的 定量分析方法称为归一化法
样品中所有组分都能从色谱柱流出来并被检测到 各个组分的含量不能相差太大
归一化法所得色谱图
在FID上,各种烃类的相对质量 校正因子都很相近,混合芳烃中 各组分的百分含量近似等同于面 积的百分含量
=>
.
47
一 NMR的三要素--磁性核、静磁场、射频场
2. 静磁场:没有外加静磁场时,原子核的自旋是任 意取向的,样品的宏观磁矩为零。当把含磁性 核的样品放入静磁场时,对于自旋I=1/2的原 子核,核自旋有两种取向:一种与外加静磁场 平行,原子核的能量降低;另一种与外加静磁 场反平行,原子核的能量升高,即原子核产生 能级分裂。
.
36
3、Varian Satrun GC/MS 是具有大质谱功能的台式质谱仪
内离子源设计
MS/MS设计
The Quadrupole Ion Trap
Top endcap Ring Electrode Bottom Endcap
Filament assembly GC column inlet
浓度为100,500,1000 ppm,直接进样1 μL
归一化法所得色谱图
.
工作曲线
14
外标法测定样品时对体积要求如何?是否像归一化法一 样,进样体积不一定要非常准确?
外标法不同于归一化法,它对进样体积的要求 非常严格,一定要很准确,这样才能得到较好 的定量依据。
归一化法测得的是百分含量
不同仪器得到的工作曲线是不一样的,在做实 验的时候,要使结果准确,还要对工作曲线进 行及时的校正
仪器分析实验

仪器分析实验指导实验一气相色谱内标法测定白酒中乙酸乙酯含量一、实验目的1、掌握气相色谱内标法测定白酒中乙酸乙酯含量2、掌握气相色谱仪的结构及使用方法二、实验原理试样被汽化后,随同载气进入色谱柱,利用被测定的各组分在气液两相中具有不同的分配系数,在柱内形成迁移速度的差异而得到分离。
分离后的组分先后流出色谱柱,进入氢火焰离子化检测器,根据色谱图上各组分峰的保留值与标样对照进行定性,利用峰面积(或峰高),以内标法定量。
三、实验仪器及试剂仪器:气相色谱仪,氢火焰离子化检测器(FID);色谱柱:白酒专用填充柱,微量注射器:10微升试剂:乙醇,色谱纯(分析纯代替)。
配成60%乙醇水溶液;乙酸乙酯,色谱纯,作标样用。
2%溶液(用60%乙醇水溶液配制);乙酸正丁酯,色谱纯,作内标用。
2%溶液(用60%乙醇水溶液配制);四、实验步骤1.仪器的准备,色谱条件的确定检测器温度:260℃;进样口温度:240℃;柱温程序:60℃保持1分钟,以3℃/分钟的速率升到90℃,然后以40℃/分钟升到220℃。
2. 校正因子(f)的测定吸取2%乙酸乙酯标准溶液1.0mL,移入100mL容量瓶中,然后加入2%内标液1.0mL,用60%乙醇溶液稀释至刻度。
上述溶液中乙酸乙酯和内标的浓度均为0.02%(体积分数)。
进行GC检测,记录乙酸乙酯和内标峰的保留值及其峰面积(或峰高),其比值计算出乙酸乙酯的相对校正因子(f)。
f= A1* d2/ A2* d1C= f* A3* C1*10-3/ A1其中:C---试样中乙酸乙酯的质量浓度,g/L;f---乙酸乙酯的相对校正因子;A1---标样f值测定时内标的峰面积(或峰高);A2---标样f值测定时乙酸乙酯的峰面积(或峰高)A3---试样中乙酸乙酯的峰面积(或峰高)A4---添加于酒样中内标的峰面积(或峰高)C1---添加在酒样中)内标的质量浓度,mg/L。
d1---内标物的相对密度;d2---乙酸乙酯的相对密度。
仪器分析实验内容-学生
实验1 紫外光谱分析法 —Aspirin 含量的测定一、目的1.通过用紫外光谱法分析Aspirin 的含量,掌握紫外光谱对有机化合物的定性、定量测定原理。
2.了解UV-2000型紫外-可见分光光度计的构造和使用方法。
二、原理Aspirin (乙酰水杨酸)在干燥空气中较稳定,但遇潮则缓缓分解,在室温下遇碱水解能定量地转变为水杨酸:O CO CH 3COOH2-O COOHH +CH 3COOH利用紫外分光光度计测定水杨酸的含量, max =296nm ,通过计算可以求出Aspirin 的含量。
三、步骤1. 标准系列及未知样品的配制取25mL 容量瓶7只,分别移取400mg/mL 水杨酸标准溶液0.4, 0.8, 1.2, 1.6, 2.0mL 及1.0mL Aspirin 待测液于6只容量瓶中, 另一只容量瓶中配制试剂空白溶液作参比。
然后各加1mL 0.1mol/L NaOH 溶液,用水稀释至刻度,摇匀。
2. 吸收曲线的绘制在紫外-可见分光光度计上,用1cm 石英比色皿,试剂空白溶液作参比,在250~320nm 之间测定标准系列中4号样品的吸光度A 值,每隔5nm 测定一次,其中290~300nm 之间每隔2nm 测定一次,然后以波长为横坐标,吸光度为纵坐标绘制出吸收曲线,从吸收曲线上找出最大吸收波长。
3. 标准曲线的绘制在紫外-可见分光光度计上,用1cm 石英比色皿,试剂空白溶液作参比,在最大吸收波长处,测定标准系列中各溶液的吸光度。
以水杨酸含量为横坐标,吸光度为纵坐标绘制出标准曲线。
4. Aspirin 待测液中Aspirin 含量的测定在与标准系列相同的条件下,测定未知样品的吸光度,然后在标准曲线上查出其中的水杨酸含量,再计算出原Aspirin 待测液中的Aspirin 含量(单位:mg/mL )。
实验2 红外光谱法测定有机化合物的结构一、实验目的1.通过本实验,初步掌握红外光谱的定性方法。
仪器分析实验
邻二氮菲分光光度法测定铁的含量铁在深层地下水中呈低价态,当接触空气并在pH大于5时, 便被氧化成高铁并形成氧化铁水合物(Fe2O3·3H2O)的黄棕色沉淀,暴露于空气的水中, 铁往往也以不溶性氧化铁水合物的形式存在。
当pH值小于5时,高铁化合物可被溶解。
因而铁可能以溶解态、胶体态、悬浮颗粒等形式存在于水体中, 水样中高铁和低铁有时同时并存。
二氮杂菲分光光度法可以分别测定低铁和高铁,适用于较清洁的水样;原子吸收分光光度法快速且受干扰物质影响较小。
水样中铁一般都用总铁量表示。
一、二氮杂菲分光光度法1. 本法适用于测定生活饮用水及其水源水中总铁的含量。
2. 钴、铜超过5mg/L,镍超过2mg/L,锌超过铁的10倍对此法均有干扰,饿、镉、汞、钼、银可与二氮杂菲试剂产生浑浊现象。
3.本法最低检则量为2.5μg, 若取50mL水样测定, 则最低检测浓度为0.05mg/L。
二、基本原理在pH 3~9的条件下,低铁离子能与二氮杂菲生成稳定的橙红色络合物,在波长510nm处有最大光吸收。
二氮杂菲过量时,控制溶液pH为2.9~3.5,可使显色加快。
水样先经加酸煮沸溶解铁的难溶化合物,同时消除氰化物、亚硝酸盐、多磷酸盐的干扰。
加入盐酸羟胺将高铁还原为低铁,还可消除氧化剂的干扰。
水样不加盐酸煮沸,也不加盐酸羟胺,则测定结果为低铁的含量。
三、仪器与试剂(一)仪器1.100mL容量瓶。
2.50mL容量瓶。
3.分光光度计。
(二)试剂1.铁标准贮备溶液:称取0.7022g硫酸亚铁铵[Fe(NH4)2(SO4)2·6H2O],溶于70mL 20+50硫酸溶液中,滴加0.02mol/L 的高锰酸钾溶液至出现微红色不变,用纯水定容至1L。
此贮备溶液1.00ml含0.100mg铁。
2.铁标准溶液(使用时现配):吸取10.00mL铁标准贮备溶液, 移入容量瓶中,用纯水定容至100mL。
此铁标准溶液1.00mL含10.0μg铁。
仪器分析实验内容(一)
邻二氮菲分光光度法测定试样中的微量铁一、实验目的1.掌握邻二氮菲分光光度法测定微量铁的方法原理2.熟悉绘制吸收曲线的方法,正确选择测定波长3.学会制作标准曲线的方法4.通过邻二氮菲分光光度法测定微量铁,掌握721型分光光度计的正确使用方法,并了解此仪器的主要构造。
二、实验原理邻二氮菲(phen )和Fe 2+在pH3~9的溶液中,生成一种稳定的橙红色络合物Fe(phen)2+3,其lg K =21.3,ε508=1.1×104 L·mol -1·cm -1,铁含量在0.1~6μg·mL -1范围内遵守比尔定律。
显色前需用盐酸羟胺或抗坏血酸将Fe 3+全部还原为Fe 2+,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。
有关反应如下:HCl OH NH 2Fe 223⋅++ ==== 22N Fe 2++↑+ 2H 2O + 4H + + 2Cl - N N Fe 2++ 3NN Fe 32+用分光光度法测定物质的含量,一般采用标准曲线法,即配制一系列浓度的标准溶液,在实验条件下依次测量各标准溶液的吸光度A ,以溶液的浓度C 为横坐标,相应的吸光度A 为纵坐标,绘制标准曲线。
在同样实验条件下,测定待测溶液的吸光度Ax ,根据测得吸光度值Ax 从标准曲线上查出相应的浓度值Cx ,即可计算试样中被测物质的质量浓度。
三、仪器和试剂1.仪器 721型分光光度计,1 cm 比色皿。
2.试剂(1)100 µg ·mL -1铁标准储备溶液。
(2)100 g ·L -1盐酸羟胺水溶液。
用时现配。
(3)0.1% 邻二氮菲水溶液。
避光保存,溶液颜色变暗时即不能使用。
(4)pH=5.0的乙酸-乙酸钠溶液。
四、实验步骤1.显色标准溶液的配制 在序号为1~6的6只50 mL 容量瓶中,用吸量管分别加入0,0.4,0.8,1.2,1.6,2.0 mL 铁标准使用液(含铁约100µg·mL -1),分别加入1.00 mL 100 g ·L-1盐酸羟胺溶液,摇匀后放置2 min ,再各加入5.0 mL 乙酸-乙酸钠溶液,3.00 mL 0.1% 邻二氮菲溶液,以水稀释至刻度,摇匀。
(精)仪器分析实验讲义
(精)仪器分析实验讲义实验⼀722 型分光光度计的性能检测⼀、⽬的1、学会使⽤分光光度计2、掌握分光光度计的性能检验⽅法⼆、提要1、分光光度计的性能好坏,直接影响到测定结果的准确性,因此新购仪器及使⽤⼀定时间后,均需进⾏检验调整。
2、利⽤KMnO4溶液的最⼤吸收峰值来检验波长的精度。
3、⽤同种厚度的⽐⾊⽫,由于材料及⼯艺等原因,往往造成透光率的不⼀致,从⽽影响测定结果,故在使⽤时须加以选择配对。
三、仪器与试剂1、722 型分光光度计;2、⼩烧杯;3、坐标纸;4、滴管;5、擦镜纸;6、KMnO4溶液;四、操作步骤1、吸收池透光率的检查(测定透光率)吸收池透光⾯玻璃应⽆⾊透明,并应⽆⽔、⼲燥。
检查⽅法如下:以空⽓的透光率为100%,则⽐⾊⽫的透光率应不低于84%,同时在450nm、650nm 处测其透光率,各透吸收池透光率差值应⼩于5%。
2、吸收池的配对性(测定透光率)同种厚度的吸收池之间,透光率误差应⼩于0.5%。
检查⽅法如下:将蒸馏⽔分别注⼊厚度相同的⼏个吸收池中。
以其中任⼀个⽐⾊⽫的溶液做空⽩,在440nm 波长处分别测定其它各⽐⾊⽫中溶液的透光率,然后选择相差⼩于0.5% 的吸收池使⽤。
3、重现性(光度重复性)(测定透光率)仪器在同⼀⼯作条件下,⽤同种溶液连续测定7 次,其透光率最⼤读数与最⼩读数之差(极差)应⼩于0.5%。
检查⽅法如下:以蒸馏⽔的透光率为100%,⽤同⼀KMnO4溶液连续测定7 次,求出极差,如⼩于0.5%,则符合要求。
4、波长精度的检查(测定A)为了检查分光系统的质量,可⽤KMnO4溶液的最⼤吸收波长525nm 为标准,在待检查仪器上测绘KMnO4溶液的吸收曲线。
检查⽅法如下:取3.0×10-5mol/L 的KMnO4溶液,以蒸馏⽔为空⽩,在460nm~580nm 范围内,分别测定460、480、500、510、520、522、524、525、526、528、530、540、550、560、570、580nm 波长处的吸光度,在坐标纸上绘出吸收曲线。
