高三化学专项训练——侯氏制碱法
山东省2023届高考化学二轮复习工艺流程题专项练3解析版

山东省2023届高考化学二轮复习工艺流程题专项练3解析版一、选择题 每小题只有一个选项符合题意,每小题3分,共24分。
1.以下是侯氏制碱法的简单流程,下列说法正确的是( )A .氨和二氧化碳的通入顺序应该调换B .操作X 为过滤,为加快过滤速率,过滤时用玻璃棒搅拌C .侯氏制碱法的主要原理是相同条件下Na 2CO 3易溶于水,NaHCO 3难溶于水D .向溶液B 中通入氨并加入氯化钠粉末可得到副产品NH 4Cl ,通入氨的目的是增大NH +4 的浓度,有利于析出NH 4Cl 并提高纯度【答案】 D【解析】A 项,氨和二氧化碳的通入顺序不能颠倒,因为氨极易溶于水,二氧化碳的溶解度较小,先通入氨可以更多地吸收二氧化碳,反应生成碳酸氢钠,A 错误;B 项,过滤时不能用玻璃棒搅拌,避免弄破滤纸,B 错误;C 项,碳酸钠和碳酸氢钠都易溶于水,但相同温度下碳酸氢钠的溶解度小于碳酸钠,C 错误;D 项,氨溶于水后与水反应生成一水合氨,电离出铵根离子,增大铵根离子浓度,有利于析出氯化铵并提高纯度,D 正确。
2.某工厂用提取粗盐后的盐卤(主要成分为MgCl 2)制备金属镁,其工艺流程如下。
下列说法中错误的是( )A.步骤Ⅰ发生的反应为非氧化还原反应B.若在实验室进行操作①,只需要漏斗和烧杯两种玻璃仪器C.操作②是蒸发浓缩、冷却结晶D.在整个制备过程中,未发生置换反应【答案】B【解析】步骤Ⅰ发生反应MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2,该反应是非氧化还原反应,A项正确;操作①是过滤操作,用到烧杯、漏斗、玻璃棒三种玻璃仪器,B项错误;操作②是由MgCl2溶液制得MgCl2·6H2O,操作是蒸发浓缩、冷却结晶,C项正确。
3.(2021·山东烟台二模)工业上利用锌焙砂(主要含ZnO、ZnFe2O4还含有少量FeO、CuO等)湿法制取金属锌的流程如图所示。
下列说法错误的是()A.ZnFe2O4与硫酸反应的离子方程式:ZnFe2O4+8H+===Zn2++2Fe3++4H2O B.加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+C.加过量的ZnS可除去溶液中的Cu2+是利用了K sp(ZnS)>K sp(CuS)D.为增大反应速率,“净化Ⅰ”和“净化Ⅰ”均应在较高的温度下进行【答案】D【解析】流程分析如下:ZnFe2O4与硫酸反应生成Zn2+、Fe3+、H2O,离子方程式为ZnFe2O4+8H+===Zn2++2Fe3++4H2O,A正确;加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+[生成Fe(OH)3沉淀],B正确;加过量ZnS可除去溶液中的Cu2+,是利用了K sp(ZnS)>K sp(CuS),C正确;“净化Ⅰ”中的H2O2在温度较高时会分解,该反应需要控制温度不能太高,D错误。
高中化学侯氏制碱法专项练习(附答案)

高中化学侯氏制碱法专项练习一、单选题1. 工业上用粗盐 (含 Ca 2+、Mg 2+、SO 42-等杂质 )为主要原料采用“侯氏制碱法”生产纯碱和化肥NH 4Cl ,工艺流程如下图所示,下列有关说法正确的是 ( )A. 在“侯氏制碱法”中涉及到了氧化还原反应B. 饱和食盐水中先通入的气体为 CO 2C. 流程图中的系列操作中一定需要玻璃棒D. 工艺中只有碳酸氢钠加热分解产生的 CO 2 可回收循环利用2. 实验室模拟工业上侯氏制碱法的原理制备纯碱,下列操作3. 下列所示物质的工业制备方法合理的是(4. 侯氏制碱法中 , 对母液中析出 NH 4Cl 无帮助的操作是 ( ) A.通入 CO 2B.通入 NH 3 C .冷却母液未涉及的是( )D.A.制 Si : SiO 2HCl aqSiCl 4 H 2 SiB.制 H 2SO 4 : 黄铁矿O2煅烧SO 2H2OH 2SO 3O2H 2SO 4 C.卤水中提取 Mg :卤水 ( 主要含 MgCl 2 ) NaOH aqMg OH 2HCl aqMgCl 2电解MgD.侯氏制碱法 通入 :饱和食盐水足量NH 3通入 足量 CO 2过滤NaHCO 3Na 2CO 3D.加入食盐+ NH 4Cl 析出碳酸氢钠,下列实验装置A.5. 侯氏制碱法原理是:NH 3+H2O+CO2+NaCl=NaHCO3及原理设计说法不合理的是:( )A.用装置甲制取氨气时得到氨气很少,主要原因是分解得到NH 3、HCl 的遇冷会重新化合B. 用装置乙生成的CO2 速率很慢,原因是反应生成微溶于水的硫酸钙,覆盖着大理石的表面C. 用装置丙模拟侯氏制碱法,可以同时通入NH3、CO2 ,也可以先通氨气再通CO2D. 用装置丁分离得到产品NaHCO 3 ,为得到干燥产品,也可采用减压过滤6、实验师模拟侯氏制碱法制取纯碱和氯化铵溶液,有关操作错误的是7. 侯德榜先生是我国现代化学工业的开拓者与奠基者,他于图所示:1943 年发明的侯氏制碱法工艺流程如下列说法错误的是 ( ) A.该工艺中循环利用的物质为 CO 2和 NH 3 B.该工艺主产品是纯碱,副产品为 NH 4ClC. “过滤”后的母液中, n(Na ) 小于 n(Cl )D. 该工艺中涉及化合反应、复分解反应和分解反应二、填空题 8、氨碱法和侯氏制碱法的生产流程图可用如图表示(2) “氨碱法”产生大量的 CaCl 2废弃物,请写出该工艺中产生 CaCl 2的化学方程式 : __ ; “侯 氏制碱法”中 , 在母液中通入③的目的是 ______ 。
专项侯氏制碱法人教版高中化学必修一教学课件

CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验), 能够吸收大量CO2气体,产生高浓度的HCO3-,才能析出NaHCO3晶体。 ②侯氏制减法有何优点? 提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本
专项侯氏制碱法课件人教版高中化学 必修一
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化 钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分 析说明是否可行? _不__可_行__。__K_H__C_O_3_的__溶__解_度__大__,与__K__C_l的__溶__解__度_差__别__小__,向__K_C__l、__N_H__3的__饱___ _和__溶_液__中__通__入__C_O_2_不__析__出_K__H_C_O__3 _。
专项侯氏制碱法课件人教版高中化学 必修一
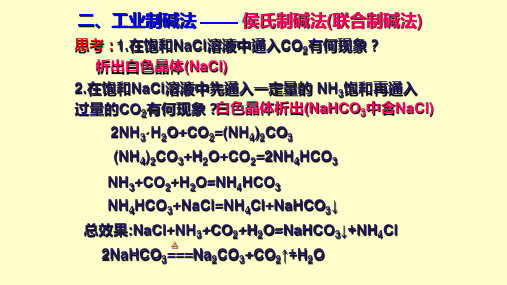
(NH4)2CO3+H2O+CO2=2NH4HCO3
NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NH4Cl+NaHCO3↓ 总效果:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2NaHCO3=△==Na2CO3+CO2↑+H2O
专项侯氏制碱法课件人教版高中化学 必修一
专项侯氏制碱法课件人教版高中化学 必修一
专项侯氏制碱法课件人教版高中化学 必修一
例1.实验室利用下列物质制备氧气时,产生等量的氧气,电子转移数最少
的是
( B)
A.高锰酸钾 B.过氧化钠 C.氯酸钾 D.硝酸钠
高中化学--侯式制碱法

高中化学--侯式制碱法work Information Technology Company.2020YEAR侯式制碱法原理和简单流程【知识梳理】实验背景:无水碳酸钠,俗名纯碱、苏打。
它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。
它的工业制法主要有氨碱法和联合制碱法两种。
一、实验原理 化学反应原理是:总反应为:将经过滤、洗涤得到的NaHCO 3微小晶体再加热,制得纯碱产品: 答案:化学反应原理: 32243NH CO H O NH HCO ++→4334()NaCl NH HCO NaHCO NH Cl +→↓+饱和 总反应 : 32234()NaCl NH CO H O NaHCO NH Cl +++→↓+饱和323222NaHCO Na CO CO H O ∆−−→+↑+二、氨碱法(又称索尔维法) 1.原料:食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气 2.步骤:先把氨气通入饱和食盐水中而成氨盐水,32243NH CO H O NH HCO ++→再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,4334()NaCl NH HCO NaHCO NH Cl +→↓+饱和将经过滤、洗涤得到的NaHCO 3微小晶体,再加热煅烧制得纯碱产品。
323222NaHCO Na CO CO H O ∆−−→+↑+(放出的二氧化碳气体可回收循环使用)含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
CaO +H 2O → Ca(OH)2,2NH 4Cl +Ca(OH)2 → CaCl 2+2NH 3↑+2H 2O其工业流程图为:知识精讲其工业生产的简单流程如图所示:3.氨碱法的优点是:(1)原料(食盐和石灰石)便宜; (2)产品纯碱的纯度高;(3)副产品氨和二氧化碳都可以回收循环使用; (4)制造步骤简单,适合于大规模生产。
3.2专项侯氏制碱法课件-人教版高中化学必修一
钾肥: KCl、K2SO4、K2CO3
复合肥: KH2PO4、NH4H2PO4
微量元素:ZnSO4、FeSO4--------
例1.为了同时施用分别含N、P、K3种元素的化肥,对于下列5种化肥:
①K2CO3 ②KCl ③Ca(H2PO4)2 ④(NH4)2SO4 ⑤氨水,合适的组合是 ( B ) A.①③④ B.②③④ C.①③⑤ D.②③⑤
KCl、K2SO4、K2CO3
2
①K2CO3 ②KCl ③Ca(H2PO4)2 ④(NH4)2SO4 ⑤氨水,合适的组合是 ( )
风化 白色粉末状物质
(NaOH潮解) (生成Na CO •10H O) ___________________________。
总效果:CO+Na2O2=Na2CO3 分别取样加盐酸,再检验是否有使澄清石灰水变浑浊的气体产生
下列反应方程式中正确的是
(C )
① 2Na2O2+2Mn2O7=4NaMnO4+O2↑
② 2Na2O2+2NO2=2NaNO2+O2
③ 2N2O3+2Na2O2=4NaNO2+O2
④ 2N2O5+2Na2O2=4NaNO3+O2
A.只有①
B.②③ C.①④ D.②③④
只用两两混合就能鉴别的物质 思考:可用类似方法鉴别的物质还有哪些? (1)强酸和可溶性碳酸盐、亚硫酸盐 (2)Al3+与OH-
①草木灰的主要成分是K CO Ca(H2PO4)2(重钙) 、KH2PO4、
铵态氮肥不易随水流失。
23
②草木灰不能与氨态氮肥混用 与H+结合生成气体快慢:HCO3->CO32-;
(3)AlO2-与H+
高中化学侯氏制碱法专项练习(附答案)

高中化学侯氏制碱法专项练习一、单选题1.工业上用粗盐(含222-4Ca Mg SO ++、、等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥4NH Cl ,工艺流程如下图所示,下列有关说法正确的是( )A. 在“侯氏制碱法”中涉及到了氧化还原反应B. 饱和食盐水中先通入的气体为2COC. 流程图中的系列操作中一定需要玻璃棒D. 工艺中只有碳酸氢钠加热分解产生的2CO 可回收循环利用2.实验室模拟工业上侯氏制碱法的原理制备纯碱,下列操作 未涉及的是( )A.B.C.D.3.下列所示物质的工业制备方法合理的是( )A.制Si :2SiO ()HCl aq −−−−→ 4SiCl −→−2H SiB.制24H SO :黄铁矿2O −−−→煅烧2SO 2H O −−−→23H SO 2O −−→24H SO C.卤水中提取Mg :卤水( 主要含2MgCl ) ()−−−→−aq NaOH ()2Mg OH ()−−−→−aq HCl … −→−2MgCl −−−→电解MgD.侯氏制碱法:饱和食盐水3NH −−−−→通入足量2CO −−−−→通入足量−−−→过滤 ()3NaHCO s 23Na CO4.侯氏制碱法中,对母液中析出NH 4Cl 无帮助的操作是( )A.通入CO 2B.通入NH 3C.冷却母液D.加入食盐5.侯氏制碱法原理是:32234NH H O CO NaCl NaHCO NH Cl ↓+++=+析出碳酸氢钠,下列实验装置及原理设计说法不合理的是:( )A.用装置甲制取氨气时得到氨气很少,主要原因是分解得到NH 3、HCl 的遇冷会重新化合B.用装置乙生成的2CO 速率很慢,原因是反应生成微溶于水的硫酸钙,覆盖着大理石的表面C.用装置丙模拟侯氏制碱法,可以同时通入3NH 、2CO ,也可以先通氨气再通2COD.用装置丁分离得到产品3NaHCO ,为得到干燥产品,也可采用减压过滤 6、实验师模拟侯氏制碱法制取纯碱和氯化铵溶液,有关操作错误的是7.侯德榜先生是我国现代化学工业的开拓者与奠基者,他于1943年发明的侯氏制碱法工艺流程如图所示:下列说法错误的是( )A.该工艺中循环利用的物质为2CO 和3NHB.该工艺主产品是纯碱,副产品为4NH ClC.“过滤”后的母液中,(Na )n +小于(Cl )n -D.该工艺中涉及化合反应、复分解反应和分解反应 二、填空题 8、氨碱法和侯氏制碱法的生产流程图可用如图表示,试回答下列问题。
高中化学实验篇(一)侯氏制碱法

高中化学实验篇(一)侯氏制碱法作为一个化学没考过的高三狗,我会通过这个平台整理一些化学小知识,夯实自己的基础。
今天来谈谈侯氏制碱法。
侯氏制碱法?是猴子吗!不不,侯氏制碱法是他!侯德榜先生研究出来的!好了,事不宜迟,我们来看看这位伟大的化学家创造的制碱方法。
一.原理第一步:氨气与水和二氧化碳反应生成一分子的碳酸氢铵第二步:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小注:根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在278K ~283K(5℃~10℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥。
其相关化学方程式有①NH3+H2O+CO2=NH4HCO3②NH4HCO3+NaCl=NH4Cl+NaHCO3↓③2NaHCO3=加热=Na2CO3+H2O+CO2↑二.实验步骤及其化学反应方程式①NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓ (溶解度一般,因为不断添加原料达到溶液饱和才沉淀)注:先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性,能够吸收大量CO2气体,产生高浓度的HCO3-,才能析出NaHCO3晶体②2NaHCO3(加热)=Na2CO3+H2O+CO2↑(过滤、洗涤、灼烧)三..优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序。
注:纯碱就是碳酸钠(Na2CO3)在制碱过程中向滤出NaHCO3晶体后的NH4Cl溶液中加熟石灰以回收氨,使之循环使用:2NH4Cl+Ca(OH)2(加热)= CaCl2+2NH3↑+2H2O注:以下添加一些实验图:其中甲装置的作用:防倒吸,(气球的作用)缓冲装置内气体压强变化由于NH3及易溶于水,故尾气处理装置应为C装置(倒扣防倒吸装置)。
侯氏制碱法

侯氏制碱法其化学方程式可以归纳为以下三步反应。
(1)NH 3+H2O+CO 2=NH4HCO3(首先通入氨气,然后再通入二氧化碳)(2)NH 4HCO3+NaCI=NH 4Cl+NaHCO 3 J(NaHCO 3溶解度最小,所以析出。
)加热(3)2NaHCO 3=Na2CO3+CO2 f +H2O(NaHCO 3热稳定性很差,受热容易分解)且利用NH4CI的溶解度,可以在低温状态下向(2)中的溶液加入NaCI,则NH4CI析出,得到化肥,提高了NaCI 的利用率。
侯氏制碱法的原理是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行。
也就是很多初中高中教材所说的复分解反应应有沉淀、气体和难电离的物质生成。
他要制纯碱(Na2CO3 ),就利用NaHCO3在溶液中溶解度较小,所以先制得NaHCO3,再利用碳酸氢钠不稳定性分解得到纯碱。
要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用。
分析一下整个过程原料是NH3和CO2以及食盐水发生的反应为:NaCI + NH3 + CO2 +H2O 宀NaHCO3 J + NH4CI进入沉淀池以后,得到NaHCO3进入煅烧炉,煅烧后得到Na2CO3和CO2 , CO2进入循环II,所以X是CO2 , 沉淀池中的母液为食盐水、NH3、Na2CO3和NH4CI的混合物所以可以再次进入沉淀池,其中食盐水是循环利用的NH4CI通过食盐细粉的同离子效应而析出了得到了铵肥,由于NH3被消耗了,所以需要再次补充氨气所以侯氏制碱法中循环利用的是CO2和食盐水好处是产生纯碱的同时,产生了铵肥,同时氯化钠的利用率比较高索氏制碱法分析一下整个流程:原料也是NH3、NH3和食盐水发生的反应为:NaCI + NH3 + CO2 +H2O 宀NaHCO3 J + NH4CICO2是由CaCO3煅烧得到的,产物同时还有CaO在母液中含有的成分为NaCI、NH3、Na2CO3还有CaCI2等其中排除液W包含CaCI2和NaCICaO和母液中的NH4CI结合又生成了NH3可以循环利用,即Y为NH3主要区别:索维尔制碱法===原料利用率低,有CaCI2副产物,几乎无用和侯氏制碱法--原料利用率高,副产物NH4CI,肥料例1 1892年比利时人索尔维以NaCI、CO?、NH3、H2O为原料制得了纯净的Na z CO s,该法又称氨碱法, 其主要生产流程如下:饱和食盐水分离1结晶法分NHQ+ 他物质的溶液MajCOj + |co^ +[pfap](1) 从理论上看,循环生产是否需要再补充NH3?___________________(2) 从绿色化学原料的充分利用的角度看,该方法有二个明显的缺陷是:a ________________________ ;b _______________________________ 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三化学专项训练——侯氏制碱法
1.(05沪)我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1)上述生产纯碱的方法称,副产品的一种用途为。
(2)沉淀池中发生的化学反应方程式是
(3)写出上述流程中X物质的分子式。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了(填上述流程中的编号)的循环。
从沉淀池中取出沉淀的操作是。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
2. 1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。
有关反应的化学方程式如下:
NH3+CO2+H2O NH4HCO3;
NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式;已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是(选填字母)。
a.高温b.低温c.常温d.高压e.低压f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是。
a.碳酸氢钠难溶于水b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
请回答:
①写出甲中发生反应的离子方程式。
②乙装置中的试剂是。
③实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入
气体,再从b管中通入气体。
②装置c中的试剂为(选填字母)。
e.碱石灰f.浓硫酸g.无水氯化钙
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述):。
3.(2010沪)工业生产纯碱的工艺流程示意图如下:
完成下列填空:
1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式:A B
2)实验室提纯粗盐的实验操作依次为:
取样、、沉淀、、、冷却结晶、、烘干。
3)工业生产纯碱工艺流程中,碳酸化时产生的现象是。
碳酸化时没有析出碳酸钠晶体,其原因是。
4)碳酸化后过滤,滤液D最主要的成分是(填写化学式),检验这一成分的阴离子的具体方法是:。
5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。
加石灰水后所发生的反应的离子方程式为:;滤液D加石灰水前先要加热,原因是。
6)产品纯碱中含有碳酸氢钠。
如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:(注明你的表达式中所用的有关符号的含义)
4.(05津)根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。
用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
0℃10℃20℃30℃40℃50℃60℃100℃NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 39.8 NH4HCO311.9 15.8 21.0 27.0 -①---
NaHCO3 6.9 8.1 9.6 11.1 12.7 14.5 16.4 -
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.3 77.3
①:>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30~35℃,是因为若高于35℃,则,若低于30℃,则;为控制此温度范围,采取的加热方法为。
(2)加料完毕后,继续保温30分钟,目的是。
静置后只析出NaHCO3晶体的原因是。
用蒸馏水洗涤NaHCO3晶体的目的是除去杂质(以化学式表示)。
(3)过滤所得的母液中含有(以化学式表示),需加入,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。
写出纯碱样品中NaHCO3质量分数的计算式:
NaHCO3(%)=
温度
溶解度
盐。
