伏安法和极谱的关系
极谱分析法和伏安分析法

-1.26
-
-1.71
-1.66 -1.29 -1.10 -1.35
讨论
三、干扰及其消除方法
(1)残余电流
现象
原因
微量杂质等所产生的微弱电流 电容电流(充电电流):影响极谱分析灵 敏度的主要因素
减小措施
可通过试剂提纯、预电解、除氧等
采用新技术
(2)迁移电流
现象 原因
由于带电荷的被测离子(或带极性的分子)在静电 场力的作用下运动到电极表面所形成的电流
2. 单扫描极谱分析法
原理与装置
又称直流示波极谱法,以示波器为电信 号检测器
电压的扫描速度极快,0.25v/s 在汞滴生长后期,加线性增长的锯齿波 脉冲电压,产生的峰电流值与样品浓度成 正比
阴极射线示波器
X轴坐标:显示扫描电压; Y轴坐标:扩散电流
p= 1/2 - 0.028/n
特点
③ 电流急剧上升阶段 这在半波电位附近 ④ 极限扩散区 此时达到极限电流值, 称为极限电流。
C0 0
δ →常数, id= kC
,
i
C C0
id 称为极限扩散电流
(3)涉及概念
极化
浓差极化及形成条件
极化电极A小,反应离子数/单位面积 大,Cs→0
C低 静止
极化电极与去极化电极
减小措施
加入大量的支持电解质
(3)极谱极大
现象
产生的原因
溪流运动
消除方法
加入小量极大抑制剂 (表面活性剂)
(4) 氧波与氢波
(5) 其他概念: 可逆与不可逆波 氧化波与还原波
伏安法与极谱法
伏安法与极谱法一、概论伏安法与极谱分析是一种特殊的电解方法,以小面积易极化的电极作为工作电极,以大面积不易极化的电极作为参比电极组成电解池,由所得的电流-电压特性曲线来进行定量/定性分析。
以滴汞为工作电极时的伏安法称为极谱法,相对极谱法伏安法重现性较差。
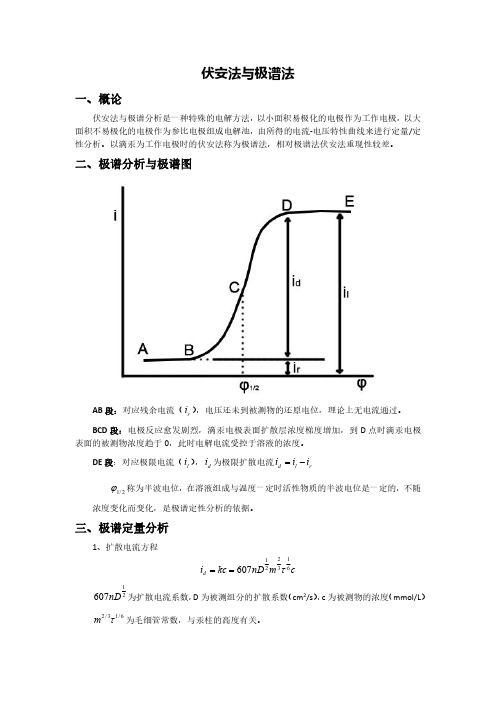
二、极谱分析与极谱图AB 段:对应残余电流(r i ),电压还未到被测物的还原电位,理论上无电流通过。
BCD 段:电极反应愈发剧烈,滴汞电极表面扩散层浓度梯度增加,到D 点时滴汞电极表面的被测物浓度趋于0,此时电解电流受控于溶液的浓度。
DE 段:对应极限电流(l i ),d i 为极限扩散电流rl d i i i -=2/1ϕ称为半波电位,在溶液组成与温度一定时活性物质的半波电位是一定的,不随浓度变化而变化,是极谱定性分析的依据。
三、极谱定量分析1、扩散电流方程cm nD kc i d 613221607τ==21607nD 为扩散电流系数,D 为被测组分的扩散系数(cm 2/s ),c 为被测物的浓度(mmol/L )6/13/2τm 为毛细管常数,与汞柱的高度有关。
2、三切线法测量波高3、标准加入法XS X S S X hV V V H hV c c -+=)(h 为加标准溶液前的波高,H 为加标准溶液后的波高。
4、多组分分别测定:V E 2.0<∆可分别测量四、干扰电流及其消除方法残余电流迁移电流极谱极大氧电流产生微量杂质的电解电流电迁移产生的电流汞滴生长产生的对流效应导致的极谱曲线上的突发电流峰氧气在电极被还原消除作图法扣除加入大量支持电解质(惰性)加入表面活性剂使汞滴表面张力均匀通惰性气体、在中性或碱性下加Na2SO3、强酸中加入Fe 粉五、极谱法特点1、电解是在静止、不搅拌的条件下进行的2、该方法不适用于阴离子的测定,汞滴作阳极时易被氧化3、汞滴与周围溶液始终保持新鲜,保证了在不同电压下的重现性4、汞易纯化,但易堵塞毛细管。
10 第十三章 极谱与伏安法

五、溶液除氧
水溶液中的氧在电极上可分两 步还原: O2+2H++2e=H2O2 -0.2V (O2 + H2O + 2e == H2O2 +2OH-) H2O2+2H++2e=2H2O -0.8V (H2O2 + 2e == 2OH-) 其半波电位正好位于极谱分析 中最有用的电位区间(0~-1.2V) ,。因而重叠在被测物的极谱 波上,故应加以消除。 消除: 通入惰性气体如N2 5~10min, 并在分析过程中通N2保护。
1-空气饱和,出现氧双波 2-部分除氧 3-完全除氧
六、极谱分析的特殊性
与常规电解分析相比,极谱分析是在特殊的电极上和特殊 条件下进行的电解过程。主要表现在:
)1 电极的特殊性;2)电解条件的特殊性;3)测量方法 的特殊性。
电极的特殊性:采用一大一小的电极:大面积的去极化电 极——参比电极;小面积的极化电极-滴汞电极; 电解条件的特殊性:电解是在加入大量支持电解质、静置、 不搅拌的情况下进行。电解过程完全由被测物质从溶液本 体向滴汞电极表面扩散的过程所控制。
id
t
t 0 d
i dt 607 zD m t c
1/2 2/ 3 1/ 6
Ilkoviĉ方程,极谱分析基础
id 607 zD m t c
1/2 2 / 3 1/ 6
Ilkoviĉ方程中单位 i —瞬时极限扩散电流(A) z—电极反应中的电子转移数 D—待测组分的扩散电流(cm2. s-1 ) m—汞流速(mg. s-1 ) t—汞滴下时间(s) c—待测物浓度(mmol.L-1)
disk electrodes.
3、旋转圆盘电极
相同面积的环电极 比盘电极上可以得 到更大的电流,因 而具有更好的灵敏 度。 主要用于痕量分析 和电极过程动力学 研究(屏蔽实验和 捕集实验)
极谱与伏安分析法

2
/ Cd ( Hg )
0.059 [Cd ] lg s 2 [Cd ( Hg )]
• 式中s表示为滴汞电极的表面。 • 当继续增大外加电压,滴汞电极电位变负,电极表 面上镉离子被还原,造成电极表面上镉离子浓度的 减少,而使得其与本体溶液中镉离子浓度产生浓度 差造成极化。
极谱分析的基本原理
5、应用比较广,仪器较为简单、便宜,凡能在电极上起氧化― 还原反应的有机或无机物均可采用,有的物质虽不能在电极上 反应,但也可以间接测定。
一、直流极谱概述:
• 1 .极谱分析的一般装置: • 电解池由滴汞电极和甘汞 电极组成。滴汞电极毛细 管 内 径 为 约 0.05mm , 汞 滴有规则地滴落,增大外 加电压,记录电流 -- 电压 曲线。如图所示:
极谱分析的基本原理
• (2)极谱电流是完全受扩散控制的电解电流:(以 镉离子为例) • 当外加电压从零开始逐渐增大时,滴汞电极电位逐 渐变负,当达到镉离子的析出电位时,汞滴表面上 的镉离子开始还原形成镉汞齐,产生电解电流,此 时在汞滴表面上的镉离子与镉汞齐符合能斯特方程 式,即: 2 s
DME Cd
id it d 607 nD1 / 2 m 2 / 3t 1 / 6 c
0
• 式中t为滴下时间(s),即为尤考维奇公式。
二、极谱定量分析
二、极谱定量分析
• 2.影响扩散电流的主要因素: t id it d 607 nD1 / 2 m 2 / 3t 1 / 6 c 0 • id kc , 只有k 保持不变,极限扩散电流才与被测物质 浓度成正比。影响k 的因素主要有:
i 708 nD1 / 2 m 2 / 3 1 / 6 c
• 式中: n:电子转移数目 D:离子扩散系数(cm2/s) • m:汞流速(mg/s) :汞滴生长时间(s) c:被测物质的 浓度(mmol/L) • 在汞滴生长的周期内,由于电极(汞滴)面积不同,电流也是变 化的。当汞滴落下时,电流迅速降为0,然后上升至imax,电流起 伏较大,难于定量分析,因此需要测量整个滴下时间的平均扩散 电流, t
第15章 伏安法与极谱法..

1 2
毛细管常数
m
2 3
1 6
id kC
极限扩散电流与浓度呈正比 –极谱定量分析的基础
Instrumental Analysis
第15章 伏安法与极谱法
例1:在一定底液中测得1.25×10-3mol· L-1Zn2+的极限 扩散电流id为7.12μA。滴汞流速为1.42mg· s-1,滴下时 间为3.47s,试计算Zn2+在该溶液中的扩散系数、扩散 电流常数和毛细管常数。
b o
Cottrell(柯泰尔)方程 15. 2. 4
id nFAD
扩散层厚度
1/ 2 o
c
t
Do t
Instrumental Analysis
第15章 伏安法与极谱法
15.3 直流极谱法
极谱分析是应用浓差极化现象来 测量溶液中待测离子的浓度的。 15. 3. 1 直流极谱的装置
直流极谱法的基本装置主 要由电子线路组成的极谱 仪和电解池两部分组成, 它包括测量电压、测量电 流和极谱电解池三部分。
Instrumental Analysis
第15章 伏安法与极谱法 对于可逆极谱波,极 谱波上任何一点的电流 都是受扩散速度控制。 对于不可逆极谱波, 一般情况下在波的底部, 电流完全受电极反应的 速度所控制;在波的中 部,电流既受电极反应 速度控制也受扩散速度 控制;达到极限电流时, 完全受扩散速度控制。
第15章 伏安法与极谱法
三. 定量分析方法 1. 直接比较法 将浓度为cs的标准溶液及浓度为cx的未知溶液在 同一实验条件下,分别测得极谱波的波高hs及hx 根据:hs=kcs
hx=kcx
hx cs 求出未知液的浓度 cx hs
伏安法和极谱法

迁移电流
产生的原因:由于带电荷的被测离子(或带极性的分子) 在静电场力的作用下运动到电极表面所形成的电流。 这种由于电极对被分析离子的静电吸引力而引起的电迁 移作用,而使更多的离子趋向电极表面,并在电极上还原 所产生的电流称为迁移电流。迁移电流与被分析物质的浓 度之间并无定量关系,故应加以消除。 消除方法:加强电解质。加强电解质后,被测离子所 受到的电场力减小。 加入的惰性电解质称为“支持电解质”。它是一些能 够导电但在该条件下不能在电极上起电极反应的所谓惰性 电解质,如氯化钾、盐酸、硫酸等。一般支持电解质的浓 度要比被测物质浓度大50-100倍。
铂丝
贮汞瓶
塑料管 毛细管
图1 滴汞电极
E外=c-w+iR
c代表饱和甘汞电极(阳极)的电位, w代表滴汞电极(阴极)的电位,R为回 路中的总电阻.当电流过小时,iR可忽略 不计,Cl-会因参与反应而消耗,但由于 电解电流很小,故消耗的Cl-很少,而饱 和氯化钾溶液中很大,故饱和甘汞电极 的电位在电解过程中基本保持恒定。 图2 极谱分析基本装置 此时滴汞电极电位在数值上就等于外加电压(符号不同),其 电位会随着外加电压的变化而变化,是极化电极。
图4 极谱波
在极谱分析中,滴汞电极面积小,电流密度大,[Cd2+]小, 易发生浓差极化称为极化电极,它的电位随外加电压的变化 而变化;参比电极的表面积较大电解电流较小(微安级), [Cl-]又很大,没有明显的浓差极化现象,它的电位很稳定 ,不随外加电压而变化,称为去极化电极。极谱波的产生是 由于在极化电极上出现浓差极化现象而引起的,所以其电流 -电位曲线称之为极化曲线或极谱波,极谱的名称也是由此 而来的。
1-空气饱和,出现氧双波 2-部分除氧 3-完全除氧
图6 氧气对极谱波的影响
第十二章伏安法与极谱法
三、极谱波形成条件:
1. 待测物质的浓度要小,快速形成浓度梯度。 2. 溶液保持静止,使扩散层厚度稳定,待测物质仅依 靠扩散到达电极表面。 3. 电解液中含有较大量的惰性电解质,使待测离子在 电场作用力下的迁移运动降至最小。 4. 微电极电解。极化电极的电位随外加电压变化而变, 保证在电极表面形成浓差极化。
参比电极为去极化电极:采用SCE饱 和甘汞电极,电极面积较大,通过极谱电 解池的电流很小,电解时的电流密度小, 不会引起面积较大的参比电极电位的显著 变化,电位恒定。
⑵. 电解条件的特殊性 加入大量的支持电解质,并在溶液静止的条件下进行的非
完全的电解过程。 电解过程中,电流的大小主要取决于离子到达电极表面的
二、极谱波的形成
每加一次电压,记录一次电流。以电流为纵坐标,电压为 横坐标作图,得电流——电压曲线,称为极谱波。以电解10-3 mol/L Cd2+的 0.1 mol/L KNO3溶液为例,所得极谱波如图:
U
1. ab段:残余电流 外加电压没达到Cd2+的分解电压前,仅有微小
的电流流过电解池,称为残余电流,用ir表示。 产生的原因是:溶液中微量的更易还原的杂质
一般都可用极谱法,还常用于化学反应机理及动力学过程 的研究及配合物的组成、化学平衡常数的测定等。
四、极谱伏安分析法的分类
极谱分析法
直流极谱法 单扫描极谱法 方波极谱法 脉冲极谱法 计时电位极谱法 交流极谱法
伏安分析法
循环伏安法 溶出伏安法
阳极溶出伏安法 阴极溶出伏安法
§12-2 直流极谱法基本原理
电解电流 充电电流
(a)微量杂质等所产生的微弱电流; 溶剂及试剂中的混入的微量杂质及微量氧等在电极上还
原产生的,杂质的电解电流通常很小。 (b)充电电流(也称电容电流):影响极谱分析灵敏度的 主要因素。
极谱-伏安法
极谱分析的特点
• ① ② ③ ④ ⑤ ⑥ 主要用于研究氧化还原、表面吸附、电极表面 电子转移机制。有时亦用于水相中无机离子或 某些有机物的测定。 电极:参比:大—去极化;工作:小—极化。 静置、不搅拌。 滴汞保持更新─保证重现。 氢过电位大。 滴汞电位不能超过+0.4V。不适于阴离子。 汞易纯化,但有毒,易堵塞毛细管。
• 极谱法定性依据。
• 作图→n、 1/2
极谱波方程(3)
• 简单金属离子、可逆极谱波。滴汞电极上发生还原反应:
RT (i d )c i c 1/ 2 ln nF ic
滴汞电极上发生氧化反应:
1/ 2 ia RT ln nF (i d )a i a
两种离子共存,且氧化态和还原态电位相近,可得混合极谱 波。如 1mol/L HCl 介质中,Tl++e = Tl (-0.55V); Tl2++e = Tl+ (0.77V)
2.3.1 极谱分析
• 阳极(参比):SCE。 • 阴极(工作):滴汞电极。 • 外加电压: – U外 = △ + iR
– i小(几微安), iR 项可忽略, 可认为电位恒定。 Hg2+:0.845 V Hg22+:0.793 V SCE:0.3356 V
极谱图
• 0.5mmol/L PbCl2,100-200 mV/min。
-1.10 -1.35
• 半波电位范围较窄(2V),经典极谱法定性并不实用。
应用
• 同一离子在不同溶液中1/2 不同。络离子1/2更负; • 两离子1/2接近或重叠时, 选用不同底液,可有效分 离,如Cd2+和Tl+在NH3和 NH4Cl溶液中可分离( Cd2+ 生成络离子);
伏安和极谱分析法
电极上的电压,并记录电流的
变化——绘制i-U曲线。如左
图所示。例如:当以100-200 mV/min的速度对盛0.5mol/L CdCl2溶液施加电压时,记录 电压U对电流i的变化曲线。
-:未达分解电压U分,随外加电压U外的增加,只有一微小电流通过电
解池——残余电流ir
②-③:继续施加电压,达到Cd2+的分解电压后,滴汞表面的Cd2+便开始还 原,随即形成Cd(Hg),产生电解电流
因此只要测量波高就可求出C 1)、平行线法 通过极谱法的残余电流 部分和极限电流部分作两条 平行线,两线间的垂直距离h, 即为波高:
2)、三切线法 通过残余电流、极限电流和扩 散电流部分分别作三条切线:相交 于O和P点,过O点与P点作二条与横 坐标平行的平行线,两线间的垂直 距离为波高:此法方便,适用于不 同的波形,故应用广泛。
④-⑤:外加电压继续增加,C0趋近于0, (C-C0)趋近于C时,这时电流不再增加,达 到一个极限值──极限电流il,极谱波出现 一个平台,极限电流与残余电流之差称为 极限扩散电流id,也叫波高。 即: id =il-ir (极谱定量分析的基础) 并知: id = KC E1/2: 半波电位:扩散电流为极限扩散电流一 半时对应的电位 (极谱定性的依据).
伏安和极谱分析法
直流极谱法概述及极谱图
极谱定量分析基础 实验技术
新的极谱和伏安分析法
应用
一、什么是伏安和极谱分析法
伏安和极谱分析法是根据测量特殊形式电解过程中的电流― 电位(电势)或电流―时间曲线来进行分析的方法。是电分析化 学的一个重要分支。 1)采用一大一小的电极:大面积的去极化电极——参比电极;小 面积的极化电极; 2)电解是在静置、不搅拌的情况下进行。
第3章 极谱与伏安分析法
三、极谱法的分类
极谱法分为控制电位极谱法和控制电流极谱法两大类。 在控制电位极谱法中,电极电位是被控制的激发信号 ,电流是被测定的响应信号。 在控制电流极谱法中,电流是被控制的激发信号,电 极电位是被测定的响应信号。 控制电位极谱法包括直流极谱法、交流极谱法、单扫描极 谱法、方波极谱法、脉冲极谱法等。控制电流极谱法有示 波极谱法。此外还有极谱催化波、溶出伏安法。
16:04:20
第二节 极谱分析的基本原理
把一切基于研究电解过程中i—U关系曲线特性而建立 起来的电化学分析方法统称为伏安法。以滴汞电极(DME) 做工作电极的伏安法称之为极谱法。 一、极谱分析的基本装置(如图所示) 极谱分析是一种在特殊条件下进行的电解过程。特殊 性表现在两个方面:
16:04:20
说明:a.为了更好地消除iR降的影响,目前多数仪器使用
三电极系统(见后); b. 极谱波呈锯齿状。
16:04:20
极谱波呈锯齿状
16:04:20
第 三 节 扩散电流方程式----极谱定量分析的基础 一、扩散电流方程式---尤考维奇方程式
仍以Cd2+的测定为例进行推导,当U外≥φCd2+,分, φde≤φCd2+,析时, Cd2+开始在DME上还原,有电流产生,电极反应如下: DME(阴极): Cd2+ + 2e- + Hg===Cd(Hg)
2、温度
实验证明,室温时,温度每升高1摄氏度,将使扩散电流约增加
1.3% ,所以,在极谱法中要求温度固定。
3、溶液组分
扩散系数与溶液的粘度有关,粘度越大,物质的扩散系数越小,因 此扩散电流也随之减小。溶液组分不同其黏度也不同,对扩散电流的影 响也随之不同。
