国家食品药品监督管理局药品补充申请-境外申请人用表
药品补充申请注册事项及申报资料要求 局第28号令 附件4

附件4:药品补充申请注册事项及申报资料要求一、注册事项(一)国家食品药品监督管理局审批的补充申请事项:1.持有新药证书的药品生产企业申请该药品的批准文号。
2.使用药品商品名称。
3.增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症。
4.变更用法用量或者变更适用人群范围但不改变给药途径。
5.变更药品规格。
6.变更药品处方中已有药用要求的辅料。
7.改变影响药品质量的生产工艺。
8.修改药品注册标准。
9.替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。
10.进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。
11.申请药品组合包装。
12.新药的技术转让。
13.修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。
14.改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等。
15.改变进口药品的产地。
16.改变进口药品的国外包装厂。
17.进口药品在中国国内分包装。
18.其他。
(二)省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监督管理局直接备案的进口药品补充申请事项:19.改变国内药品生产企业名称。
20.国内药品生产企业内部改变药品生产场地。
21.变更直接接触药品的包装材料或者容器(除上述第10事项外)。
22.改变国内生产药品的有效期。
23.改变进口药品制剂所用原料药的产地。
24.变更进口药品外观,但不改变药品标准的。
25.根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。
26.补充完善进口药品说明书安全性内容。
27.按规定变更进口药品包装标签。
28.改变进口药品注册代理机构。
29.其他。
(三)省级食品药品监督管理部门备案的补充申请事项:30.根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书。
药品补充申请申报程序及资料要求

精品课件
省局备案程序
➢形式审查(5个工作日内)
申请资料不当,允许申请人当场更正;或者 5日内一次告知申请人需要补正的全部内容,
符合要求的,出具受理通知书,并将备案资 料交省局审评中心注册处;
不符合要求的,不予受理通知书,并说明理 由。
精品课件
省局备案程序
➢技术审评
药品注册检验时间一般为30个工作日,同时进行标准复核为 60工作日;特殊药品和疫苗类制品 60工作日,同时进行标 准复核为90工作日。
精品课件
省局审批,国家局备案
➢审查结果:
省局自收到检验通知10日内完成审查并出具批 准意见。
批准后3个工作日内告知申请人: 符合规定,发给《药品补充申请批件》,并 上报国家局备案。 不符合规定,发《审批意见通知件》,并说 明理由。
第10项外)。 改变国内生产药品的有效期。 改变进口药品制剂所用原料药的产地。 变更进口药品外观,但不改变药品标准的。
精品课件
根据国家药品标准或者国家食品药品监 督管理局的要求修改药品说明书。
补充完善药品说明书安全性内容。 按规定变更进口药品包装标签。 改变进口药品注册代理机构。 其他。
注册事项中未列事项,可选“其他”项,并填 入事项说明。如:修改药品名称,填写新的药 品名称,并在“其他”事项注明“修改药品名 称”。
精品课件
证明性文件
批准证明文件,属换发批准文号的以换发文 号为起点,2002年以后(含2002年)以生产 批件或新药证书为准,应能够清晰了解该品 种完整的历史演变过程和目前状况。
精品课件
事项变更
原报国家局审批的事项““变更直接接 触药品的包装材料或者容器”分为:
进口药品、国内生产的注射剂、眼用制剂、气 雾剂、粉雾剂、喷雾剂变更直接接触药品的包 装材料或者容器;使用新型直接接触药品的包 装材料或容器。--报国家局审批
国家食品药品监督管理局关于进口药品再注册有关事项的公告

国家食品药品监督管理局关于进口药品再注册有关事项的公告文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2009.01.07•【文号】国食药监注[2009]18号•【施行日期】2009.01.07•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于进口药品再注册有关事项的公告(国食药监注[2009]18号)根据《药品注册管理办法》的有关规定,国家食品药品监督管理局对进口药品再注册和分包装申报、受理、审批,再注册核档程序、再注册期间临时进口和分包装、再注册涉及的补充申请,再注册和补充申请注册证编发等有关事项,进一步作了规范。
现公告如下:一、关于再注册和分包装的申报、受理和审批事项(一)根据《中华人民共和国药品管理法实施条例》和《药品注册管理办法》的规定,进口药品再注册申请应当在《进口药品注册证》或《医药产品注册证》有效期届满前6个月内提出。
(二)进口药品分包装用大包装规格的《进口药品注册证》或《医药产品注册证》可以申请再注册,但必须与原小包装的《进口药品注册证》或《医药产品注册证》同时申报,分别填写《药品再注册申请表》,共用一套申报资料。
国家食品药品监督管理局予以同时受理,对符合要求的,分别出具大包装规格和原小包装规格的再注册申请受理通知单,同时办理再注册手续。
(三)申请进口药品境内分包装的,可在大包装规格进口再注册的申请获得批准后,填写《药品补充申请表》,提交新的大包装规格的《进口药品注册证》或《医药产品注册证》复印件(加盖申报单位的公章),以及《药品注册管理办法》规定的进口药品分包装所需的其他有关资料,向分包装企业所在地省级药品监督管理部门申报进口药品分包装。
省级药品监督管理部门应当在5日内对申报进口分包装的资料进行审查,符合要求的,出具受理通知单,并将全部资料寄送国家食品药品监督管理局行政受理服务中心(以下简称受理中心)。
国家食品药品监督管理局对进口药品分包装申请进行审查,符合规定的,发给《补充申请批件》;不符合规定的,发给《审批意见通知件》。
报国家食品药品监督管理局备案的药品补充申请分类及申报资料要求
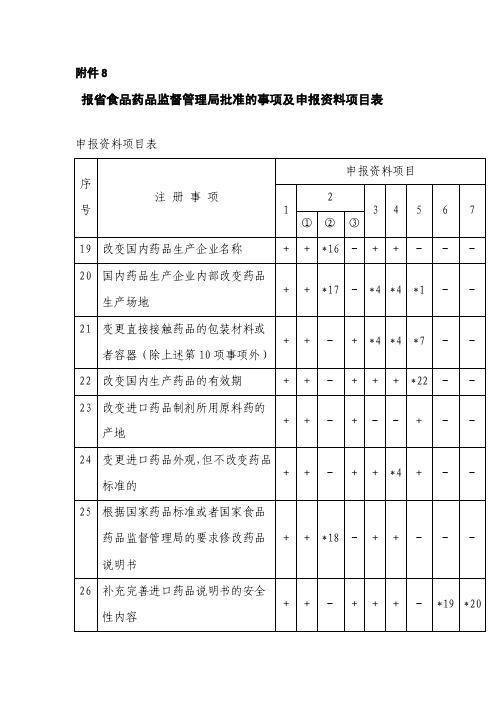
附件8报省食品药品监督管理局批准的事项及申报资料项目表申报资料项目表注:*1.仅提供连续3个批号的样品检验报告书。
*2.提供商标查询单。
*3.提供临床使用情况报告或文献。
*4.如有修改的应当提供。
*5.仅提供质量研究工作的试验资料及文献资料、药品标准草案及起草说明、连续3个批号的样品检验报告书。
*6有关毒性药材、处于濒危状态药材的证明文件,或者有关部门要求进行替代、减去的文件、证明。
*7.仅提供连续3个批号的样品检验报告书、药物稳定性研究的试验资料、直接接触药品的包装材料和容器的选择依据及质量标准。
*8.按照中药、天然药物、化学药品、生物制品注册分类中已在国外上市但尚未在国内上市销售的复方制剂的相应资料要求提供。
其中药学研究部分仅提供药物稳定性研究的试验资料、直接接触药品的包装材料和容器的选择依据及质量标准、连续3个批号的样品检验报告书。
*9.同时提交新药证书原件。
*10.提供技术转让有关各方签订的转让合同,原生产企业放弃生产的应当提供相应文件原件。
*11.国家食品药品监督管理局根据评价需要另行提出要求。
*12.提供包装厂所在国家或地区药品管理机构出具的该药品包装企业符合药品生产质量管理规范的证明文件。
*13.仅提供分包装工艺、药物稳定性研究的试验资料、直接接触药品的包装材料和容器的选择依据及质量标准、连续3个批号的样品检验报告书。
*14.提供进口药品分包装合同(含使用进口药品商标的授权)。
*15.仅提供分包装工艺、直接接触药品的包装材料和容器的选择依据及质量标准。
*16.提供有关管理机构同意更名的文件复印件,更名前与更名后的营业执照、《药品生产许可证》、药品生产质量管理规范认证证书等的复印件。
*17.提供有关管理机构同意药品生产企业变更生产场地的证明文件。
*18.提供新的国家药品标准或者国家食品药品监督管理局要求修改药品说明书的文件。
*19.可提供毒理研究的试验资料或者文献资料。
*20.可提供文献资料。
药品注册管理—进口药品、仿制药品、补充申请、再注册的管理

期、国内药品 审批,同时通知申请人。修改药品注
生产企业内部 改变药品生产
册标准的补充申请,必要时由药品检
场地等的补充 验所进行标准复核。
申请
(二)审批
按规定变更 药品包装标 签、根据国 家局的要求 修改说明书 的补充申请
报省级药品监督管理部门备案
由SFDA审批。
1.申请进 口药品分 包装要求
(5)除片剂、胶囊剂外 ,分包装的其他剂型应 当已在境外完成内包装
(4)分包装的药品应 与受托方所持有的许可 证和药品GMP证书上载
明的生产范围一致
(3)同一制药厂商的同 一品种应当由一个药品 生产企业分包装,分包 装期限一般不超过5年
(四)进口药品分包装的申报与审批
审批意见通知件
与
国家食品药品监督管理局
检验报告
审
同意 药
申请人
程
进口药品、仿制药品、补充 申请、再注册的管理
二、进口药品注册管理
( 一 ) 申请进口药品的要求
申请进口的药品必须获得境外制药厂商所在生产国家或者地区的
1 上市许可。未在生产国家或者地区获得上市许可,经国家食品药 品监督管理局确认该药品安全、有效而且临床需要的,可以批准 进口。
(二)进口药品再注册
《进口药品注册证》、《医药产品注册证》有效期5年。有效期届 满前6个月提出再注册申请。
(三)进口药品分包装的申报与审批
(1)申请分包装的药 品已经取得《进口药品 注册证》或《医药产品 注册证》
(2)该药品应当是中 国境内尚未生产的品种 ,或者虽有生产但是不 能满足临床需要的品种
进口药品的 补充申请
其中改变进口药品制剂所用原料药的产地、 变更进口药品外观但不改变药品标准、根据 国家药品标准或SFDA的要求修改说明书、补
药品注册管理办法(局令第28号)附件4 药品补充申请注册事项及申报资料要求

附件4:药品补充申请注册事项及申报资料要求一、注册事项(一)国家食品药品监督管理局审批的补充申请事项:1.持有新药证书的药品生产企业申请该药品的批准文号。
2.使用药品商品名称。
3.增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症。
4.变更用法用量或者变更适用人群范围但不改变给药途径。
5.变更药品规格。
6.变更药品处方中已有药用要求的辅料。
7.改变影响药品质量的生产工艺。
8.修改药品注册标准。
9.替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。
10.进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。
11.申请药品组合包装。
12.新药的技术转让。
13.修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。
14.改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等。
15.改变进口药品的产地。
16.改变进口药品的国外包装厂。
17.进口药品在中国国内分包装。
18.其他。
(二)省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监督管理局直接备案的进口药品补充申请事项:19.改变国内药品生产企业名称。
20.国内药品生产企业内部改变药品生产场地。
21.变更直接接触药品的包装材料或者容器(除上述第10事项外)。
22.改变国内生产药品的有效期。
23.改变进口药品制剂所用原料药的产地。
24.变更进口药品外观,但不改变药品标准的。
25.根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。
26.补充完善进口药品说明书安全性内容。
27.按规定变更进口药品包装标签。
28.改变进口药品注册代理机构。
29.其他。
(三)省级食品药品监督管理部门备案的补充申请事项:30.根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书。
国家食品药品监督管理局药品补充申请表 - 法律文书

国家食品药品监督管理局药品补充申请表-法律文书原始编号:_________受理号:_________申请事项1.注册事项分类:报国家食品药品监督管理局备案的补充申请事项:2.本品种属于:3.药品分类:药品情况4.药品通用名称:5.英文名/拉丁名:汉语拼音6.其他名称:7.商品名称:8.制剂类型:9.规格:10.包装:11.药品有效期:12.新药证书编号:批准日期:13.药品批准文号:批准日期:有效期截止日期:14.处方内辅料(含处方量):15.制剂中化学原料药来源:序号来源原料药名称批准文号(注册号或受理号)生产企业16.药品标准:来源:17.主要适应症或者功能主治:18原企业信息:生产企业名称:生产地址:补充内容19.补充申请的内容:药品生产企业地址变更为:20.原批准注册的相应内容:21.申请理由:22.品种清单:序号药品名称(通用名)剂型规格批准文号(注册证号)相关情况23.是否特殊管理药品:24.专利:有外国专利专利名称:专利权人:25.同品种药品保护:26.新药监测期:申请人27.机构1(国内药品生产企业):有本机构负责缴费名称:组织机构代码:《药品生产许可证》编号:法定代表人:职位:注册地址:邮政编码:生产地址:邮政编码:注册申请负责人:职位:电话(含区号及分机号):传真:电子信箱:注册证所在省份:联系人:手机号码:电话:是否持有相应的《药品生产质量管理规范》认证证书:持有28.机构2(新药证书持有人):29.机构3(新药证书持有人):30.机构4(新药证书持有人):31.机构5(新药证书持有人):32.其他新药证书申请人:33.指定联系机构:机构为指定联系机构邮政编码:通讯地址:对本项注册申请单独以该机构名义提交的文件是否能够代表全部申请机构资料目录34.所报资料目录:1、药品批准证明文件及其附件的复印件。
2、证明性文件:(1)《药品生产许可证》、营业执照、《药品生产质量管理规范》认证证书复印件。
药品注册申请表格模板填表格模板说明

药品注册申请-填表说明我保:本内容是各申机构于本申切合法律、法和章的重保,各申机构当一致赞同。
品上市可拥有人:切合《品上市可拥有人制度点方案》点行政地区、点品种范和申人条件,申成品上市可拥有人的申人,依据申人状况勾“生企” 或“研机构”或“科研人” ,并填写第二机构 1(受托生企)和机构 2(申人)有关的内容。
(注:《品上市可拥有人制度点方案》正式印后,能够填写有关内容。
)其余特声明事:需要另行声明的事。
1.本申属于:系指假如属于申国注册品种“国品注册” ,假如属于申口注册“ 口品注册” ,假如属于申港澳台注册“港澳台医品注册”。
本必目。
2.申分:按品注册申的分填写,属新的,新申;属按新管理的,新管理的申;属申仿造已有国家准的,仿造申。
本必目。
3.申事:依照申申事填写。
申床研究(包含附带申免床研究的),床;申生,生;若申新的,新。
本必目。
当申分新申或按新管理的申,生和新多;当仿造申,只好床或生。
4.品注册分:品分及注册分依照《品注册管理法》附件一、附件二、附件三中的有关分要求。
本必目。
(系置下拉菜。
中置 1、2、3、4、5、6.1.1 、6.1.2 、6.1.3 、6.2 、 6.3 、7、8、9 ;化置1、2.1 、2.2 、 2.3 、2.4 、3、4、5.1 、5.2 ;生物制品挨次置 1、2、⋯、 15)。
假如是新或按新管理,化注册分只好1-2 ,中只好 1-8 ,生物制品不限制;假如是仿造,化注册分只好3-4 ,中只好9,生物制品不可以。
5.附带申事:在申分和品注册分定后,好像申非方,非方,此不,默申方;如申仿造的品属于按非方管理的,此必非方;同申减免床研究,减或免床研究;属于《品注册管理法》第四条定的新申申特别批的可特别批程序如了特别批程序,填写“ 品注册特别批程序申表” 。
属于上述申之外的其余附带申事(如申Ⅰ期床等),可其余。
“其余”的,当要填写申事。
国药品通用名称》或其补充本收载的药品通用名称。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国家食品药品监督管理局药品补充申请-境外申请人用表国家食品药品监督管理局药品补充申请-境外申请人用表声明我们保证:①本申请遵守《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》和《药品注册管理办法》等法律、法规和规章的规定;②申请表内容及所提交资料、样品均真实、来源合法,未侵犯他人的权益,其中试验研究的方法和数据均为本药品所采用的方法和由本药品得到的试验数据;③一并提交的电子文件与打印文件内容完全一致。
如查有不实之处,我们承担由此导致的一切法律后果。
其他特别申明事项:申请事项1 本申请属于:进口注册2 药品分类:〇中药〇天然药物〇化学药物〇按药品管理的体外诊断试剂〇治疗用生物制品〇预防用生物制品〇药用辅料3 是否OTC:〇处方药〇非处方药4 原申请品种状态:〇已上市〇已批准临床〇在审评或审批中5 申请事项分类:〇报国家食品药品监督管理局审批的补充申请事项:□持有新药证书的药品生产企业申请该药品的批准文号; □使用药品商品名称; □增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症; □变更用法用量或者变更适用人群范围但不改变给药途径;□变更药品规格;□变更药品处方中已有药用要求的辅料;□改变影响药品质量的生产工艺;□修改药品注册标准;□替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材; □进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;□使用新型直接接触药品的包装材料或者容器; □申请药品组合包装;□新药技术转让; □修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目;□改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等;□改变进口药品的产地;□改变进口药品的国外包装厂; □进口药品在中国国内分包装; □其他;〇报省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监督管理局直接备案的进口药品补充申请事项:□改变国内药品生产企业名称; □国内药品生产企业内部改变药品生产场地; □变更直接接触药品的包装材料或者容器(除上述第10事项外);□改变国内生产药品的有效期; □改变进口药品制剂所用原料药的产地; □变更进口药品外观,但不改变药品标准的; □根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书; □补充完善进口药品说明书安全性内容; □按规定变更进口药品包装标签; □改变进口药品注册代理机构; □进口药品分包装;□其他〇报省级食品药品监督管理部门备案的补充申请事项:□根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书; □补充完善国内生产药品说明书安全性内容; □按规定变更国内生产药品包装标签; □变更国内生产药品的包装规格; □改变国内生产药品制剂的原料药产地; □变更国内生产药品外观,但不改变药品标准的; □进口药品分包装; □其他;本表必须使用SFDA制发的申请表填报软件填写、修改和打印。
不得涂改。
数据核对码:XXXXXXXXXX 第X 页共Y 页药品情况6 药品通用名称:______________________________________7 英文名称/拉丁名称:______________________________________8 汉语拼音:______________________________________9 化学名称:______________________________________10 商品名:______________________________________11 制剂类型:非制剂:〇原材料〇中药材〇中药材新的药用部位〇有效成分〇有效部位〇制剂中间体〇辅料〇其它______________制剂:〇中国药典剂型______________________________________〇非中国药典剂型______________________________________〇特殊剂型______________________________________12 规格:______________________________________13 同品种已被受理或同期申报的其他制剂及规格:______________________________________14 包装:直接接触药品的药包材:___________________________________________包装规格:___________________________________________15 药品有效期:_____个月16 处方(含处方量):活性成分/中药药味/...:________________________________________ ___辅料: ___________________________________________17 原/辅料来源:序号原/辅料批准文号/注册证生产企业名执行是否有变更获准名称号/受理号称标准变更情况及批准机构18 中药材标准:序号药材名称是否法定标准来源执行标准是否有变更变更获准情况及批准机构19 适应症或功能主治:适应症分类: ____ ________{适应症}补充内容20 补充申请的内容:{补充申请的内容}21 提出现补充申请理由:{提出现补充申请理由}22 原批准注册内容及相关信息:原申请受理号:________________________________________临床批件编号:________________________________________原进口药品注册证号/医药产品注册证号:________________________________________ 药品标准编号:________________________________________本表必须使用SFDA制发的申请表填报软件填写、修改和打印。
不得涂改。
数据核对码:XXXXXXXXXX 第X 页共Y 页相关情况23 专利情况:□有中国专利:□化合物专利;□处方专利;□工艺专利;□其他专利;专利号: __________________专利权人: __________________专利授权/公开日期: ___________□有外国专利专利号: __________________专利权人: __________________专利授权/公开日期: __________专利权属声明: 我们声明:本申请对他人专利不构成侵权。
24 中药品种保护中药品种保护,终止日期:______________25 新药监测期:终止日期:___________26 本次申请为〇首次申请〇多次申请第__次申请□曾经撤回,日期:______________ 原因:______________□曾经被不予批准,日期: ______________,原因:___________ ___申请人及委托研究机构27.机构1(境外制药厂商):□本机构负责缴费中文名称:_____________________英文名称:_____________________法定代表人:_____________________ 职位:_____________________注册地址:_____________________ 国家或地区:_____________________ 注册申请负责人:_____________________ 职位:_____________________电话:_____________________ 传真:_____________________电子信箱:_____________________法定代表人(签名): (加盖公章处)年月日28 机构2(进口药品生产厂):□本机构负责缴费中文名称:_____________________英文名称:_____________________法定代表人:_____________________ 职位:_____________________生产地址:_____________________ 国家或地区:_____________________ 注册申请负责人:_____________________ 职位:_____________________电话:_____________________ 传真:_____________________电子信箱:_____________________法定代表人(签名): (加盖公章处)年月日29 机构3(进口药品国外包装厂):□本机构负责缴费中文名称:_____________________英文名称:_____________________法定代表人:_____________________ 职位:_____________________生产地址:_____________________ 国家或地区:_____________________ 本表必须使用SFDA制发的申请表填报软件填写、修改和打印。
不得涂改。
数据核对码:XXXXXXXXXX 第X 页共Y 页注册申请负责人:_____________________ 职位:_____________________电话:_____________________ 传真:_____________________电子信箱:_____________________法定代表人(签名): (加盖公章处)年月日30 机构4(进口药品分包装厂):□本机构负责缴费中文名称:_____________________英文名称:_____________________组织机构代码:_____________________《药品生产许可证》编号: _____________________法定代表人:_____________________ 职位:_____________________注册地址:_____________________ 邮编:_____________________通讯地址:_____________________ 邮编:_____________________注册申请负责人:_____________________ 职位:_____________________电话:_____________________ 传真:_____________________电子信箱: _____________________ 手机:_____________________法定代表人(签名): (加盖公章处)年月日31 机构5(进口药品注册代理机构):□本机构负责缴费中文名称:_____________________英文名称:_____________________组织机构代码:_____________________法定代表人:_____________________ 职位:_____________________注册地址:_____________________ 邮编:_____________________通讯地址:_____________________ 邮编:_____________________注册申请负责人:_____________________ 职位:_____________________联系人:_____________________ 职位:_____________________电话:_____________________ 传真:_____________________电子信箱: _____________________ 手机:_____________________法定代表人(签名): (加盖公章处)年月日32 委托研究机构:序号研究项目研究机构名称研究负责人联系电话本表必须使用SFDA制发的申请表填报软件填写、修改和打印。
