九年级化学溶质的质量分数复习PPT优秀课件
合集下载
人教版-化学-九年级下册-精品课件9.3 溶质的质量分数

100%
溶液质量=溶液中溶质质量+溶剂质量
溶液中溶质的质量=溶液的质量×溶质的质 量分
数
请填空:
溶质质量 溶剂质量 溶液质量 溶质质量
/g
/g
/g
分数
10
190
200
10%
4
96
100
4%
24
126
150
35.7
100 135.7
16%
26.3%
3,与浓稀关系:
溶质质量分数越大,溶液越浓;
(1)77.9% (2)4.4g (3)5.3%
而溶液的质量有两种求法: ➢溶液的质量=溶质质量+溶剂质量 ➢利用质量守恒定律:反应前后的
物质总质量不变。
例题:
32.5克锌粒与280克稀硫酸恰好完全 反应。试求:
(1)稀硫酸中溶质的质量分数。 (2)生成物溶液中溶质的质量分数。
(1)17.5% (2)25.8%
练一练:
1、使30克某盐酸A与6.5克锌反应,锌有剩 余;再加40克7.3%的盐酸,恰好跟剩余的 锌完全反应。计算:
换算公式:溶液质量=溶液体积 ,× 溶液密度 单位要统一。
不同溶液的体积不__能__(能不能)相加。
在溶液中进行的化学反应,进行有关计算 时应注意以下几点:
➢不能将溶液的质量代入化学方程式进 行计算。应先将溶质的质量利用质量 分数的表达式求出来。
求反应后所得溶液中溶质的质量分 数时,溶质质量可由化学方程式的 计算直接求得。
4,20˚C时食盐的溶解度是36克,求该温 度下食盐饱和溶液中溶质的质量分数。
5,配制质量分数为20%的氢氧化钠溶 液100克,需质量分数为80%的氢氧化 钠溶液多少克?
《溶质的质量分数》(化学精品课件)
投入49克稀硫酸中,恰好完全反应,生成0.2克氢 气,试求: (1)黄铜中锌的质量分数是多少? (2)反应后所得溶液的溶质的质量分数是多少?
6、根据图示回答下列问题 溶 解 度
30
N
0
.t
.
.
A B C
M
1
t2 t3
温度(℃)
4、将三种物质的饱和溶液由t3℃降低到t1℃时, 1、将t3℃时三种物质的饱和溶液降低温度至 2.在t3℃时,将100克A、B、C三物质的饱和溶液 所得溶液中溶质的质量分数由大到小顺序为 5.若想分离A、B两物质,应该用 法。 t1℃,有晶体析出的是 ,析出晶体质量最多 3、t3℃时,将接近饱和的C物质溶液变成饱 ____________. 分别蒸发10克水,析出晶体的质量关系是____. 若从A溶液中得到全部的A,宜采用的方法是__ 的是 。 和溶液,可采用的方法是_________.
饱和溶液的
溶解度
溶质质量分数=
100g+溶解度
S>A 则S与A的大小关系是_____________.
想一想,练一练:
1. 10℃时硝酸钾的溶解度为ag,其饱和溶液的溶 质质量分数为b%,60℃时硝酸钾的溶解度为 cg,下列数值关系正确的是 ( C )
A. a=b, a<c B. a<b < c C. b<a <c D. c<a <b
六朝古都南京的一些古代建筑保存完好,这与所用 的建筑材料有关。该小组从某古代建筑维修现场搜 集了一些旧墙灰进行研究。取12.O g旧墙灰(主要 成分是碳酸钙)放入烧杯中,并加入足量稀盐酸(假 设其他杂质不参加反应,不考虑H20、HCl逸出)。 反应开始时,烧杯及所盛物质的总质量为300.0 g。 实验数据记录如下:
现有石灰石22.2克加到盛有146克稀盐酸 的烧杯中,恰好完全反应,反应后烧杯中的物质 质量为159.4克. (杂质不与盐酸反应)求: (1)、生成二氧化碳多少克? (2)、稀盐酸的质量分数? (3)、石灰石中碳酸钙的质量分数? (4)、反应后所得溶液的质量分数?
6、根据图示回答下列问题 溶 解 度
30
N
0
.t
.
.
A B C
M
1
t2 t3
温度(℃)
4、将三种物质的饱和溶液由t3℃降低到t1℃时, 1、将t3℃时三种物质的饱和溶液降低温度至 2.在t3℃时,将100克A、B、C三物质的饱和溶液 所得溶液中溶质的质量分数由大到小顺序为 5.若想分离A、B两物质,应该用 法。 t1℃,有晶体析出的是 ,析出晶体质量最多 3、t3℃时,将接近饱和的C物质溶液变成饱 ____________. 分别蒸发10克水,析出晶体的质量关系是____. 若从A溶液中得到全部的A,宜采用的方法是__ 的是 。 和溶液,可采用的方法是_________.
饱和溶液的
溶解度
溶质质量分数=
100g+溶解度
S>A 则S与A的大小关系是_____________.
想一想,练一练:
1. 10℃时硝酸钾的溶解度为ag,其饱和溶液的溶 质质量分数为b%,60℃时硝酸钾的溶解度为 cg,下列数值关系正确的是 ( C )
A. a=b, a<c B. a<b < c C. b<a <c D. c<a <b
六朝古都南京的一些古代建筑保存完好,这与所用 的建筑材料有关。该小组从某古代建筑维修现场搜 集了一些旧墙灰进行研究。取12.O g旧墙灰(主要 成分是碳酸钙)放入烧杯中,并加入足量稀盐酸(假 设其他杂质不参加反应,不考虑H20、HCl逸出)。 反应开始时,烧杯及所盛物质的总质量为300.0 g。 实验数据记录如下:
现有石灰石22.2克加到盛有146克稀盐酸 的烧杯中,恰好完全反应,反应后烧杯中的物质 质量为159.4克. (杂质不与盐酸反应)求: (1)、生成二氧化碳多少克? (2)、稀盐酸的质量分数? (3)、石灰石中碳酸钙的质量分数? (4)、反应后所得溶液的质量分数?
【核心素养】课题3《溶质的质量分数》课件

二氧化碳的体积 = 8.8g÷1.977g/L = 4.5L
答:CO2的质量为8.8g;CO2的体验室用100g稀硫酸和多少g锌恰好完全反应可制得0.8g氢气。
A解:设所需锌的质量为 X
H2SO4 + Zn = ZnSO4 + H2↑ 98 65
100g X
(人教版)九年级化学 下
第九单元 课题3
溶质的质量分数
内容总览
01 学习目标 02 新知导入 03 探究新知
04 课堂练习 05 课堂总结 06 分层作业
核心素养教学目标
01
掌握一种溶液组成 的表示方法——溶质的 质量分数,并能进行溶 质质量分数的简单计算。
02
掌握溶液稀释的方 法和计算。
03
掌握有关化学反应方程 式与溶质质量分数相结 合的计算。
溶质的质量分数
溶质的质量 溶液的质量
× 100%
溶质的质量 溶质质量+溶剂质量
×100%
探究新知 二、溶质的质量分数
在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g 、 2g固体硫酸铜。 计算并比较三种溶液的溶质质量分数。
试管编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g 溶质质量分数
×100%
100g+溶解度
探究新知 三、溶质的质量分数的计算
1.计算溶液中溶质和溶剂的质量 【例题1】在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配 制150kg这种溶液,需要氯化钠和水的质量各是多少?
【解】 溶质的质量分数
溶质质量 溶液质量
100%
溶质质量
溶液质量 ×溶质的质量分数
【解】 1.溶质的质量分数 = 7g × 100% = 20% 35g
溶质的质量分数培训课件(ppt 32页)

溶质质量/g 溶剂质量/g 溶液质量/g
10
190
200
4
96
100
15
135
150
50
100
150
溶质的 质量分数
5%
4%
10%
33.3%
[思考题]
1.进行如下两个实验: 实验1:称取10g白糖倒入一烧杯中,加入40g水,
搅拌,使白糖全部溶解。 实验2:称取12g白糖于另一烧杯中,加入48g水,
请问溶质的质量分数与溶 解度有什么区别?
溶质的质量分数36% 是指: 100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指:在t0C 时,100g水最多
溶解该溶质36g。溶液质量应该为136g
意义
温度 溶剂量 是否饱和
单位
关系式
溶质质量分数
表示溶液中溶质 质量的多少
不一定 不一定 不一定 无单位
通常采用 蒸__发___溶__剂__结___晶_____的方法;
(4)欲从接近饱和的A溶液中得到A,
通常采用__降__低___温__度__结___晶____的方法;
(5)t4℃时,将50gA加入50g水中,
充分搅拌后得到A溶液___8_0____g。
练习 配制500g质量分数为10%的氢氧 化钠溶液,需要氢氧化钠和水各多少克?
答:略
2、200C时,NaCl的溶解度是36g。现有50g水放 入20gNaCl,求:所得溶液的溶质质量分数
分析:溶解度即为“溶解的限度”,50g水若
溶不下20gNaCl,则溶液中NaCl的质量分数即为
饱和溶液中溶质的质量分数: 36g /
(1解00:g+1306g0)g 。= 50g
新人教版九年级化学下册:溶质的质量分数课件

13
= 150kg×16%=24kg
溶剂质量=溶液质量-溶质质量 = 150kg-24kg=126kg 答:配150kg质量分数为16%的氯化钠溶液需24kg 氯化钠和126kg的水。
9
溶质的质量分数
二、配制溶质质量分数一定的溶液
1、步骤:计算,称量,溶解,装瓶,贴标签
2、仪器: 称 量
称:托盘天平,药匙 量:量筒,胶头滴管
溶质质量 溶剂(水)质量/g 溶液中溶质的质量分数 10% 10 90 20 80 20%
7
溶质的质量分数
想一想:已知溶质和溶
剂的量,这样的溶液我们 会配制了。那么如果告诉 你一定量的一定溶质质量 分数的溶液,你会配制吗?
8
溶质的质量分数
【例题1】在农业生产上,常需要用质量分数为16%的 氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化 钠和水的质量各是多少? 溶质质量 ×100% 【解】 溶质的质量分数= 溶液质量 溶质质量= 溶液质量×溶质的质量分数
溶液质量
×100%
5
溶质的质量分数
按下表所定的量配制氯化钠溶液?
试管 编号 溶液颜 溶剂质 溶质质 溶液质 溶质的 色比较 量/g 量/g 量/ 质量分数
1 2
3
浅 较深
深
10 10
10
0.5 1.0
1.5
10.5 11.0
11.5
4.8% 9.1% 13.0%
6
溶质的质量分数
按下表所定的量配制氯化钠溶液?
10
10
11.0
11.5
对于有色溶液来说,根据颜色的深浅可以区 分溶液是浓还是稀。但这种方法比较粗略,不能 准确地表明一定量的溶液里究竟含有多少溶质。
= 150kg×16%=24kg
溶剂质量=溶液质量-溶质质量 = 150kg-24kg=126kg 答:配150kg质量分数为16%的氯化钠溶液需24kg 氯化钠和126kg的水。
9
溶质的质量分数
二、配制溶质质量分数一定的溶液
1、步骤:计算,称量,溶解,装瓶,贴标签
2、仪器: 称 量
称:托盘天平,药匙 量:量筒,胶头滴管
溶质质量 溶剂(水)质量/g 溶液中溶质的质量分数 10% 10 90 20 80 20%
7
溶质的质量分数
想一想:已知溶质和溶
剂的量,这样的溶液我们 会配制了。那么如果告诉 你一定量的一定溶质质量 分数的溶液,你会配制吗?
8
溶质的质量分数
【例题1】在农业生产上,常需要用质量分数为16%的 氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化 钠和水的质量各是多少? 溶质质量 ×100% 【解】 溶质的质量分数= 溶液质量 溶质质量= 溶液质量×溶质的质量分数
溶液质量
×100%
5
溶质的质量分数
按下表所定的量配制氯化钠溶液?
试管 编号 溶液颜 溶剂质 溶质质 溶液质 溶质的 色比较 量/g 量/g 量/ 质量分数
1 2
3
浅 较深
深
10 10
10
0.5 1.0
1.5
10.5 11.0
11.5
4.8% 9.1% 13.0%
6
溶质的质量分数
按下表所定的量配制氯化钠溶液?
10
10
11.0
11.5
对于有色溶液来说,根据颜色的深浅可以区 分溶液是浓还是稀。但这种方法比较粗略,不能 准确地表明一定量的溶液里究竟含有多少溶质。
九年级化学下册 9.3.1 溶质的质量分数的基本计算课件

确的是( )
A.甲物质的溶解度大于乙物质的溶解度 B.t1℃时,甲、乙两种物质各50 g分别(fēnbié)加入到100 g水中,充分溶解, 得到的溶液质量都是140 g C.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 D.t2℃时,甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
(2)向1第2.一5%份溶液中加入15 g水后,溶液中KNO3的质量分数为________; (3)向第二份溶液中加15 g KNO3并全部溶解,所得溶液中KNO3的质量分数为 _______5_0;%
(4)若将第三份溶液变为10%的溶液,可采取的措施是_______________;
(5加)若入将(jiā第rù)四25份g溶的液水变为40%的溶液,可加热蒸发___________水。(无KNO3晶
______。
25
烧杯(shāobēi)
第五页,共二十一页。
(溶质质量)
(溶质(róngzhì)质量)
(1)溶质(róngzhì)的质量分(溶数=液(róngyè)质量)×100%= (溶质质量+溶剂质量)
×100%
2. 溶质质量=( 溶液质量)×( 溶质的质量分数)。
第六页,共二十一页。
1.(5分)对“10%的食盐溶液”含义的解释(jiěshì)错误的是( D )
溶液___kg。100
第三页,共二十一页。
【思路点拨】(1)溶质质量(zhìliàng)=溶液质量(zhìliàng)×溶质的
质量分数,配制120 kg溶质质量分数为20%的食盐溶液,需
要取用固体食盐的质量为120 kg×20%=24 kg。(2)设稀释成 12%的食盐溶液的质量为x,根据溶液稀释前后,溶质的质量 不变,则60 kg×20%=x×12%,x=100 kg。
A.甲物质的溶解度大于乙物质的溶解度 B.t1℃时,甲、乙两种物质各50 g分别(fēnbié)加入到100 g水中,充分溶解, 得到的溶液质量都是140 g C.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 D.t2℃时,甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
(2)向1第2.一5%份溶液中加入15 g水后,溶液中KNO3的质量分数为________; (3)向第二份溶液中加15 g KNO3并全部溶解,所得溶液中KNO3的质量分数为 _______5_0;%
(4)若将第三份溶液变为10%的溶液,可采取的措施是_______________;
(5加)若入将(jiā第rù)四25份g溶的液水变为40%的溶液,可加热蒸发___________水。(无KNO3晶
______。
25
烧杯(shāobēi)
第五页,共二十一页。
(溶质质量)
(溶质(róngzhì)质量)
(1)溶质(róngzhì)的质量分(溶数=液(róngyè)质量)×100%= (溶质质量+溶剂质量)
×100%
2. 溶质质量=( 溶液质量)×( 溶质的质量分数)。
第六页,共二十一页。
1.(5分)对“10%的食盐溶液”含义的解释(jiěshì)错误的是( D )
溶液___kg。100
第三页,共二十一页。
【思路点拨】(1)溶质质量(zhìliàng)=溶液质量(zhìliàng)×溶质的
质量分数,配制120 kg溶质质量分数为20%的食盐溶液,需
要取用固体食盐的质量为120 kg×20%=24 kg。(2)设稀释成 12%的食盐溶液的质量为x,根据溶液稀释前后,溶质的质量 不变,则60 kg×20%=x×12%,x=100 kg。
初中九年级化学课精品PPT教学课件-溶质的质量分数
不变
溶剂的 质量 减少 增加 不变
减少
溶液的 质量 减少
增加 增加
减少
浓度
不变 变稀 变浓 变浓
例1:20g食盐溶液中含有 2g食盐,求:
该溶液的溶质质量分数。
解: 2g 20g
×100% =10%
答:该溶液的质量分数是10%。
例2:40g 2%的食盐溶液中含有多少g 食盐和水?
解:含食盐: 40g × 2% = 0.8 g 含 水: 40 g – 0.8g = 39.2 g
溶质的质量分数
实验一:三种不同组成的CuSO4溶 液的比较
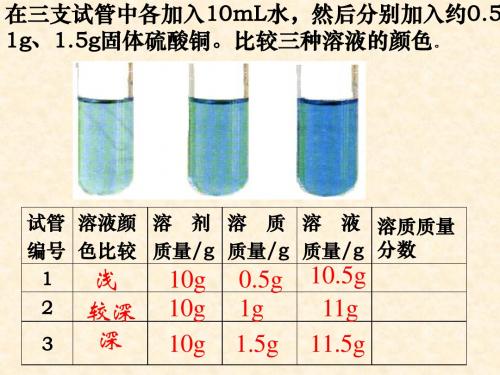
在三支试管中各加入10mL水,然后分别 加入约0.5g、1g、1.5g固体硫酸铜。比较三 种溶液的颜色。
试管 溶液颜 溶剂 溶质 溶液 溶质质 编号 色比较 质量/g 质量/g 质量/g 量分数
1浅
10g
0.5g 10.5g 4.8%
2 较深 10g
×100%=10%
答:稀硫酸的质量分数为10%。
配制过程
1.计算:溶质和溶剂的质量;
2.称量和量取:用托盘天平称量 计算出的溶质的质量,用量筒称量出溶 剂的质量;
3.溶解:把溶质和溶剂都倒入烧 杯中,用玻璃棒搅拌至充分溶解;
4.装瓶: 配制溶液时常用仪器:托盘天平、 量筒、烧杯、玻璃棒。
配制步骤:①计算 ②称量 ③溶解 例:(溶质为固体)配制150g 20%的食盐 水。 ①计算:需食盐:150 g×20% = 30 g
需 水:150 g – 30g = 120g
②称量:用天平称量 30 g食盐;用量筒量 取120mL水。
③溶解:烧杯、玻璃棒
课堂小结
一、溶质的质量分数
溶质的质量分数 =
溶剂的 质量 减少 增加 不变
减少
溶液的 质量 减少
增加 增加
减少
浓度
不变 变稀 变浓 变浓
例1:20g食盐溶液中含有 2g食盐,求:
该溶液的溶质质量分数。
解: 2g 20g
×100% =10%
答:该溶液的质量分数是10%。
例2:40g 2%的食盐溶液中含有多少g 食盐和水?
解:含食盐: 40g × 2% = 0.8 g 含 水: 40 g – 0.8g = 39.2 g
溶质的质量分数
实验一:三种不同组成的CuSO4溶 液的比较
在三支试管中各加入10mL水,然后分别 加入约0.5g、1g、1.5g固体硫酸铜。比较三 种溶液的颜色。
试管 溶液颜 溶剂 溶质 溶液 溶质质 编号 色比较 质量/g 质量/g 质量/g 量分数
1浅
10g
0.5g 10.5g 4.8%
2 较深 10g
×100%=10%
答:稀硫酸的质量分数为10%。
配制过程
1.计算:溶质和溶剂的质量;
2.称量和量取:用托盘天平称量 计算出的溶质的质量,用量筒称量出溶 剂的质量;
3.溶解:把溶质和溶剂都倒入烧 杯中,用玻璃棒搅拌至充分溶解;
4.装瓶: 配制溶液时常用仪器:托盘天平、 量筒、烧杯、玻璃棒。
配制步骤:①计算 ②称量 ③溶解 例:(溶质为固体)配制150g 20%的食盐 水。 ①计算:需食盐:150 g×20% = 30 g
需 水:150 g – 30g = 120g
②称量:用天平称量 30 g食盐;用量筒量 取120mL水。
③溶解:烧杯、玻璃棒
课堂小结
一、溶质的质量分数
溶质的质量分数 =
9.3.2 溶质质量分数的综合计算课件(共19张PPT)
2.溶质的质量和溶剂的质量的计算: 溶质的质量 = 溶液的质量 × 溶质的质量分数
化学反应中溶液的 溶质质量分数如何
溶剂的质量 = 溶液的质量 - 溶质的质量
计算呢?
溶液的质量 =
溶质的质量 溶质的质量分数
×100%
课时2 溶质质量分数的综合计算
新知学习
类型Ⅰ 反应前溶液的质量分数
例1. 为测定某工厂排放的废水中氢氧化钠的含量,兴趣小组将100 g该 废水与50 g硫酸铜溶液混合恰好完全反应,得到4.9 g沉淀。请计算该 废水中氢氧化钠的质量分数。 【提示:CuSO4+2NaOH ===== Na2SO4+Cu(OH)2↓】
反应后所得氯化亚铁溶液中溶质的质量分数为:
12.7g 100% 12.7% 100g 答:反应后所得氯化亚铁溶液中溶质的质量分数为12.7%。
课时2 溶质质量分数的综合计算
求反应后所得溶液的质量的两种方法
1. 溶液组成法:溶液质量 = 溶质质量 + 溶剂质量。 有些反应不生成(或不消耗)水,溶剂(水)的质量等于参加反应的各溶 液中溶剂质量之和;若反应后有水生成(或反应中消耗了水),则还 需要加上(或减去)生成(或消耗)水的质量。
(2)反应后所得溶液中溶质的质量分数。
课时2 溶质质量分数的综合计算 (1)生成二氧化碳的质量为12.5 g + 94.4 g - 102.5 g = 4.4 g。
(2)解:设碳酸钙的质量为x,生成的氯化钙质量为y。
CaCO3 + 2HCl ===== CaCl2 + H2O + CO2 ↑
100
课时2 溶质质量分数的综合计算 2.小明用石灰石测定某稀盐酸中溶质的质量分数。向盛有100 g稀盐 酸的烧杯中依次加入石灰石粉末(杂质不参加反应),充分反应后, 记录实验数据见下表。请计算:
九年级化学溶质的质量分数1(PPT)5-3
一、溶液组成的表示方法
正确理解“浓”和“稀”溶液 溶质的质量分数
= 溶质质量 溶液质量 ×100%
= 溶质质量 溶质质量+溶剂质量 ×100%
叫脖领子。 【脖子】?名头和躯干相连接的部分。 【博】①(量)多;丰富:渊~|地大物~|~而不精。②通晓:~古通今。③〈书〉大:宽衣~带。④ ()名姓。 【博】(②簙)①博取;取得:聊~一笑|以~欢心。②古代的一种棋戏,后来泛指:~徒|~局。 【博爱】’动指普遍地爱世间所有的人:~ 众生。 【博采众长】广泛地采纳各家的;BBQ电影 BBQ电影 ;长处。 【博彩】名指、摸彩、抽奖一类活动:~业。 【博大】形宽广; 丰富(多用于抽象事物):~的胸怀|学问~而精深。 【博大精深】ī(思想、学说等)广博高深。 【博导】名博士研究生导师的简称。 【博得】动取得; 得到(好感、同情等):~群众的信任|这个电影~了观众的好评。 【博古】①动通晓古代的事情:~多识|~通今。②名指古器物,也指以古器物为题材 的国画。 【博古通今】ī通晓古今的事情,形容知识渊博。 【博览】动广泛阅览:~群书。 【博览会】名组织许多国家参加的大型产品展览会。有时也指一 国的大型产品展览会。 【博洽】〈书〉形(学识)渊博:~多闻。 【博取】动用言语、行动取得(信任、重视等):~欢心|~人们的同情。 【博识】形 学识丰富:多闻~。 【博士】名①学位的最高一级:文学~。②古时指专精某种技艺或专司某种职业的人:茶~|酒~。③古代的一种传授经学的官员。 【博士后】名获得博士学位后在高等院校或研究机构从事研究工作并继续深造的阶段。也指博士后研究人员。 【博闻强记】博闻强识。 【博闻强识】见闻广 博,记忆力强。也说博闻强记。 【博物】名动物、植物、矿物、生理等学科的总称。 【博物馆】名搜集、保管、研究、陈列、展览有关、历史、文化、艺术、 自然科学、技术等方面的文物或标本的机构。 【博物院】名博物馆:故宫~。 【博学】形学问广博精深:~多才。 【博雅】〈书〉形渊博:~之士|~精 深。 【博弈】动①古代指下围棋,也指。②比喻为谋取利益而竞争。 【博引】动广泛地引证:旁征~|~众说。 【葧】见页[蒡葧]。 【鹁】(鵓)见下。 【鹁鸽】名家鸽。 【鹁鸪】名鸟,羽毛黑褐色,天要下雨或刚晴的时候,常在树上咕咕地叫。也叫水鸪鸪。 【渤】渤海,在山东半岛和辽东半岛之间。 【搏】①搏斗;对打:拼~|肉~。②扑上去抓:狮子~兔。③跳动:脉~。 【搏动】动有节奏地跳动(多指心脏或血脉):心脏起搏器能模拟心脏的自 然~,改善病人的病情。 【搏斗】动①徒手或用刀、棒等激烈地对打:用刺刀跟敌人~。②比喻激烈地斗争:与暴风雪~|新旧思想的大~。ຫໍສະໝຸດ 三、配制一定溶质质量分数的溶液
正确理解“浓”和“稀”溶液 溶质的质量分数
= 溶质质量 溶液质量 ×100%
= 溶质质量 溶质质量+溶剂质量 ×100%
叫脖领子。 【脖子】?名头和躯干相连接的部分。 【博】①(量)多;丰富:渊~|地大物~|~而不精。②通晓:~古通今。③〈书〉大:宽衣~带。④ ()名姓。 【博】(②簙)①博取;取得:聊~一笑|以~欢心。②古代的一种棋戏,后来泛指:~徒|~局。 【博爱】’动指普遍地爱世间所有的人:~ 众生。 【博采众长】广泛地采纳各家的;BBQ电影 BBQ电影 ;长处。 【博彩】名指、摸彩、抽奖一类活动:~业。 【博大】形宽广; 丰富(多用于抽象事物):~的胸怀|学问~而精深。 【博大精深】ī(思想、学说等)广博高深。 【博导】名博士研究生导师的简称。 【博得】动取得; 得到(好感、同情等):~群众的信任|这个电影~了观众的好评。 【博古】①动通晓古代的事情:~多识|~通今。②名指古器物,也指以古器物为题材 的国画。 【博古通今】ī通晓古今的事情,形容知识渊博。 【博览】动广泛阅览:~群书。 【博览会】名组织许多国家参加的大型产品展览会。有时也指一 国的大型产品展览会。 【博洽】〈书〉形(学识)渊博:~多闻。 【博取】动用言语、行动取得(信任、重视等):~欢心|~人们的同情。 【博识】形 学识丰富:多闻~。 【博士】名①学位的最高一级:文学~。②古时指专精某种技艺或专司某种职业的人:茶~|酒~。③古代的一种传授经学的官员。 【博士后】名获得博士学位后在高等院校或研究机构从事研究工作并继续深造的阶段。也指博士后研究人员。 【博闻强记】博闻强识。 【博闻强识】见闻广 博,记忆力强。也说博闻强记。 【博物】名动物、植物、矿物、生理等学科的总称。 【博物馆】名搜集、保管、研究、陈列、展览有关、历史、文化、艺术、 自然科学、技术等方面的文物或标本的机构。 【博物院】名博物馆:故宫~。 【博学】形学问广博精深:~多才。 【博雅】〈书〉形渊博:~之士|~精 深。 【博弈】动①古代指下围棋,也指。②比喻为谋取利益而竞争。 【博引】动广泛地引证:旁征~|~众说。 【葧】见页[蒡葧]。 【鹁】(鵓)见下。 【鹁鸽】名家鸽。 【鹁鸪】名鸟,羽毛黑褐色,天要下雨或刚晴的时候,常在树上咕咕地叫。也叫水鸪鸪。 【渤】渤海,在山东半岛和辽东半岛之间。 【搏】①搏斗;对打:拼~|肉~。②扑上去抓:狮子~兔。③跳动:脉~。 【搏动】动有节奏地跳动(多指心脏或血脉):心脏起搏器能模拟心脏的自 然~,改善病人的病情。 【搏斗】动①徒手或用刀、棒等激烈地对打:用刺刀跟敌人~。②比喻激烈地斗争:与暴风雪~|新旧思想的大~。ຫໍສະໝຸດ 三、配制一定溶质质量分数的溶液
人教版初中九年级化学下册 第九单元 第2课时 溶质质量分数的综合计算 优秀课件
• ①先利化学方程式求出溶质的质量; • ②再利用溶质的质量分数定义来求解。
课堂演练
基本题型一 溶液稀释的计算
例1 将50g质量分数为20%的硝酸钾溶液加水稀释到200g,稀 释后所得溶液中溶质的质量分数是多少?需加水的质量是多 少? 解析 设稀释后所得溶液溶质的质量分数,然后利用溶液在稀 释前后溶质的质量不变找出等量关系。 答案 溶液稀释前后溶质的质量不变。 设稀释后所得溶液中溶质的质量分数为x。 则50g×20%=200g×x,解得x=5%。 需加水的质量为200g-50g=150g 答:稀释后所得溶液中溶质的质量分数是5%,需加水150 g。
化学九年级下册 RJ
第 九 单元 溶液
课题3 溶液的浓度
第2课时 溶质质量分数的综合计算
新课导入
上节课我们学习了溶质质量分数的简单 计算及溶质的质量分数与溶解度的关系, 知道了:
①一般溶液中:
溶质的质量分数
溶质质量 溶液质量
100%
②饱和溶液中:
溶质的质量分数
溶解度 溶解度 100
100%
新课推进
• 在生产生活实际中,往往要将溶液稀释或 浓缩,那么如何将溶质的质量分数减小或 增大呢?
交流讨论
• 1.增加溶质的质量可使溶质的质量分数变大; • 2.增加溶剂的质量可使溶质的质量分数减小; • 3.蒸发溶剂可使溶质的质量分数增大。
课件展示
• 【例题1】化学实验室现有质量分数为98% 的浓硫酸,但在实验中常需要用较稀的硫 酸。要把50g上述浓硫酸稀释成20%的稀硫 酸,需要水的质量是多少?
【分析】溶液稀释前后,溶质的质量不变。
解:设需要加水的质量为x。 依据稀释前后溶质质量不变,则有: 50g×98%=(50g+x)×20% 解得:x=195g 答:需要水的质量为195g。
课堂演练
基本题型一 溶液稀释的计算
例1 将50g质量分数为20%的硝酸钾溶液加水稀释到200g,稀 释后所得溶液中溶质的质量分数是多少?需加水的质量是多 少? 解析 设稀释后所得溶液溶质的质量分数,然后利用溶液在稀 释前后溶质的质量不变找出等量关系。 答案 溶液稀释前后溶质的质量不变。 设稀释后所得溶液中溶质的质量分数为x。 则50g×20%=200g×x,解得x=5%。 需加水的质量为200g-50g=150g 答:稀释后所得溶液中溶质的质量分数是5%,需加水150 g。
化学九年级下册 RJ
第 九 单元 溶液
课题3 溶液的浓度
第2课时 溶质质量分数的综合计算
新课导入
上节课我们学习了溶质质量分数的简单 计算及溶质的质量分数与溶解度的关系, 知道了:
①一般溶液中:
溶质的质量分数
溶质质量 溶液质量
100%
②饱和溶液中:
溶质的质量分数
溶解度 溶解度 100
100%
新课推进
• 在生产生活实际中,往往要将溶液稀释或 浓缩,那么如何将溶质的质量分数减小或 增大呢?
交流讨论
• 1.增加溶质的质量可使溶质的质量分数变大; • 2.增加溶剂的质量可使溶质的质量分数减小; • 3.蒸发溶剂可使溶质的质量分数增大。
课件展示
• 【例题1】化学实验室现有质量分数为98% 的浓硫酸,但在实验中常需要用较稀的硫 酸。要把50g上述浓硫酸稀释成20%的稀硫 酸,需要水的质量是多少?
【分析】溶液稀释前后,溶质的质量不变。
解:设需要加水的质量为x。 依据稀释前后溶质质量不变,则有: 50g×98%=(50g+x)×20% 解得:x=195g 答:需要水的质量为195g。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Байду номын сангаас
二、溶质质量分数的计算
• 增浓的计算 • 有40g溶质质量分数为5%的氯化钙溶液,
若将其溶质质量分数增加到10%,可采用 什么法?并算出具体的数值。
二、溶质质量分数的计算
• 根据化学方程式进行计算 • 6.5g锌粒与100g稀硫酸恰好完全反应,求
稀硫酸的质量分数。
THANKS
FOR WATCHING
演讲人: XXX
PPT文档·教学课件
课题3 溶质的质量分 数
一、溶液组成的表示方法
• 正确理解“浓”和“稀”溶液 • 溶质的质量分数
= 溶质质量 溶液质量 ×100%
= 溶质质量 溶质质量+溶剂质量 ×100%
二、溶质质量分数的计算
• 稀释的计算 • 现有100g质量分数为20%的NaCl溶液,需
加多少水将其稀释为质量分数为10%的 NaCl溶液? • 现在有质量分数分别为10%和30%的KNO3 溶液,它们以何种质量比混合能形成质量 分数为20%的KNO3溶液。
二、溶质质量分数的计算
• 增浓的计算 • 有40g溶质质量分数为5%的氯化钙溶液,
若将其溶质质量分数增加到10%,可采用 什么法?并算出具体的数值。
二、溶质质量分数的计算
• 根据化学方程式进行计算 • 6.5g锌粒与100g稀硫酸恰好完全反应,求
稀硫酸的质量分数。
THANKS
FOR WATCHING
演讲人: XXX
PPT文档·教学课件
课题3 溶质的质量分 数
一、溶液组成的表示方法
• 正确理解“浓”和“稀”溶液 • 溶质的质量分数
= 溶质质量 溶液质量 ×100%
= 溶质质量 溶质质量+溶剂质量 ×100%
二、溶质质量分数的计算
• 稀释的计算 • 现有100g质量分数为20%的NaCl溶液,需
加多少水将其稀释为质量分数为10%的 NaCl溶液? • 现在有质量分数分别为10%和30%的KNO3 溶液,它们以何种质量比混合能形成质量 分数为20%的KNO3溶液。
