溶解性表
常见物质溶解性表

OH
NO
Cl
SO
S
SO
CO
SiO
PO
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
微
溶
NH
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
溶
不
不
不
不
Ca2+
微
溶
溶
微
微
不
不
不
不
Mg2+
不
溶
溶
溶
溶
微
不
不
不
Al3+
不
溶
溶
溶
-
-
-
不
不
Mn2+
不
溶
溶
溶
不
不
不
不
不
Zn2+
不
溶
溶
溶
不
不
不
不
不
Cr3+
不
溶
溶
溶
-
-
-
不
不
Fe2+
不
溶
溶
溶
不
不
不
不
不
Fe3+
不
溶
溶
溶
-
-
不
不
不
Sn2+
不
溶
溶
溶解性表

碳酸盐, CO32草酸盐, C2O42-
氟化物, F-
亚硫酸盐, SO32AsO33AsO43-
磷酸盐, PO43BO2-
硅酸盐, SiO32酒石酸, C4H4O62-
硫酸盐, SO42CrO42-
硫化物S2-
氰化物, CNFe(CN)64Fe(CN)63S2O32CNS-
碘化物, I-
溴化物, Br-
HCl
水 -
HCl
不溶 不溶 不溶 水 水
水
水
水 水 -
水
Mn2+ HCl HCl
HCl
HCl HCl HCl HCl HCl HCl 略溶, HCl 水 略溶, HCl HCl
HCl
HCl 不溶 水 水
水
水
水 水 水
水
-
-
-
-
水
水
水
水
水
HCl
HCl
HCl
HCl, 略溶
HCl
HCl
HCl
HCl
HCl
H+ NH4+
K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Cr3+ Fe2+ Fe3+ Sn2+ Pb2+ Bi3+ Cu2+ Hg22+ Hg2+ Ag+
部分酸、碱和盐的溶解性表(20℃)
OH-
NO3-
Cl-
SO42-
溶、挥 溶、挥 溶
I-
S2-
SO32-
溶 溶、挥 溶、挥
略溶
水
水
高中化学溶解性表(仅供参考)
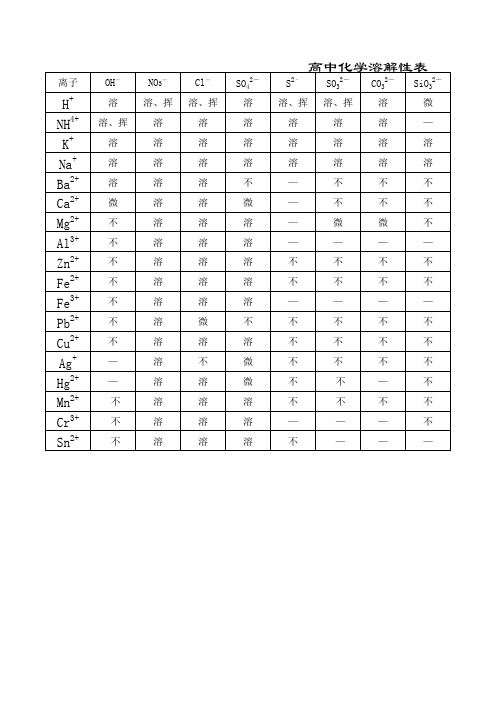
Cl- 溶、挥
溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 微 溶 不 溶 溶 溶 溶
SO42- 溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 不 溶 微 微 溶 溶 溶
高中化学溶解性表
S2ˉ
SO32-
CO32-
SiO32-
溶、挥 溶、挥 溶
微
溶
溶
溶
—
溶
溶
溶
溶
溶
溶
溶
溶
—
不
不
不
—
不
不
不
—
微
微
不
—
—
—
—
不
不
不
不
离子
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Zn2+ Fe2+ Fe3+ Pb2+ Cu2+ Ag+ Hg2+ Mn2+ Cr3+ Sn2+
OH- 溶 溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不 — — 不 不 不
NO3- 溶、挥
溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
不
不
不
不
—
—
—
—
不
不
不
不
不
不
不
不
不
不
不
不
不
不
—
不
不
不
不
不
—
—
—
不
不
—
—
—
性表
PO43- 溶
F-
高中化学溶解性表

高中化学溶解性表溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解—:该物质不存在或遇水发生水解常见沉淀:白色:BaSO4、BaCO3、CaCO3、AgCl、Mg(OH)2、Fe(OH)2、Al(OH)3、ZnCO3、MnCO3、Zn(OH)2。
蓝色:Cu(OH)2、CuCO3浅黄色:AgBr、Ag2CO3红褐色:Fe(OH)3沉淀鉴别Cu(OH)2蓝色沉淀;Fe(OH)3红褐色沉淀;AgBr淡黄色沉淀;AgI,Ag3PO4黄色沉淀;AgCl白色沉淀;CuO黑色沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)溶解性口诀:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住(见上表)。
化学溶解性表

化学溶解性表物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难溶(不溶)小于0.01g在许多化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
原子团又叫做根或基团,如氢氧根OH- 、硝酸根NO3- 、碳酸根CO32-、硫酸根SO42-、氯酸根ClO3-、磷酸根PO43-、碳酸氢根HCO3-、铵根NH4+、碳酸根CO32-等。
值得注意的是:原子团不能独立存在,只是化合物的一个组成部分。
在溶液中原子团作为一个整体参加反应。
各种原子团都有自己的特性反应,如CO32 -遇酸变成CO2,SO 42-遇Ba2+产生不溶于稀硝酸的白色沉淀,OH-使酚酞试液变成红色等。
利用特性反应可以检验根的存在。
g (气体)、l (液体)、s (固体)、aq (溶液)化学活动性金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>O s>Ru>Ir>Rh>Pt>Pd>Au 非金属活动性,一般是指卤素与类卤素的活动性。
一般的,周期大的卤素可以把周期小的卤素从它们的卤化物中置换出来F>SCN>Cl(O)>Br>CN>OCN>I>S>N>P>C>Si>H物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3 +2H2O10.碳酸氢钠加热的反应2Na HCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应N H4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应 S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应 2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应 2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2H Cl+S↓71.硫化氢与浓硫酸的反应 H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca(OH)2(3) Mg2++2OH2-==== Mg(OH)2↓ (4) Mg(OH)2+2HCl==== MgCl2+2H2O(5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3105.硅酸加热分解H2SiO3==== SiO2+H2O106.铝与氧气的反应4Al+3O2==== 2Al2O3107.铝与氯气的反应2Al+3Cl2==== 2AlCl3108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4]115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH)3↓+3(NH4)2S O4117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl 119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl 121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+Na Cl+H2O122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3N aCl125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3 127.铜与氧气的反应2Cu+O2==== 2CuO 128.铜与氯气的反应Cu+Cl2==== CuCl2129.铜氧化在高温下转化4CuO==== 2Cu2O+O 2↑ 130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体 (1)(2)铵盐:O H NH NH 234+↑−→−+碱2.与酸反应产生气体(1)(2)()()()2332222332H H H CO HCO CO S HS H S SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O 4.与水反应产生气体 (1)单质⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na ⎪⎧↑+=+2222422O NaOH O H O Na(2)化合物5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
最全的溶解性表

NH4+ 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 - 水
HCl HCl HCl HCl HCl HCl HCl HCl HCl HCl 水 水 HCl HCl 不溶 HCl 水 水 水 水 水 水 水 水 HCl HCl
磷酸盐, PO4
-
硅酸盐, SiO3
- HCl 水 HCl HCl HCl HCl HCl - HCl 水 HCl 浓HCl - - 不溶 水 - 水 水解, HCl 水解, HCl 水 - - HCl HCl
磷酸盐, PO4
-
硅酸盐, SiO3
2-
酒石酸, C4H4O62硫酸盐, SO42CrO42硫化物S2氰化物, CNFe(CN)64Fe(CN)6 S2O32CNS
3-
碘化物, I溴化物, Br氯化物, ClCH3COONO2
-
硝酸盐, NO3O2OH-
Zn2+ 碳酸盐, CO32草酸盐, C2O4 氟化物, F亚硫酸盐, SO32AsO33AsO4 BO2
332-
Ba2+ HCl HCl 略溶 HCl HCl HCl HCl HCl HCl HCl 不溶 HCl 水 略溶, HCl 水 水 HCl 水 水 水 水 水 水 水 HCl HCl
Hg2+ HCl HCl 水 HCl HCl HCl HCl - - HCl 略溶 HCl 王水 水 - 不溶 - 水 HCl 水 水 水 水 水 HCl -
Bi3+ HCl HCl HCl - HCl HCl HCl HCl HCl HCl 略溶 HCl HNO3 - - - - - HCl 水解, HCl 水解, HCl 水 - 略溶, HNO3 HNO3 HCl
高中化学溶解性表
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
—:该物质不存在或遇水发生水解
红褐色:Fe(OH)3
沉淀鉴别
沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;
Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;
BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)
溶解性口诀:
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住(见上表)。
溶解性表
图例溶:该物质可溶于水难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解—:该物质不存在或遇水发生水解常见沉淀白色:BaSO4BaCO3CaCO3AgCl Ag2CO3Mg(OH)2Fe(OH)2Al(OH)3CuCO3 ZnCO3 MnCO3 Zn(OH)2Fe(OH)2蓝色:Cu(OH)2浅黄色:AgBr红褐色:Fe(OH)3编辑本段常见化合物沉淀Cu(OH)2蓝色沉淀Fe(OH)3红褐色沉淀AgBr淡黄色沉淀AgI ,Ag3PO4黄色沉淀CuO 黑色沉淀Cu2O 红色沉淀Fe2O3 红棕色沉淀FeO 黑色沉淀FeS2 黄色沉淀PbS 黑色沉淀FeCO3 灰色沉淀Ag2CO3 黄色沉淀AgBr 浅黄色沉淀AgCl 白色沉淀Cu2(OH)2CO3 暗绿色沉淀BaCO3白色沉淀(且有CO2生成)CaCO3白色沉淀(且有CO2生成)BaSO4白色沉淀不溶的碳酸盐白色沉淀(且有CO2生成)不溶的碱、金属氧化物白色沉淀(且有CO2生成)Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)编辑本段溶解性口诀钾钠铵盐硝酸盐均可溶盐酸盐银不溶硫酸盐钡不溶白色沉淀: CaCO3. BaCO3 . BaSO4. AgCL. Mg(OH)2蓝色沉淀: Cu(OH)2红褐色沉淀: Fe(OH)3不建议死记硬背,只需记住每个阴离子里哪个不溶即可,钾钠铵硝都溶溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡银铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③氢氧根多溶一个钡④口诀中未有皆下沉。
⑤注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀);③硝酸盐都溶于水;④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶⑤口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
物质溶解性表
结论:溶于水的碱有 氨水、氢氧化钠、氢 氧化钾、氢氧化钡
溶 溶
溶 不、溶
碱
部分常见盐的溶解性表(室温)
阴离子
阳离子
NO3溶
Cl溶
SO42溶 溶 溶 不溶 微溶
硫酸盐
CO32溶 溶 溶 不溶 不溶
碳酸盐
铵盐
NH4+ Na+ K+ Ba2+ Ag+
硝酸盐
溶 溶
溶
溶 溶
溶
钠盐
钾盐 钡盐 银盐
溶
不溶
盐酸盐
常见盐的溶解性记忆口诀
钾钠铵盐硝酸盐, 均能溶入水中间。 硫酸盐中钡不溶, 氯化盐中银不溶。 碳酸钾钠铵盐溶, 氢氧钾钠氨钡溶。
Baห้องสมุดไป่ตู้O4不溶
AgCl不溶
K2CO3 、Na2CO3 、(NH4)2CO3 溶 溶于水的碱有氨水、氢氧化钠、 氢氧化钾、氢氧化钡
离子共存原理
在溶液中离子间不能形成沉淀(不溶于水的物质)、水和气体(二氧化碳、 氨气),离子间就能共存。 否则,就不能共存(即离子间能形成沉淀(不溶于水的物质)、水和气体 (二氧化碳、氨气)。 • 例如:归纳与小结: • (1)H+ 不能与 、 、 共存;(2)Cl- 不能与 共存; • (3)CO32-不能与 、 、 、 共存; • (4)OH--不能与 、 、 、 、 共存; • (5)Ba2+ 不能与 共存; (6) Ca2+不能与 共存; • (7) SO42-不能与 共存; (8)Ag +不能与 共存; • (10)Fe3+ 不能与 共存; (11)Cu2+不能与 共存; • 溶液中离子颜色Cu2+ Fe3+ Fe2+ MnO4• 注意题干暗示条件:pH >7 意为 性溶液,含有大量的 • pH <7 意为 性溶液,含有大量的
化合物溶解性全表
HCl
不溶
HCl
HCl
HCl
HCl
略溶
HCl
HCl
微溶
水
水
水
水
水
水
水
水
水
水
水
水
水
略溶,HCl
略溶,HCl
Sr2+
HCl
HCl
HCl
HCl
HCl
HCl
HCl
略溶
HCl
HCl
不溶
略溶
水
水
水
水
水
水
水
水
水
水
水
水
HCl
略溶,HCl
Ba2+
HCl
HCl
略溶
HCl
HCl
HCl
HCl
HCl
HCl
HCl
不溶
HCl
-
-
-
-
-
HCl
水解,HCl
水解,HCl
水
-
略溶,HNO3
HNO3
HCl
Hg2+
HCl
HCl
水
HCl
HCl
HCl
HCl
-
-
HCl
略溶
HCl
王水
水
-
不溶
-
水
HCl
水
水
水
水
水
HCl
-
Pb2+
HNO3
HNO3
略溶,HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
