镁和铝的性质
镁铝合金的熔点

镁铝合金的熔点
镁铝合金是一种轻质高强度的材料,其熔点随着镁和铝的比例不同而有所变化。
一般来说,镁铝合金的熔点范围在600°C到700°C之间。
要进一步了解镁铝合金的熔点,需要先了解镁和铝的基本性质。
镁是一种轻质金属,其密度仅为1.74g/cm³,具有良好的耐腐蚀性和导电性能。
铝也是一种轻质金属,密度为2.7g/cm³,具有较好的导热性、机械性能和耐腐蚀性能。
将镁和铝混合成合金后,可以得到一种强度高、密度低、具有良好耐蚀性和导电性能的材料。
此外,镁铝合金还具有较好的可塑性和加工性能,可用于制造航空航天、汽车、移动设备等领域的零部件。
根据实验分析,镁铝合金的熔点范围在600°C到700°C之间。
这是因为,镁铝合金中镁和铝的不同比例导致了其热性能的差异。
通常情况下,镁铝合金中镁和铝的比例越高,熔点就越低;反之则熔点较高。
需要注意的是,镁铝合金的熔点不仅受合金中镁铝比例的影响,还受到其他合金元素的影响。
例如,当添加稀土元素、锰、硅等合金元素时,会影响镁铝合金的热性能和稳定性,进而影响其熔点。
总的来说,镁铝合金是一种具有良好性能的材料,其熔点随着其成分的变化而有所波动。
了解镁铝合金的热性能特点以及其他合金元素的影响,可以更好地指导其生产和应用。
高中化学知识总结:金属专题二镁、铝、铁

金属专题二——镁、铝、铁3.其它常见的金属(如Mg、Al、Fe)[考点扫描]1.Mg、Al的性质。
2.Al2O3和Al(OH)3的两性。
3.铁的化学性质。
4.铁的氧化物和铁的氢氧化物。
5.Fe、Fe2+、Fe3+之间的相互转化关系。
6.Fe2+、Fe3+的检验。
[知识指津]1.Mg、Al的性质(1)物理性质:镁、铝都是密度小、熔点低、硬度较小的银白色金属,但镁与铝相比较,铝的硬度、密度都比镁大,熔沸点都比镁高。
二者都有良好的导热、导电性能及韧性和延展性。
(2)镁、铝化学性质及用途比较镁铝与非金属反应与X2、O2、S、N2等反应,如:Mg+S MgS,2Mg+O22MgO与X2、O2、S等反应,如:2Al+3S Al2S3,4Al+3O22Al2O3与酸反应Mg+2H+=Mg2++H2↑,与氧化性酸浓H2SO4、HNO3反应较为复杂2Al+6H+=2Al3++3H2↑,室温时,在浓硫酸、浓硝酸中钝化与水反应Mg+2H2O Mg(OH)2+H2↑生成的Mg(OH)2能使酚酞试液变红去掉氧化膜的Al与沸水缓慢反应2Al+6H2O2Al(OH)3+3H2↑与碱反应不反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑与氧化物反应(干态置换)2Mg+CO22MgO+C 镁着火,不能用CO2灭之2Al+Fe2O3Al2O3+2Fe (铝热反应) 用途照明弹,制合金等导线、电缆、炊具、化工、合金2.Al2O3Al2O3是一种白色难熔的物质,不溶于水,是冶炼金属铝的原料,也是一种比较好的耐火材料。
是典型的两性氧化物,Al2O3+6H+=2Al3++3H2O,Al2O3+2OH-=2AlO2-+H2O3.Al(OH)3Al(OH)3是几乎不溶于水的白色胶状物质,能凝聚水中的悬浮物,又能吸附色素,是典型的两性氢氧化物,在酸或强碱中都能溶解,能用平衡移动原理解释,其两性电离方程式如下:H2O+AlO2-+H+Al(OH)3Al3++3OH-酸式电离碱式电离4.“铝三角”及其应用――典型复分解关系(1)“铝三角”系指Al3+、Al(OH)3、AlO2-相互依存的三角关系;有关离子方程式为:Al3++3OH-=Al(OH)3↓或Al3++3NH3·H2O=Al(OH)3↓+3NH4+Al(OH)3+OH-=AlO2-+2H2O,AlO2-+4H+=Al3++2H2O;Al3++4OH-=AlO2-+2H2O,AlO2-+H++H2O=Al(OH)3↓或AlO2-+CO2+2H2O=Al(OH)3+HCO3-,Al(OH)3+3H+=Al3++3H2O(2)应用①制取Al(OH)3,最好用铝盐与氨水作用或将CO2通人偏铝酸盐中;②离子共存问题:Al3+与S2-、AlO2-、HCO3-、CO32-因相互促进水解而不能大量共存,AlO2-与H+、NH4+、Al3+、Fe3+等不能大量共存。
镁铝及其化合物(1)概要

反应现象:镁条剧烈燃烧,放出大量的热,发出耀
眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有 熔融物落入沙中。
高温
Fe2O3+2Al === 2Fe + Al2O3
铝热剂 问题 1、镁条的作用是什么?
2、氯酸钾的作用是什么? 结论:铝也是还原剂,在一定的条件下与某些金属
氧化物反应,把其中的金属还原成单质。所以一些 活泼的金属也可作还原剂。
O2
具有抗腐蚀的性能
点燃
点燃
2Mg+ O2 = 2MgO 4Al+ 3O2 = 2Al2O3
点燃
N2 3Mg+ N2 = Mg3N2
质
加热
反 S Mg+ S = MgS
加热
2Al+ 3S =Al2S3
应
点燃
点燃
Cl2 Mg+Cl2 = MgCl2
2Al+ 3Cl2 = 2AlCl3
与 氧
H2O Mg+2冷H水2O反应=△缓M慢g(OH)2↓+2HA2l↑+6H冷2O水△几= 乎2A不l(反O应H)3 ↓+3H2↑
Al(OH)3+OH-=AlO2ˉ+2H2O
类别 主要用途
中强碱,水溶液能够使酚 酞变红
两性氢氧化物
制MgO和镁盐 制备Al2O3和净水剂,治疗胃酸
实验室 制法
Mg2++2OHˉ = Mg(OH)2↓Al3++3NH3•H2O=Al(OH)3
↓+Biblioteka NH4+ 其它方法思考:
(1)Al(OH)3为何既能与酸又能与强碱液反应?
4、镁、铝的制备及用途
镁和铝

△ 通电 (3)MgCl2 溶液― ― → MgCl2· 6H2O― ― ― → Mg( 熔化
-
×
)
(4)MgO是一种电解质,工业上常用电解MgO冶镁( × )
通电 (5)电解氯化镁溶液产生黄绿色气体 2Cl +2H2O===== Cl2↑+H2↑+2OH-(
×
)
(6)在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液: Mg +2HCO3 +Ca +2OH ===MgCO3↓+CaCO3↓+
(4) 甲、乙两烧杯中各盛有 100 mL 3 mol· L - 1 的盐酸和 NaOH 溶液,向两烧杯中分别加入等质量的铝粉,反应结
束后,测得生成的气体体积比为 V( 甲 )∶V( 乙 ) = 1∶2 ,则
A 。 加入铝粉的质量为________
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
)
涤并收集沉淀( × ) (11)将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸 干得无水MgCl2固体( × )
题组二 镁及其化合物的性质综合应用
2.镁是海水中含量较多的金属,镁、镁合金及其镁的化合物 在科学研究和工业生产中用途非常广泛。
(1)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱
+ ===Fe2 + Fe + 2H (3)③中所发生的各反应的离子方程式是________________ 3+===3Fe2+ + H ↑ 、 Fe + 2Fe 2 _________________________ 。
②另取20 g A全部溶于0.15 L 6.0 mol· L-1盐酸中,得溶液C; 同时生成溶液D,还残留有固体物质B; ④用KSCN溶液检验时,溶液D不变色。
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,
镁、铝单质的性质

第 1 页 共 1 页镁、铝单质的性质1.镁、铝的结构和存在镁、铝分别位于元素周期表的第三周期ⅡA 族和ⅢA 族,原子结构示意图为和,它们都是活泼的金属,在自然界中全部以化合态的形式存在。
铝是地壳中含量最多的金属元素。
2.镁、铝单质物理性质比较(1)相同点:均为银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度、硬度均较小。
(2)不同点:铝的熔点比镁高,硬度比镁大。
3.对比掌握镁、铝的化学性质铝镁能与非金属单质反应①与空气中的氧气形成致密的氧化膜 ②与氯气加热反应:2Al +3Cl 2=====△2AlCl 3①在空气中燃烧发出耀眼白光 ②与氮气反应:3Mg +N 2=====点燃Mg 3N 2与水反应反应很困难与沸水反应:Mg +2H 2O=====△Mg(OH)2+H 2↑与酸反应 ①与H +:2Al +6H +===2Al 3++3H 2↑ ②在冷的浓硫酸、浓硝酸中钝化 Mg +2H +===Mg 2++H 2↑,相同条件下,反应速率比Al 快与碱反应 2Al +2OH -+2H 2O===2AlO -2+3H 2↑ 不反应与某些氧化物反应 与Fe 2O 3的铝热反应:2Al +Fe 2O 3=====高温2Fe +Al 2O 3能在CO 2中燃烧:2Mg +CO 2=====点燃2MgO +C4.镁、铝的冶炼Mg :MgCl 2(熔融)=====电解Mg +Cl 2↑; Al :2Al 2O 3(熔融)=====电解冰晶石4Al +3O 2↑。
镁 铝的性质及应用

镁铝的性质及应用镁和铝是两种常见的金属元素,它们具有许多相似的性质和应用。
接下来,我将分别介绍镁和铝的性质及其在工业和日常生活中的应用。
首先,我们来看一下镁的性质。
镁是一种轻便的碱土金属元素,化学符号为Mg,原子序数为12。
它具有银白色光泽,是一种相对较软的金属。
镁的熔点约为650摄氏度,沸点约为1090摄氏度。
它可以在空气中燃烧,产生一种强烈而明亮的白色火焰,因此常被用作烟花和信号弹的原料。
镁具有良好的导热性和导电性,因此在工业上被广泛应用于制造铸造件、合金、防腐涂料等产品。
此外,由于镁具有较高的比强度和耐蚀性,因此在航空航天、汽车制造等领域也被广泛应用。
接下来,我们了解一下铝的性质。
铝是一种轻质金属元素,化学符号为Al,原子序数为13。
它也具有银白色光泽,比镁稍硬一些。
铝的熔点约为660摄氏度,沸点约为2450摄氏度。
铝是一种具有良好延展性和导热性的金属,因此在工业上被广泛应用于制造包装材料、建筑材料、航空器件等产品。
与镁一样,铝也具有良好的耐蚀性和可加工性,因此在汽车制造、建筑领域也有着广泛的应用。
此外,铝也可以用于制造电线、电缆、管材等产品,因为它具有良好的导电性。
除了在工业上的应用,镁和铝在日常生活中也有着广泛的用途。
比如,我们常见的镁铝合金材料,可以用于制造手机壳、摄影器材、运动器材等产品。
此外,铝箔是一种常见的包装材料,可用于食品包装、医药包装等方面。
而镁合金的轻便特性也使得它在汽车、航空器件中有着广泛的应用。
在环保方面,镁和铝的再生利用也备受关注。
由于它们具有较高的可回收性和可循环性,因此可以用于制造再生材料,如再生铝和再生镁合金,从而减少对自然资源的消耗,减少环境污染。
总的来说,镁和铝是两种重要的金属元素,它们具有良好的物理化学性质和广泛的应用领域,在工业和生活中都发挥着重要作用。
随着科学技术的进步和对环保的重视,相信镁和铝的应用将会更加广泛和深入。
镁和铝的化学性质
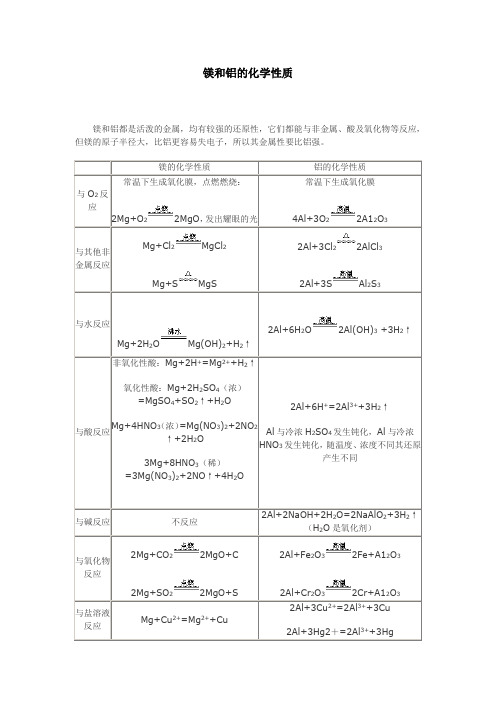
镁和铝都是活泼的金属,均有较强的还原性,它们都能与非金属、酸及氧化物等反应,但镁的原子半径大,比铝更容易失电子,所以其金属性要比铝强。
镁的化学性质
铝的化学性质
与O2反应
常温下生成氧化膜,点燃燃烧:
2Mg+O2 2MgO,发出耀眼的光
常温下生成氧化膜
4Al+3O2 2A12O3
与其他非金属反应
2Mg+SO2 2MgO+S
2Al+Fe2O3 2Fe+A12O3
2Al+Cr2O3 2Cr+A12O3
与盐溶液反应
Mg+Cu2+=Mg2++Cu
2Al+3Cu2+=2Al3++3Cu
2Al+3Hg2+=2Al3++3Hg
Mg+Cl2 MgCl2
Mg+S MgS
2Al+3Cl2 2AlCl3
2Al+3S Al2S3
与水反应
Mg+2H2O Mg(OH)2+H2↑
2Al+6H2O 2Al(OH)3+3H2↑
与酸反应
非氧化性酸:Mg+2H+=Mg2++H2↑
氧化性酸:Mg+2H2SO4(浓)=MgSO4+SO2↑+H2O
Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O
3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O
2Al+6H+=2Al3++3H2↑
镁和铝的性质

镁和铝的性质二. 重点、难点1. 镁和铝的原子结构比较。
2. 镁和铝的单质物理性质比较(色、态、熔沸点、硬度、密度、延展性等)。
3. 合金及其特点(定义、熔点等),镁、铝的重要用途。
4. 镁、铝的化学性质(与氧气、硫、卤素的反应,与非氧化性酸、某些氧化物的反应,铝的钝化,铝与碱反应),铝热反应的有关知识,铝的两性。
三.知识分析:(一)金属的物理性质有金属光泽、不透明、有导电性、导热性有延展性、多数具有较高熔点、较大硬度金属可以根据其颜色、密度、存在形式可把金属分为以下几类:从颜色分:黑色金属(Fe、Cr、Mn)有色金属(除以上金属外)从密度分:轻金属(d <4.5g/cm-3)重金属(d > 4.5g/cm-3)从存在分:常见金属(Fe、Al、Cu)稀有金属以上同学们对金属应有一定的认识,下面我们通过学习镁和铝的性质来深入了解金属的性质及用途。
(二)合金1. 定义——由两种或两种以上的金属(或金属与非金属)熔合在一起形成的具有金属特性的物质,合金属于混合物。
2. 合金的性质特点一般说来,合金的熔点比其成分金属都低,而在硬度、韧性等方面却往往有其成分金属所不具有的独特的性质。
3. 镁、铝的合金简介(三)镁和铝1. 原子结构(1)原子结构示意图(2)电子式2. 物理性质(1)共同点:均为银白色,属于轻金属,熔点较低,硬度较小、有良好的导电性、导热性。
(2)不同点:密度:铝>镁熔点、硬度:铝>镁思考:a. 镁和铝分别位于元素周期表的第几周期,第几族?b. 分别画出镁和铝的原子结构示意图,它们的原子结构有哪些特点?c. 为什么镁的化学性质比铝活泼?举出几个能说明镁的化学性质比铝活泼的实验事实。
3. 化学性质:(1)与非金属反应: a. 镁条在空气中的燃烧2Mg + O 2 = 2MgO 3Mg + N 2 = Mg 3N 2 b. 铝在氧气中的燃烧4Al + 3O 2 = 2 Al 2O 3 (2)与酸的反应: a. 与非氧化性酸反应: Mg + 2H + = Mg 2+ + H 2↑ 2Al + 6H + = 2Al 3+ + 3H 2↑b. 与氧化性酸反应:镁与浓硫酸、浓硝酸的反应: Mg + 2 H 2SO 4(浓)= MgSO 4 + SO 2 ↑+ 2H 2O Mg + 4HNO 3(浓)= 23)Mg(NO +2NO 2↑ + 2H 2O 铝与浓硫酸、浓硝酸发生钝化 (3)镁与水的反浓应:Mg +2 H 2O (沸水)=↑+↓22H Mg(OH)(4)铝与碱的反应:2Al + 2NaOH + 6H 2O = 2NaAlO 2 +3H 2↑+ 4H 2O 还原剂:Al 氧化剂: H 2O(5)镁、铝与某些氧化物的反应:镁条在二氧化碳里燃烧:2 Mg + CO 2 = 2MgO + C 铝热反应:2Al + Fe 2O 3 = Al 2O 3 +2Fe铝热剂:铝粉和某些金属氧化物组成的混合物运用:焊接钢轨;可以用于冶炼工业,冶炼难熔金属。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
镁和铝的性质·教案
教学目标
知识技能:了解镁、铝与非金属单质、氧化物、酸、碱溶液的反应程度,能正确描述实验现象,并通过实验现象分析推测镁、铝的化学性质,初步掌握镁、铝的共性和特性。
能力培养:通过位、构、性关系和镁、铝化学性质的学习,培养分析对比和总结归纳能力;加深对元素化合物知识学习方法及规律的认识;培养应用概念认识新事物的能力。
科学思想:通过对镁、铝的位、构、性关系的分析,加深对“外因通过内因起作用”的辩证唯物主义观点的理解。
科学品质:通过演示实验和设问,激发好奇心,求知欲,培养积极进取追求科学的思想品质。
科学方法:学会观察、描述、记录实验现象,并能根据实验现象将微观与宏观、现象与本质、感性与理性进行相互转化。
重点:镁、铝的还原性,铝的特性;分析对比和总结归纳能力的培养;微观与宏观,现象与本质,感性与理性进行相互转化方法的学习。
难点:铝的特性;微观与宏观,现象与本质,感性与理性的相互转化方法。
教学过程设计
续表
图。
带性质,加深
对位、构、性三者
之间关系
续表
续表
续表
Mg+NaOH 续表
续表
附:随堂检测答案
1.(D)
2.(B)
3.(C)
4.(C)。
