碳正离子机理
(完整版)碳正离子机理

第五讲 与酸和亲电试剂有关的反应一、 碳正离子酸性介质中的反应可能涉及到碳正离子。
碳正离子的稳定性为:3o > 2o > 1o 〉 +CH3 1. 碳正离子的形成 (1) 离解a. 醇发生质子化后,碳氧单键发生异裂,得到碳正离子。
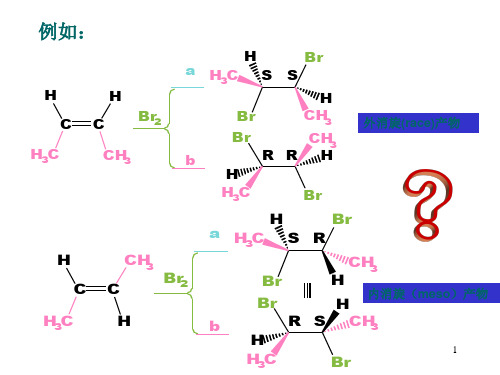
例如:C CH 3CH 3H 3COH + H +C CH 3CH 3H 3COH 2+C CH 3CH 3H 3C+一般仅限制于生成稳定的碳正离子(SN1或E1反应的中间体为碳正离子).b. 极性介质中,反应物分子中又存在好的离去基团,不需要酸的催化,也会发生键的异裂,生成碳正离子.MeOCH 2OS OOOCF 3H O CF 3SO 3-+MeOCH2+(2) 亲电试剂对双键的加成3H+-OSO 3H(3) 羰基的质子化3H+-OSO 3H(4) 羰基化合物与Lewis 酸的反应+ COClCH 3O3例如,Friedel-Crafts 酰基化反应 该反应的机理是:CCH 3CH 3O3ClCH 33-C ClCH 3AlCl 3O +-AlCl 333+- H +CH 3O2.碳正离子的重排碳正离子重排的驱动力是:生成更稳定的碳正离子。
重排通常涉及到碳正离子中心原子的α—C 上的烷基、苯基或 – H 的迁移. (1)– H 的迁移BrOH + H 2SO 42(2)烷基的迁移下列反应涉及到烷基的迁移,为它提出一个合理的机理。
OH 3O+H机理OH 3O +OH实例1:二烯酮—酚的重排反应反应:OH 3O +OH机理:OH 3O +OH实例2: 片呐醇重排 反应PhPhOH OH H 2SO 4PhOPh H机理:Ph Ph OH OH+H +H 2-H 2O- H+PhPh OH H+Ph Ph O H3. 涉及缺电子氮的正离子重排下列反应为Beckmann 重排:PhPh N OH (1)PCl 5(2)H 2OPhNHOPh机理:PhPhN O P ClCl ClClO PCl 4Ph N Ph +H 2OPhN Ph H 2O +--OPCl 4-H +PhN Ph HOPhNH O PhPCl 5的作用是增大底物分子中氮氧键的极性,帮助其异裂.迁移基团处于离去基团的对面.最后一步可以看成是酮式与烯醇式的互变异构。
正碳离子和相关的反应机理

20 0 7年 8月
石 油 学 报 ( 油加 工 ) 石 A T E R 【 I I I A ( E R L U P O E SN E T 0 ) C A P T o N C P T 0 E M R C S I G S C 1 N ES
第 2 3卷第 4期
文 章 编 号 :1 0 —71 ( 0 7 0 — 0 lO 0 18 9 2 0 ) 40 0 — 7
( 国石 化 石 油化 工 科 学 研 究 院 ,北 京 1 0 8 ) 中 0 0 3
( ee rh I s t t o e rlu o esn SI R sa c n t ue f P toe m Pr csig, NOPE Be i g 1 0 8 ,C ia i C, i n 0 0 3 h n ) j
正 碳 离 子 和 相 关 的 反 应 机 理
CA RBENI UM o NS AND ELATI I R VE REACTI oN ECH AN I M M S
何 奕工 ,舒 兴 田 ,龙 军
HE Yi o g.SHU n —in.LONG n — n g Xig t a J u
具有极高超强酸活性的h质这是预测和考察正碳离子性质和行为的一个重要原子可以加成在饱和烷烃分子上使烷烃分子变成在4石油学报石油加工第23卷其ch键和cc键之间具有两电子三中心的附态在酸中心中脱附后成为异丁烷分子完成正非经典正碳离子然后再转变成正碳离子同时释丁烷的异构化反应
维普资讯 http://www.cqvห้องสมุดไป่ตู้
Absr c : Ca b ni m i n S n c i e nt r e it s a e n r n c e c i ns, w h c ha be n ta t re u o i a a tv i e m d a e t t i o ga i r a to ih s e i e tg t d f r o e e r . I t e a e o cd c t l z d e c i ns, t o t f h r c r o nv s i a e o v r 1 00 y a s n h r a f a i — a a y e r a to he m s o yd o a b n— c nv r e e c i ns,s c sf u d c t l tcc a ki g,iom e ia i n,a ky a i n a m e ia i n,a e o e t d r a to u h a l i a a y i r c n s rz to l l to nd di rz to r c r id ou a c r ng o t m e ha i m o c r n um i n e c i n I w e l a re t c o di t he c ns f a be i o r a to . tS l kn ow n ha t t t he m e ha i m f c r e i m i n r a to w a g ne a l r c g z d by m os o r s a c e s, a s a c ns o a b n u o e cin s e r ly e o nie t f eerh r nd i po e f n fe tve t oli s rbi g t dr c r o c nv r e e c i p o e s s A c o di w r ula d e f c i o n de c i n he hy o a b n— o e t d r a ton r c s e . c r ng t t r S og to o au ho c nii ns,t hit r a d fnii n, t e t uc ur a d he s o y nd e i to h s r t e n pr pe te , t e e e a i o ris h g n r tng pt a hwa s,a e a ie r a to e ha s o a be u o e e d s rb d a ic s e y nd r l tv e c i n m c nim f r c r ni m i ns w r e c i e nd d s u s d. Ke r s:c r e i y wo d a b n um o ;r a to e ha s in e c i n m c nim
碳正离子

有机活性中间体——碳正离子的研究一、碳正离子的生成在有机化学反应中碳正离子可以通过不同的方法产生,主要有以下三种。
1、直接离子化[1]在化合物的离解过程中,以共价键的异裂方式产生碳正离子。
最常见的为卤代烃的异裂,在离解过程中,与碳原子相连的卤原子带着一对电子离去,产生碳正离子。
R —X →R + +X - 在这个反应中,极性溶剂的溶剂化作用是生成碳正离子的重要条件。
反应是可逆的,反应生成难溶物或用SbF 5作为Lewis 酸生成稳定SbF 6一, 会使反应向右进行,有利于碳正离子的生成。
R —Br+ Ag +→R ++ AgBr ; R —F+SbF5→R ++SbF 6-。
但是醇、醚、酰卤在酸或Lewis 酸的催化下也可以离解为碳正离子。
R 一0H → R +-OH 2→R ++H 20 ; CH 3COF+BF 3-→CH 3CO ++BF 4-利用超强酸可以从非极性化合物如烷烃中,夺取负氢离子而生成碳正离子。
(CH 3)3CH + SbF 5·FSO 3H →(CH 3)3C ++ SbF 5·FSO 3-+H 2 2、间接离子化[2]主要由其它正离子对中性分子加成而产生的碳正离子,最常见的为烯烃的亲电加成反应和芳环上的亲电取代反应。
CCH;+NO223、其它生成的途径由其它较容易获得的碳正离子转换成较稳定的难以获得的碳正离子。
常见的有重氮基正离子脱N 2而生成碳正离子。
RN R +N2 ;N 2+N2二、碳正离子的结构碳正离子带有正电荷,其结构是由其本身所决定的,碳正离子的中心碳原子为三价,价电子层仅有六个电子,根据杂化轨道理论,其构型有两种可能:一种是中心碳原子处于sp 3杂化状态下的角锥构型,另一种是中心碳原子处于sp 2杂化状态下的平面构型(见下图)。
SP3杂化角锥构型 SP2杂化平面构型在这两种构型中,以平面构型比较稳定,这一方面是由于平面构型中与碳原子相连的三个基团相距最远,空间位阻最小;另一方面是sp2杂化的s成份较多,电子更靠近于原子核,也更为稳定;再一方面空的P轨道伸展于平面两侧,便于溶剂化。
碳正离子综述

碳正离子综述。
分析这种物质对发碳正离子是一种带正电的极不稳定的碳氢化合物教授发现了现能廉价制造几十种当代必需的化工产品是至关重要的。
欧拉使碳正离子保持稳定的方法,能够配制高浓度的碳正离子和仔细利用超强酸研究它。
他的发现已用于提高炼油的效率、生产无铅汽油和研制新药物。
碳正离子与自由基一样,是一个活波的中间体。
碳正离子有一个正电荷,2个原子(或原SP3 杂化轨道与最外层有6 个电子。
带正电荷的碳原子以P与碳原子处于同一个平面。
碳原子剩余的键(T ,子团)结合,形成3个轨道与这个平面垂直。
碳正离子是平面结构。
年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为1963 它的存在及其结构提供了实验依据。
根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。
碳正离子的结构与稳定性直接受到与之相连接的基团的影响。
它们稳定性的一般规律如下:)苄基型或烯丙型一般较稳定;(1 3°>2°> 1°; (2)其它碳正离子是:碳正离子越稳定,能量越低,形成越容易,加成速度也越快,可见碳正离子的稳定性决定烯烃加成的取向。
碳正离子根据结构特点不同可分为:经典碳正离子和非经典碳正离子下面着重讨论经典碳正离子:碳正离子化学是有机化学非常重要的组成部分,Olah 由于发现在超强酸中稳定存在的碳正离子,获得了1994 年的诺贝尔化学奖。
碳正离子是带有正电荷的含碳离子,是一类重要的活性中间体,可用R3C+表示(R为烷基)。
碳正离子及其反应于20世纪20年代由C.K.英戈尔德等提出的。
碳正离子可以认为是通过共价C-C 单键中一对电子的异裂反应而产生,式中X 为卤素。
-RC++X-C:XR 33杂化,中心原子以三个sp23, —个正电荷,配位数为所形成的碳正离子R3C+轨道垂直于平面,正电荷p 轨道和三个原子成键,三个键轴构成平面,空着的.的共轭效应,诱导效应和立体效应,以及烷基的超Rp 集中在轨道上。
有机化学武汉大学2碳正离子PPT课件
2)反应的选择性是由碳正离子的稳定性决定的,双 键连有拉电子基团(CF3,X,OH,OR,OCOR)时,会
出现违反Markonikovs(马氏规则)的情况。
H F3C C CH2
+H-X
稳定性:
H
F3C C CH2
H
H F3C C CH2
HX H > F3C C CH2
H
CF3为拉电子基团
33
H 3 C B r
C 3 + H B r -
C 3 C 2 H B H rC 3 C 2 H + B r H -ΔH=184Kcal
CH3CHCH3 Br
CH 3
CH 3CC3H
Br
CH3CHCH3 + Br-
ΔH=164Kcal
CH 3 CH 3CC3H+Br-
ΔH=149Kcal
10
不同结构的C+能量不同,生成C+的能量越少,说明C+所 具有的能量越低,越稳定,由上可知,C+的稳定性为:
C CH2
0~10 0C
H3C C C
C3 HH
CH3 C CH3 H
异 辛 烷
30
历程
H3C
CH3
C CH2 H
H3C
CH3 C
H2C CH3
CH3
H3C C CH3
CH3
C CH3 H3C
CH3 H CC
CH3 H
C
CH3 C CH3 CH3
H3C
CH3 H CC CH3 H
CH3
C H + H3C
Br S
H
CH3
Br
H CH3
碳正离子机理

第五讲与酸和亲电试剂有关的反应—、 碳正离子 酸性介质中的反应可能涉及到碳正离子。
碳正离子的稳 定性为:3。
> 2° > 1。
> +CH31.碳正离子的形成 (1) 离解a.醇发生质子化后,碳氧单键发生异裂,得到碳正离子。
例如:CH 3H 3C —C —OH + H ICH 3(3)羰基的质子化:0+ H^OSOH(4) 羰基化合物与Lewis 酸的反应AICI 3 + CH —c —ci ―►例如,Friedel-Crafts 酰基化反应 该反应的机理是:OCH+H 3C —C —OHICH—般仅限制于生成稳定的碳正离子 间体为碳正离子)。
b.极性介质中,反应物分子中又存在好的离去基团,不需要 酸的催化,也会发生键的异裂,生成碳正离子。
_OHO —MeOCH^O —AOCF 3 :热・MeOCH 2 + CF 3SO 3-O—⑵亲电试剂对双键的加成(SN1或E1反应的中CH 3H 3C — C +CH 3Q OSOH+ 'OSOH+ 「OSOHQkAICI 3CH 3 一 C —Cl-O AICI 3H^Jci O CH - H ++0AICI3-OAICI3* CH — L CI-CIAICI 32.碳正离子的重排碳正离子重排的驱动力是:生成更稳定的碳正离子。
重 排通常涉及到碳正离子中心原子的a-C 上的烷基、苯基或H 的迁移。
(1) -H 的迁移OH〜/ + H 2SQBr -BrH O反应: 机理:+严一性2(2)烷基的迁移下列反应涉及到烷基的迁移,为它提出一个合理的机理。
比0\机理实例1: 二烯酮-酚的重排反应百度文库-让每个人平等地提升自我实例 反应机理:HO片呐醇重排2: OHOHPhPhO Ph_ HOH ”\ + H + PhPhOH -H 2O +_ Ph^^^PhOH OH PhHPhPhPPh O PhH3.涉及缺电子氮的正离子重排下列反应为Beckmann 重排:Z OHN ⑴PCl5. ⑵ NOA tPh Ph机理:Ph PhCl I 广——込Cl/1Cl ClH?OPh、O U NH PhCl ,ClCl 一 — ClN ' * H ClOPCI5的作用是增大底物分子中氮氧键的极性,帮助其异裂。
第五章 加成与消除反应

*2
+ CH2I2 + Zn(Cu)
*3
O CH2=CH-C-CH3 =
Zn/Cu CH2I2
5.1.9 烯烃的复分解反应
+ cat. +
CH3
[M]
H
H
H H3C H H H3C C C H H H
H H
H3C
[M]
C CH3
H H
C C H
[M]
C CH3 H H
“舞伴交换”
[M]
H3C
H3C
(CH3)2CHCH=CH2
HBr
+
+
(CH3)2C-CH2CH3
(CH3)2CHCHBrCH3 + (CH3)2CBr-CH2CH3
次要产物
主要产物
(3) 速率问题 *1 HI > HBr > HCl
*2 双键上电子云密度越高,反应速率越快。
CH3 2C C CH3 2 > CH3 2C CHCH3 > CH3 2C CH2
5.1.3 烯的酸催化水合反应
例1
CH2=C(CH3)2 + H+
慢
CH3C+(CH3)2
H2O
CH3C(CH3)2
+
-H+
CH3C(CH3)2
OH
CH3 H CH3
H 2O
OH2
CH3 CH3 + H 2O
例2
H+
OH CH3 CH3 + H
CH3 OH CH3 H
5.1.4 卤素与烯键的加成
E
C
反应特点:
C
C
tiffeneau重排机理

tiffeneau重排机理
Tiffeneau重排反应是一种有机化学反应,涉及一个胺基醇在亚硝酸作用下发生重氮化,然后发生碳正离子重排,最终生成羰基化合物。
以下是该反应的机理:
1. 氨基转化为重氮盐:伯氨基与亚硝酸反应,形成重氮盐或其前驱体三氧化二氮(N₂O₃)。
2. 重氮离子的形成与氮气的释放:重氮盐受到亲电试剂(如伯氨基)的进攻,经过一系列质子转移,形成重氮离子。
这种重氮离子不稳定,很容易放出氮气。
3. 碳正离子的形成与重排:放出氮气后,生成一级碳正离子。
然后,碳正离子发生[1,2]-烷基转移,生成更加稳定的氧鎓离子。
4. 去质子化与环酮的形成:最后,氧鎓离子去质子化,生成环酮。
需要注意的是,这个反应存在竞争反应,例如重氮离去基团可能被溶剂(如水)取代,或者形成可能发生其他重排(如氢化物转移)的碳正离子。
由于氢化物转移的活化熵更高,所以扩环反应有利于Tiffeneau-Demjanov重排反应的进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)通过烯醇式结构和碳亚离子反应来连接两种反应原料; (2)利用双键质子化再去质子化是双键发生位移
CH3
O
CH3
O
+
-H+
H OH
CH
O
+H+
_H O 2
CH3 O
Thank you!
碳正离子机理
一、碳正离子稳定性对产物构型的影响
机理
三氟化硼是缺电子分子,同时该反应涉及碳正离子稳定性 比较(两种迁移方式的碳正离子的稳定性)。
前者相邻羰基的存在使碳正离子极不稳定
BF3 O
O
O
O
BF3
二、一个涉及基团迁移和芳香性驱动的反应
O
OH
CH3
CH3
CH 3
CH3
机理
O
CH3
CH3
HO+
H+
CH3
CH 3
OH
CH3 CH3
OH
H
CH3
_
H+
CH3
芳香化合物有很好的稳定性,这是促使甲基取代基迁移 和脱除质子的主要动力。
三、一个酸性条件下的成环反应
O
OH
O
+
CH3 O
O
H3CO
机理
o
OH
CH 2
H3C
H+
HO
CH3 O
CH3
O
A
-H+
CH3 O
O
H+ 双键转移
+OH
CH3O
CH3O
