原料药中重金属残留检测 原料药中重金属残留测试
icp-oes法测定康艾注射液原料药中重金属元素的含量

的广泛应用ꎬ给患者服药提供了一定便利ꎮ 以往患者服用的
痛的作用ꎬ适用于气虚湿热型腰痛症的治疗ꎻ同时采用六合汤
中药汤剂是多种药材合煎的剂型ꎬ可随症加减治疗ꎬ对疾病的
单味中药颗粒剂治疗的临床疗效与中药汤剂接近ꎬ但其总成
治疗非常有效ꎮ 单味颗粒剂是单味中药饮片经提取加工浓缩
本有所降低ꎬ六合汤单味中药颗粒剂可作为气虚湿热型腰痛
镍、铅( As、Ba、Cd、Co、Cr、Cu、Hg、Mn、Ni、Pb) 等元素均具有良好的检出限、精密度、重复性和准确度ꎮ 结论 ICP ̄OES 能够准确快捷检测康艾注
射液原料药中多种重金属元素ꎬ对提高康艾注射液的质量标准具有参考意义ꎮ
关键词:电感耦合等离子体发射光谱ꎻ康艾注射液ꎻ重金属元素
中图分类号:R927 文献标识码:A 文章编号:1006 ̄3765(2019)  ̄11 ̄02101 ̄0072 ̄04
〔2〕 郑筱萸 中药新药临床研究指导原则( 试行) 〔 M〕 中国医药科技
比较无明显差异ꎮ 本研究显示ꎬA、B 两组治疗总有效率比较
型腰痛症的治疗ꎮ 单味颗粒剂的应用ꎬ改变了传统汤剂大包
装饮片、长时间煎煮、过滤饮用等繁琐操作ꎬ但制作成本较高ꎮ
本研究经药物经济学成本 ̄效果分析ꎬ发现单味颗粒剂的价格
ZHOU Jie1 ꎬDU Bao ̄ping1 ꎬHE Xin1 ꎬLIU Qing1 ꎬWANG Ru ̄yi2 ꎬHUANG Hai ̄chao2 (1 Sun Yat ̄sen Universi ̄
ty Cancer Centerꎬ Guangzhou 510060ꎬ Chinaꎻ2 Guangdong Food and Drug Vocational Collegeꎬ Guang ̄
比汤剂高ꎬ但颗粒剂组总成本却低于汤剂组ꎬ主要是 B 组治
天然提取物中重金属溶剂残留的检测

天然提取物中重金属溶剂残留的检测作者:张欢罗忠国来源:《科学与财富》2015年第33期摘要:近年来,生物技术获得了很大的发展,多数产品都打着天然提取物的旗号在销售和使用。
但对于天然提取物而言,并没有想象的那么神奇。
从客观的角度来分析,天然提取物,是一种针对各类物质的提取,多数情况下是针对植物的提取。
提取物虽然是在天然环境形成的,但并非是完全清洁的,提取物中含有的其他物质相对较多,且在检测中不易察觉。
目前,很多地区的土地都受到了严重的污染,环境破坏严重。
针对天然提取物的重金属溶剂残留检测,是非常有必要的,日后应加强该方面的研究。
关键词:天然提取物;重金属;溶剂;残留重金属溶剂是对人体危害较大的一种溶剂,并且在检测中比较困难。
重金属溶剂会随着河流、土地等,不断的融入到植物当中,即便是某些天然提取物,其内部依然有可能含有大量的重金属溶剂,这对植物的加工和产品的销售,都是非常不利的。
为此,应针对天然提取物的检测进行重视,尤其是重金属溶剂的检测工作,必须选择有效的方法,实现高度精准的检测。
在此,本文主要对天然提取物中重金属溶剂残留的检测进行讨论。
一、概述近年来,天然提取物获得了很大的重视,并且在各个领域中均获得了较大的发展,其创造的经济效益和社会效益均是值得肯定的。
但在检测中发现,部分天然提取物中,含有一定数量的重金属溶剂,该物质所造成的恶劣影响非常严重。
从客观的角度来分析,重金属溶剂会对人体构成极大的威胁,如果持续的加大剂量,将导致较多的疾病和身体不适,最终危及生命。
从主观的角度来分析,盲目的相信天然提取物显然是不明智的,应针对天然提取物中的重金属溶剂,进行深入的检测分析,任何残留现象都将是极大的安全隐患。
在大环境中,土地的污染和水源的污染,都为重金属溶剂的残留提供了较多的路径,天然提取物的安全性也是有待深究的。
二、天然提取物中重金属溶剂残留的检测经过长时间的分析和研究,发现大多数的天然提取物中,其含有的重金属溶剂并不多,一般表现为残留现象。
化学原料药中元素杂质的风险评估

化学原料药中元素杂质的风险评估吴洁;黄青兰【摘要】原料药中可能存在多个来源的元素杂质,由于元素杂质通常没有治疗作用,因而原料药生产中元素杂质含量应被控制在可接受的限度.国际人用药物注册技术协调会议(ICH)Q3D元素杂质指南,提出对于潜在存在于药物中的元素杂质需进行定性和定量分析评估,并基于进行风险评估以限制最低元素杂质含量.为响应ICH颁布的元素杂质指导原则,进一步控制原料药中元素杂质水平,现就原料药生产实际,通过对生产工艺及设备等因素可能导致的元素杂质进行评估,确定其风险以制定相应控制策略,从而有效保障药品质量.【期刊名称】《上海医药》【年(卷),期】2019(040)001【总页数】4页(P74-77)【关键词】元素杂质;风险评估;原料药;ICH_Q3D【作者】吴洁;黄青兰【作者单位】上海紫源制药有限公司上海 201108;上海紫源制药有限公司上海201108【正文语种】中文【中图分类】TQ460.72元素杂质主要是指药品生产或贮藏过程中生成、加入或无意引入的物质。
由于药品中元素杂质不能给病人提供任何治疗益处(个别药品除外),而且还可能引发不良反应,或可能对药品的稳定性、保质期产生不利影响,因而建立旨在减少存在于药物中的元素杂质,或者对允许可接受的元素杂质浓度范围进行分析评估尤为重要[1]。
2014年12月人用药品注册技术要求国际协调会(ⅠCH)更新关于金属杂质的指南,该指导原则对元素杂质进行了重新分类,监控的元素杂质种类增加至24种,包含了毒性较大的非金属元素如砷、汞、硒及各种常用的金属催化剂、重金属等,并于2015年9月更名为ⅠCH_Q3D元素杂质指导原则(Q3D Guideline for elements impurities)[2]。
自ⅠCH更新Q3D元素杂质指南后,欧洲药品管理局(EMA)和美国FDA相继更新了这一指南,与ⅠCH高度保持一致,由此可见控制的杂质种类已经从传统的重金属扩展到非金属元素,对元素杂质的监控越来越严格,范围也变宽。
ICP-MS法测定富马酸福莫特罗原料药中催化剂钯的残留量

IC P-M S法测定富马酸福莫特罗原料药中催化剂钯的残留量李春盈,张静,钟依雯,曾敏珊(广州市药品检验所,广东广州510160)摘要:目的建立富马酸福莫特罗中催化剂钯(P d)残留的检测方法。
方法通过直接溶解样品,以电感耦合等离子质谱法(1CP-MS)测定样品中钯的含量。
结果测定了3批富马酸福莫特罗中钯的含量。
ICP-MS条件经优化后,测得钯在2~50 浓度范围内相关系数为0.999 9(^1 = 6),线性关系良好,方法检测限为0.03 fxg.L_1,回收率在98.0%〜101.4%之间,ftSZ)为l.l%(n = 6)。
结论本方法操作简便、快捷、灵敏度高,适用于富马酸福莫特罗中钯残留量的检测。
关键词:电感耦合等离子质谱法;钯残留量;富马酸福莫特罗中图分类号:R917 文献标志码:A文章编号:1674-229X( 2020) 11-0767-02Doi : 10.12048/j.issn. 1674-229X.2020.11.009Determination of Catalyst Palladium Residue in Formoterol Fumarate Dihydrate Crude Product by ICP-MS LI Chunying, ZHANG Jing,ZHONG \iwen,ZENG Minshan( Giia/igz/low Institute of Drug Control, Guangzhou ^ Guangdong 5\0\60 y China)ABSTRACT : OBJECTIVE To establish a method for determinating the residual content of palladium which was used as a catalyst in drug substance of formoterol fumarate dihydrate. METHODS The samples were prepared through dissolving directly and analyzed by inductively coupled plasma mass spectrometry (ICP-MS). RESULTS The content of palladium residue in 3 batches of formoterol fumarate dihydratewere determined.Optimized by ICP-MS, the calibration curves of palladium were at good linear of the concentration range of 2-50 fxg • L 1 , with correlation coefficient (r) was 0.999 9 (n = 6).Detection limits of the method was 0.03 ixg'L-1. The recoveries were in the range of 98.0%-101.4%,and RSD was 1.1% (n = 6).CONCLUSION The method is highly sensitive, rapid and accuracy for determination of catalyst palladium residue in formoterol fumarate dihydrate crude product.KEY WORDS:ICP-MS;palladium residue;formoterol fumarate dihydrate富马酸福莫特罗最初是由日本山之内制药公司 开发的长效、高选择性p2受体激动剂,用于治疗支 气管哮喘,急性支气管炎或喘息性支气管炎等气道 阻塞性肺病[M]。
食品药品原料中元素杂质的法规要求与控制方法

原料药中元素杂质的法规要求及控制方法张再奇元素杂质又称重金属,重金属原义指比重大于5的金属,元素杂质包括可能存在于原料、辅料或制剂中,来源于合成中催化剂残留、药品生产制备过程中引入或辅料中存在的、生产设备引入、或容器密闭系统引入。
某些元素杂质不仅对药品的稳定性、保质期产生不利影响,还可能因为潜在的毒性引发药物副反应。
因此欧盟、美国对杂质的控制越来越严格,对此项不断修订,中国在加入ICH后对此项检测应该也会向国际靠拢,因此了解法规对元素杂质的要求、建立有效的检测方法变得尤为重要。
一、各国法规变更史(1)EMA、EP关于元素杂质的修订EP最新版为9.0版,其中保留了2.4.8金属测试方法A-H;2.4.20章节金属催化剂和金属试剂残留检测;5.20金属催化剂或金属试剂残留。
但在9.3增补版(2018年1月1日实施)中5.20项下规定,元素杂质限度遵循ICH要求。
EMA对元素杂质的修订如下表1。
(2)ICH对元素杂质的修订历程ICH于2009年10月批准了Q3D,经多方讨论后,修订版本的Q3D step4于2014年12月16日生效,其中列出了24种元素杂质的三种给药途径的PDE 值,确定实施日期为:新上市许可为2016年6月生效,已上市品种为2017年12月生效。
(3)USP对元素杂质的修订历程FDA规定在2018年1月1日之后,针对USP药典品种,提交新的NDA、ANDA 应该符合USP<232>、<233>。
针对非USP药典品种,申请人提交新的NDA、ANDA时,应该遵循Q3D。
美国对元素杂质的规定与ICH规定在不同时期,内容不一致,但从2017年12月之后,USP对元素种类和限量均与ICH保持一致。
修订历程详见下表2。
(4)中国药典对重金属检测的修订中国药典对重金属检测的修订主要体现在表3中,名称仍然为重金属,方法仍采用比色法,2017年中国成为了ICH成员国,未来中国的药政监管将遵循ICH指南规定,元素杂质与国际接轨也是大势所趋。
酸枣仁中5种重金属及有害元素含量的测定
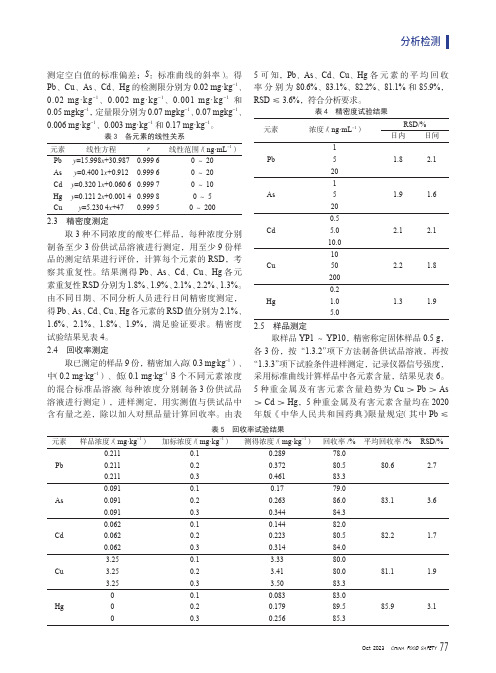
测定空白值的标准偏差;S:标准曲线的斜率)。
得Pb、Cu、As、Cd、Hg的检测限分别为0.02 mg·kg-1、0.02 mg·kg-1、0.002 mg·kg-1、0.001 mg·kg-1和0.05 mg·kg-1,定量限分别为0.07 mg·kg-1、0.07 mg·kg-1、0.006 mg·kg-1、0.003 mg·kg-1和0.17 mg·kg-1。
表3 各元素的线性关系元素线性方程r线性范围/(ng·mL-1)Pb y=15.998x+30.9870.999 60~20As y=0.400 1x+0.9120.999 60~20Cd y=0.320 1x+0.060 60.999 70~10Hg y=0.121 2x+0.001 40.999 80~5Cu y=5.230 4x+470.999 50~2002.3 精密度测定取3种不同浓度的酸枣仁样品,每种浓度分别制备至少3份供试品溶液进行测定,用至少9份样品的测定结果进行评价,计算每个元素的RSD,考察其重复性。
结果测得Pb、As、Cd、Cu、Hg各元素重复性RSD分别为1.8%、1.9%、2.1%、2.2%、1.3%。
由不同日期、不同分析人员进行日间精密度测定,得Pb、As、Cd、Cu、Hg各元素的RSD值分别为2.1%、1.6%、2.1%、1.8%、1.9%,满足验证要求。
精密度试验结果见表4。
2.4 回收率测定取已测定的样品9份,精密加入高(0.3 mg·kg-1)、中(0.2 mg·kg-1)、低(0.1 mg·kg-1)3个不同元素浓度的混合标准品溶液(每种浓度分别制备3份供试品溶液进行测定),进样测定,用实测值与供试品中含有量之差,除以加入对照品量计算回收率。
由表5可知,Pb、As、Cd、Cu、Hg各元素的平均回收率分别为80.6%、83.1%、82.2%、81.1%和85.9%,RSD≤3.6%,符合分析要求。
重金属残留检测实验方法

原子吸收分光光度法测定重金属残留铅、镉测定法(石墨炉法)供试品溶液制备:取供试品粗粉(过2号筛)0.5~1.0g,精密称定,置消化瓶中加硝酸-高氯酸(4:1)混合溶液10mL,混匀,瓶口加一小漏斗,浸泡过夜。
置消化炉上,加热消解,保持微沸,至棕色烟散尽后,加温继续加热直至白烟散尽,消解液呈无色或略带黄色,放冷,转入50mL量瓶中,用2%硝酸定容至刻度,摇匀,即的。
同法同时制备试剂空白溶液。
铜测定法(火焰法)供试品溶液制备同铅测定下供试品溶液制备。
砷测定法(氢化物法)供试品溶液制备:取供试品粗粉(过2号筛)0.5~1.0g,精密称定,置消化瓶中加硝酸-高氯酸(4:1)混合溶液10mL,混匀,瓶口加一小漏斗,浸泡过夜。
置消化炉上,加热消解,保持微沸,至棕色烟散尽后,加温继续加热直至白烟散尽,消解液呈无色或略带黄色,放冷,转入50mL量瓶中,用2%硝酸定容至刻度,摇匀,即的。
精密量取10mL,置25mL量瓶中,加25%碘化钾(临用前配置)1mL,摇匀,加10%抗坏血酸(临用前配置)1mL,摇匀,用20%盐酸定容,摇匀,密塞,置80度水浴中加热3min,取出放冷。
取适量吸入氢化物发生装置,测定吸收值。
同法同时制备试剂空白溶液。
汞测定法(冷吸收法)供试品溶液制备:取供试品粗粉(过2号筛)0.5~1.0g,精密称定,置消化瓶中加硝酸-高氯酸(4:1)混合溶液10mL,混匀,瓶口加一小漏斗,浸泡过夜。
置消化炉上,加热消解,保持微沸,至棕色烟散尽后,加温继续加热直至白烟散尽,消解液呈无色或略带黄色,放冷,加4%硫酸溶液适量、5%高锰酸钾溶液0.5mL,摇匀,滴加5%盐酸羟胺溶液至紫红色恰消失,转入25mL量瓶中,用4%硫酸定容至刻度,摇匀,即得。
同法同时制备试剂空白溶液。
注意事项:1、视实际消化情况称取供试品,一般是取1.0g,有些量多就称取少些比如菟丝子只能是0.5g,否则消化不完,有残渣。
因瓶壁上会沾有供试品,所以加硝酸-高氯酸(4:1)混合溶液时先冲洗瓶壁。
利伐沙班原料药中重金属镍残留量的检测方法与评价

利伐沙班原料药中重金属镍残留量的检测方法与评价王宣江苏省淮安市食品药品检验所,淮安223001摘要目的:建立利伐沙班原料药中金属催化剂镍残留的两种测定方法,并对不同方法进行比较分析。
方法:方法一采用石墨炉原子吸收分光光度法;方法二采用电感耦合等离子体质谱法"结果:方法一在10〜100范围内线性良好,最低检出浓度为1.9方法检测限为0.2!g・gT,加标回收率平均为112%;方法二在0.5〜20!g・LT范围内线性良好,最低检出浓度为0.056!g・L%i,方法检测限为0.007^g-g%1,加标回收率平均为97.9%。
结论:6批样品的检验结果表明,两种方法对结果的测量无明显差异,但电感耦合等离子体质谱法具有分析速度快、检测限更低、灵敏度高以及可多种元素同时测定等优点,在重金属痕量分析检测方面更具优势。
关键词利伐沙班;金属催化剂;镍;电感耦合等离子体质谱法;石墨炉原子吸收分光光度法中图分类号R927.1文献标志码A文章编号1673-7806(2020)05-338-03利伐沙班(Rivaroxaban)化学名为5-氯(((5S)-2-氧代-3-(4-(3-氧代-4-吗啉基)苯基)-1,3-恶唑烷-5-基)甲基)-2-噻吩甲酰胺巴分子式为G9H27CIN3O5S,是一种口服的抗凝血药物,它通过高选择性直接抑制Xa因子达到抑制凝血酶产生和血栓形成的作用,与传统抗凝血药物相比,具有服用方便、起效迅速、安全性高等特点叫在利伐沙班合成中,用到雷尼鎳作为催化剂目,鎳及其盐类的毒性较低,但由于它本身具有生物化学活性,故能激活或抑制一系列的酶(精氨酸酶、羧化酶、酸性磷酸酶和脱羧酶)而发挥其毒性。
长期接触(如冶炼鎳、镀鎳等)、吸入或注射鎳化物,均有致癌作用。
欧洲药物评审组织(EMEA)将金属催化剂按风险级别分类管理,鎳作为第1类金属,规定注射用原料药中不得超过1!g-g"1[4]o药物中鎳含量的测定方法主要有火焰原子吸收法、石墨炉原子吸收法、电感耦合等离子体质谱法等%本研究采用微波消解法进行样品前处理,建立了石墨炉原子吸收法、电感耦合等离子体质谱法两种方法测定利伐沙班中残留的鎳,并作比较分析,为药物中痕量鎳的测定提供参考。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原料药中重金属残留检测原料药中重金属残留测试
一、仪器及试剂
1、仪器:
电感藕合等离子质谱(ICP-MS,美国THERMO iCAP Q);WX-8000微波消解仪(上海屹尧仪器科技发展有限公司);Dura series超纯水处理系统。
2、试剂:
65%-68%优级纯硝酸(国药集团);超纯水(Dura series超纯水处理系统);各元素元素标准溶液(国家有色金属及电子材料分析测试中心,1000 μg/mL)。
3、标准溶液的配置:
吸取各元素元素标准溶液,用5 % HNO3将标准溶液稀释成20 mg/L的储备液,取20 mg/L的储备液再次稀释为200 µg/L、400 µg/L的储备液,取200 µg/L、400 µg/L储备液适量依次配制成0 µg/L、8 µg/L、16 µg/L、24 µg/L、32 µg/L、48 µg/L、64 µg/L的系列标准溶液,摇匀待用。
二、样品分析方法
1、前处理方法:
称取0.5mL样品至聚四氟乙烯消解罐中(精确至0.1 mg),加入5 mL硝酸。
静置,反应结束后,盖盖密封,放入微波消解仪,消解程序见表1。
步骤温度(℃)保温时间(min)
1 100 3
2 140 3
3 160 3
4 180 3
5 190 15
表1:消解程序
待温度冷却至50℃以下后,取出消解罐放入通风橱中,打开消解罐,用超纯水润洗,转移至50 mL容量瓶中,至少润洗3~4次,用超纯水稀释定容至刻度,待测。
空白对照同法处理。
2、仪器工作参数
载气流量(L/min)0.98 积分时间(ms)500
三、方法学验证
1、专属性检测
向样品溶液中使用移液枪移取50μL的100ng/mL的标准中间液,按照消解程序消解定容至50mL。
同时准备一份空白溶液,进样后对比分析。
要求专属性良好,其他元素对各元素元素检测无干扰。
2、系统适用性
根据制备溶液步骤制备溶液,在测试溶液前后各测量加标浓度为1.0 ng/mL的样品加标,前后两次的漂移不得超过20%。
3、线性关系和检出限、定量限
将系列标准溶液分别进样分析,得到各元素的线性方程和相关系数,要求线性关系良好。
取空白对照溶液进行测试,连续进样10次,以空白对照溶液测定值的3倍标准偏差除以相应元素标准曲线的斜率计算该方法的检出限。
4、重复性
取6份样品于微波消解罐中,按照上述过程消解,定容50mL,使用仪器读数,计算各元素元素的偏差。
测得RSD值均不得大于5%。
5、中间精密度
连续三天取1份样品于微波消解罐中,按照上述过程消解,定容50mL,使用仪器读数,计算各元素元素的偏差。
测得RSD值均不得大于5%。
6、加标回收率
取6份样品于微波消解罐中,使用移液枪取0.5 mL的1000ng/mL的标准溶液于微波消解罐中,按照上述过程消解,定容50mL,使用仪器读数,计算各元素元素的偏差。
加标回收率均要求在80%-120%之间,测得RSD值均不得大于5%。
科标技术分析中心简称“科标技术”,是青岛科标(检测)研究院旗下的专业分析研发品牌,由科标技术研发中心(青岛)有限公司独立运营。
科标技术依托科标检测品牌旗下的技术、设备、人员、平台等优势资源,地处化工行业产学研示范基地,可利用资源包括气相色谱质谱联用仪、液相色谱仪、ICP-OES等200余台/套先进的研发分析配套设备、5000平方米的实验室,保证分析的精度,为客户提供一站式的分析技术服务和整套解决方案。
科标技术作为“科标检测”品牌重点投资建设的专业研发品牌,可共享科标检测品牌旗下的优势团队资源。
专业研发团队150余人,其中教授(高级工程师、研究员)共9人,研究生以上学历共90余人,专业实验人员60余人。
科标品牌的发展得到了国家、省、市的大力支持与认可,是国家化工行业产学研示范基地分析研发板块支撑单位、科技部中小企业公共分析检测与科研创新资源共享服务平台、青岛市技术转移服务机构、青岛市名牌单位、青岛市“专、精、特、新”计划单位。
科标技术专业提供生物、环境、药品、精细化工、能源、材料等领域分析研发技术服务,专业解决国内外企业、高校院所、科研机构的分析方法开发与优化、课题外包、项目攻关等服务,致力于为客户提供最专业的分析研发解决方案,支撑科技进步,成为社会尊重、客户信赖的研究型分析研发机构。
科标技术始终引领分析研发行业的科学化、标准化发展,秉承“敢为人先、开拓创新、同心协力、勇承重载”的科标精神,以服务赢得信任,以品质铸就辉煌。
科标技术——“让研发更简单”。
