第八章 配位化合物
配位化合物
8.2 配合物的空间结构和异构现象
1、配合物的空间结构 空间构型
配位数 2 杂化轨道 sp 空间构型 直线型 实例 [Ag(NH3)2]+
3
4
sp2
sp3
平面三角形
平面正方形
[HgI3][Ni(CN)4]-、[PdCl4]2-
四面体
5 dsp3或d3sp d2sp2 6 d2sp3或sp3d2 三角双锥 正方锥形 正八面体
配位数(不一定是配体数)
与中心原子直接以配位键结合的配位原子的数目 称为中心原子的配位数。中心原子的配位数一般可为 2-12,以配位数2,4,6最为常见。 中必原子的配位数与配体的齿数有关,
配体是单齿,那么中心原子的配位数就是配体的数目; 配体是多齿,那么中心原子的配位数则是配体的数目 与其齿数的乘积。 例如: [Co Br(NH3)5] (SO4),
1.62×107=(0.02-x)/4x3
x=6.8×10-4
二、配位解离平衡移动
1. 与弱电解质平衡的竞争
M+ + L+ + OHH+ [ML]
当Ka, Kb越小,配离子越易解离 平衡向生成弱酸、弱碱方向移动 MOH HL
[ Fe(C2O4 )3 ]3
Fe3 3C2O4 2
+ 6H+
→
3. 杂化轨道形式与配合物的空间构型
配 位 数 2 3
空间构型
直线形 平面三角形
杂化轨 道类型 sp sp2
实例
Ag(NH3)2+ , Ag(CN)2– Cu(CN)32 – ,HgI3–
4 4 5
5 6
正四面体 四方形 三角双锥
四方锥 八面体
普通化学 第八章 配位化合物和配位平衡

c(NH ) / c
3
2
0.10 0.10 1.9 103 {( x 2 0.10mol / L) / c }2
x = 2.5 mol/L, 即氨水的初始浓度至少为 2.5 mol· -1。 L
3
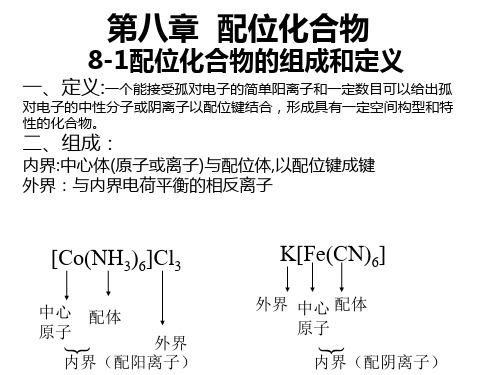
8.1.1 配合物的组成
[Ag(NH3)2]Cl
配合物 内界 外界
[Ag(NH3)2]+
中 心 离 子 配 位 原 子 配 位 体 配 位 体 数 配 离 子 电
Cl外 界 离 子
4
荷
常见配位体名称、配位原子
配位体 FClBrISCNNCSH2 O NH3 NH2OHCNS2O32配位体名 称 氟 氯 溴 碘 硫氰酸根 异硫氰酸 根 水 氨 氨基 羟基 氰 硫代硫酸 根 配位 原子 F Cl Br I S N O N N O C O 配位体 CO NO ONONO2CH3COOC2O42(ox)* 配位体名称 羰基 亚硝酰 亚硝酸根 硝基 乙酸根 草酸根 吡啶 联吡啶 甲胺 乙二胺 乙二胺四乙酸 根 配 位 原 子 C N O N O O N N N N N,O
Hongmei Wang , Zhiliang Liu, Caiming Liu, Deqing Zhang, et al
Inorganic chemistry, 2004, 43,4091-4098.
12
13
不饱和烃配合物 π 电子参与形成配位键的配合物。
14
冠醚类配合物
15
C60-配合物
4.31
Cu(NH 3 ) 2 NH 3 Cu(NH ) NH 3
2 Cu(NH 3 )3 NH 3
第八章 络合物(配位化合物)化学基础

第八章络合物(配位化合物)化学基础【竞赛要求】配位键。
重要而常见的配合物的中心离子(原子)和重要而常见的配位(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。
螯合物及螯合效应。
重要而常见的络合剂及其重要而常见的配合反应。
配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。
配合物几何构型和异构现象基本概念。
配合物的杂化轨道理论。
八面体配合物的晶体的颜色。
路易斯酸碱的概念。
场理论。
Ti(H2O) 36【知识梳理】一、配合物基本知识1、配合物的定义由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。
凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。
[Co(NH3)6]3+,[Cr(CN)6]3–,Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。
[Co(NH3)6]Cl3、K3[Cr(CN)6]、Ni(CO)4都是配位化合物。
[Co(NH3)6]、[Cr(CN)6] 也是配位化合物。
判断的关键在于是否含有配位单元。
思考:下列化合物中哪个是配合物①CuSO4·5H2O ②K2P t Cl6 ③KCl·CuCl2④Cu(NH2CH2COO)2 ⑤KCl·MgCl2·6H2O ⑥Cu(CH3COO)2注意:①配合物和配离子的区别②配合物和复盐的区别2、配合物的组成中心离子内界单齿配体配位体多齿配体配合物螯合配体外界(1)配合物的内界和外界以[Cu(NH3)4]SO4为例:[Cu(NH3)4]2+ SO 24内界外界内界是配位单元,外界是简单离子。
又如K3[Cr(CN)6] 之中,内界是[Cr(CN)6]3–,外界是K+。
可以无外界,如Ni(CO)4。
但不能没有内界,内外界之间是完全电离的。
(2)中心离子和配位体中心离子:又称配合物的形成体,多为金属(过渡金属)离子,也可以是原子。
第八章 配位化合物

A·m2
(3)测定 磁矩可通过磁天平测定。 • 顺磁性:被磁场吸引
• 反磁性:被磁场排斥
• 铁磁性:被磁场强烈吸引 (如 Fe , Co , Ni)
..
..
..
..
N
S
(a)无磁场
N
S
(b)磁场打开
顺磁性的说明
(4)影响因素 未成对电子数越多,磁矩越高,配合物
的磁性越大。
(5)意义
• 根据未成对电子数求磁矩; • 根据磁矩求未成对电子数; • 判断杂化方式、空间构型、配合物类型。
未成对电子数 0 1 2 3 4 5
µ计 / B.M
0 1.73 2.83 3.87 4.90 5.92
例: 测定FeF63-的µ为5.90 B.M,可判断: Fe3+有5个未成对电子;
Ag+
4d
[Ag(NH3)2]+
4d
5s
5p
NH3 NH3
5s
5p
sp杂化
2. 配位数为4的配合物的杂化方式及空间构型
(1)[NiCl4]2-:Ni 3d84s2
sp3杂化
Ni2+
Ni2+ 3d8 外轨型
四面体
3d
[NiCl4]2-
3d
4s
4p
Cl-
Cl- Cl- Cl-
4s
4p
sp3杂化
[NiCl4]2-
NH2-CH2-CH2-H2N
说明:
少数配体虽然有两个配位原子,由于两 个配位原子靠得太近,只能选择其中一 个与中心原子成键,故仍属单齿配体。
硝基NO(2 N是配位原子) 亚硝酸根ONO- (O是配位原子) 硫氰根SCN (S是配位原子) 异硫氰根NCS (N是配位原子)
第8章_配位化合物
1704年,普鲁士人在染料作坊中发现第一个配合物 1789年,B. M. Tassert发现分子加合物[Co(NH3)6]Cl3 1893年,Werner提出“络合理论” 1930年,Pauling 提出配位键理论
1929 年,H. Bethe 提出晶体场理论
X-射线晶体衍射技术的产生,促进配位化学的发展
•• ••
4s 3d
•• ••
4p
dsp2杂化
Ni(CN)42 –的空间构型为平面四边形
③ML6配合物:
[FeF6]3– Fe3+ (3d5):
3d
F–的配位作用较弱,利用4s、4p、4d轨道杂化
•• •• •• •• •• ••
3d
4s
4p sp3d2杂化
4d
[FeF6]3–的空间构型为八面体
[Fe(CN)6]4Fe2+ (3d6):
例如:
[NiCl4]2-
[Ni(CN)4]2-
sp3杂化
外轨型 正四面体
dsp2杂化 内轨型 平面正方形
3. 价键理论的应用
⑴判断配合物的空间构型
判断中心离子杂化类型及配合物空间构型的方法
1. 根据配位数=杂化轨道数,初步判断中心离子
也有中性原子,如[Ni(CO)4]、[Co(CO)4]中的Ni、Co等。
②配位体:
含有孤对电子的分子或离子
配体中提供孤对电子与 中心离子以配位键相结 合的原子称配位原子, 如NH3分子中的N原子, H2O分子中的O原子。
常见配体和配位原子
配体
NH3,RNH2,NCS-
配位原子
N
H2O,OH-,RCOO-,
②中心离子提供的空轨道是经过杂化的。 杂化类型由中心原子M的价电子构型和配 体L的种类、数目决定。 ③配合物(配离子)的空间构型取决于中 心离子的杂化方式。
无机化学第8章 配位化合物

HBNU-Liujy
2. 四面体场(Td, Tetrahedron Field)中d轨道的分裂
Z
Z
Y
dz2
Z
X Y
Z
X
dX2-Y2
Z
X
X
X
Y
dXY
Y
dXZ
Y
dYZ
18
第08章 配位化合物
HBNU-Liujy
Td
Splitting分裂能Δt =Et2-Ee
d
d
自由离子 free ion
球形场 sphere
Py
Px
Px
S
S
Py
pz
Py
Py
Px
Px
Pz
pz
Py
Py dx2-y2
pz
dz2
杂化轨 直 道的空 线 间构型 形
平面 正四 平面 三角 三角形 面体 正方形 双锥
形
四方 锥形
正八 面体 形
正八 面体 形
10
第08章 配位化合物
HBNU-Liujy
3. Inner-Orbital and Outer-Orbital Complex
16
第08章 配位化合物
HBNU-Liujy
Oh
Splitting分裂能Δo =Eeg-Et2g
d
d
自由离子 free ion
球形场 sphere
eg(dz2,dx2-y2)
Δo=10Dq
160Δo 140Δo
t2g(dxy,dxz,dyz)
四面体场 tetrahedron
17
第08章 配位化合物
22
第08章 配位化合物
HBNU-Liujy
第八章配位化合物解析

P t Cl 3 ( NH3 )
( 2 )
( 3) K 3 Fe(CN)6
赤血盐 ,
( 2) K 4 Fe(CN)6
黄血盐
(0) ( 3) Co Cl 3 (NH3 ) 3 , Fe(CO)5
配合物磁性的测定是判断配合物结构的一个重要手段。 磁矩: µ = [n(n+2)]1/2 (B.M.)玻尔磁子.
[Fe(H2O)6]3+ 磁矩 5.9B.M. 5个未成对电子 外轨型 [Fe(CN)6]3磁矩 2.0B.M. 1个未成对电子 内轨型
价键理论能很好地解释了配合物的空间构型、
磁性、稳定性,直观明了,使用方便,但它无
的多面体结构的化合物。
金属冠状配合物:过渡金属离子相互连接成 与冠醚结构类似的环状结构的化合物。 有机金属配合物:含有金属-碳键的配合物。
8.2.2 配位化合物的命名
配酸:×××酸。例: H2[PtCl6]
配碱:氢氧化×××。 例:[Ag(NH3)2]OH
配盐:先阴离子后阳离子,简单酸根加“化”字,
8.2.1 配合物的类型 简单配合物:一个中心离子,每个配体均为单齿配体. 如 Fe(CN)4 Co(NH ) (H O)3
6 3 5 2
螯合物:一个中心离子与多齿配体成键形成环状结构 的配合物. 如[Cu(en)2]2+, CaY2-
其它分类: 多核配合物:一个配位原子同时与两个中心 离子结合形成的配合物。 原子簇化合物:簇原子以金属-金属键组成
2
4 3 1 4 2 2 2 6 3 2 6 1 6 6
P tCl3 (NH3 ) 2 CoCl2 (en)2 3 Al(C2O 4 )3 2 Ca(EDT A)
8配位化合物

单齿配体 Cu(NH 3 ) 4 多齿配体 4 3 1 4 2 2 2 6 3 2 6 1 6 6
12
PtCl 3 (NH 3 ) CoCl 2 (en) 2 2 Al(C 2 O 4 ) 3 3 Ca(EDTA) 2
影响中心原子配位数的主要因素有:
Fe(CO) 5
硫酸四氨合铜(Ⅱ) 六异硫氰根合铁(Ⅲ)酸钾
六氯合铂(Ⅳ)酸
氢氧化四氨合铜(Ⅱ) 五氯•氨合铂(Ⅳ)酸钾
硝酸羟基•三水合锌(Ⅱ)
(三)氯化五氨•水合钴(Ⅲ) 五羰(基)合铁
三硝基•三氨合钴(Ⅲ)
乙二胺四乙酸根合钙(Ⅱ)
18
Question
命名下列配合物和配离子: (1)(NH4)3[SbCl6]; (2)[Co(en)3]Cl3
(一)晶体场理论的基本要点
二、配合物的晶体场理论
(1)在配位个体中,中心原子与配体靠静电作
用结合,这是配位个体稳定的主要因素。 (2)配体所形成的负电场对中心原子的电子, 特别是价电子层的 d 电子产生排斥作用,使中心 原子原来 5 个简并 d 轨道的能级发生分裂。 (3)由于 d 轨道的能级发生分裂,中心原子 价电子层的 d 电子重新分布,使配合物的能量降 低,在中心原子和配体之间产生附加成键效应。
1价金属离子 2价金属离子 3价金属离子
Cu+ 2,4 Ag+ 2 Au+ 2,4
Ca2+ 6 Mg2+ 6 Fe2+ 6 Co2+ 4,6 Cu2+ 4,6 Zn2+ 4,6
Al3+ Cr3+ Fe3+ Co3+ Au3+
4,6 6 6 6 4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章配位化合物思考题解析以下配合物中心离子的配位数为6假定它们的浓度均为0.001mol.L-1,指出溶液导电能力的顺序,并把配离子写在方括号内.(1)Pt(NH3)6Cl4(2)Cr(NH3)4Cl3(3)Co(NH3)6Cl3(4)K2[PtCl6]解:溶液导电能力顺序为Pt(NH3)6Cl4>Co(NH3)6Cl3>K2[PtCl6]>Cr(NH3)4Cl32. PtCl4和氨水反应, 生成化合物的化学式为)Pt(NH3)4Cl4。
将1mol此化合物用AgNO3处理,得到2molAgCl,试推断配合物内界和外界的组分, 并写出其结构式。
解:内界为[PtCl2 (NH3)4]2+、外界为2 Cl-,结构式为:[Pt Cl2 (NH3)4] Cl2。
3下列说法哪些说法不正确?说明理由。
配合物由内界和外界两部分组成。
(2)只有金属离子才能作为配合物的形成体。
(3)配位体的数目就是形成体的配位数。
(4)配离子的电荷数等于中心离子的电荷数。
(5)配离子的几何构型取决于中心离子所采用的杂化轨道类型。
解:(1)不正确。
有些化合物不存在外界,如[PtCl2 (NH3)2]、[CoCl3 (NH3)3]等。
不正确。
少数高氧化数的非金属元素离子也可作为形成体,如[BF4]-、[SiF6]2-中的B3+、Si4+等;另外,有些中性原子也可作形成体,如[Ni(CO)4]中的Ni原子。
不正确。
在多齿配体的螯合物中,配位体数目就不等于配位数,如[Cu(en)2]2+中。
不正确。
配离子电荷应是形成体和配位体电荷的代数和。
如[Fe(CN)6]3-。
正确。
4.实验测得下列配合物磁矩数据(B.M.)如下:[CoF6]3- 4.5 [Ni(NH3)4]2+ 3.0 [Ni(CN)4]2-0 [Fe(CN)6]4-0 [Cr(NH3)6]3+ 3.9 {Mn(CN)6}4- 1.8试判断它们的几何构型,并指出哪个属于内轨型,哪个属于外轨型配合物。
解:5.下列配离子中哪个磁矩最大?[Fe(CN)6]3-[Fe(CN)6]4- [Co(CN)6]3-[Ni(CN)4]2- [Mn(CN)6]3-解:可见, [Mn(CN)6]3-的磁矩最大。
6.下列配离子(或中性配合物)中,哪个为平面正方形构型?哪个为正八面体构型?哪个为正四面体构型?[PtCl4]2-[Zn (NH3)4]2+Fe(CN)6]3-[HgI4]2-[Ni(H2O)6]2+[Cu(NH3)4]2+解:10.试解释下列事实:用王水可溶解Pt、Au等惰性较大的贵金属,但单独用硝酸或盐酸则不能溶解。
[Fe(CN)6]4-为反磁性,而[Fe(CN)6]3-为顺磁性。
[Fe(CN)6]3-为低自旋,而[Fe(CN)6]4-为高自旋。
[Co(H2O)6]3+的稳定性比[Co(NH3)6]3+差得多。
解:(1)由于王水是由浓硝酸和浓盐酸组成,浓硝酸将Pt、Au氧化形成的金属离子可与浓盐酸提供的高浓度的氯离子形成稳定的[PtCl6]2-、[Au Cl4]-,使Pt4+、Au3+的浓度大大降低,从而使Pt、Au进一步被氧化。
(2)[Fe(CN)]4-中Fe2+(3d6)d电子分布方式为无成单电子,故为反磁性。
[Fe(CN)6]3-中Fe3+(3d5)d电子分布方式为有成单电子,故为顺磁性。
(3)因为CN-为强场,Δ0大,易形成低自旋配合物;而F-为弱场,Δ0小,易形成高自旋配合物。
由于配体NH3的场强比H2O的大的多,所以[Co(H2O)6]3+的晶体场稳定化能比[Co(NH3)6]3+的小的多,导致前者比后者稳定性差的多。
11.下列说法中哪些不正确?说明理由。
(1)某一配离子的K f值越小,该配离子的稳定性越差。
(2)某一配离子的K d值越小,该配离子的稳定性越差。
(3)对于不同类型的配离子,K f值大者,配离子越稳定。
(4)配合剂浓度越大,生成的配离子的配位数越大。
解:(1)正确。
(2)不正确。
K d值越小,说明该配离子越难离解,亦即稳定性越好。
(3)不正确。
不同类型配离子的配位数不相同,故其稳定性不能按K f值大小比较。
(4)不一定。
当配位剂浓度大小已经满足形成体的特征配位数后,配位物浓度即使再增大,对形成配离子的配位数已无大影响。
12.向含有[Ag(NH3)2]+的溶液中分别加入下列物质:(1)稀HNO3(2)NH3·H2O(3)Na2S溶液。
试问下列平衡的移动方向。
[Ag(NH3)2]+ ========= ==Ag++ 2 NH3解:(1)平衡向右移动。
(2)平衡向左移动。
(3)平衡向右移动。
13.AgI在下列相同浓度的溶液中,溶解度最大的是哪一个?KCN Na2S2O3KSCN NH3·H2O 解:AgI若在上述相同的配合剂中溶解,生成的配离子分别为[Ag(CN)2]-、[Ag(S2O3)2]3-、[Ag(SCN)2]-、[Ag(NH3)2]+, 它们的K f值分别为1.26×1021、2.88×1013、3.72×107、1.12×107,由此可得出AgI在KCN溶液中溶解度最大.14.根据配离子的K f(标准)值判断下列E(标准)值哪个最小?哪个最大?(1)E(标准)(Ag+/Ag)(2) E(标准)([Ag(NH3)2]+/Ag)(3) E(标准)([Ag(S2O3)2]3-/Ag)(4) E(标准)([Ag(CN)2]-/Ag)解:根据8-13题解数据可知:K f(标准)值(4)>(3)>(2),K f(标准)值越大,说明相应氧化型物质中c(Ag+)越小,导致其电对的标准电极电势值越小。
所以E(标准)(Ag+/Ag)最大,E(标准)([Ag(CN)2]-/Ag)最小。
15.判断下列转化反应能否进行。
(1)[Cu(NH3)4]2+ + 4H+Cu2+ + 4NH4+(2) AgI + 2 NH3 [Ag(NH3)2]+ + I-(3) Ag2S + 4CN-2[Ag(CN)2]- + S2-(4) [Ag(S2O3)2]3- + Cl-AgCl + 2 S2O32-解:(1)能。
(2)不能。
(3)不能。
(4)不能。
习题解答指出下列配离子的形成体、配体、配位原子及中心离子的配位数。
解:命名下列配合物,并指出配离子电荷数和形成体的氧化数。
解:写出下列配合物的化学式:三氯·一氨合铂(Ⅱ)酸钾高氯酸六氨合钴(Ⅱ)二氯化六氨合镍(Ⅱ)四异硫氰酸根·二氨合铬(Ⅲ)酸胺一羟基·一草酸根·一水·一乙二胺合铬(Ⅲ)五氰·一羰基合铁(Ⅱ)酸钠解:(1)K[PtCl3(NH3)] (2) [Co(NH3)6](ClO4)2(3) [Ni(NH3)6]Cl2NH4[Cr(NCS)4(NH3)2(5) [Cr(OH)(C2O4)(H2O)(en)] (6) Na2[Fe(CN)5(CO)]有下列三种铂的配合物,用实验的方法确定它们的结构,其结果如下:根据上述结果,写出上列三种配合物的化学式。
解:三种配合物的化学式分别为(1)(2)(3)[Pt(NH3)6]Cl4[PtCl2(NH3)4]Cl2[PtCl4(NH3)2根据下列配离子中心离子未成对电子数及杂化类型,试绘制中心离子价电子层电子分布示意图。
解:[Cu(NH3)4]2+dsp2杂化3d 4s 4pNH3 NH3 NH3 NH3[CoF6]3-sp3d2杂化3d 4s 4p 4dF-F-F-F-F-F- [Ru(CN)6]4-d2sp3杂化4d 5s 5pCN- CN- CN- CN- CN- CN-[Co(NCS)4]2-sp3杂化3d 4s 4pSCN- SCN- SCN- SCN-已知[MnBr4]2-和[Mn(CN)6]3-的磁矩分别为5.9和2.8B.M.,试根据价键理论推测这两种配离子d电子分布情况及它们的几何构型。
解:已知[MnBr4]2-和μ=5.9B.M., [Mn(CN)6]3-μ=2.8B.M. 由μ=√n (n+2) 式求得[MnBr4]2- 中n =5 Mn2+(n=5),与相比较,可推测[Mn(CN)6]3- 中n =2 Mn3+(n=4)[MnBr4]2-价电子层分布为sp3杂化3d 4s 4pBr- Br- Br- Br-[MnBr4]2- 几何构型为正四面体。
[Mn(CN)6]3- 价电子层分布为d2sp3杂化3d 4s 4pCN- CN- CN- CN- CN- CN-[Mn(CN)6]3- 几何构型为正八面体。
在50.0mL0.20mol·L-1AgNO3溶液中加入等体积的1.00mol·L-1的NH3·H2O,计算达平衡时溶液中Ag+、[Ag(NH3)2]+ 和NH3·H2O 的浓度。
解:混合后尚未反应前: c (Ag +)=0.10mol.L -1 c (NH 3·H 2O)=0.50 mol.L -1又因K f Θ([Ag(NH 3)2]+)较大,可以认为Ag +基本上转化为[Ag(NH 3)2]+,达平衡时溶液中c (Ag +)、c (NH 3·H 2O)、c ([Ag(NH 3)2]+)由下列平衡计算:Ag + + 2 NH 3·H 2O ====== [Ag(NH 3)2]+ + 2 H 2O起始浓度/(mol ·L -1) 0.50-2×0.10 0.10 平衡浓度/(mol ·L -1) x 0.30+2x 0.10-x72023*********.1}/)(}{/)({}/)])(([{⨯=∙=++c O H NH c c Ag c c NH Ag c K f721012.1)230.0(10.0⨯=+-x x x K f 0较大,故x 很小,0.10-x ≈0.10,0.30+2x ≈0.30。
则721012.130.010.0⨯=xx =9.9×10-8即c (Ag +)=9.9×10-8 mol ·L -1, c ([Ag(NH 3)2]+)=( 0.10-x ) mol.L -1≈0.10mol.L -1 c (NH 3·H 2O)=(0.30+2x ) mol.L -1≈0.30mol.L -18.10mL0.10 mol.L -1CuSO 4溶液与10mL6.0 mol.L -1 NH 3·H 2O 混合达平衡,计算溶液中Cu 2+, NH 3·H 2O,[Cu(NH 3)4]2+的浓度各是多少?若向此混合溶液中加入0.010 mol.L -1NaOH 固体,问是否有Cu(OH)2沉淀生成?解:混合后未反应前:c (Cu 2+)=0.050 mol.L -1, c (NH 3)=3.0 mol.L -1,达平衡时: Cu 2+ + 4 NH 3·H 2O ====== [Cu(NH 3)4]2+ + 4 H 2O 平衡浓度/( mol.L -1) x 3.0-4×0.050+4x 0.050-x13440302024301009.2)48.2(050.0}/)(}{/)({/)])(([⨯=+-==++x x x c NH c c Cu c c NH Cu c K fx 很小,故2.8+4x ≈2.8, 0.050-x ≈0.050,134101.2)8.2(050.0⨯=x x =3.9×10-17 即c (Cu 2+)=3.9×10-17 mol.L -1, c ([Cu(NH 3)4]2+)≈0.050 mol.L -1, c (NH 3·H 2O)≈2.8 mol.L -1 若在此溶液中加入0.010 mol.L -1NaOH(s),即: c (OH -)(0.010×1000/20) mol.L -1 =0.50 mol.L -1,J=21720202)50.0(109.3)()}({)(⨯⨯=⨯--+c OH c c Cu c =9.8×10-18>K sp 0(Cu(OH)2)故有Cu(OH)2沉淀产生。
