第八章 配位化合物(1)
合集下载
配位化合物
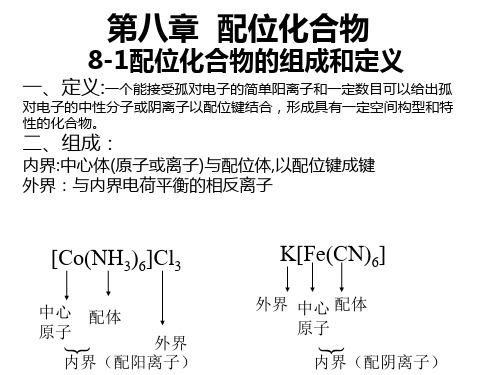
8.2 配合物的空间结构和异构现象
1、配合物的空间结构 空间构型
配位数 2 杂化轨道 sp 空间构型 直线型 实例 [Ag(NH3)2]+
3
4
sp2
sp3
平面三角形
平面正方形
[HgI3][Ni(CN)4]-、[PdCl4]2-
四面体
5 dsp3或d3sp d2sp2 6 d2sp3或sp3d2 三角双锥 正方锥形 正八面体
配位数(不一定是配体数)
与中心原子直接以配位键结合的配位原子的数目 称为中心原子的配位数。中心原子的配位数一般可为 2-12,以配位数2,4,6最为常见。 中必原子的配位数与配体的齿数有关,
配体是单齿,那么中心原子的配位数就是配体的数目; 配体是多齿,那么中心原子的配位数则是配体的数目 与其齿数的乘积。 例如: [Co Br(NH3)5] (SO4),
1.62×107=(0.02-x)/4x3
x=6.8×10-4
二、配位解离平衡移动
1. 与弱电解质平衡的竞争
M+ + L+ + OHH+ [ML]
当Ka, Kb越小,配离子越易解离 平衡向生成弱酸、弱碱方向移动 MOH HL
[ Fe(C2O4 )3 ]3
Fe3 3C2O4 2
+ 6H+
→
3. 杂化轨道形式与配合物的空间构型
配 位 数 2 3
空间构型
直线形 平面三角形
杂化轨 道类型 sp sp2
实例
Ag(NH3)2+ , Ag(CN)2– Cu(CN)32 – ,HgI3–
4 4 5
5 6
正四面体 四方形 三角双锥
四方锥 八面体
chap8-1 配位化合物

5
(2) 配位体 配位体可以是简单阴离子,也可以是多原子离子 或中性分子 ,如F-、SCN-、NH3、乙二胺等。 与中心原子直接结合的原子,称为配位原子。作 为配位原子,它们大都是位于周期表右上方 IVA,VA,VIA,VIIA族电负性较强的非金属原子。 只有一个配位原子的配位体称为单齿配位体,如 NH3,CN- 等;含有两个或两个以上配位原子的配位 体称为多齿配位体,如乙二胺 (en , NH2-CH2-CH2NH2 ) (注意:多齿配位体的配位数等于配体数乘 以该配体的基数(齿数))。 由多齿配位体与同一个金属离子形成的具有环状 6 2+ 结构的配合物称为螯合物,如[Cu(en)2] 。
20
(1)外轨型配合物 中心离子以最外层的原子轨道( ns , np , nd ) 组成杂化轨道,和配位原子形成的配位键,称 为外轨配键,其对应的配合物称为外轨(型) 配合物。
21
外轨型配合物特点:
形成外轨型配合物时,中心离子的内层电 子排布没有发生变化,未成对的 d 电子尽可能 分占轨道而自旋平行,所以外轨型配合物也称 作高自旋型配合物。 它们常常具有顺磁性,未成对电子数越多、 磁矩越大。 由于中心离子以能量较高的最外层轨道杂 化成键,故外轨型配合物的稳定性较小(与内 轨型相比较)。
29
(3)判断外轨型、内轨型配合物:
中心离子的电子构型 中心离子所带的电荷
配位原子的电负性大小
30
中心离子的电子构型:
具有 d10 构型的离子只能用外层轨道形成外
轨型配合物;如 Ag+,Zn2+,Cd2+ 等只能形成外轨
型。 具有 d8 构型的离子,如:Ni2+,Pt2+,Pd2+等, 在大多数情况下形成内轨型配合物;
第八章 配位化合物

说明:最小的磁矩称为玻尔磁子,其值为9.27×10-24
A·m2
(3)测定 磁矩可通过磁天平测定。 • 顺磁性:被磁场吸引
• 反磁性:被磁场排斥
• 铁磁性:被磁场强烈吸引 (如 Fe , Co , Ni)
..
..
..
..
N
S
(a)无磁场
N
S
(b)磁场打开
顺磁性的说明
(4)影响因素 未成对电子数越多,磁矩越高,配合物
的磁性越大。
(5)意义
• 根据未成对电子数求磁矩; • 根据磁矩求未成对电子数; • 判断杂化方式、空间构型、配合物类型。
未成对电子数 0 1 2 3 4 5
µ计 / B.M
0 1.73 2.83 3.87 4.90 5.92
例: 测定FeF63-的µ为5.90 B.M,可判断: Fe3+有5个未成对电子;
Ag+
4d
[Ag(NH3)2]+
4d
5s
5p
NH3 NH3
5s
5p
sp杂化
2. 配位数为4的配合物的杂化方式及空间构型
(1)[NiCl4]2-:Ni 3d84s2
sp3杂化
Ni2+
Ni2+ 3d8 外轨型
四面体
3d
[NiCl4]2-
3d
4s
4p
Cl-
Cl- Cl- Cl-
4s
4p
sp3杂化
[NiCl4]2-
NH2-CH2-CH2-H2N
说明:
少数配体虽然有两个配位原子,由于两 个配位原子靠得太近,只能选择其中一 个与中心原子成键,故仍属单齿配体。
硝基NO(2 N是配位原子) 亚硝酸根ONO- (O是配位原子) 硫氰根SCN (S是配位原子) 异硫氰根NCS (N是配位原子)
A·m2
(3)测定 磁矩可通过磁天平测定。 • 顺磁性:被磁场吸引
• 反磁性:被磁场排斥
• 铁磁性:被磁场强烈吸引 (如 Fe , Co , Ni)
..
..
..
..
N
S
(a)无磁场
N
S
(b)磁场打开
顺磁性的说明
(4)影响因素 未成对电子数越多,磁矩越高,配合物
的磁性越大。
(5)意义
• 根据未成对电子数求磁矩; • 根据磁矩求未成对电子数; • 判断杂化方式、空间构型、配合物类型。
未成对电子数 0 1 2 3 4 5
µ计 / B.M
0 1.73 2.83 3.87 4.90 5.92
例: 测定FeF63-的µ为5.90 B.M,可判断: Fe3+有5个未成对电子;
Ag+
4d
[Ag(NH3)2]+
4d
5s
5p
NH3 NH3
5s
5p
sp杂化
2. 配位数为4的配合物的杂化方式及空间构型
(1)[NiCl4]2-:Ni 3d84s2
sp3杂化
Ni2+
Ni2+ 3d8 外轨型
四面体
3d
[NiCl4]2-
3d
4s
4p
Cl-
Cl- Cl- Cl-
4s
4p
sp3杂化
[NiCl4]2-
NH2-CH2-CH2-H2N
说明:
少数配体虽然有两个配位原子,由于两 个配位原子靠得太近,只能选择其中一 个与中心原子成键,故仍属单齿配体。
硝基NO(2 N是配位原子) 亚硝酸根ONO- (O是配位原子) 硫氰根SCN (S是配位原子) 异硫氰根NCS (N是配位原子)
8配位化合物

例如:
单齿配体 Cu(NH 3 ) 4 多齿配体 4 3 1 4 2 2 2 6 3 2 6 1 6 6
12
PtCl 3 (NH 3 ) CoCl 2 (en) 2 2 Al(C 2 O 4 ) 3 3 Ca(EDTA) 2
影响中心原子配位数的主要因素有:
Fe(CO) 5
硫酸四氨合铜(Ⅱ) 六异硫氰根合铁(Ⅲ)酸钾
六氯合铂(Ⅳ)酸
氢氧化四氨合铜(Ⅱ) 五氯•氨合铂(Ⅳ)酸钾
硝酸羟基•三水合锌(Ⅱ)
(三)氯化五氨•水合钴(Ⅲ) 五羰(基)合铁
三硝基•三氨合钴(Ⅲ)
乙二胺四乙酸根合钙(Ⅱ)
18
Question
命名下列配合物和配离子: (1)(NH4)3[SbCl6]; (2)[Co(en)3]Cl3
(一)晶体场理论的基本要点
二、配合物的晶体场理论
(1)在配位个体中,中心原子与配体靠静电作
用结合,这是配位个体稳定的主要因素。 (2)配体所形成的负电场对中心原子的电子, 特别是价电子层的 d 电子产生排斥作用,使中心 原子原来 5 个简并 d 轨道的能级发生分裂。 (3)由于 d 轨道的能级发生分裂,中心原子 价电子层的 d 电子重新分布,使配合物的能量降 低,在中心原子和配体之间产生附加成键效应。
1价金属离子 2价金属离子 3价金属离子
Cu+ 2,4 Ag+ 2 Au+ 2,4
Ca2+ 6 Mg2+ 6 Fe2+ 6 Co2+ 4,6 Cu2+ 4,6 Zn2+ 4,6
Al3+ Cr3+ Fe3+ Co3+ Au3+
4,6 6 6 6 4
单齿配体 Cu(NH 3 ) 4 多齿配体 4 3 1 4 2 2 2 6 3 2 6 1 6 6
12
PtCl 3 (NH 3 ) CoCl 2 (en) 2 2 Al(C 2 O 4 ) 3 3 Ca(EDTA) 2
影响中心原子配位数的主要因素有:
Fe(CO) 5
硫酸四氨合铜(Ⅱ) 六异硫氰根合铁(Ⅲ)酸钾
六氯合铂(Ⅳ)酸
氢氧化四氨合铜(Ⅱ) 五氯•氨合铂(Ⅳ)酸钾
硝酸羟基•三水合锌(Ⅱ)
(三)氯化五氨•水合钴(Ⅲ) 五羰(基)合铁
三硝基•三氨合钴(Ⅲ)
乙二胺四乙酸根合钙(Ⅱ)
18
Question
命名下列配合物和配离子: (1)(NH4)3[SbCl6]; (2)[Co(en)3]Cl3
(一)晶体场理论的基本要点
二、配合物的晶体场理论
(1)在配位个体中,中心原子与配体靠静电作
用结合,这是配位个体稳定的主要因素。 (2)配体所形成的负电场对中心原子的电子, 特别是价电子层的 d 电子产生排斥作用,使中心 原子原来 5 个简并 d 轨道的能级发生分裂。 (3)由于 d 轨道的能级发生分裂,中心原子 价电子层的 d 电子重新分布,使配合物的能量降 低,在中心原子和配体之间产生附加成键效应。
1价金属离子 2价金属离子 3价金属离子
Cu+ 2,4 Ag+ 2 Au+ 2,4
Ca2+ 6 Mg2+ 6 Fe2+ 6 Co2+ 4,6 Cu2+ 4,6 Zn2+ 4,6
Al3+ Cr3+ Fe3+ Co3+ Au3+
4,6 6 6 6 4
第八章_配位化合物

0.10 21 1.0 10 2 y (0.10)
y 1.0 10
20
即Ag+的平衡浓度为1.0×10-20 mol/L。
2、判断配位反应进行的方向
[Ag(NH3)2] ++ 2CN反应向哪个方向进行?
2 [ Ag ( CN ) ][ NH ] 2 3 K [ Ag ( NH 3 ) 2 ][CN ]2
[Cu( NH 3 ) ] 1 2 [Cu ][NH 3 ]
2
2
[Cu( NH 3 ) 2 ] [Cu 2 ][NH 3 ]2
2
3
[Cu( NH 3 ) 3 ] [Cu 2 ][NH 3 ]3
2
2
4
[Cu( NH 3 )4 ] K稳 2 4 [Cu ][ NH 3 ]
[Zn(NH3)4]2+ [Zn(CN)4]2+ 5×108 1.0×1016
中心离子不同,配体相同,配位数相同。
[Zn(NH3)4]2+ [Cu(NH3)4]2+ 5×108 4.8×1012
不同类型配合物稳定性要通过计算 求出溶液中的离子浓度。
CuY2[Cu(en)2]2+ 6.3×1018 4.9×1019
配位离子 [Cu(NH3)4]2+ 配位单元 配合物 配位分子 Fe(SCN)3 配离子与带有异电荷的离子 组成的中性化合物。 [Cu(NH3)4]SO4
Hale Waihona Puke 1.2 配合物的组成中心离子和配位体之 间以配位键结合。
NH3 H3N Cu NH3 NH3
2+ 2 SO4 2
配合物的组成分为内 界和外界两部分。
第八章配位化合物ppt课件
● 配离子与形成体的电荷数
()
3
Ag(S 2O3 ) 2 ,
(2)
Pt Cl 3 (NH 3 )
(3)
K 3 Fe (CN) 6
赤血盐 ,
(2)
K 4 Fe (CN) 6
(3)
(0)
Co Cl 3 (NH 3 )3 , Fe(CO) 5
黄血盐
12
13
←
← ←
← ← ←
(1) 内界与外界
32
8.4.1 价键理论 (valence bond theory)
同一原子内,轨道的杂化和不同原子间轨道的重叠构成了共价键 理论的核心论点之一.这里把第二章的s-p杂化轨道扩大到d轨道上 ,形成s-p-d杂化轨道.
(1) 价键理论的要点
● 形成体(M)有空轨道,配位体(L)有孤对电子,形成配位键
Ag(NH 3 )2 Cl
中配 外 心位 界 离体 子
Ni(CO) 4 CoCl3 (NH3 )3
中配 心位 原体 子
中 心配 离位 子体
配离子
形成体 — 中心离子或原子(central ion or central atom)
(配分子) 配位体 — 中性分子或阴离子
形成体 — 提供空轨道 电子对接受体 Lewis酸 配位体 — 提供孤对电子 电子对给予体 Lewis碱
8
(三)配位数
配合物中,直接与中心离子(或原子)配 位的配位原子的数目称中心离子(或原子)的 配位数。
一般中心离子(或原子)配位数为2、4、 6。中心离子的配位数的多少,主要取决于中 心离子和配体的电荷、体积和电子层结构,以 及配合物形成时温度和反应物的浓度等。
配离子的电荷数等于中心离子和配位体电 荷的代数和。
第八章 配位化合物1
[Cu(NH3)4]SO4
8.2 配合物的类型和命名
8.2.1配合物的类型 配合物的类型
1. 按中心离子分:单核配合物和多核配合物。 按中心离子分:单核配合物和多核配合物。
H2N H2N Pt Cl Cl
第 八 章 配 位 化 合 物
H2N H2N
Pt
Cl Cl
Pt
NH2 NH2
2. 按配体种类
水合 卤合 氨合 氰合 [Cu(H2O)6]2+ [AlF63-] [Co(NH3)6]3+ [Fe(CN)6]4-
OH [(H2O)4Fe OH [Fe(H2O)4](SO4)2
配 位 化 合 物
(2)簇类配合物(簇合物) )簇类配合物(簇合物)
含有2个或 个 以上金属原子,并含有金属 金属——金属键 。 含有 个或 2个 以上金属原子,并含有金属 金属键 也称原子簇化合物如Fe 也称原子簇化合物如 2(CO )9等。 生成簇合物的金属原子的金属原子主要是过渡金属。 生成簇合物的金属原子的金属原子主要是过渡金属。 过渡金属
第 八 章 配 位 化 合 物
配位原子:在配位体中直接和中心原子连接的原子。 配位原子:在配位体中直接和中心原子连接的原子。 配位数:一个中心原子所结合的配位原子的总数。 配位数:一个中心原子所结合的配位原子的总数。
配位体:含有孤对电子 孤对电子的离子或分子 (一)配位体:含有孤对电子的离子或分子 如:NH3、H2O、Cl-、Br- 、I- 、CN-、CNS、 配体分类: 配体分类: 单齿): 一个配位原子 (1)单基配体 (单齿 :配体只含有一个配位原子。 ) 单齿 配体只含有一个配位原子。
一般为2、 、 、 (少见) 一般为 、4、6、8(少见) 对于单基(单齿 单齿)配体的配合物 对于单基 单齿 配体的配合物 配位数=配体的数目 配体的数目; 配位数 配体的数目; 对于多基(多齿 配体的配合物: 对于多基 多齿)配体的配合物: 多齿 配体的配合物 配位数=配体的数目 齿数。 配体的数目× 配位数 配体的数目×齿数。 配位数的影响因数: 配位数的影响因数:中心离子的配位数主要决定于 中心原子和配体的性质 的性质, 如它们的半径 电荷的高 半径、 中心原子和配体的性质,(如它们的半径、电荷的高 中心离子的核外电子排布 核外电子排布) 以及形成配合物的 低、中心离子的核外电子排布),以及形成配合物的 条件(如浓度、温度等) 条件(如浓度、温度等)。
第八章 配位化合物
2 3 2 0 K f,1 104.31 0 K f,2 103.67
NH3 Cu(NH )
2 3 3
K f,3 10
0
3.04
2 Cu ( NH3 ) 3 NH3 Cu(NH3 ) 2 4 K 0 K0 K0 K0f,3 K0f,4 1013.32 f f,1 f,2
外界: 普通阴、阳离子(Cl-,K+,SO42-等),有的配合物无外界
例如:[Ag(NH3)2]Cl
、 K[PtCl5(NH3)]、
[Ni(CO)4](无外界)
几个基本概念:
1、配合物:内界+外界(有的 无外界)
2、配离子: [Ag(NH3)2]+ 、[PtCl5(NH3)]配分子: [Ni(CO)4 ]
1
Ag(NH3 ) 2 0 0.010 0.010 x
0.030 0.030 0.020 0.010 2 x
0 x
1
0.010 x K f 1.67 107 x (0.010 2 x ) 2 0.010 x 0.010 0.010 2 x 0.010 0.010 1.67 107 x 6.0 106 x 0.0102 c ( Ag ) 6.0 106 mol L1 c ( NH3 ) c (Ag(NH3 ) 0.010mol L1 2
Cu(en)2
H 2C H 2C
2
的结构:
H2
H2
N Cu N
H2
N N
CH 2 CH 2
2+
H2
8、配离子与形成体的电荷数
Ag(S2 O3 ) 2
() ( 2 ) 3
NH3 Cu(NH )
2 3 3
K f,3 10
0
3.04
2 Cu ( NH3 ) 3 NH3 Cu(NH3 ) 2 4 K 0 K0 K0 K0f,3 K0f,4 1013.32 f f,1 f,2
外界: 普通阴、阳离子(Cl-,K+,SO42-等),有的配合物无外界
例如:[Ag(NH3)2]Cl
、 K[PtCl5(NH3)]、
[Ni(CO)4](无外界)
几个基本概念:
1、配合物:内界+外界(有的 无外界)
2、配离子: [Ag(NH3)2]+ 、[PtCl5(NH3)]配分子: [Ni(CO)4 ]
1
Ag(NH3 ) 2 0 0.010 0.010 x
0.030 0.030 0.020 0.010 2 x
0 x
1
0.010 x K f 1.67 107 x (0.010 2 x ) 2 0.010 x 0.010 0.010 2 x 0.010 0.010 1.67 107 x 6.0 106 x 0.0102 c ( Ag ) 6.0 106 mol L1 c ( NH3 ) c (Ag(NH3 ) 0.010mol L1 2
Cu(en)2
H 2C H 2C
2
的结构:
H2
H2
N Cu N
H2
N N
CH 2 CH 2
2+
H2
8、配离子与形成体的电荷数
Ag(S2 O3 ) 2
() ( 2 ) 3
第八章_配位化合物
NH3 H3N H3N Co NH3 NH3 NH3
中心离子最高配位数: 第一周期 2 , 第二周期 4 第三,四周期 6 ,第五周期 8 影响配位数的因素: 中心离子 半径 电荷 半径 电荷 配位数 配位数
(AlF63-, BF4-)
配位原子 半径 电荷 半径 电荷 配位数 配位数
(AlF63-, AlCl4-)
配位数: 与中心原子成键的配位原子总数.
配位数 配位原子
[Fe(CO)5]若配位单元为中性分子,只有内界,没有外界
1、中心离子(或原子)
一般为带正电的过渡金属离子
[Co(NH3)6]3+, [Fe(CN)6]4-, [HgI4]2 电中性原子:Ni(CO)4 , Fe(CO)5 , Cr(CO)6 非金属元素原子:SiF62- , PF6-
二者形成配位键ML. (2)中心原子采用杂化轨道成键. (3)中心原子杂化方式与配合物空间构型有关.
配位键形成条件: 成键原子一方有孤对电子; 另一方有空轨道.
配位键的形成: 配位键是由中心原子空的杂化轨道与配 位原子充满孤对电子的原子轨道相互重叠而 形成的。
二、σ配键和π配键
1、σ配键
[Co(NH3)6]3+ Co3+: 3s23p6 3d6
8.4 配合物的化学键本性
目前有三种理论讨论配合物中的化学键。 这
里介绍价键理论(实际上只是把杂化轨道扩大到 d
轨道)、晶体场理论和分子轨道理论。在此介绍价
键理论。
8.4 配位化合物的化学键本性
一、配合物价键理论要点 (1)中心原子(M):价电子层有空轨道,是电子对接
受体;
配体(L):提供孤对电子,是电子对给予体;
8.3 配合物的异构现象
配位化合物配位化合物组成命名配合物的空间构型配位平衡
这样我们可以得到配位反应的方向和配合物的 稳定性: 硬+硬、软+软
所生成的配离子稳定性高。
交界酸碱不论对象如何都可生成配离子。酸: Fe2+ 、 Co2+ 、 Ni2+ 、 Cu2+ 、 Zn2+ 、 Pb2+ 、 Sn2+ 、 Sb3+、Cr3+、Bi3+等。
碱 : C6H5NH2 、 C2H5N 、 N3- 、 Br- 、 NO2- 、 SO32-、N2等。
6个配位原子都能
以孤对电子和中
心原子形成配位,
Cu2+、Zn2+、Cd2+、
Hg2+和EDTA则形
成四、六配位的 螯合离子结构如 下:
EDTA合钙
二乙二胺合铂(Ⅱ)
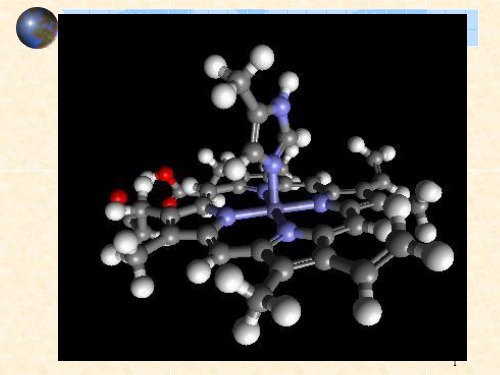
叶绿素
五、配合物空间结构与异构现象*
1.配合单元的空间结构:
配合物的几何构型与中心离子的配位数 有一定关系,一定的配位数有其物定的
配合物中,以空轨道接受配体孤对电子或π键 电子形成配位键的原子或离子称为中心原子 或中心离子。
2、配位体L
在配合物中,与中心离子或原子以配位键 结合的离子或分子称为配位体简称配体
(ligand)。例如[Cu(NH3)4]2+中的NH3分
子。
它们与中心原子结合构成为配合物的内界。
3、配位数
配位原子的电负性 → 大,与中心原子间的配位能
正离子名称在后。
命名内界时,配体名称列在中心原于之前,
不同配体之间以中圆点(· )分开。
相同配体的个数用数字二、三、四等表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Pt H2O Pt
草酸
3
Cቤተ መጻሕፍቲ ባይዱ
二氨二氯合铂的可能构型 两种不同的二氨二氯合铂异构体的不同的化学性质
4-2-3 对映异构 M(AABBCC)的异构体 的异构体
4-1-1 配合物的定义 1. 配合物的定义 由一定数量的可以供出孤对电子或π电子的离子或 由一定数量的可以供出孤对电子或 电子的离子或 分子(统称配体)与接受孤对电子或 统称配体 与接受孤对电子或π电子的原子或离子 分子 统称配体 与接受孤对电子或 电子的原子或离子 (统称中心原子或离子 以配位键结合形成的化合物。 统称中心原子或离子 结合形成的化合物。 统称中心原子或离子)以配位键结合形成的化合物 2. 配合物的组成 配合物的组成: (1) 内界和外界 内界和外界: 配合物一般有内界和外界组成, 配合物一般有内界和外界组成 [Cu(NH3)4] SO4
内界 外界
具有一定稳定性的结构单元称为配合物的内界, 具有一定稳定性的结构单元称为配合物的内界 用 中括号表示出来, 其余部分为外界. 中括号表示出来 其余部分为外界 K3[Fe(CN)6]
外界 内界
配合物的内界和外界以离子键结合 配合物的内界和外界以离子键结合. 如果配合物的 界和外界以离子键结合 内界是中性分子 无外界, 如[PtCl2(NH3)2], Ni(CO)4]. 内界是中性分子, 无外界 中性分子 (2) 中心原子 中心离子)或形成体 中心原子(中心离子 或形成体 中心离子 中心原子是配合物的核心部分. 中心原子是配合物的核心部分 [Cu(NH3)4]2+: Cu2+ [PtCl2(NH3)2]: Pt2+ Ni(CO)4]: Ni [S9]2-: S2中心原子不一定是阳离子, 可以是中性原子, 中心原子不一定是阳离子 可以是中性原子 也可是 阴离子. 阴离子 (3) 配体和配位原子 在配体中, 在配体中,直接与中心离子或原子相结合的原子称 为配位原子, 为配位原子,如NH3中N,CN-中C。 , 。
4-1 配合物基本概念
硫酸铜水溶液天蓝色: [Cu(H2O)4]2+; 向硫酸铜溶液 硫酸铜水溶液天蓝色 滴加过量氨水,形成深蓝色的透明溶液: 滴加过量氨水,形成深蓝色的透明溶液 [Cu(NH3)4]2+;向 向 其中滴加过量浓盐酸,得到黄色透明溶液: [CuCl4]2-。 其中滴加过量浓盐酸,得到黄色透明溶液 这样的由金 像[Cu(H2O)4]2+、[Cu(NH3)4]2+、[CuCl4]2-这样的由金 属原子与中性分子或者阴离子结合形成的复杂离子叫做 配离子(络离子 其中的金属原子是配离子形成体 络离子), 形成体或 配离子 络离子 ,其中的金属原子是配离子形成体或中 心原子,其中的H2O、NH3、Cl-等叫做配体。 心原子,其中的 、 等叫做配体。 配体 中心离子与配体之间的化学作用力叫做配位键, 中心离子与配体之间的化学作用力叫做配位键,一 般是中心原子接受配体中的某原子的孤对电子形成的。 般是中心原子接受配体中的某原子的孤对电子形成的。 中心原子周围的配位原子的个数叫做配位数 配位原子的个数叫做配位数。 中心原子周围的配位原子的个数叫做配位数。
4-2-2 几何异构 几何异构是立体异构之一, 几何异构是立体异构之一 是配体在中心原子周 围因排列方式不同而产生的异构现象 而产生的异构现象。 围因排列方式不同而产生的异构现象。 顺式 顺式 顺式 见教材MA4B2型(图4-5): 反式和顺式 cis见教材 图 cis- 反式和顺式. cisMA3B3型(图4-6):N 面式和经式. Cl NH3 图 H3 面式和经式 O OH HN O
第4章 配位化合物
基 本 概 念 配 合 物 的 命 名 杂 化 理 论 晶 体 场 理 论 配 合 物 的 立 体 异 构 作 业
基本要求
1. 掌握配位化合物的组成及有关的概念。 掌握配位化合物的组成及有关的概念。 2. 掌握配位化合物价键理论的主要论点,并能用此 掌握配位化合物价键理论的主要论点, 解释一些实例。 解释一些实例。 3. 理解晶体场理论,并能解释双峰图、配合物的稳 理解晶体场理论,并能解释双峰图、 定性及配离子的颜色。 定性及配离子的颜色。
4. 如果外界是氢氧根离子,称氢氧化某。 如果外界是氢氧根离子 称氢氧化某。 氢氧根离子, [Cu(NH3)4](OH)2: 氢氧化四胺合铜 氢氧化四胺合铜(II) 5. 处于配合物内界的配离子,其命名方法一般地依照如 处于配合物内界的配离子, 下顺序:配位体数、配位体的名称(不同配位体名称之间 下顺序:配位体数、配位体的名称 不同配位体名称之间 以中圆点(·)分开 分开), 中心离子名称, 以中圆点 分开 ,“合”,中心离子名称,中心离子氧 化态(加括号 用罗马数字注明)。 加括号:用罗马数字注明 化态 加括号 用罗马数字注明 。 Cu2[SiF6]: 六氟合硅 六氟合硅(IV)酸亚铜 酸亚铜 K3[Fe(CN)6]: 六氰合铁 六氰合铁(III)酸钾 酸钾 若配离子中的配位体不止一种, 若配离子中的配位体不止一种,在命名时配体列出的 顺序按如下规定: 顺序按如下规定: 6. 配位体中既有无机配体又有有机配体,无机配体排列 配位体中既有无机配体又有有机配体, 在前, 有机配体排列在后。 在前 有机配体排列在后。 二氯·二 三苯基膦 合铂(II) 三苯基膦)合铂 cis-PtCl2(Ph3P)2]: 顺-二氯 二(三苯基膦 合铂 二氯 -
(4) 配位数 配合物中心原子周围的配位原子的个数, 配合物中心原子周围的配位原子的个数 称为配位 数. 配位数不一定等于配体的数目, 只有是单齿配体时 配位数不一定等于配体的数目 才相等. 才相等 [Fe(CN)6]3-: Fe3+配位数为 配位数为6. [Cu(en)2]2+: Cu2+配位数为4. 配位数为4. (5) 多核化合物 含有多个中心原子的配合物称为多核配合物(图4含有多个中心原子的配合物称为多核配合物 图 4). (6) π-配合物 配合物 配体中没有孤电子对,而是提供π 配体中没有孤电子对,而是提供π电子与中心原 子形成π配键 配键. 年发现的蔡斯盐K[Pt(C2H4)Cl3] 子形成 配键 如1825年发现的蔡斯盐 年发现的蔡斯盐 [图4-15]. 图
K2[PtCl4]加氨水得棕黄色配合物, 组成为[PtCl2(NH3)2], 有 Pt 加氨水得棕黄色 棕黄色配合物 Cl NH3 Cl C H3N OH H3N O O 极性, 水中溶解度0.26g/100g. Cl NH3 Cl NH3 反式 反式 Pt 将其用氯化氢处理或热至250℃, 转变为浅黄色, 组成仍为 Pt 转变为浅黄色 Pt trans-) ], NH3 transCl [PtCl2(NH3 2 但极性消失, 水中溶解度减至0.037g/100g.Cl ? Cl NH3 NH3 H3N Cl NH3 草酸 HO NH3 H2O 四配位配合物的几何构型不是四面体而是平面四边形;如 四配位配合物的几何构型不是四面体而是平面四边形; Pt 反式 四面体构型 Pt 顺式 H3N Cl 果是四面体, [PtCl2(NH33N2]不可能出现异构现象, 而平面四边形 H ) trans不可能有立体异构体 OHcis不能反应 则可以有两种异构体 的[PtCl2(NH3)2]则可以有两种异构体(图4-8).
4-2 配合物的异构现象与立体结构
化学式相同而结构不同的化合物称为同分异构体。 化学式相同而结构不同的化合物称为同分异构体。 同分异构体 4-2-1 结构异构 1. 结构异构:组成相同而结构不同的异构现象 结构异构:组成相同而结构不同的异构现象. 紫色), CrCl3·6H2O: [Cr(H2O)6]Cl3(紫色 紫色 [CrCl(H2O)5]Cl2·H2O(灰绿色 灰绿色), 灰绿色 [CrCl2(H2O)4]Cl·2H2O(深绿色 深绿色) 深绿色 键合异构: 2. 键合异构 由于同一种配体以两种不同配位原子 配位引起的异构. 配位引起的异构 都可作为配位原子: 硫氰根), 如: SCN-中S和N都可作为配位原子 SCN-(硫氰根 和 都可作为配位原子 硫氰根 异硫氰根); 硝基), 亚硝酸根). NCS-(异硫氰根 NO2-(硝基 ONO-(亚硝酸根 异硫氰根 硝基 亚硝酸根
H[PtCl3(NH3)]: 三氯 一胺合铂 酸 三氯·一胺合铂 一胺合铂(II)酸 7. 有多种无机配体和有机配体时,先列出阴离子的名 有多种无机配体和有机配体时, 称后列出中性分子的名称。 称后列出中性分子的名称。 [Pt(en)Cl2]: 二氯 一(乙二胺 合铂 二氯·一 乙二胺 合铂(II) 乙二胺)合铂 8. 同类配体 按配位原子元素符号的英文字母顺序列出 同类配体, 配位原子元素符号的英文字母顺序列出 列出. [Co(NH3)5(H2O)]Cl3: 三氯化五胺 一水合钴 三氯化五胺·一水合钴 一水合钴(III) 9. 同类配体, 配位原子也相同时, 将含原子个数少的配 同类配体, 配位原子也相同时, 将含原子个数少的配 体排在前面, 较多的排在后面. 体排在前面 较多的排在后面 [PtNO2NH3(NH2OH)(py)]Cl: 一氯化硝基 胺·羟胺 吡啶 一氯化硝基·胺 羟胺 羟胺·吡啶 合铂(II) 合铂 10. 如果配位原子相同 配体含的原子个数也相同 按配 如果配位原子相同, 配体含的原子个数也相同, 体结构式中与配位原子相连的原子的元素符号的字母 顺序列出. 顺序列出 氨基·硝基 二胺合铂(II) 硝基·二胺合铂 [PtNH2NO2(NH3)2]: 氨基 硝基 二胺合铂
按配位原子种类分为: 按配位原子种类分为: a. 含N配位:NH3, NO(亚硝酰 NO2(硝基 NCS-(异硫 配位: 亚硝酰), 硝基), 亚硝酰 硝基 异硫 配位 氰根). 氰根 b. 含O配体 H2O, OH-(羟基 CO32-, ONO-(亚硝酸根 配体: 羟基), 亚硝酸根). 配体 羟基 亚硝酸根 c. 含C配体 CN-(氰), CO(羰基 配体: 羰基). 配体 氰 羰基 d. 含S配体 S2-, SCN-(硫氰根 SH-(巯). 配体: 硫氰根), 配体 硫氰根 巯 e. 含P配体 PH3, PR3(膦). 配体: 配体 膦 f. 卤素配体 F-, Cl-. 卤素配体: 按配体所含配位原子的数目分为: 按配体所含配位原子的数目分为 单齿配体: 配体中只有一个配位原子, 单齿配体 配体中只有一个配位原子 F-, OH-, NH3. 多齿配体(双齿 三齿、四齿等等): 双齿、 多齿配体 双齿、三齿、四齿等等 配体中有多个配位 原子, 乙二胺四乙酸) 原子 en, EDTA(乙二胺四乙酸 (图4-1,4-2). 乙二胺四乙酸 图 多齿配体形成的配合物又被形象地叫做螯合物。 多齿配体形成的配合物又被形象地叫做螯合物。 螯合物
草酸
3
Cቤተ መጻሕፍቲ ባይዱ
二氨二氯合铂的可能构型 两种不同的二氨二氯合铂异构体的不同的化学性质
4-2-3 对映异构 M(AABBCC)的异构体 的异构体
4-1-1 配合物的定义 1. 配合物的定义 由一定数量的可以供出孤对电子或π电子的离子或 由一定数量的可以供出孤对电子或 电子的离子或 分子(统称配体)与接受孤对电子或 统称配体 与接受孤对电子或π电子的原子或离子 分子 统称配体 与接受孤对电子或 电子的原子或离子 (统称中心原子或离子 以配位键结合形成的化合物。 统称中心原子或离子 结合形成的化合物。 统称中心原子或离子)以配位键结合形成的化合物 2. 配合物的组成 配合物的组成: (1) 内界和外界 内界和外界: 配合物一般有内界和外界组成, 配合物一般有内界和外界组成 [Cu(NH3)4] SO4
内界 外界
具有一定稳定性的结构单元称为配合物的内界, 具有一定稳定性的结构单元称为配合物的内界 用 中括号表示出来, 其余部分为外界. 中括号表示出来 其余部分为外界 K3[Fe(CN)6]
外界 内界
配合物的内界和外界以离子键结合 配合物的内界和外界以离子键结合. 如果配合物的 界和外界以离子键结合 内界是中性分子 无外界, 如[PtCl2(NH3)2], Ni(CO)4]. 内界是中性分子, 无外界 中性分子 (2) 中心原子 中心离子)或形成体 中心原子(中心离子 或形成体 中心离子 中心原子是配合物的核心部分. 中心原子是配合物的核心部分 [Cu(NH3)4]2+: Cu2+ [PtCl2(NH3)2]: Pt2+ Ni(CO)4]: Ni [S9]2-: S2中心原子不一定是阳离子, 可以是中性原子, 中心原子不一定是阳离子 可以是中性原子 也可是 阴离子. 阴离子 (3) 配体和配位原子 在配体中, 在配体中,直接与中心离子或原子相结合的原子称 为配位原子, 为配位原子,如NH3中N,CN-中C。 , 。
4-1 配合物基本概念
硫酸铜水溶液天蓝色: [Cu(H2O)4]2+; 向硫酸铜溶液 硫酸铜水溶液天蓝色 滴加过量氨水,形成深蓝色的透明溶液: 滴加过量氨水,形成深蓝色的透明溶液 [Cu(NH3)4]2+;向 向 其中滴加过量浓盐酸,得到黄色透明溶液: [CuCl4]2-。 其中滴加过量浓盐酸,得到黄色透明溶液 这样的由金 像[Cu(H2O)4]2+、[Cu(NH3)4]2+、[CuCl4]2-这样的由金 属原子与中性分子或者阴离子结合形成的复杂离子叫做 配离子(络离子 其中的金属原子是配离子形成体 络离子), 形成体或 配离子 络离子 ,其中的金属原子是配离子形成体或中 心原子,其中的H2O、NH3、Cl-等叫做配体。 心原子,其中的 、 等叫做配体。 配体 中心离子与配体之间的化学作用力叫做配位键, 中心离子与配体之间的化学作用力叫做配位键,一 般是中心原子接受配体中的某原子的孤对电子形成的。 般是中心原子接受配体中的某原子的孤对电子形成的。 中心原子周围的配位原子的个数叫做配位数 配位原子的个数叫做配位数。 中心原子周围的配位原子的个数叫做配位数。
4-2-2 几何异构 几何异构是立体异构之一, 几何异构是立体异构之一 是配体在中心原子周 围因排列方式不同而产生的异构现象 而产生的异构现象。 围因排列方式不同而产生的异构现象。 顺式 顺式 顺式 见教材MA4B2型(图4-5): 反式和顺式 cis见教材 图 cis- 反式和顺式. cisMA3B3型(图4-6):N 面式和经式. Cl NH3 图 H3 面式和经式 O OH HN O
第4章 配位化合物
基 本 概 念 配 合 物 的 命 名 杂 化 理 论 晶 体 场 理 论 配 合 物 的 立 体 异 构 作 业
基本要求
1. 掌握配位化合物的组成及有关的概念。 掌握配位化合物的组成及有关的概念。 2. 掌握配位化合物价键理论的主要论点,并能用此 掌握配位化合物价键理论的主要论点, 解释一些实例。 解释一些实例。 3. 理解晶体场理论,并能解释双峰图、配合物的稳 理解晶体场理论,并能解释双峰图、 定性及配离子的颜色。 定性及配离子的颜色。
4. 如果外界是氢氧根离子,称氢氧化某。 如果外界是氢氧根离子 称氢氧化某。 氢氧根离子, [Cu(NH3)4](OH)2: 氢氧化四胺合铜 氢氧化四胺合铜(II) 5. 处于配合物内界的配离子,其命名方法一般地依照如 处于配合物内界的配离子, 下顺序:配位体数、配位体的名称(不同配位体名称之间 下顺序:配位体数、配位体的名称 不同配位体名称之间 以中圆点(·)分开 分开), 中心离子名称, 以中圆点 分开 ,“合”,中心离子名称,中心离子氧 化态(加括号 用罗马数字注明)。 加括号:用罗马数字注明 化态 加括号 用罗马数字注明 。 Cu2[SiF6]: 六氟合硅 六氟合硅(IV)酸亚铜 酸亚铜 K3[Fe(CN)6]: 六氰合铁 六氰合铁(III)酸钾 酸钾 若配离子中的配位体不止一种, 若配离子中的配位体不止一种,在命名时配体列出的 顺序按如下规定: 顺序按如下规定: 6. 配位体中既有无机配体又有有机配体,无机配体排列 配位体中既有无机配体又有有机配体, 在前, 有机配体排列在后。 在前 有机配体排列在后。 二氯·二 三苯基膦 合铂(II) 三苯基膦)合铂 cis-PtCl2(Ph3P)2]: 顺-二氯 二(三苯基膦 合铂 二氯 -
(4) 配位数 配合物中心原子周围的配位原子的个数, 配合物中心原子周围的配位原子的个数 称为配位 数. 配位数不一定等于配体的数目, 只有是单齿配体时 配位数不一定等于配体的数目 才相等. 才相等 [Fe(CN)6]3-: Fe3+配位数为 配位数为6. [Cu(en)2]2+: Cu2+配位数为4. 配位数为4. (5) 多核化合物 含有多个中心原子的配合物称为多核配合物(图4含有多个中心原子的配合物称为多核配合物 图 4). (6) π-配合物 配合物 配体中没有孤电子对,而是提供π 配体中没有孤电子对,而是提供π电子与中心原 子形成π配键 配键. 年发现的蔡斯盐K[Pt(C2H4)Cl3] 子形成 配键 如1825年发现的蔡斯盐 年发现的蔡斯盐 [图4-15]. 图
K2[PtCl4]加氨水得棕黄色配合物, 组成为[PtCl2(NH3)2], 有 Pt 加氨水得棕黄色 棕黄色配合物 Cl NH3 Cl C H3N OH H3N O O 极性, 水中溶解度0.26g/100g. Cl NH3 Cl NH3 反式 反式 Pt 将其用氯化氢处理或热至250℃, 转变为浅黄色, 组成仍为 Pt 转变为浅黄色 Pt trans-) ], NH3 transCl [PtCl2(NH3 2 但极性消失, 水中溶解度减至0.037g/100g.Cl ? Cl NH3 NH3 H3N Cl NH3 草酸 HO NH3 H2O 四配位配合物的几何构型不是四面体而是平面四边形;如 四配位配合物的几何构型不是四面体而是平面四边形; Pt 反式 四面体构型 Pt 顺式 H3N Cl 果是四面体, [PtCl2(NH33N2]不可能出现异构现象, 而平面四边形 H ) trans不可能有立体异构体 OHcis不能反应 则可以有两种异构体 的[PtCl2(NH3)2]则可以有两种异构体(图4-8).
4-2 配合物的异构现象与立体结构
化学式相同而结构不同的化合物称为同分异构体。 化学式相同而结构不同的化合物称为同分异构体。 同分异构体 4-2-1 结构异构 1. 结构异构:组成相同而结构不同的异构现象 结构异构:组成相同而结构不同的异构现象. 紫色), CrCl3·6H2O: [Cr(H2O)6]Cl3(紫色 紫色 [CrCl(H2O)5]Cl2·H2O(灰绿色 灰绿色), 灰绿色 [CrCl2(H2O)4]Cl·2H2O(深绿色 深绿色) 深绿色 键合异构: 2. 键合异构 由于同一种配体以两种不同配位原子 配位引起的异构. 配位引起的异构 都可作为配位原子: 硫氰根), 如: SCN-中S和N都可作为配位原子 SCN-(硫氰根 和 都可作为配位原子 硫氰根 异硫氰根); 硝基), 亚硝酸根). NCS-(异硫氰根 NO2-(硝基 ONO-(亚硝酸根 异硫氰根 硝基 亚硝酸根
H[PtCl3(NH3)]: 三氯 一胺合铂 酸 三氯·一胺合铂 一胺合铂(II)酸 7. 有多种无机配体和有机配体时,先列出阴离子的名 有多种无机配体和有机配体时, 称后列出中性分子的名称。 称后列出中性分子的名称。 [Pt(en)Cl2]: 二氯 一(乙二胺 合铂 二氯·一 乙二胺 合铂(II) 乙二胺)合铂 8. 同类配体 按配位原子元素符号的英文字母顺序列出 同类配体, 配位原子元素符号的英文字母顺序列出 列出. [Co(NH3)5(H2O)]Cl3: 三氯化五胺 一水合钴 三氯化五胺·一水合钴 一水合钴(III) 9. 同类配体, 配位原子也相同时, 将含原子个数少的配 同类配体, 配位原子也相同时, 将含原子个数少的配 体排在前面, 较多的排在后面. 体排在前面 较多的排在后面 [PtNO2NH3(NH2OH)(py)]Cl: 一氯化硝基 胺·羟胺 吡啶 一氯化硝基·胺 羟胺 羟胺·吡啶 合铂(II) 合铂 10. 如果配位原子相同 配体含的原子个数也相同 按配 如果配位原子相同, 配体含的原子个数也相同, 体结构式中与配位原子相连的原子的元素符号的字母 顺序列出. 顺序列出 氨基·硝基 二胺合铂(II) 硝基·二胺合铂 [PtNH2NO2(NH3)2]: 氨基 硝基 二胺合铂
按配位原子种类分为: 按配位原子种类分为: a. 含N配位:NH3, NO(亚硝酰 NO2(硝基 NCS-(异硫 配位: 亚硝酰), 硝基), 亚硝酰 硝基 异硫 配位 氰根). 氰根 b. 含O配体 H2O, OH-(羟基 CO32-, ONO-(亚硝酸根 配体: 羟基), 亚硝酸根). 配体 羟基 亚硝酸根 c. 含C配体 CN-(氰), CO(羰基 配体: 羰基). 配体 氰 羰基 d. 含S配体 S2-, SCN-(硫氰根 SH-(巯). 配体: 硫氰根), 配体 硫氰根 巯 e. 含P配体 PH3, PR3(膦). 配体: 配体 膦 f. 卤素配体 F-, Cl-. 卤素配体: 按配体所含配位原子的数目分为: 按配体所含配位原子的数目分为 单齿配体: 配体中只有一个配位原子, 单齿配体 配体中只有一个配位原子 F-, OH-, NH3. 多齿配体(双齿 三齿、四齿等等): 双齿、 多齿配体 双齿、三齿、四齿等等 配体中有多个配位 原子, 乙二胺四乙酸) 原子 en, EDTA(乙二胺四乙酸 (图4-1,4-2). 乙二胺四乙酸 图 多齿配体形成的配合物又被形象地叫做螯合物。 多齿配体形成的配合物又被形象地叫做螯合物。 螯合物
