第八章配位化合物解析
配位化合物
8.2 配合物的空间结构和异构现象
1、配合物的空间结构 空间构型
配位数 2 杂化轨道 sp 空间构型 直线型 实例 [Ag(NH3)2]+
3
4
sp2
sp3
平面三角形
平面正方形
[HgI3][Ni(CN)4]-、[PdCl4]2-
四面体
5 dsp3或d3sp d2sp2 6 d2sp3或sp3d2 三角双锥 正方锥形 正八面体
配位数(不一定是配体数)
与中心原子直接以配位键结合的配位原子的数目 称为中心原子的配位数。中心原子的配位数一般可为 2-12,以配位数2,4,6最为常见。 中必原子的配位数与配体的齿数有关,
配体是单齿,那么中心原子的配位数就是配体的数目; 配体是多齿,那么中心原子的配位数则是配体的数目 与其齿数的乘积。 例如: [Co Br(NH3)5] (SO4),
1.62×107=(0.02-x)/4x3
x=6.8×10-4
二、配位解离平衡移动
1. 与弱电解质平衡的竞争
M+ + L+ + OHH+ [ML]
当Ka, Kb越小,配离子越易解离 平衡向生成弱酸、弱碱方向移动 MOH HL
[ Fe(C2O4 )3 ]3
Fe3 3C2O4 2
+ 6H+
→
3. 杂化轨道形式与配合物的空间构型
配 位 数 2 3
空间构型
直线形 平面三角形
杂化轨 道类型 sp sp2
实例
Ag(NH3)2+ , Ag(CN)2– Cu(CN)32 – ,HgI3–
4 4 5
5 6
正四面体 四方形 三角双锥
四方锥 八面体
第八章 配位化合物

A·m2
(3)测定 磁矩可通过磁天平测定。 • 顺磁性:被磁场吸引
• 反磁性:被磁场排斥
• 铁磁性:被磁场强烈吸引 (如 Fe , Co , Ni)
..
..
..
..
N
S
(a)无磁场
N
S
(b)磁场打开
顺磁性的说明
(4)影响因素 未成对电子数越多,磁矩越高,配合物
的磁性越大。
(5)意义
• 根据未成对电子数求磁矩; • 根据磁矩求未成对电子数; • 判断杂化方式、空间构型、配合物类型。
未成对电子数 0 1 2 3 4 5
µ计 / B.M
0 1.73 2.83 3.87 4.90 5.92
例: 测定FeF63-的µ为5.90 B.M,可判断: Fe3+有5个未成对电子;
Ag+
4d
[Ag(NH3)2]+
4d
5s
5p
NH3 NH3
5s
5p
sp杂化
2. 配位数为4的配合物的杂化方式及空间构型
(1)[NiCl4]2-:Ni 3d84s2
sp3杂化
Ni2+
Ni2+ 3d8 外轨型
四面体
3d
[NiCl4]2-
3d
4s
4p
Cl-
Cl- Cl- Cl-
4s
4p
sp3杂化
[NiCl4]2-
NH2-CH2-CH2-H2N
说明:
少数配体虽然有两个配位原子,由于两 个配位原子靠得太近,只能选择其中一 个与中心原子成键,故仍属单齿配体。
硝基NO(2 N是配位原子) 亚硝酸根ONO- (O是配位原子) 硫氰根SCN (S是配位原子) 异硫氰根NCS (N是配位原子)
第八章_配位化合物

0.10 21 1.0 10 2 y (0.10)
y 1.0 10
20
即Ag+的平衡浓度为1.0×10-20 mol/L。
2、判断配位反应进行的方向
[Ag(NH3)2] ++ 2CN反应向哪个方向进行?
2 [ Ag ( CN ) ][ NH ] 2 3 K [ Ag ( NH 3 ) 2 ][CN ]2
[Cu( NH 3 ) ] 1 2 [Cu ][NH 3 ]
2
2
[Cu( NH 3 ) 2 ] [Cu 2 ][NH 3 ]2
2
3
[Cu( NH 3 ) 3 ] [Cu 2 ][NH 3 ]3
2
2
4
[Cu( NH 3 )4 ] K稳 2 4 [Cu ][ NH 3 ]
[Zn(NH3)4]2+ [Zn(CN)4]2+ 5×108 1.0×1016
中心离子不同,配体相同,配位数相同。
[Zn(NH3)4]2+ [Cu(NH3)4]2+ 5×108 4.8×1012
不同类型配合物稳定性要通过计算 求出溶液中的离子浓度。
CuY2[Cu(en)2]2+ 6.3×1018 4.9×1019
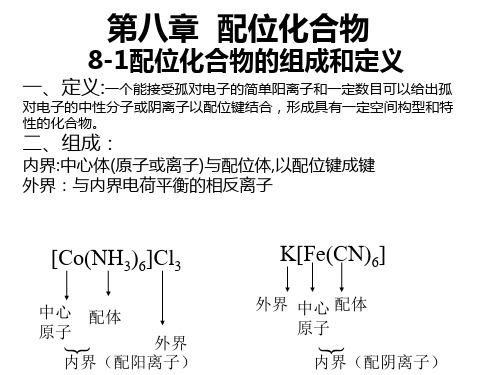
配位离子 [Cu(NH3)4]2+ 配位单元 配合物 配位分子 Fe(SCN)3 配离子与带有异电荷的离子 组成的中性化合物。 [Cu(NH3)4]SO4
Hale Waihona Puke 1.2 配合物的组成中心离子和配位体之 间以配位键结合。
NH3 H3N Cu NH3 NH3
2+ 2 SO4 2
配合物的组成分为内 界和外界两部分。
第八章配位化合物ppt课件
● 配离子与形成体的电荷数
()
3
Ag(S 2O3 ) 2 ,
(2)
Pt Cl 3 (NH 3 )
(3)
K 3 Fe (CN) 6
赤血盐 ,
(2)
K 4 Fe (CN) 6
(3)
(0)
Co Cl 3 (NH 3 )3 , Fe(CO) 5
黄血盐
12
13
←
← ←
← ← ←
(1) 内界与外界
32
8.4.1 价键理论 (valence bond theory)
同一原子内,轨道的杂化和不同原子间轨道的重叠构成了共价键 理论的核心论点之一.这里把第二章的s-p杂化轨道扩大到d轨道上 ,形成s-p-d杂化轨道.
(1) 价键理论的要点
● 形成体(M)有空轨道,配位体(L)有孤对电子,形成配位键
Ag(NH 3 )2 Cl
中配 外 心位 界 离体 子
Ni(CO) 4 CoCl3 (NH3 )3
中配 心位 原体 子
中 心配 离位 子体
配离子
形成体 — 中心离子或原子(central ion or central atom)
(配分子) 配位体 — 中性分子或阴离子
形成体 — 提供空轨道 电子对接受体 Lewis酸 配位体 — 提供孤对电子 电子对给予体 Lewis碱
8
(三)配位数
配合物中,直接与中心离子(或原子)配 位的配位原子的数目称中心离子(或原子)的 配位数。
一般中心离子(或原子)配位数为2、4、 6。中心离子的配位数的多少,主要取决于中 心离子和配体的电荷、体积和电子层结构,以 及配合物形成时温度和反应物的浓度等。
配离子的电荷数等于中心离子和配位体电 荷的代数和。
08第八节配位化合物

Cu2+ + 4NH3
Cu2++ 4NH3
[Cu(NH3)4]2+
前者是配离子的解离反响,后者那么是配离子的生成反响。
与之相应的标准平衡常数分别叫做配离子的解离常数〔 K不
稳〕和生成常数〔 K稳〕
K稳=1/K不稳
K稳与K不稳表示了K的意义, K稳越大,离子越稳定〔故 亦称稳定常数〕,K不稳越大,配离子越不稳定〔故亦称不 稳定常数〕 。
K 不稳Fe(CN)63 K 不稳Fe(CN)64
0.059lg1036.9 1043.6
-
Fe3 / Fe2 x
0.059lg107
0.0597
-
Fe3 / Fe2 x
0.413
x 0.770.413 0.36(V)
硬软酸碱理论〔HSAB〕
➢ 硬碱:电负性大、半径小、难被氧化、不易变形 的原子为配位原子的碱,F-, OH-
1-3 配合物的化学式和命名
解:
[Co(NH3)5(H2O)]Cl3 三氯化五氨一水合钴(Ⅲ) [Pt(NH3)2(NO2)(NH2)] 一氨基一硝基二氨合铂(Ⅱ) [Co(NH3)5(NO2)]SO4 硫酸一硝基五氨合钴(Ⅲ) [Co(en)2(NO2)Cl]SCN 硫氰酸化一氯一硝基二乙二胺合钴(Ⅲ) [Pt(NO2)(NH3)(NH2OH)(Py)]Cl 氯化一硝基一氨一羟氨一吡啶合铂(Ⅱ)
配离子电荷分别为 +1、+2、-3 、0 、0
1-3 配合物的化学式和命名
1. 配合物的化学式 书写原那么如下:
含配离子的配合物,其化学式中阳离子写在 前,阴离子在后。 如:K 3 F e (C N )6 、 C u (N H 4 )4 S O 4
第八章 配位化合物

NH3 Cu(NH )
2 3 3
K f,3 10
0
3.04
2 Cu ( NH3 ) 3 NH3 Cu(NH3 ) 2 4 K 0 K0 K0 K0f,3 K0f,4 1013.32 f f,1 f,2
外界: 普通阴、阳离子(Cl-,K+,SO42-等),有的配合物无外界
例如:[Ag(NH3)2]Cl
、 K[PtCl5(NH3)]、
[Ni(CO)4](无外界)
几个基本概念:
1、配合物:内界+外界(有的 无外界)
2、配离子: [Ag(NH3)2]+ 、[PtCl5(NH3)]配分子: [Ni(CO)4 ]
1
Ag(NH3 ) 2 0 0.010 0.010 x
0.030 0.030 0.020 0.010 2 x
0 x
1
0.010 x K f 1.67 107 x (0.010 2 x ) 2 0.010 x 0.010 0.010 2 x 0.010 0.010 1.67 107 x 6.0 106 x 0.0102 c ( Ag ) 6.0 106 mol L1 c ( NH3 ) c (Ag(NH3 ) 0.010mol L1 2
Cu(en)2
H 2C H 2C
2
的结构:
H2
H2
N Cu N
H2
N N
CH 2 CH 2
2+
H2
8、配离子与形成体的电荷数
Ag(S2 O3 ) 2
() ( 2 ) 3
无机化学:第八章配位化合物讲解

无机化学:第八章配位化合物讲解第八章配位化合物一、配合物的基本概念1、配位化合物的定义及其组成定义:把由一定数目的阴离子或中性分子与阳离子或原子以配位键形成的复杂分子或离子称配合单元。
含有配合单元(配位键) 简单化合物反应生成的复杂化合物。
配合单元相对稳定,存在于晶体及溶液中,在溶液中不能完全离解为简单组成的部分。
配位键——由配体单方面提供电子对给中心原子(离子)而形成的共价键。
组成中心离子的元素种类:◆能充当中心离子的元素几乎遍及元素周期表的各个区域,但常见的是金属离子,尤其是一些过渡金属离子,如[Co(NH3)6]3+、[Fe(CN)6]4—、[HgI4]2—。
◆高氧化态非金属元素原子:如B、Si、P等形成[ BF4]—、[SiF6]2—、PF6—。
◆金属元素电中性原子:如[ Ni(CO)4]、[ Fe(CO)5]、[Cr(CO)6]配合物的组成:配合物由内界和外界组成。
内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号表明。
方括号以外的离子构成配合物的外界。
内外界之间以离子键结合,故在水溶液中易解离出外界离子,而内界即配合单元很难发生离解。
如[Cu (NH3)4] SO4↓↓↓中心原子,配位体,外界在配合物中同中心原子/离子配位的分子如NH3、H2O或阴离子如Cl—、CN—、SCN—称配体属于Lewis碱,都含有孤对电子,是电子对的给予体。
中配位体中与中心离子(或原子)直接成键的离子称为配位原子。
配位体所提供的孤对电子即是配位原子所具有的孤对电子。
常见的配位原子有:F、Cl、Br、配位体分类——单齿配体和多齿配体单齿配体:一个配位体只提供1个孤对电子与1个中心离子结合形成1个配位键。
如NH3、—OH(羟基)、H2O:、:X—等。
多齿配体:一个配位体中含有2个或更多个配位原子,与一个中心离子形成2个或2 个以上的配位键。
例如:乙二胺(en)NH2–CH2–CH2–NH2、草酸根C2O42—是双齿配体。
第八章配位平衡和配位滴定法ppt课件

K f
1
(
K
a
)6
Kf越小,即生成的配合物稳定性越小;Ka越小, 即生成 的酸越弱,K就越大。
Fe3+ + 6F3OH-
[FeF6]3+
Fe(OH)3↓
既要考虑配位体的酸效应,又要考虑金属离子的水解效应。
2. 沉淀反应对配位平衡的影响
[Cu(NH3) 4]2+
Cu2+ + 4NH3 +
S2-
CuS↓
y 2.2310-7
二、配位平衡的移动
Mn+ + x L-
水解 氧化还原 沉淀
酸效应
MLx(n-x)
1. 酸度的影响 2.沉淀影响 3.氧化还原的影响
1. 酸度的影响
Fe3+ + 6F+ 6H+
[FeF6]36HF
总反应为:[FeF6]3- +6H+
Fe3+ + 6HF
K
c(Fe3 ) c6 (HF) c(Fe3 ) c6 (HF) • c6 (F- ) c([FeF6 ]3 ) c6 (H ) c([FeF6 ]3 ) c6 (H ) c6 (F- )
2. 配位体和配位原子 有孤电子对
Na[BF4]中[BF4]-是配位体, F为配位原子. a 单基配位体(一个配位体中只有一个配位原子)
含氮配位体 NH3 、 NCS-
含氧配位体 H2O 、 OH-
含卤素配位体 F- 、 CI- 、 Br- 、 I- 含碳配位体 CN- 、 CO
含硫配位体 SCN-
代入稳定常数表达式得:
Kf
c(Ag(NH3 )2 ) c(Ag )c2 (NH3 )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
P t Cl 3 ( NH3 )
( 2 )
( 3) K 3 Fe(CN)6
赤血盐 ,
( 2) K 4 Fe(CN)6
黄血盐
(0) ( 3) Co Cl 3 (NH3 ) 3 , Fe(CO)5
配合物磁性的测定是判断配合物结构的一个重要手段。 磁矩: µ = [n(n+2)]1/2 (B.M.)玻尔磁子.
[Fe(H2O)6]3+ 磁矩 5.9B.M. 5个未成对电子 外轨型 [Fe(CN)6]3磁矩 2.0B.M. 1个未成对电子 内轨型
价键理论能很好地解释了配合物的空间构型、
磁性、稳定性,直观明了,使用方便,但它无
的多面体结构的化合物。
金属冠状配合物:过渡金属离子相互连接成 与冠醚结构类似的环状结构的化合物。 有机金属配合物:含有金属-碳键的配合物。
8.2.2 配位化合物的命名
配酸:×××酸。例: H2[PtCl6]
配碱:氢氧化×××。 例:[Ag(NH3)2]OH
配盐:先阴离子后阳离子,简单酸根加“化”字,
8.2.1 配合物的类型 简单配合物:一个中心离子,每个配体均为单齿配体. 如 Fe(CN)4 Co(NH ) (H O)3
6 3 5 2
螯合物:一个中心离子与多齿配体成键形成环状结构 的配合物. 如[Cu(en)2]2+, CaY2-
其它分类: 多核配合物:一个配位原子同时与两个中心 离子结合形成的配合物。 原子簇化合物:簇原子以金属-金属键组成
2
4 3 1 4 2 2 2 6 3 2 6 1 6 6
P tCl3 (NH3 ) 2 CoCl2 (en)2 3 Al(C2O 4 )3 2 Ca(EDT A)
4. 电荷
● 配离子与形成体的电荷数的代数和
Ag(S2 O 3 ) 2 ,
分子(配体, Ligand L)和具有接受孤对电子或
多个不定域电子的空位的原子或离子(中心原子) 按一定的组成和空间构型所形成的化合物。 配位化学(Coordination Chemistry)
配位化学诞生
1893年,Werner (维尔纳,27岁)
发表第一篇配位学说(配位化学理论)
论文。1913年,Werner (维尔纳)获得 诺贝尔化学奖。创新点: 首次从立体角度系统考查配合物的结构;引 入了主价和副价的慨念;将有机化学中的立体学
(Ligand Field Theroy, LFT)
1935年,J. H. Van Vleck把分子轨道(MO)理 论应用到配位化学中
配位化学的发展
20世纪50年代,P. L. Pauson和S. A. Miller 分 别独立合成了二茂铁,突破传统配位化学慨念, 带动金属有机化学发展。 Ziegler(1953)
Linkage isomers
键合异构
NCS-, 异硫氰酸根
亚硝酸根
SCN-, 硫氰酸根
硝基
Coordination isomers
配位异构
8.4 配位化合物的化学键本性 目前有三种理论讨论配合物中的化学键。这
里介绍价键理论和晶体场理论的基础。
8.4.1 价键理论
价键理论的要点
●形成体(M)有空轨道,配位体(L)有孤对电子, 形成配位键ML ●形成体(中心离子)采用杂化轨道成键 ● 杂化方式与空间构型有关
二配位的配合物
[Ag(NH 3 ) 2 ]
Ag
直线形
4d 4d 5s sp
μ 0
5p 5p
[Ag(NH 3 ) 2 ]
[
]
NH3 NH3
内轨型和外轨型配合物 [FeF6]4- 外轨型配合物 配位原子的电负性很大,
如卤素、氧等, 不易给出孤电子对,使中心离子的
结构不发生变化,仅用外层的空轨道ns, np, nd进行
N H3
● 多齿配体: 一个配体中含有多个配位原子 二齿配体:乙二胺(en)
H2 N
CH 2
CH 2
N H2
六齿配体:乙二胺四乙酸根 EDTA(Y4-)
3. 配位数 ● 中心离子(或原子)与配位体形成配位键的数目
配位数 配位体i 的数目 齿数
单齿配体 Cu(NH3 ) 4 多齿配体
非金属元素(少)
Fe(CO)5 , Ni(CO)4
常见金属离子的配位数 1价金属离子 Cu+ 2,4 Ag+ 2 Au+ 2,4 2价金属离子 Ca 2+ 6 Mg2+ 6 Fe2+ 6 Co2+ 4,6 Cu2+ 4,6 3价金属离子 Al3+ 4,6 Cr3+ 6 Fe3+ 6 Co3+ 6 Au3+ 4
说理论运用到无机领域的配合物中。
值得指出的是:当时化学键理论尚未出现, 没有X射线衍射和现代光谱方法。
配位化学的发展
Pauling(1954年获诺贝尔化学
奖)在二十世纪初将分子结构中的
价键理论应用到配位化学中 1929年,H. Bethe提出晶体场理 论(Crystal Field Theory, CFT) 20世纪50年代,CFT发展改进成配位场理论
复杂酸根加“酸”字。 例:[Co(en)3]Cl3 ;(NH4)3[SbCl6]。
按照中国化学会无机专业委员会制定规则命名
配体数 以二、
三、四
配体名称
不同配体 “•”分开
合 中心元素名称(氧化态值) 以罗马数字
Ⅱ、Ⅲ、 Ⅳ
表示
表示
▲ 若含有多种配体时,先无机后有机,先简单
后复杂。 ▲ 若为多种无机配体时,先阴离子后中性分子。
Ag2[HgI4]
[Co(en)3]Cl3
[CoBr(NH3)5]SO4
[Fe(CN)5(Py)]3-
8.3 配位化合物的异构现象 配合物的空间构型 空间构型基本规律: (1)配位体围绕中
心离子排布
(2)配位体倾向于 尽可能远离 (3)能量低,配合 物稳定
8.3.1 立体异构现象 组成相同而结构不同的分子或复杂离子叫做异构体。
指出各配合物和配离子的中心离子、配位体、 配位原子和配位数 [CoOH(NH3)4(H2O)]2+ [Pt(NH3)4][PtCl6] [Co(en)3]Cl3 [Co(NO2)3(NH3)3] Ag2[HgI4] [Fe(CN)5(Py)]3-
Cu[SiF6]
[CoBr(NH3)5]SO4
8.2 配位化合物的类型和命名
Fe(CO)5
硫酸四氨合铜(Ⅱ) 六异硫氰根合铁(Ⅲ)酸钾 六氯合铂(Ⅳ)酸 氢氧化四氨合铜(Ⅱ) 五氯•氨合铂(Ⅳ)酸钾 硝酸羟基•三水合锌(Ⅱ) (三)氯化五氨•水合钴(Ⅲ) 五羰(基)合铁 三硝基•三氨合钴(Ⅲ) 乙二胺四乙酸根合钙(Ⅱ)
[练习]命名下列各配合物和配离子 [CoOH(N释配合物的颜色,不能定量或半定量说明
配合物性质.
晶体场理论是一种改进了的静电理论,除
考虑L与M间的静电引力外,着重考虑L电性对
M d 轨道的影响.
Some of the impure forms of -alumina are prized as gems. (a) Ruby, Cr3+ (b) Sapphire, Fe3+, Ti4+ (c)Topaz, Fe3+
①几何异构
cis — 二氯二氨合铂(II) (II) 棕黄色,m > 0 具抗癌活性
trans — 二氯二氨合铂 淡黄色, 不具抗癌活性
几何异构体结构不同,性质也不同,其反应也不同:
[CoSO4(NH3)5] Br
红色 AgNO3 AgBr 淡黄沉淀
[CoBr(NH3)5] SO4
紫色 BaCl2 BaSO4白色沉淀
水合异构
键合异构
配位异构
Ionization isomers
电离异构
[CoBr(NH3)5]SO4 [CoSO4(NH3)5]Br
Hydrate isomers
水合异构
[Cr(H2O)6]Cl3 [CrCl(H2O)5]Cl2· H2O [CrCl2(H2O)4]Cl· 2H2O
[CrCl3(H2O)3]· 3H2O
杂化生成能量相同,数目相等的杂化轨道与配体结
合
[Fe(CN)6]4- 内轨型配合物 配位原子的电负 性较小,如氰基较易给出孤电子对,对中心离子的
影响较大,使电子层结构发生变化,(n-1)d 轨道
上的成单电子被强行配位腾出内层能量较低的d轨 道接受配位体的孤电子对,形成内轨配合物。
[例 ]
Fe3+
H. Taube和R. A.Marcus分别由于在金属配
合物的电子转移反应机理和溶液中电子传递理 论方面研究成果分别获得1983年和1992年诺贝 尔化学奖
C. J. Pederson, D. J. Cram和J. M. Lehn由
于在超分子化学(Supramolecule Chemistry) 方 面研究成果获得1987年诺贝尔化学奖
2. 配位体和配位原子 配位体
负离子 中性分子
X SCN C2O 2 4
CN en
H 2O NH3 CO
● 单齿配体: 一个配体中只含一个配位原子.
X
O H (羟基)
C N
S CN(硫氰根) CO (羰基) N CS(异硫氰根)
N O(硝基) H2 O 2
和Natta(1955)催
化剂——立体选 择性聚合反应。 1963年获得诺贝 尔化学奖
配位化学的发展
20世纪60年代,M.
Eigen研究快速反应取得
