第八章配位化合物-4资料
配位化合物
8.2 配合物的空间结构和异构现象
1、配合物的空间结构 空间构型
配位数 2 杂化轨道 sp 空间构型 直线型 实例 [Ag(NH3)2]+
3
4
sp2
sp3
平面三角形
平面正方形
[HgI3][Ni(CN)4]-、[PdCl4]2-
四面体
5 dsp3或d3sp d2sp2 6 d2sp3或sp3d2 三角双锥 正方锥形 正八面体
配位数(不一定是配体数)
与中心原子直接以配位键结合的配位原子的数目 称为中心原子的配位数。中心原子的配位数一般可为 2-12,以配位数2,4,6最为常见。 中必原子的配位数与配体的齿数有关,
配体是单齿,那么中心原子的配位数就是配体的数目; 配体是多齿,那么中心原子的配位数则是配体的数目 与其齿数的乘积。 例如: [Co Br(NH3)5] (SO4),
1.62×107=(0.02-x)/4x3
x=6.8×10-4
二、配位解离平衡移动
1. 与弱电解质平衡的竞争
M+ + L+ + OHH+ [ML]
当Ka, Kb越小,配离子越易解离 平衡向生成弱酸、弱碱方向移动 MOH HL
[ Fe(C2O4 )3 ]3
Fe3 3C2O4 2
+ 6H+
→
3. 杂化轨道形式与配合物的空间构型
配 位 数 2 3
空间构型
直线形 平面三角形
杂化轨 道类型 sp sp2
实例
Ag(NH3)2+ , Ag(CN)2– Cu(CN)32 – ,HgI3–
4 4 5
5 6
正四面体 四方形 三角双锥
四方锥 八面体
第八章 配位化合物

系统命名 配合物的命名与一般无机化合物的命名原则相同: 先提阴离子,再提阳离子。 若阴离子为简单离子,称某化某。 若阴离子为复杂离子,称某酸某。 内界的命名次序是: 配位体数—配位体名称—合—中心原子(中心原子 氧化数)
配体的命名顺序:先无机配体,后有机配体。
对于同类配体: (1)先阴离子,后中性分子。 (2)同类配体按配位原子元素符号的英文字母顺序排列。 (3)同类配体中若配位原子相同,则按配体中含原子 数的多少 来排列。原子数少的排前面,原子数多
为了增强成键能力,中心原子采取杂化轨 道与配体成键,配位键具有方向性和饱和性
8.2.2 配离子的形成
1. 外轨型配离子的形成 中心原子全部用外层空轨道(ns,np,nd) 杂化成键形成的配合物称为外轨型配合物. 4d 5s 5p sp杂化 5p 5s .. ..
NH3 NH3
Ag+
4d
[Ag(NH3)2]+
少量BaCl2 少量NaOH 定量乙醇
晶体析出(深蓝)
经分析,深蓝色晶体为[Cu(NH3)4]SO4,在 水中以[Cu(NH3)4]2+和SO42-形式存在,复 杂离子[Cu(NH3)4]2+几乎不能解离出Cu2+, 在结构上4个NH3与1个Cu2+牢固地结合 [Cu(NH3)4]SO4—配位化合物
0.1-x ≈ 0.1
0.1 x 7 Kf 1.62 10 2 x(2 x)
0.1 3 1 3 x 1.2 10 mol L 7 4 1.62 10
Ag+ + 2CN初始: 0 平衡: y 0 2y
[Ag (CN)2 ]0.1 0.1- y mol· -1 L
1. 离解程度 内轨型配离子比外轨型配离子更稳定,
第八章配位化合物

顺式结构具有抗癌作用。而反式结构则没有抗癌作用。
八面体配合物的几何异构更为普遍,对于[MA4X2]型,其最典型 的是二氯· 四氨合铬(III)离子的紫色型(顺式)和绿色型(反式),如图:
(顺式)
(反式)
(顺式)
(反式)
本课题组有关工作:大环配合物超分子自组装
一维链状结构
§8-2 配合物结构的价键理论
多齿配体:
H2C—CH2
草酸பைடு நூலகம் (OX)
O
CH2—CH2
NH2 ..
H2N ..
二乙烯三胺
NH ..
CH2—C : C—CH2 O: :O : :N—CH2—CH2—N O: : :O C—CH2 CH2—C O O
O
乙二胺四乙酸(EDTA)
3、配离子的电荷 中心离子的电荷与配体电荷的代数和即为配离子的电荷,例如: K2[HgI4] [HgI4]2-的电荷为: 21+(-1)4 = -2 [CoCl(NH3)5]Cl2 [CoCl(NH3)5]2+的电荷为: (31) ( - 11)+(05) = +2
[Cr(OH)3(H2O)(en)] 三羟基•一水•乙二胺合铬(III)
(3)同类配体的顺序为配位原子元素符号英文字母顺序。 [CoCl2 (NH3)3 (H2O)]Cl 氯化二氯•三氨•一水合钴(III)
(4)同类配体中若配位原子相同,则将含原子数较少的配体排列在前,较多原子 数的配位排后。如: [PtNO2NH3(NH2OH)(py)]Cl 氯化一硝基· 一氨· 一羟胺· 一吡啶合铂(Ⅱ) (5)配体原子相同,配体中含原子的数目也相同,则按在结构式中与配位原 子相连的元素符号的英文字母顺序排列。如: [PtNH2NO2(NH3)2] 一氨基· 一硝基· 二氨合铂(Ⅱ)
第八章 配位化合物

A·m2
(3)测定 磁矩可通过磁天平测定。 • 顺磁性:被磁场吸引
• 反磁性:被磁场排斥
• 铁磁性:被磁场强烈吸引 (如 Fe , Co , Ni)
..
..
..
..
N
S
(a)无磁场
N
S
(b)磁场打开
顺磁性的说明
(4)影响因素 未成对电子数越多,磁矩越高,配合物
的磁性越大。
(5)意义
• 根据未成对电子数求磁矩; • 根据磁矩求未成对电子数; • 判断杂化方式、空间构型、配合物类型。
未成对电子数 0 1 2 3 4 5
µ计 / B.M
0 1.73 2.83 3.87 4.90 5.92
例: 测定FeF63-的µ为5.90 B.M,可判断: Fe3+有5个未成对电子;
Ag+
4d
[Ag(NH3)2]+
4d
5s
5p
NH3 NH3
5s
5p
sp杂化
2. 配位数为4的配合物的杂化方式及空间构型
(1)[NiCl4]2-:Ni 3d84s2
sp3杂化
Ni2+
Ni2+ 3d8 外轨型
四面体
3d
[NiCl4]2-
3d
4s
4p
Cl-
Cl- Cl- Cl-
4s
4p
sp3杂化
[NiCl4]2-
NH2-CH2-CH2-H2N
说明:
少数配体虽然有两个配位原子,由于两 个配位原子靠得太近,只能选择其中一 个与中心原子成键,故仍属单齿配体。
硝基NO(2 N是配位原子) 亚硝酸根ONO- (O是配位原子) 硫氰根SCN (S是配位原子) 异硫氰根NCS (N是配位原子)
第八章配位化合物解析

P t Cl 3 ( NH3 )
( 2 )
( 3) K 3 Fe(CN)6
赤血盐 ,
( 2) K 4 Fe(CN)6
黄血盐
(0) ( 3) Co Cl 3 (NH3 ) 3 , Fe(CO)5
配合物磁性的测定是判断配合物结构的一个重要手段。 磁矩: µ = [n(n+2)]1/2 (B.M.)玻尔磁子.
[Fe(H2O)6]3+ 磁矩 5.9B.M. 5个未成对电子 外轨型 [Fe(CN)6]3磁矩 2.0B.M. 1个未成对电子 内轨型
价键理论能很好地解释了配合物的空间构型、
磁性、稳定性,直观明了,使用方便,但它无
的多面体结构的化合物。
金属冠状配合物:过渡金属离子相互连接成 与冠醚结构类似的环状结构的化合物。 有机金属配合物:含有金属-碳键的配合物。
8.2.2 配位化合物的命名
配酸:×××酸。例: H2[PtCl6]
配碱:氢氧化×××。 例:[Ag(NH3)2]OH
配盐:先阴离子后阳离子,简单酸根加“化”字,
8.2.1 配合物的类型 简单配合物:一个中心离子,每个配体均为单齿配体. 如 Fe(CN)4 Co(NH ) (H O)3
6 3 5 2
螯合物:一个中心离子与多齿配体成键形成环状结构 的配合物. 如[Cu(en)2]2+, CaY2-
其它分类: 多核配合物:一个配位原子同时与两个中心 离子结合形成的配合物。 原子簇化合物:簇原子以金属-金属键组成
2
4 3 1 4 2 2 2 6 3 2 6 1 6 6
P tCl3 (NH3 ) 2 CoCl2 (en)2 3 Al(C2O 4 )3 2 Ca(EDT A)
第八章_配位化合物

0.10 21 1.0 10 2 y (0.10)
y 1.0 10
20
即Ag+的平衡浓度为1.0×10-20 mol/L。
2、判断配位反应进行的方向
[Ag(NH3)2] ++ 2CN反应向哪个方向进行?
2 [ Ag ( CN ) ][ NH ] 2 3 K [ Ag ( NH 3 ) 2 ][CN ]2
[Cu( NH 3 ) ] 1 2 [Cu ][NH 3 ]
2
2
[Cu( NH 3 ) 2 ] [Cu 2 ][NH 3 ]2
2
3
[Cu( NH 3 ) 3 ] [Cu 2 ][NH 3 ]3
2
2
4
[Cu( NH 3 )4 ] K稳 2 4 [Cu ][ NH 3 ]
[Zn(NH3)4]2+ [Zn(CN)4]2+ 5×108 1.0×1016
中心离子不同,配体相同,配位数相同。
[Zn(NH3)4]2+ [Cu(NH3)4]2+ 5×108 4.8×1012
不同类型配合物稳定性要通过计算 求出溶液中的离子浓度。
CuY2[Cu(en)2]2+ 6.3×1018 4.9×1019
配位离子 [Cu(NH3)4]2+ 配位单元 配合物 配位分子 Fe(SCN)3 配离子与带有异电荷的离子 组成的中性化合物。 [Cu(NH3)4]SO4
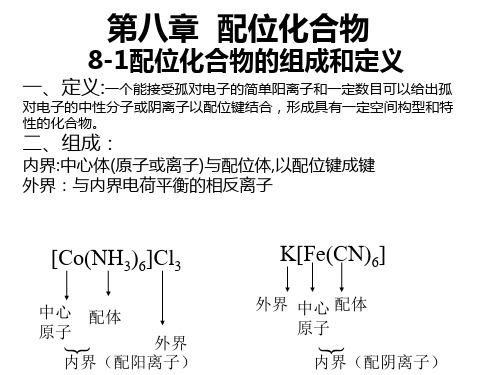
Hale Waihona Puke 1.2 配合物的组成中心离子和配位体之 间以配位键结合。
NH3 H3N Cu NH3 NH3
2+ 2 SO4 2
配合物的组成分为内 界和外界两部分。
第八章配位化合物ppt课件
● 配离子与形成体的电荷数
()
3
Ag(S 2O3 ) 2 ,
(2)
Pt Cl 3 (NH 3 )
(3)
K 3 Fe (CN) 6
赤血盐 ,
(2)
K 4 Fe (CN) 6
(3)
(0)
Co Cl 3 (NH 3 )3 , Fe(CO) 5
黄血盐
12
13
←
← ←
← ← ←
(1) 内界与外界
32
8.4.1 价键理论 (valence bond theory)
同一原子内,轨道的杂化和不同原子间轨道的重叠构成了共价键 理论的核心论点之一.这里把第二章的s-p杂化轨道扩大到d轨道上 ,形成s-p-d杂化轨道.
(1) 价键理论的要点
● 形成体(M)有空轨道,配位体(L)有孤对电子,形成配位键
Ag(NH 3 )2 Cl
中配 外 心位 界 离体 子
Ni(CO) 4 CoCl3 (NH3 )3
中配 心位 原体 子
中 心配 离位 子体
配离子
形成体 — 中心离子或原子(central ion or central atom)
(配分子) 配位体 — 中性分子或阴离子
形成体 — 提供空轨道 电子对接受体 Lewis酸 配位体 — 提供孤对电子 电子对给予体 Lewis碱
8
(三)配位数
配合物中,直接与中心离子(或原子)配 位的配位原子的数目称中心离子(或原子)的 配位数。
一般中心离子(或原子)配位数为2、4、 6。中心离子的配位数的多少,主要取决于中 心离子和配体的电荷、体积和电子层结构,以 及配合物形成时温度和反应物的浓度等。
配离子的电荷数等于中心离子和配位体电 荷的代数和。
无机化学:第八章配位化合物
无机化学:第八章配位化合物第八章配位化合物一、配合物的基本概念1、配位化合物的定义及其组成定义:把由一定数目的阴离子或中性分子与阳离子或原子以配位键形成的复杂分子或离子称配合单元。
含有配合单元(配位键)的化合物即配合物。
配合物可看成是一类由简单化合物反应生成的复杂化合物。
配合单元相对稳定,存在于晶体及溶液中,在溶液中不能完全离解为简单组成的部分。
配位键——由配体单方面提供电子对给中心原子(离子)而形成的共价键。
中心离子(或中心原子)——又称“配合物形成体”。
特征:带有空轨道。
组成中心离子的元素种类:◆能充当中心离子的元素几乎遍及元素周期表的各个区域,但常见的是金属离子,尤其是一些过渡金属离子,如[Co(NH3)6]3+、[Fe(CN)6]4—、[HgI4]2—。
◆高氧化态非金属元素原子:如B、Si、P等形成[ BF4]—、[SiF6]2—、PF6—。
◆金属元素电中性原子:如[ Ni(CO)4]、[ Fe(CO)5]、[Cr(CO)6]配合物的组成:配合物由内界和外界组成。
内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号表明。
方括号以外的离子构成配合物的外界。
内外界之间以离子键结合,故在水溶液中易解离出外界离子,而内界即配合单元很难发生离解。
如[Cu (NH3)4] SO4↓↓↓中心原子,配位体,外界在配合物中同中心原子/离子配位的分子如NH3、H2O或阴离子如Cl—、CN—、SCN—称为配位体,简称配体。
配体属于Lewis碱,都含有孤对电子,是电子对的给予体。
中配体无机化学配位化学CO 一氧化碳羰基OH—氢氧根离子羟基NO2—亚硝酸根硝基ONO—亚硝酸根亚硝酸根SCN—硫氰酸根硫氰酸根NCS—硫氰酸根异硫氰酸根Cl—氯离子氯配位体中与中心离子(或原子)直接成键的离子称为配位原子。
配位体所提供的孤对电子即是配位原子所具有的孤对电子。
常见的配位原子有:F、Cl、Br、配位体分类——单齿配体和多齿配体单齿配体:一个配位体只提供1个孤对电子与1个中心离子结合形成1个配位键。
(完整版)配位化合物与配位滴定法
第八章配位化合物与配位滴定法【知识导航】本章知识在《中国药典》(2010年版)中主要应用于含金属离子药物的含量测定,以配位反应为基础的滴定分析法。
目前多用氨羧配位剂为滴定液,其中以乙二胺四醋酸(EDTA)应用最广。
《中国药典》中使用直接滴定法对葡萄糖酸钙、葡萄糖酸钙口服液、葡萄糖酸钙含片、葡萄糖酸钙注射剂、葡萄糖酸钙颗粒、葡萄糖酸锌、葡萄糖酸锌口服液、葡萄糖酸锌片、葡萄糖酸锌颗粒进行含量测定;使用间接滴定法对氢氧化铝、氢氧化铝片、氢氧化铝凝胶进行含量测定。
在历年执业药师考试中也有相关考题出现。
学好本章内容有利于掌握配位滴定法的原理、配位滴定法在药物分析中的应用以及备战执业药师考试。
【重难点】1.配位化合物(coordination compound)简称配合物,以具有接受电子对的空轨道的原子和离子为中心(中心离子),与一定数量的可以给出电子对的离子或分子(配体)按一定的组成和空间构型形成的化合物。
配位键的形成:中心离子(原子)提供空轨道,配位体上的配位原子提供孤对电子。
例如:[Cu(NH3)4]SO4、K3[Fe(NCS)6]等。
这些化合物与简单的化合物区别在于分子中含有配位单元,而简单化合物中没有这些配位单元。
以[Cu(NH3)4]SO4为例:[Cu (NH3)4 ] SO4↓ ↓↓内界配体外界配位体中提供孤电子对的,与中心离子以配位键结合的原子称为配位原子。
一般常见的配位原子是电负性较大的非金属原子。
常见配位原子有C、N、O、P及卤素原子。
由于不同的配位体含有的配位原子不一定相同,根据一个配位体所提供的配位原子的数......目.,可将配位体分为单齿配位体(unidentate ligand)和多齿配位体(multidentate ligand)。
只含有一个配位原子配位体称单齿配位体如H2O、NH3、卤素等。
有两个或两个以上的配位原子配位体称多齿配位体,如乙二胺NH2一CH2一CH2一NH2(简写为en),草酸根C2O42-(简写为ox)、乙二胺四醋酸根(简称EDTA)等。
第八章 配位化合物
配合物生成反应
Cu 2 4NH3
[Cu( NH 3 )4 ]2
[Cu( NH 3 )2 4 ] K稳 [Cu 2 ][ NH 3 ]4
● K稳值愈大,表示该配离子越稳定------直 接反映配离子稳定性的大小。
K稳
1 K不稳
溶液中配离子的生成是分步进行的,每一步都 有一个对应的稳定常数,我们称为逐级稳定常数 1 2 2 θ Cu NH3 Cu(NH 3 ) K 稳1 θ 10 4.31 K 不稳4
Cu( NH3 ) NH3 Cu(NH ) Cu( NH ) NH3 Cu(NH ) Cu( NH ) NH3 Cu(NH ) K K
θ 稳 θ 稳,1 2 3 3 2 3 2
2
2 3 2
K K K
θ 稳2
1 K
θ 不稳3
103.67 103.04 10 2.3
(NH4)2[Pt(NH3)2Cl4]
内界命名法: 三先三后原则 先配位体 先离子配体 先无机配体 后有机配体
后分子配体
同类配体: 配位原子英文字母顺序
后中心离子
先NH3后H2O
配合物内界的命名原则:
内界配体命名次序:先阴后中、先无后有、 先 A后 B 、先少后多。
配体名称列在中心离子之前,配体数目用倍 数词头二、三、四等数字表示(配体数为一时省 略),不同配体名称之间以“•”分开,在最后一 个配体名称之后缀以“合”字。中心离子的氧化 数用带括号的罗马数字表示(氧化数为 0 时省略)。 配体数 - 配体名称-合-中心离子名称(氧化态值) 不同 以罗马数 以二、 配体 字Ⅱ、Ⅲ、 三、四 “•” Ⅳ表示 表示 分开
NH3 Cl NH3 NH3 Cl
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[Zn(en)2]2+ 6.8×1010 [Zn(NH3)4]2+ 2.88×109
[Co(en)2]2+ 6.6×1013 [Co(NH3)4]2+ 1.29×105
[Ni(en)2]2+ 2.1×1018 [Ni(NH3)4]2+ 5.50×108
螯合物比非螯配合物稳定
螯合物 特性——特殊的稳定性
符合有效原子序数规则(简称EAN) 过渡金属形成体与一定数目配体结合, 以使其周围的电子数等于同周期稀有 气体元素的电子数(即有效原子序数)
如 Cr(CO)6] 6个CO提供12个电子, Cr原子序数为24,核外电子数为24, Cr周围共有电子(24+12)个=36个。 相当于同周期Kr(氪)的电子数(36), 因此, [Cr(CO)6]可稳定存在。
丙二胺
NH2CH2CH2NH2
en
CH3COCH2COCH3 Hacac
H2NCH2CH2CH2NH2 pn
乙二胺四乙酸 (CH2N)2(CH2COOH)4 H4edta
螯合物 特性——特殊的稳定性
螯合物
Kf 一般配合物 Kf
[Cu(en)2]2+ 1.0×1020 [Cu(NH3)4]2+ 2.09×1013
O (H3N)5Cr Cr(NH3)5
O2
4+
(NH3)4Co Co(NH3)4
N H2
多核配合物
多核配合物
Hale Waihona Puke 2-OOC
C
O
O
多核配合物
多S 核配O合物2C
C
S
O
羰合物(羰基化合物) 以CO为配体的配合物
M←C间的σ键—羰—合C原物子提供孤电子对
中心金属原子提供空杂化轨道
M→C的反馈π键——CO分子提供空的 π*(2p)反键轨道,金属原子提供d轨道上 的孤电子对
四个Mo3O120- 是配体
大环配合物
骨架上带有O、大N环、配S、合P物、As等多个配
位原子的多齿配体所形成的配合物
如 Na+与苯并-15-冠-5形成的配合物
O O
O O
O
苯并-15-冠-5
夹心配合物 如 二茂铁——(C5H5)2Fe
夹心配合物
在茂环内,每个C 原子 各有一个垂直于茂环平 面的 2p 轨道,5个 2p 轨道与未成键的p 电子
螯合物
由多齿配体与中螯心合离物子结合而成的具
有环状结构的配合物
如
H2
N
H2 N
2+
乙二胺为双齿配
H2C Cu
H2C
N H2
CH2
CH2 N H2
体,与Cu2+形成 两个五原子环。 配位数4
[Cu(en)2]2+
螯合物
由多齿配体与中心离子结合而成的具
有环状结构的配合物
如
CO
2-
O CO-CH2
CH2
原子簇化合物(簇合物)
Rh13
同多酸、杂多酸型配合物
同多酸同型多配酸合、物杂——多由酸多型核配配离合子物形成
的同多酸及其盐
如 K2Cr2O7,其中Cr2O72-为多核离子
同多酸、杂多酸型配合物
杂多酸型配合物——由不同酸根组成的 配酸
如 磷钼酸铵(NH4)3PO4·12MoO3·6H2O 实际上应写成(NH4)3[P(Mo3O10)4]·6H2O 其中 P(V)是形成体
O
N
Ca
CH2
O
N CH2
乙二胺四乙酸有 六个配位原子, 与Ca2+形成五个 五原子环。
CO-CH2 O
CH2 CO
配位数6
[Ca(edta)]2-
螯合物
螯合剂——形成螯合物的配合剂
一般为含有O、S、N、P 等配位原子的有 机化合物。配位原子之间要间隔两个或三 个其它原子。
螯合剂
化学式
缩写
乙二胺 乙酰丙酮
无机化学多媒体电子教案
第四节配合物的类型
第八章 配位化合物
第四节
配合物的类型
8-4-1 配合物的类型
主要有8:-4简-1单配配合合物物的类型
螯合物 多核配合物 羰合物 原子簇状化合物 同多酸及杂多酸型配合物 大环配合物 夹心配合物
简单配合物
由单齿配体与简中单心配离合子直物接配位形成
的配合物
如 [Cu(NH3)4]SO4、[Ag(NH3)2]Cl、 K4[Fe(CN)6]、(NH4)3[Cr(NCS)6]、 [PtCl2(NH3)2]、[CrCl2(H2O)4]Cl、 [Co(NH3)5(H2O)]Cl3
符合有效原子序数规则(简称EAN) 过渡金属形成体与一定数目配体结合, 以使其周围的电子数等于同周期稀有 气体元素的电子数(即有效原子序数)
如 [Mn(CO)6]+ 6个CO提供12个电子, Mn原子序数为25,核外电子数为25, Mn周围共有电子(25+12-1)个=36个, 相当于同周期Kr(氪)的电子数(36), 因此, [Mn(CO)6]+可稳定存在。
原子簇状化合物(簇合物)
两个或两个以簇上合金物属原子以金属-金
属键(M-M键) 直接结合而形成的化合物
如 [Re2Cl8]2- 有24个电子成键,其中: 16个形成Re-Cl键 8个形成Re-Re键 即填充在一个σ轨道 两个π轨道 一个δ轨道 相当于一个四重键
原子簇化合物(簇合物)
Rh2Fe(CO)12
螯环的大小——一般五原子环
螯合物 稳定性
或六原子环 最稳定
螯环的多少——一个配体与中 心离子形成的 螯环数越多, 越稳定
螯合物 特性——具有特征颜色
如 在弱碱性条件下,丁二酮肟与Ni2+形成 鲜红色的螯合物沉淀,用来鉴定Ni2+
多核配合物
两个或两个以多上核中配心合原子物结合所形成
的配合物
如
H
5+
形成Π 65键,通过所有
这些π电子与Fe2+形成 夹心配合物
无机化学多媒体电子教案
第四节结束
第八章 配位化合物
第四节
结束
