痛觉过敏探究
教学实验疼痛1111

实验:化学刺激性痛觉过敏
1.实验目的:
1)致痛动物模型制备
2)痛阈测定方法
3)痛行为的观察
4)痛行为时程反应观察
2.方法,材料:
化学致痛模型:躯体痛,内脏痛
躯体痛模型制备:5%福尔马林50μL各组任选一侧足底皮下注射,分别观察缩腿次数/5分钟,舔爪时间/5分钟,持续时间60-80分钟。
每5分钟记录一次
内脏痛模型制备:0.6%醋酸0.2ml小鼠腹腔注射,记录30分钟扭体次数
镇痛药物对痛敏的影响观察:
复方氨基比林:50mg/ml 0.5ml/只腹腔注射
吗啡:2mg/ml 0.8ml/只腹腔注射
3. 实验步骤
1).每组首先测大鼠基础痛阈(1 次/10分钟X3),取均值作为基础痛阈。
2).造模前30分钟腹腔注射镇痛药物
3).讲解造模方法(打生理盐水示教)
4. 结果观察分析
1.“辐射热—抬腿“痛阈的测定结果
2. 痛行为观察。
痛觉过敏的研究进展

Cl n e s2 o 1 2 8 -3 2. i Ca c rRe .o 4.0:3 6 2 9 n
7 XuJ, mb l T , rn N, ta. Ki al R Lo zJ e 1 GDF1 / I 1fn t n sapo e 5 M C・ u ci sa r・ o
m e hg hbt sctkn- idci f r inya dln nuy amp aei iir y iel nu tnat d e n gijr. n o o o ek u
S o k, 0 h c 2 05. 5 3 5 8. 23: 4 - 4
记物 , 加已确定 的临床和生化标记 物的预后信息 的一种新 的 增
阿北 医药 2 1 0 1年 8月 第 3 3卷 第 l 5期
H bi dcl ora。0 1V l 3A gN . 5 ee Mei un 2 1 , o 3 u o 1 aJ l
反 , D 一5水平升高的患者预示 预后不好 , G F1 中度升高 的( 0 120
—
p en fmi . o e , 9 8, 7 1 7 0 1 7 7. mti a l BilCh m 1 9 2 3: 3 6 . 3 6 y
t ei e a th p rr p i a t r rl a e r m h o a d u i s o i- e tv n i y e t h c f co e s d fo t e my c r i m n a s c a o e to t ma r ti c i ai n C r s 2 ( 9 3 2- 5 in wi S d p o en a t t . i Re , 0 ) 8: 4 3 0. h v o e 6,
瑞芬太尼诱发痛觉过敏研究新进展

瑞芬太尼诱发痛觉过敏研究新进展摘要】瑞芬太尼作为较为理想的超短效的阿片类镇痛药,起效迅速且消除不依赖输注时间,被广泛应用于临床麻醉及疼痛治疗的各个领域,但其所引起的痛觉过敏也引起了人们的关注。
随着对其引起的痛觉过敏作用机制和痛觉过敏的防治措施研究的不断深入,已由实验动物和人类健康的志愿者逐渐转向临床,本文就近年来国内外对瑞芬太尼诱发痛觉过敏发生的评价和影响因素、作用机制、防治药物的给药途径和最佳剂量的研究进行综述。
【关键词】瑞芬太尼痛觉过敏机制防治【中图分类号】R614 【文献标识码】A 【文章编号】2095-1752(2012)08-0370-03瑞芬太尼是一种人工合成的新型超短效μ 阿片受体激动剂,起效迅速、作用时间短、消除迅速、连续输注无蓄积作用以及代谢不依赖于肝肾功能是其显著特点,已被广泛应用于临床麻醉,由应用瑞芬太尼所带来的各种不良反应正逐渐引起研究者的关注。
阿片药物所诱发的痛觉过敏OIH(opioid-induced hyperalgesia) 是指暴露于阿片药物的患者出现一种以痛阈降低和( 或) 对正常疼痛刺激的过激反应为特点的皮肤感觉异常现象。
瑞芬太尼起效快、短效的独特的药代动力学特点导致它诱发的痛觉过敏也明显频于、强于其他阿片类药物。
现就近几年国内外瑞芬太尼诱发痛觉过敏发生的评价和影响因素、机制及其防治药物加以综述。
1瑞芬太尼术后痛觉过敏发生的评价和影响因素1.1 瑞芬太尼术后痛觉过敏发生的评价以往的研究在实验动物和人类健康的志愿者进行,结果表明,瑞芬太尼可诱发痛觉过敏。
如Celerier[1] 研究提示接受瑞芬太尼(0.04mg/k g ) 持续泵注30mi n 的切口痛模型大鼠术后24h 开始出现痛觉过敏,并在术后24 ~ 48h 迅速达到高峰;Hood 等[2] 人在志愿者身上使用辣椒素痛敏模型观察经过数小时瑞芬太尼输注是否可导致疼痛敏化,认为大剂量瑞芬太尼可致痛觉过敏。
痛觉过敏的处理与预防

痛觉过敏的治疗及处理
▪ 由于至今对痛觉敏感的形成机制尚不清楚,故目前临床上还未有 治疗痛觉敏感的有效方法,但随着痛觉敏感机制的深入研究,N 甲基-D-门冬氨酸(NMBA)受体拮抗剂、一氧化氮合成酶(NOS)抑 制剂、环氧化酶抑制剂、小剂量阿片受体拮抗剂、钙离子通道阻 断剂等,都曾被用于痛觉敏感的治疗:
▪ ⑤胶质细胞抑制剂也可减轻或阻断痛觉敏感现象。
麻醉与实践
▪ 阿片类药物是用于临床麻醉镇痛的经典药物,是目前治疗术中与 术后患者中、重度疼痛必须应用的药物,也是全身麻醉患者首选 镇痛药,但极少数患者应用阿片类药不仅不能镇痛,相反促进痛 觉感知,造成疼痛明显加重(即痛觉敏感),这一现象严重影响 着患者的术后恢复与生活质量,也困惑了麻醉医师。
谢谢观看
痛觉过敏的机制
④一氧化氮(NO)作为细胞间的“信使”有可能参与了痛觉敏感的相 关过程,因为NO是机体相关活性物质之一,即NO可能是痛觉敏感 产生的一种介导物质。 ⑤神经免疫系统也参与了痛觉敏感的形成,如阿片类药物耐受或痛 觉敏感时其脊髓、海马、额叶扣带回区域的星形胶质细胞活性增强, 胶质细胞分泌的促炎性细胞因子活性增加,通过反馈进一步激活胶 质细胞,从而促进痛觉敏感或异常性疼痛产生。
痛觉过敏的治疗及处理
②在手术切口处,浸润注射适宜剂量的长时效局麻药,可阻滞皮肤、 皮下组织的躯体感觉神经纤维,以降低应用阿片药物所致的痛觉敏 感现象,从而减轻术后疼痛。 ③鞘内注射可乐定也可抑制痛觉敏感。
痛觉过敏的治疗及处理
▪ ④选择性环氧化酶-2(COX2)抑制剂(如帕瑞昔布钠)容易透过血-脑 屏障,抑制外周和中枢COX2的表达,减少外周和中枢前列腺素 的合成,从而抑制痛觉敏感;
痛觉过敏的定义
③痛觉过敏:是一种以痛阈降低或对较弱的疼痛刺激,产生较强的 疼痛反应,以及产生特异性敏感反射为特点的异常症状。 ④阿片类药物常见副作用(或并发症)为药物耐受、依赖及成瘾,但近 些年来发现阿片类药物可产生痛觉敏感性增高,如阿片药物应用后表 现为疼痛阈值降低,即相同强度的刺激则引起更强烈的疼痛反应。 ⑤就痛觉过敏而言,该措词与痛觉本身并非相符,有被误认为过敏反 应之嫌,故笔者改用“痛觉敏感”或“痛觉异常增强”这措词。
痛觉过敏

1痛觉过敏在术后早期阶段加重疼痛经历,引起机体循环、呼吸、消化、内分泌、免疫、凝血等系统发生改变。
剧烈的疼痛甚至会造成精神创伤,使患者产生焦虑、恐惧、失眠等。
这些改变和反应与术后并发症的发生密切相关,给预后带来不良的影响。
同时,由于疼痛加重,镇痛药物的使用量增加,使镇痛药物相关的不良反应也相应增加。
2痛觉过敏的定义痛觉过敏是指外周组织损伤或炎症导致的对伤害性刺激产生过强的伤害性反应,或对非伤害性刺激产生伤害性反应。
可以表现为局部的有限区域或弥散的全身性症状。
典型的局部痛觉过敏与损伤相关,通常分为两个亚型,即原发性痛觉过敏和继发性痛觉过敏。
原发性痛觉过敏表现为对来自损伤区域的刺激产生夸大的疼痛反应,是外周敏化引起的。
继发性痛觉过敏表现为对损伤区域外的刺激也能产生加重的疼痛反应,是中枢敏化所致。
3术后痛觉过敏的原因及机制术后痛觉过敏可以发生于外科伤害性刺激(伤害性刺激导致的痛觉过敏),也可以发生于麻醉性镇痛药的效应引起的神经系统的致敏作用(药物引起的痛觉过敏)4阿片类药物诱导的痛觉过敏有3个主要的机制。
①中枢谷氨酰肽系统的活化,主要通过与阿片肽能和脑啡肽能系统稳态配对的NMDA受体发挥作用,研究表明,NMDA受体的激活在痛觉过敏的产生和维持中发挥着重要的作用②通过脊髓释放一种可引发痛觉过敏的物质强啡肽。
强啡肽最初被认为是外源性K-阿片受体激动剂,而目前认为它在某些情况下具有内源性抗阿片作用。
③通过位于延髓头端腹内侧的阿片敏感的“兴奋型”细胞调节脊髓下行易化。
5伤害性刺激引起的痛觉过敏与药物诱导的痛觉过敏在术后早期阶段并存,产生对伤害性感受和疼痛的高敏感性。
动物研究也显示,阿片类药物和伤害性刺激诱导的痛觉过敏有协同作用。
6 瑞芬太尼瑞芬太尼是新型超短效的炒阿片受体激动剂,1996年由美国FDA 批准用于临床。
其起效快,消除半衰期短,具有独特的药理学特性,20世纪70年代研究者在动物实验发现阿片类药物在治疗疼痛时也引起痛觉敏感性增加,增加先前的疼痛强度,即阿片药物引起的痛觉过敏(opioid.induce hyperalgesia,OIH)。
痛觉过敏与其发生机制的相关因子

no,l 2001,108(2):250 257.[22]H a l dar P ,B ri gh tli ng CE,H argadon B,e ta l .M epoliz um ab and exac erbati ons of refractory eosi noph ili c asthma [J ].N E ngl J M ed ,2009,360(10):973 984.[23]Nair P ,Pizzich i n iMM,K j ars gaard M,et a l .M epoliz um ab for p red n i sone dep endent ast hm a w ith s putum eos i noph ili a [J].N Engl J M ed,2009,360(10):985 993.[24] B arn es PJ .Role of GATA 3i n allerg i c d i seases [J ].Curr M ol M ed,2008,8(5):330 334.[25]F i notto S ,San cti s GT ,Lehr HA,e t a l .T reat m ent of allerg i c ai r w ay i n fl a mm ati on and hyperrespons i venes s by anti sense i nduced local b l ockade of GATA 3exp ress i on [J].J E xp M ed,2001,193(11):1247 1260.[26]Sel S ,W eg m ann M,D i cke T.E ffecti ve preven tion and t herapy ofexperi m en t al all ergic as t hm a us i ng a GATA 3 s p ecific DNA z ym e[J].J A llergy C li n I mm uno,l 2008,121(4):910 916.[27] D i ng L,Zhou X ,Yang L,et a l .Liqu i d ch ro m at ography/electros p rayi on i zation m ass s p ectro m etry m ethod f or the deter m i nation of t h e active m et ab oliteM 1of s up latast t osil ate i n hu m an p l as m a[J].B io m ed Ch ro m at ogr ,2007,21(12):1297 1302.[28] 方萍,孙秀珍,李雅莉,等.新型Th2细胞因子抑制剂甲磺司特治疗支气管哮喘的临床研究[J ].西安交通大学学报(医学版),2009,30(5):575 578.[29] M u raka m iT,Y a m anaka K,Tok i m e K,et a l .Top ical s up l atas t t os ilat e(IP D )a m eli orates Th2cyt ok i ne m ed i ated der mati tis i n cas p ase 1transgen ic m i ce by do w nregu l ating i n terleuk i n 4and i nterleuk i n 5[J].Br J Der m at o,l 2006,155(1):27 32.收稿日期:2010 09 20 修回日期:2010 11 05痛觉过敏与其发生机制的相关因子吕兴业(河北承德护理职业学院生理教研室,河北承德067000)中图分类号:R962 文献标识码:A 文章编号:1006 2084(2011)01 0030 04摘要:外周组织损伤后,在受损部位及周围组织或远处可产生各种敏感性增强的疼痛和痛觉过敏。
瑞芬太尼痛觉过敏的预防及治疗研究进展(全文)

瑞芬太尼痛觉过敏的预防及治疗研究进展(全文)瑞芬太尼痛觉过敏是指应用瑞芬太尼所导致的机体对伤害性刺激的反应增强。
瑞芬太尼是一种超短效的μ-阿片受体激动剂,由于它具有起效快、清除快、无蓄积、代谢不依赖于肝肾功能等优点,在临床工作中,广泛应用于急性、慢性疼痛的治疗及全身麻醉的维持。
但是,瑞芬太尼痛觉过敏的发生率远高于其他的阿片类镇痛药物。
由于瑞芬太尼痛觉过敏与其治疗初衷相悖,严重限制了瑞芬太尼的临床应用。
因此,对瑞芬太尼痛觉过敏的预防及治疗的研究是目前麻醉医生的研究热点之一。
1.瑞芬太尼痛觉过敏的高危因素瑞芬太尼痛觉过敏的高危因素包括:瑞芬太尼的输注剂量、手术时间及累计输注量。
我国学者在一项队列研究中发现,手术时间超过2小时的患者,瑞芬太尼痛觉过敏的发生率为32.7%;累计输注量超过30μg·kg-1时,瑞芬太尼痛觉过敏的发生率为41.8%。
临床调查发现,术中以0.2μg·kg-1·min-1瑞芬太尼临床剂量输注会导致切口周围区域机械痛阈值降低,增加患者术后对镇痛药物需求,引发痛觉过敏现象。
2.瑞芬太尼痛觉过敏的发生机制瑞芬太尼痛觉过敏的发生机制尚不清楚,目前对于瑞芬太尼痛觉过敏的机制研究,得到肯定的机制包括以下三个方面。
2.1通过NMDA受体激活谷氨酸能系统,从而导致脊髓中枢敏化研究发现瑞芬太尼能直接激活突触后膜的NMDA受体,使Ca2+通透性增加,导致大量Ca2+进入细胞,激活了胞内Ca2+依赖的PKC和CaMKII,二者被激活后从胞浆转位至胞膜磷酸化NMDA受体,并可刺激NMDA受体的不同亚型之间发生结合,使NMDA受体兴奋性增高和Ca2+内流增加,又可以进一步活化PKC,形成一种正反馈。
2.2诱导突触传递的长时程增强(long-termpotentiation,LTP)LTP是通过短暂的高频强直刺激诱发突触传递效能的持久性增大,是由突触前与突触后机制共同参与的过程,分为诱导和维持两个阶段。
瑞芬太尼引起痛觉过敏的研究进展
瑞芬太尼引起痛觉过敏的研究进展雷洪伊徐世元南方医科大学珠江医院麻醉科广州(510282)瑞芬太尼是新型超短效的μ-阿片受体激动剂,1996年由美国FDA批准用于临床。
其起效快,其消除半衰期短,具着独特的药理学特性,其化学结构中含有甲酯键,通过血浆和组织中非特异性酯酶代谢,不依赖于肝肾代谢,用于老年人和肝肾功能不良的病人无需担心苏醒延迟,为较理想的阿片类药物,在阿片类药物发展史上具有里程碑意义。
与其他阿片类药物不同,瑞芬太尼具有恒定的时量半衰期即使长时间持续输注也无蓄积现象,停药后很快代谢,提高静脉麻醉的可控性,因而被广泛的应用于各种病人的全身麻醉、术后镇痛和分娩镇痛中。
被誉为21世纪的阿片类镇痛药[1]。
上世纪70年代研究者在动物实验发现阿片类药物在治疗疼痛时也引起痛觉敏感性增加,增加先前的疼痛强度,即阿片药物引起的痛觉过敏(opioid-induce hyperalgesia OIH)[2]。
随后的临床病例和实验研究也得出类似的结果。
近年来随着瑞芬太尼在临床上的广泛应用,发现持续输注瑞芬太尼后可出现痛觉过敏。
OIH的产生与阿片类药物的药代动力学特点关系密切,瑞芬太尼起效迅速,镇痛作用消退也快,其产生较强的术后痛觉过敏。
瑞芬太尼引起的痛觉过敏正逐渐引起研究者的关注,本文论述其研究现状。
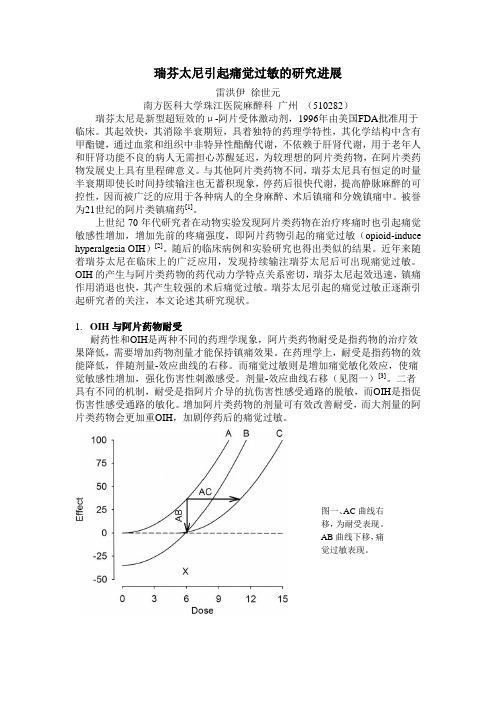
1.OIH与阿片药物耐受耐药性和OIH是两种不同的药理学现象,阿片类药物耐受是指药物的治疗效果降低,需要增加药物剂量才能保持镇痛效果。
在药理学上,耐受是指药物的效能降低,伴随剂量-效应曲线的右移。
而痛觉过敏则是增加痛觉敏化效应,使痛觉敏感性增加,强化伤害性刺激感受。
剂量-效应曲线右移(见图一)[3]。
二者具有不同的机制,耐受是指阿片介导的抗伤害性感受通路的脱敏,而OIH是指促伤害性感受通路的敏化。
增加阿片类药物的剂量可有效改善耐受,而大剂量的阿片类药物会更加重OIH,加剧停药后的痛觉过敏。
图一、AC曲线右移,为耐受表现。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
痛觉过敏的研究【关键词】过敏;疼痛外周组织炎症或神经损伤常常引起持续性自发痛(spontaneous pain)、痛觉过敏(hyperalgesia)和痛觉超敏(allodynia)等病理性疼痛。
持续性自发痛是指在不受任何外来刺激下持续发生的疼痛,痛觉超敏是指非伤害性刺激即可引起的疼痛,痛觉过敏指伤害性刺激下在受损部位及周围组织或远处可产生各种敏感性增强的疼痛或痛觉过敏区域,引起的更加强烈的疼痛。
这些病理性疼痛是外周和中枢敏感化的结果,其中脊髓敏感化起着十分重要的作用。
痛觉过敏时机体对疼痛的感觉阈值降低,轻微刺激即可引起疼痛感觉的现象。
兴奋性氨基酸(excitatory amino acids,EAAs)的释放及受体的激活所引起的细胞内信使,特别是蛋白激酶C(protein kinase C,PKC)、一氧化氮(nitric oxide,NO)等生成是此种外周损伤或伤害性刺激所引发的痛觉过敏现象的原因。
1痛觉过敏及疼痛模型1.1敏化和痛觉过敏组织损伤可以导致伤害感受系统出现两种反应,即外周敏化和中枢敏化。
外周敏化是初级传入纤维的变化引起的,表现为:对刺激反应阈值的下降、对阈上刺激反应增强、自主活动增强、感受野(刺激可诱发传入神经纤维动作电位的区域)的扩大。
伤害性刺激的输入能提高中枢神经系统疼痛传递神经元的反应,称为中枢敏化。
例如,损伤区域以外的刺激也可诱发脊髓背角疼痛反应增加。
外周敏化导致初级痛觉过敏,表现为对来自损伤区域的刺激产生夸大的疼痛反应。
中枢敏化导致次级痛觉过敏,表现为损伤区域外的刺激也能产生增加的疼痛反应。
许多研究表明:机械刺激(不是温度刺激)产生的次级痛觉过敏(次级机械性痛觉过敏)发生在损伤后,它不是由未损伤区域的初级传入纤维的敏化引起的。
1.2痛觉过敏的类型皮肤或周围组织损伤可引起各种感觉敏感性增强的疼痛称痛觉过敏。
初级痛觉过敏产生于受损部位,二级痛觉过敏产生于邻近未受损部位的组织、皮肤或远距离及深部组织。
通过进一步研究痛觉过敏的产生机理表明,初级痛觉过敏主要是由于外周受损部位神经末梢伤害性感受器不断受到刺激产生的,而二级痛觉过敏为神经中枢尤其脊髓神经元兴奋性发生改变所致。
根据测试方法及组织对不同刺激的感受,痛觉过敏分为热痛觉过敏和机械性痛觉过敏。
前者指皮肤损伤后产生持续性疼痛和痛觉过敏,原发性痛觉过敏发生在组织损伤部位,表现为热刺激的反应增强;后者指继发性痛觉过敏发生在损伤周围的正常组织,表现为对机械刺激的反应增强,如轻触刺激诱发疼痛。
在实验室里对热刺激痛觉过敏观测,热板法是研究动物对伤害性刺激反应的常用方法,但不太适用于神经损伤后的动物。
目前较常用的是Hargreaves发明的热辐射刺激的方法。
采用一定功率之辐射热,从下向上照射动物之脚底,测试其回缩潜伏期(热刺激回缩潜伏期),或采用后脚浸泡方法测试一定温度下后脚回缩潜伏期。
也有采用不同温度的热探头刺激以观测后脚回缩阈值。
对机械性痛觉过敏的观测,一般可应用软毛刷或铅笔头轻触动物的皮毛以测试动物对轻触觉刺激的反应。
目前较常用的方法是应用系列的Von Frey 针丝压迫皮肤以产生不同程度的压力(几毫克至几百克)。
1.3动物疼痛模型包括机械刺激致痛模型(小肠扩张模型,输尿管结石痛模型)、温度变化致痛模型(热辐射刺激法,甩尾发)、化学因素致痛模型(扭体实验,甲醛致痛模型,角叉菜胶炎症模型,大鼠上切牙牙髓炎疼痛模型,大鼠输尿管膀胱炎症疼痛模型)、中枢病理性疼痛模型、周围神经损伤模型(慢性缩窄性损伤,坐骨神经部分损伤,脊神经选择结扎,坐骨神经分支选择损伤)、癌痛模型(大鼠胫骨骨癌疼痛模型,小鼠骨癌疼痛模型)等。
2兴奋性氨基酸及其受体2.1兴奋性氨基酸的种类兴奋性氨基酸指L-谷氨酸(glutamic acid,GLu)、L-天冬氨酸(aspartic acid,Asp)及其人工合成的类似物,如红藻氨酸、N-甲基-D-天冬氨酸等,在中枢神经系统是兴奋性神经递质。
谷氨酸和天冬氨酸是哺乳动物中枢神经系统中最重要的两种内源性EAAs,其中Glu含量最高,尤其在大脑皮层。
脊髓中Glu含量虽明显低于脑内,但有特异性分布。
免疫组织化学研究表明,接受伤害性信息传入的的脊髓后角Ⅰ~Ⅲ板层内有大量的EAAs存在,位于脊髓后根神节中的初级传入纤维胞体内均有EAAs的分布,背根内的EAAs浓度为腹根的12~19倍。
EAAs通过相应的受体参与体内各种信号传递和调节神经元的兴奋性,发挥多种作用,参与多种生理过程包括学习、记忆和伤害性感受等。
谷氨酸不仅参与神经元的正常信息传递,还具神经毒性作用。
EAA大量释放致其受体的过度兴奋会产生兴奋性毒性而造成神经元的损伤和死亡及诸多伤害性反应。
2.2兴奋性氨基酸受体兴奋性氨基酸受体可分为离子型受体(ionotropic glutamate receptors,iGluRs)和代谢型受体(metabotropic glutamate receptors,mGluRs)。
前者包括N-甲基-D-天冬氨酸受体(N-Methyl-D-Aspartate,NMDA)、使君子酸(a-amino-3-hydroxy-5-methyl-4-isoxa-zolep-propionate,AMPA)和红藻氨酸(kainate,KA)型受体,AMPA受体和KA受体合称为非NMDA受体。
这三种受体都属于配体或化学门控离子通道。
2.2.1离子型受体:NMDA受体是离子型谷氨酸受体的一个亚型,分子结构复杂,药理学性质独特,不仅在神经系统发育过程中发挥重要的生理作用,如调节神经元的存活,调节神经元的树突、轴突结构发育及参与突触可塑性的形成等,而且对神经元回路的形成亦起着关键的作用,是学习和记忆过程中一类至关重要的受体。
NMDA受体是由NR1和NR2亚单元组成的离子通道蛋白,前者有8种剪接变异体,后者又有8个亚单位。
是电依赖性离子通道,对Ca2+高度通透。
NMDA受体激活的一个重要作用是钙离子内流进入突触后膜,进而引发细胞内的一系列代谢变化而导致热痛觉过敏。
AMPA受体被激活后,可使钠离子内流和钾离子外流,对钙离子通透性影响不大,这一变化与许多兴奋性突触中的快速去极化作用有关。
2.2.2代谢型受体:代谢型受体(mGluRs)则是与G-蛋白耦联,调节细胞内的第二信使,有8个亚型即mGluR1-8,根据其对激动剂的敏感性差异分为3组:mGluRⅠ包括mGluR1和mGluR5主要通过激活细胞内磷酸脂酶C,从而使磷酸肌醇分解成三磷酸肌醇(inositol 1,4,5-triphosphate,IP3)和二酰甘油(Diacylglycerol,DAG);mGluRⅡ(mGluR2和mGluR3)以及mGluRⅢ(mGluR4,mGluR6,mGluR7,mGluR8)两者均抑制腺苷酸环化酶,而使cAMP合成减少。
机械性痛觉过敏需要AMPA与代谢型受体的共同激活。
然而Guan等[1]研究表明,炎性痛觉过敏大鼠延髓吻段腹内侧区的EAAs的神经传递是按时间依赖性增加的。
EAAs受体激动剂超过一定剂量痛觉过敏反而下降。
Fujita等[2]研究表明,在疏松结扎大鼠下牙槽神经的痛觉过敏模型上,三叉神经核尾侧EAAs水平升高,牙齿触痛敏感性增加。
Schmidt等[3]研究表明,NMDA受体拮抗剂地卓西平马来酸盐(dizocilpine maleate,MK-801)可降低痛觉过敏,但可增加大鼠脑脊液里EAAs的含量,后者可被鸟嘌呤核苷所反转。
Yan等[4]研究表明,维持脊髓水平的EAAs和抑制性氨基酸(inhibitory amino acids ,IAAs)的平衡是防止慢性持续性疼痛的一个新线索。
Wong等[5]研究表明,抑制NMDA受体可抑制EAAs的兴奋作用,降低鞘内注射百日咳毒素大鼠的吗啡诱导的抗伤害作用。
3PKC与伤害性信息的传递密切相关PKC广泛存在于组织细胞,为一单体蛋白多肽链,以无活性形式存在于细胞质。
目前发现哺乳类动物至少有7种亚型,在脑及脊髓中以γ亚型最多。
PKC具有同功酶及分布广泛的特性,使不同的第一信使都可启动该信号转导途径。
因此,这条信号转导途径在各种生命活动中发挥广泛而重要的作用。
大鼠足底注射佛氏佐剂可引起脊神经元PKC上调并促进伤害性反应。
鞘内注射PKC抑制剂双吲哚马来酰胺(bisindoylmaleimideⅠ,BIM/GF109203X),可减少足底注射福尔马林引起的搔抓反应。
慢性酒精饮食喂养大鼠引起的痛觉过敏可被鞘内注射PKC抑制剂所减弱。
结扎坐骨神经引起热痛觉过敏其PKC水平明显增高。
鞘内注射灯盏花素乙(chelerythrin,CH)、1-(5-异喹啉磺酰基)-2-甲基哌嗪[1-(5-isoquinolinesulfonyl)2-methylpiperazine dihydrochloride,H-7]等PKC抑制剂可以减弱足底注射蜂毒引起的搔抓反应及对侧热痛觉过敏。
PKC兴奋剂对酞酸(terephthalic acid,TPA)、佛波醇脂(phorbol-12- myristate-13- acetate,PMA)可增强机械性痛觉过敏。
鞘内应用神经节苷脂(monosialoganglioside,GM1),一种PKC 抑制剂,降低伤害性痛觉行为。
以上事实表明,PKC参与了痛觉过敏的形成。
然而Wu等[6]研究表明,灯盏花素乙(chelerythrine,CH)可降低鞘内注射百日咳毒素大鼠的吗啡诱导的抗伤害作用及兴奋性氨基酸的水平。
Oe等[7]研究表明,激动慢性疼痛或痛觉过敏大鼠脊髓里PKC可减弱该动物模型吗啡诱导的奖赏效应(rewarding effect,亦称“正强化效应”,指在反应后出现的能够增强那一反应的效应)。
Sweitzer等[8]研究表明,PKCε、γ(PKC亚型)在吗啡诱导的抗伤害作用大鼠脊髓里有明显的调节作用,类似疼痛病人停用吗啡后表现出对刺激敏感性增强或夸大痛觉反应的现象。
Lee等[9]研究表明,选择性地阻断神经末梢代谢性谷氨酸受体5(metabotropic glutamate receptor 5,mGluR5)、PKCε、γ受体,可以为慢性肌肉疼痛如颞颌关节紊乱症(disorders of temporomandibular joint)的治疗提供新思路。
Chiu等[10]研究表明,大鼠脊髓在NMDA调控下由可卡因和安非他明调节转录肽(cocaine and amphetamine regulated transcript peptide,CARTp) 产生的伤害性反应增强是通过PKC和蛋白激酶A(protein kinase,PKA)信号通道完成的。
4NO调控着热痛觉过敏NO在神经组织中是一种新型的生物信使分子。
