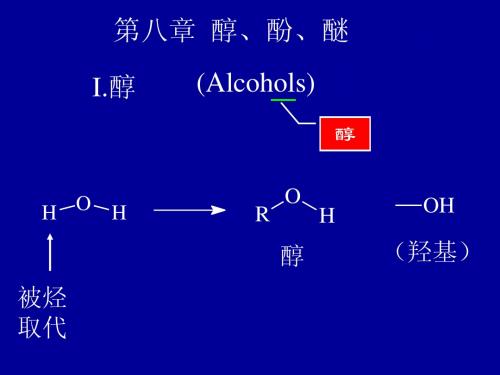
第八章醇酚醚
合集下载
08第八章醇酚醚-chy
1.2.1.2 氢键对溶解度的影响
O H H
R OH
相似
★ C3 以下无限溶解
R O H R O H R O H
形成氢键
n – 丁醇 n – 戊醇
8g / 100g 水 2g / 100g 水
∵ 随烷基的增大, 占的比例小
相似相溶原理
1.3 醇的反应 极性键的断裂
H R C H O H
酸性、酯化
78.5 ℃
-44.5 ℃ 256 ℃
十三烷
184
235.4 ℃
1. 醇比烷 bp 高的多
2. 随 M 的增大,Δbp → 0
bp
ROH RH
C 原子数
bp
CH3CH2CH2CH2OH
CH3 CH3 CH3 CH3 CH CH2 CH3 C CH3
C2H5OH CH2 OH CH2 OH CH2 OH CH CH2 OH OH
H H C OH OH
H 4 IO
HCOH + H O + NH3 + H COOH + CO2 2
断开的地方加羟基
H HO C NH2 OH
∵
HO C O
OH
脱H2O
HC O H + H2O
HC O + NH3 OH
CO2 + H2O
II. 酚 (Phenols)
OH
CH2OH
酚
醇
1 结构、命名(书中例子 p141) 、性质 1 命名:
CH3 CH3-C-CH2+OH2 CH3
-H2O
CH3 CH3-C +CH2 ( 。 +) 1 C CH3
CH3 CH3-C +CH2 CH3 。 1 C+
第八章醇酚醚

C-O键断裂 取代或消除
碱性
孤对电子
1. 氧孤对电子导致的化学性质——Lewis碱
①溶于强酸
ROH 浓H2SO4 ROH H
应用: 钼羊盐
稀释或受热
ROH
▪除去烷烃或卤代烃中的少量醇 ▪区分醇与烷烃、卤代烃
②与金属离子的络合
MgCl2•6ROH CaCl2•4ROH
结晶醇 (溶于水不溶于有机溶剂)
第八章:醇、酚、醚
一. 醇的分类与命名
1. 分类
①按羟基所连碳原子的类型分:
10 伯醇( RCH2OH ): CH3CH2OH
20 仲醇( R CH OH ): CH 3CHCH 2CH 3
OH
R'
OH
R
30 叔醇( R' C OH ):
R''
(CH3)3COH
②按羟基所连的烃基分:
饱和醇:
CH3CH2OH (CH3)3COH
不饱和醇:CH2=CHCH2OH
CH3C≡ CCH2OH
芳香醇:
CH OH 2
OH OH
CH OH 2
③按羟基的数目分:
一元醇C:H3CH2CH2OH
OH
二元醇:H2C CH CH3 OH OH
OH OH
三元醇:H2C CH CH 2 OH OH OH
2. 命名
①普通命名法
CH3CH2CH2OH 正丙醇
R C OH
*源自格式试剂
H3C C O + R MgX 干醚
H
H3C C OMgX H R
H2O
*源自羰基碳
R
*源自格式试剂
H
C CH3 OH
3. 醛、酮还原制醇
8章-醇酚醚

H2O + Na C2H5OH + Na
反应随R基团的增大而减慢
NaOH + 1/2 H2 C2H5ONa + 1/2 H2
HOH > CH3OH >1o醇 > 2o 醇 > 3o醇
2. 与氢卤酸的反应,断裂醇分子中的 C-OH 键
R-OH
A 活性
HX
RX + H2O
HI > HBr > HCl 这主要是依卤原子的原子半径所致,I 是最大,依次减小,
第八章 醇、 酚、 醚
1
醇 酚 醚可看成是水分子中的 H 被烷基,芳基取代的产物
如下图所示
R H O H Ar 2R
ROH ArOH ROR
醇 酚 醚
8.1
醇
醇的代表物,醇的分类及命名
醇的制备
醇的物理性质 醇的化学性质
硫醇(十二章部分内容)
3
一. 醇的代表物,分类及命名
CH3CH2OH
乙醇
CH3OH
OH OH OH
+ HO NO2 - 3 H2O HC H2C
H2SO4
三硝酸甘油酯是一种炸药,也是人药,治疗心肌病 从上面的例子中可以看出,醇出H,酸出OH。
例 2 烷基磷酸酯
HO ROH + HO P HO RO O HO P HO RO O + RO P HO RO O + RO P RO O
因此,实验室不能用氯化钙干燥醇类化合物。
四. 醇的化学性质
由于电负性的不同,如 O: 3.5; C: 2.5; H: 2.1
因而,在醇分子中,C-O 和 O-H 两种键均有极性,可发 生两种反应形式
【课件】第八章醇酚醚10-11学年1PPT

酸性序: H2O > R-OH > HC≡CH > NH3 > R-H 碱性序:OH- < RO- < HC≡C- < NH2- < R-
Li、K等碱金属和Mg、Ca、Ba等碱土金属也能和 C1 ~ C8的醇类反应,生成相应的醇的金属化合物
问题:比较CH3CH2CH2OH、
(CH3)2CHOH及(CH3)3COH与 Na反应的活性以及相应醇钠的 碱性大小
问题:氯化钙能用作干燥剂,是因为它能与水形成 CaCl2 ·6H2O。能否用氯化钙来干燥醇类?
某些醇具有特殊的
香味,多用来配制 香精。如苯乙醇具 有玫瑰香气
8.1.4 醇的化学性质
氧化反应
H CC H
形成氢键 形成金羊盐
酸性(被金属取代)
O
H
取代反应 脱水反应
1. 与活泼金属反应——似水
H—O-H + Na ——> Na OH + H2 (反应激烈) R—O-H + Na ——> RO Na + H2 (反应和缓)
2、由于醇分子与水分子之间能形成氢键,三个碳的醇和叔丁醇 能与水混溶。
从丁醇开始,在水中的溶解度随相对分子量的增加而减小。
R
O HH O
H
R
O HH O
H
R
O HH O
H
醇与水之间形成的氢键
3、醇合物 醇与水的另一相似之处:能形成象水合物那 样的醇合物,称为结晶醇。如:
MgCl2 ·6CH3OH
CaCl2 ·4CH3OH
或: Al2O3,250 ℃
+ H2O
Lewis酸如Al2O3,也能催化醇的脱水反应。
醇的脱水是质子化的醇作为脱水物的单分子消除反应(E1)。
Li、K等碱金属和Mg、Ca、Ba等碱土金属也能和 C1 ~ C8的醇类反应,生成相应的醇的金属化合物
问题:比较CH3CH2CH2OH、
(CH3)2CHOH及(CH3)3COH与 Na反应的活性以及相应醇钠的 碱性大小
问题:氯化钙能用作干燥剂,是因为它能与水形成 CaCl2 ·6H2O。能否用氯化钙来干燥醇类?
某些醇具有特殊的
香味,多用来配制 香精。如苯乙醇具 有玫瑰香气
8.1.4 醇的化学性质
氧化反应
H CC H
形成氢键 形成金羊盐
酸性(被金属取代)
O
H
取代反应 脱水反应
1. 与活泼金属反应——似水
H—O-H + Na ——> Na OH + H2 (反应激烈) R—O-H + Na ——> RO Na + H2 (反应和缓)
2、由于醇分子与水分子之间能形成氢键,三个碳的醇和叔丁醇 能与水混溶。
从丁醇开始,在水中的溶解度随相对分子量的增加而减小。
R
O HH O
H
R
O HH O
H
R
O HH O
H
醇与水之间形成的氢键
3、醇合物 醇与水的另一相似之处:能形成象水合物那 样的醇合物,称为结晶醇。如:
MgCl2 ·6CH3OH
CaCl2 ·4CH3OH
或: Al2O3,250 ℃
+ H2O
Lewis酸如Al2O3,也能催化醇的脱水反应。
醇的脱水是质子化的醇作为脱水物的单分子消除反应(E1)。
高教版 有机化学 第八章 醇 酚 醚

C2H5ONa+H2
(C 2H 5O)2Mg+H 2
6CH 3CHCH 3 + 2 Al OH
[HgCl2或 AlCl3]
[(CH 3)2CHO] 3Al + 3 H 2 异丙 醇 铝
7
说明 R—OH H—OH 1)醇与金属反应比水与金属反应缓和一些。 2)醇(如甲醇的pKa=16) 的酸性比水的酸性 (pKa=15.4)稍弱,故醇不能使石蕊变红。和氢氧化钠 的作用也很难,是一个可逆反应。
OH OH Ph C C CH3 Ph CH3 Ph CH3 C C Ph CH3
+ H3O
Ph CH3 C C
O
Ph CH3
+ H3O O
25
O + H3O OH OH
Ph Ph OH OH + H 3O
O Ph Ph
26
5 欧芬脑尔(Oppenauer, R.V.)氧化
OH CH R1 R2 Al[OC(CH3)3]3 CH3COCH3 R1 O C OH
36
酚的命名
OH OH OH
Me CH3
间甲酚
CH3
C(CH3)3
对甲酚
3-甲基-4-叔丁基苯酚
O2N HO
OH
Cl H3CO
OH
HO
CO2H 对羟基苯甲酸
4-硝基间苯二酚 or 4-硝基-1,3-苯二酚
6-甲氧基-7-氯-2-萘酚 or 6-甲氧基-7-氯--萘酚
or 4-羟基苯甲酸
37
二、酚的物理性质
13
3)、与SOCl2、PCl3、PBr3、PCl5的反应
SOCl2
RCl + SO2 + HCl RX + H3PO3 (Br2 / P, I2 / P) RCl + POCl3
第八章醇、酚、醚消除反应

甲醇的分子结构
H
::
H H
C O
sp3
H
二、醇的物理性质和光学性质
1.物理性质 低级一元醇:C1-C4无色流动液体,比水轻。
C5-C11油状液体, C12以上无色蜡状固体。 甲醇、乙醇、丙醇都带有酒味. 丁醇开始到十一醇有不愉快的气味. 二元醇和多元醇:是具有甜味液体,故乙二醇俗
称甘醇,丙三醇俗称甘油.
[O]
[O]
1°ROH
RCHO
RCOOH
[O]
2°ROH
RCOR’
等。
3°ROH 因无 α - H,难以被氧化,若在强烈条件下氧化,碳链将断裂。
CH3CH2CH2CH2OH K2Cr2O7 / dil. H2SO4 CH3CH2CH2CHO (50%)
CH3CH(CH2)3CH3 OH
K2Cr2O7 / dil. H2SO4
结晶醇: 低级醇和一些无机盐类(MgCl2,CaCl2,CuSO4等) 形成结晶状的分子化合物, 如:MgCl2.6CH3OH,CaCl2.4C2H5OH等。 结晶醇不溶于有机溶剂而溶于水,可使醇与 其他有机物分开或从反应物中除去醇类 如:乙醚中的少量乙醇,加入 CaCl2便可除去.
2.光谱性质 IR:-OH未缔合的3640-3610cm-1有尖峰;
可用来区别一元醇和邻二醇或邻多醇ch2ohch2ohcuoh2ch2och2ocu可溶性洛合物降兰色h2o2与高碘酸或四乙酸铅反应二醇可被高碘酸四乙酸铅氧化生成相应的羰基化合物反应是定量的每分裂一组邻二醇结构消耗一个分子hio4因此根据hio4的消耗量可以推知分子中有几组邻二醇结构可用agno3来检测邻二羟基结构rchohrchohio4rchorchoiooohohrchorchoio3h2o白agio3io3agno3四乙酸铅作氧化剂rchchrch3coo4pbohohrchhcrch3coo2pbch3coohoo被hio4氧化断键除邻二醇外还有羰基醇
第八章 醇酚醚1

H H O H R O H H O H R O H H O
醇与水分子间氢键缔合
自正丁醇开始,随着烃基的增大,在水中的溶解度降 低,癸醇以上的醇几乎不溶于水。
21
多元醇分子中含有两个以上的羟基,可以形成更 多的氢键,所以分子中所含羟基越多,沸点越高, 在水中的溶解度也越大。
例:乙二醇 沸点:197℃ 甘油(丙三醇) 沸点:290℃。 低级醇能和一些无机盐类(MgCl2,CaCl2,CuSO4等) 形成结晶状的分子化合物,称为结晶醇。 CaCl2· 4CH3OH CaCl2· 4C2H5O H MgCl2· 6CH3OH MgCl2· 6C2H5OH
3o 醇 、烯丙醇、苄醇 室温下反应液立即混浊、分层; 2o醇 1o醇 2 ~ 5 min. 反应液混浊、分层; 加热,反应液混浊、分层;
31
Lucas试剂(无水ZnCl2与浓HCl配制的溶液)鉴别六 个碳以下的伯、仲、叔醇(烯丙式醇)
现象
R3C-OH 烯丙式醇 R2CHOH R3C-Cl Lucas试剂 立即浑浊
CH2Cl2 + H2O CH3Cl 225C 加压 OH HC OH OH H2O 165C 加压 OH H2C OH H2O O H C H O H C OH
9
(三)命名:
1.普通命名法:
适用于结构简单的醇,在醇前加烃基名称,称为“某醇”
CH3CH2OH CH3 2CHOH CH3 3COH
22
醇类物质不能用氯化钙、氯化镁做干燥剂。
(二)光谱性质
IR:-OH 未缔合时在3650-3500 cm-1有尖峰
缔合时在3500-3200 cm-1宽峰
C-O 吸收峰在1260-1000 cm-1 (1060-1030 cm-1
醇与水分子间氢键缔合
自正丁醇开始,随着烃基的增大,在水中的溶解度降 低,癸醇以上的醇几乎不溶于水。
21
多元醇分子中含有两个以上的羟基,可以形成更 多的氢键,所以分子中所含羟基越多,沸点越高, 在水中的溶解度也越大。
例:乙二醇 沸点:197℃ 甘油(丙三醇) 沸点:290℃。 低级醇能和一些无机盐类(MgCl2,CaCl2,CuSO4等) 形成结晶状的分子化合物,称为结晶醇。 CaCl2· 4CH3OH CaCl2· 4C2H5O H MgCl2· 6CH3OH MgCl2· 6C2H5OH
3o 醇 、烯丙醇、苄醇 室温下反应液立即混浊、分层; 2o醇 1o醇 2 ~ 5 min. 反应液混浊、分层; 加热,反应液混浊、分层;
31
Lucas试剂(无水ZnCl2与浓HCl配制的溶液)鉴别六 个碳以下的伯、仲、叔醇(烯丙式醇)
现象
R3C-OH 烯丙式醇 R2CHOH R3C-Cl Lucas试剂 立即浑浊
CH2Cl2 + H2O CH3Cl 225C 加压 OH HC OH OH H2O 165C 加压 OH H2C OH H2O O H C H O H C OH
9
(三)命名:
1.普通命名法:
适用于结构简单的醇,在醇前加烃基名称,称为“某醇”
CH3CH2OH CH3 2CHOH CH3 3COH
22
醇类物质不能用氯化钙、氯化镁做干燥剂。
(二)光谱性质
IR:-OH 未缔合时在3650-3500 cm-1有尖峰
缔合时在3500-3200 cm-1宽峰
C-O 吸收峰在1260-1000 cm-1 (1060-1030 cm-1
有机化学第8章 醇、酚、醚

8.11.3过氧化物的生成
醚对氧化剂比较稳定,但是,遇空气长期接触,却能被空气中 的氧逐渐氧化生成过氧化物。一般认为氧化是首先发生在 -C-H键上,然后再转变成结构更为复杂的过氧化物。
■另外,氧上电子云密度降低,使O-H键极性增加,酚羟基中H的
酸性增加。 共轭的结果使得:
1.酚羟基氢易于以质子的形式离去使酚显酸性;
2.苯环上的电子云密度增高易于进行亲电取代反应。
8.5.2命名
8.6酚的物理性质(自学)
8.7酚的化学性质
酚中羟基与苯环形成大的p—π共轭体系,由于氧的给电子共轭
醚键对强酸不稳定,遇强酸会发生醚键断裂,但HCl、HBr断裂
较难,需要催化剂;使醚键断裂最有效的试剂是浓的氢碘酸(HI)。 醚键的断裂是醚在HI中,先形成洋盐,然后,I-再作为亲核试 剂进攻-C而发生醚键断裂。 醚键断裂的顺序:30烷基>20烷基>10烷基>芳烃基
I-有两种进攻方向,但从电子效应和空间效应两方面看,都是
I-进攻甲基碳有利。所以,在混醚断键时,总是先从碳链较 小的一端断裂。如果 HI过量,则生成的醇可进一步生成碘代烃。
芳香混醚与浓HI作用时,总是断裂烷氧键,生成酚和碘代烷。
总结:
◆反应活性:HI>HBr>HCl ◆伯烷基醚按SN2机制断裂, ◆叔烷基醚按SN1机制断裂, ◆芳基烷基醚总是烷氧键断裂
碱性溶液中与烃基化剂(硫酸二甲酯、卤代烃等)作用生成。
羧酸与醇在酸催化下可以成酯,由于酚羟基中的氧与苯环发 生了p_π共轭其反应活性减小,与羧酸难于成酯。但可与活 性较大的酰基化试剂酰氯或酸酐成酯。
8.7.2芳环上的亲电取代反应
8.7.2.1卤代反应
反应很灵敏,很稀的苯酚溶液就能与溴水生成沉 淀。故此反应可用作苯酚的鉴别和定量测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
己酮)氧化成酮,丙酮被还原成异丙醇,这一反应称为欧芬脑尔 (Oppenauer,R.V)氧化法,其逆反应称为麦尔外因-彭道夫(MeerweinPonndorf)还原。
O R2CHOH + CH3CCH3
Al(OCMe3)3 欧芬脑尔氧化法
麦尔外因-彭道夫还原
OH R2CH=O + CH3CHCH3
反应方向的控制
减压蒸餾
-H2SO4
CH3OSO2OCH3 硫酸二甲酯
C2H5OH NaOH
甲基化反应
C2H5OCH3 + CH3OSO3Na + H2O
2oROH , 3oROH在硫酸作用下消除。
五 氧化反应
ROH
氧化剂 反应条件
产物
氧化剂
氧化剂
RCH2OH
RCHO
RCOOH
O
氧化剂
R2CHOH
RC R
O
H+
氧化剂
反应机理
C OH C OH
OH
CO
OH
C O I O-
O
OH
HO HO
I
OH O-
O
-2H2O
I = +7
-H2O
C=O + C=O + IO3-
I = +5
邻二醇被高碘酸氧化的分析
OH OH
OH
OH OH
OH
OH OH
?
OH
(CH3)3C
OH
OH
OH
-羟基酸、 -二酮、 -氨基酮、1-氨基2-羟基化合物也能发生类似的反应。
100%
Br
3oROH 、大多数2oROH和空阻大 的 1oROH按SN1机理进行反应。
2 经醇与磺酰氯反应为中间阶段来制卤代烃
(1)磺酰氯的制备
C3H
SO 2OH +PC5l C3H
SO 2Cl+P O3 C +lHC
对甲苯磺酸(TSOH)
对甲苯磺酰氯(TSCl)
(2)磺酰氯的应用
H
H
C
CH3CH2CH2
HBr (0oC)
P + I2 HI (0oC)
四 成酯反应
酯:醇与有机酸或含氧的无机酸的失水产物。
1 醇与硝酸、亚硝酸的反应
H +
C H 3 O H + H O N O 2 C H 3 O N O 2 + H 2 O 硝酸甲酯
C H 3 O H + H O N O
C H 3 O N O + H 2 O 亚硝酸甲酯
低级醇与一些无机盐形成的结晶状分子化合物称 之为结晶醇,也称之为醇化物。
MgCl2• 6CH3OH
CaCl2 • 4C2H5OH
注意
许多无机 盐不能作 为醇的干
燥剂。
结晶醇不溶于有 机溶剂而溶于水。 利用这一性质, 可以使醇和其它 有机溶剂分开, 或从反应物中除 去醇类。
工业乙醚常杂
有少量乙醇, 加入CaCl2可 使醇从乙醚中
亲核试剂 碱性试剂
1 2C2H5OH + 2Na
2C2H5ONa + H2
C2H5OH + NaOH
C2H5ONa +H2O
苯乙醇水 =74.118.57.4(64.9)
2 2(CH3)3COH + 2K
2(CH3)3COK + H2
强碱性试剂 亲核性相对弱一些
3 2C2H5OH + Mg (C2H5O)2Mg + H2O
R2COH
R2C=CH2
RC R + HCOOH
CH3
氧化反应一般都是在溶剂中进行的。
醇各类氧化反应的总结-1
氧化剂 KMnO4 冷,稀,中性, 酸性,碱性
一级醇 酸
二级醇
三级醇
特点和说明
酮
小分子酸,酮
K2Cr2O7
40~50%H2SO4
稀 HNO3
浓
醛酸
酮
小分子酸,酮 酸性条件
醛酸
酸
酮
小分子酸,酮 酸性条件
(2)反应方程式
3ROH + PBr3
3RBr + H3PO4
5ROH + PX5
RX + HX + POX3
(3)适用范围
主要应用于1oROH, 2oROH 转化为卤代烷。3oROH很少使用。
(4)反应机理
1oROH (SN2)
Br C3H C2H OH+ P
Br
SN2
Br
HH
Br- +
C
+ O
(欧芬脑尔氧化) 合付反应,不用。) 酮
三级醇 特点和说明
中性 不饱和键不受影响 弱碱,反应条件温和, 不饱和键不受影响。
稀酸,反应条件温和, 不饱和键不受影响。 酸性 (H3PO4) , 其它基团不受影响。
碱性,可逆,分子 内双键不受影响。
欧芬脑尔氧化法的讨论
在三级丁醇铝或异丙醇铝的存在下,二级醇被丙酮(或甲乙酮,环
(C2H5O)2Mg + H2 乙醇镁
2C2H5OH + MgO
乙醇镁可用来除去乙醇中的少量水,以制备无水乙醇 这两个反应在同一体系中完成。
4 6(CH3)2CHOH + 2Al
HgCl2 or AlCl3
2 [(CH3)2CHO]3Al + 3H2
用于氧化还原
醇的酸性强弱的分析
液相测定酸性强弱
该反应的特点是: 反应条件温和,
R O H+S O C l2
b.p. 79oC
R C l +S O 2 +H C l
反应速率快,产 率高,没有副产 Nhomakorabea物。
(2) 反应机理 SNi
醇制卤代烃的方法选择
1oROH 2oROH 3oROH
SOCl2 浓HCl (0oC)
PBr3 or NaBr + H2SO4
第二节 醇的物理性质
一 物理性质 醇分子之间能形成氢键。
固态,缔合较为牢固。液态,形成氢 键和氢键的解离均存在。气态或在非极性溶 剂的稀溶液中,醇分子可以单独存在。
由于醇分子之间能形成氢键,沸点较相 应分子量的烷烃高。
由于醇分子与水分子之间能形成氢键, 三个碳的醇和叔丁醇能与水混溶。
醇化物(结晶醇)
丙三醇(甘油)
醇的结构特点
1 大部分醇的羟基与sp3杂化的碳原子相连。烯 醇中的羟基与sp2杂化的碳原子相连。
2 根据甲醇分子的键长、键角分析,醇羟基中 的氧是sp3杂化。
3 醇的偶极矩在2D左右。甲醇的偶极矩为 u=1.71D。
4 一般地说,相邻两个碳上最大的两个基团处 于对交叉最稳定,但当这两个基团可能以氢 键缔合时,则这两个基团处于邻交叉成为优 势构象。
CH2–O –NO2 CH2–O –NO2
乙二醇二硝酸酯
C H 2–O –N O 2
CH–O –NO2
C H 2–O –N O 2 甘油三硝酸酯 (硝化甘油)
2 磷酸酯的制备
Cl 3C4H9OH + Cl P=O
Cl
CH 2OH
O
CHOH+ HO P OH
CH 2OH
OH
O
CH 2 O P O
Ca++
邻二醇在酸的作用下发生重排生 成酮的反应称为嚬哪醇重排。
(2) 反应式
(CH3)2C C(C3H )2 OHOH 嚬哪醇
H2SO4 或 HCl
(CH3)3C CC3H O
嚬哪酮
Al2O3, 420-470oC (气相)
CH2=C C=C H2 CH3CH3
(3) 反应机理
(C 6H5)2C CH6H C 5 H+
CH3O
CH3
C6H5
Cl
V相对
500
16
12
1
0.7
如迁移基团是烷基,则3o > 2o > 1o
(4) 实例
OH CH 3 HO
CH 3
CH 3
H+
CH 3
O
OH CH 3 CH 3
HO
H3C OH HO
CH 3
H+
CH3
CH3C
O
第六节 醇的制备
一 实验室制备 二 工业制备简介
一 实验室制备
P
Br
H Br
CH3
SN2
BrCH2CH3
+
HO P Br Br
2oROH , 3oROH (SN1)
(C H3)3C
Br OH + P
Br
BrSN2
H3C CH3
Br- +
C
+ O
P
Br
H Br
CH3
SN1 (CH3)3C+ + HOPBr2
Br -
(CH3)3CBr
4 与氯化亚砜的反应
(1) 反应方程式
沉淀下来。
第三节 醇的反应
一 醇反应性的总分析 二 醇羟基中氢的反应 三 碳氧键的断裂,羟基被卤原子取代 四 成酯反应 五 氧化反应 六 脱氢反应 七 多元醇的特殊反应
一 醇反应性的总分析
氧化反应
H CC H
脱 水 反 应
形成氢键 形成金羊盐
酸性(被金属取代)
OH
取 代 反 应
二 醇羟基中氢的反应
2 邻二醇被四醋酸铅氧化
C6H 5OCH 2CHO H
Pb(OAc)4
反
CH 2OH
C 6H 6
应
O R2CHOH + CH3CCH3
Al(OCMe3)3 欧芬脑尔氧化法
麦尔外因-彭道夫还原
OH R2CH=O + CH3CHCH3
反应方向的控制
减压蒸餾
-H2SO4
CH3OSO2OCH3 硫酸二甲酯
C2H5OH NaOH
甲基化反应
C2H5OCH3 + CH3OSO3Na + H2O
2oROH , 3oROH在硫酸作用下消除。
五 氧化反应
ROH
氧化剂 反应条件
产物
氧化剂
氧化剂
RCH2OH
RCHO
RCOOH
O
氧化剂
R2CHOH
RC R
O
H+
氧化剂
反应机理
C OH C OH
OH
CO
OH
C O I O-
O
OH
HO HO
I
OH O-
O
-2H2O
I = +7
-H2O
C=O + C=O + IO3-
I = +5
邻二醇被高碘酸氧化的分析
OH OH
OH
OH OH
OH
OH OH
?
OH
(CH3)3C
OH
OH
OH
-羟基酸、 -二酮、 -氨基酮、1-氨基2-羟基化合物也能发生类似的反应。
100%
Br
3oROH 、大多数2oROH和空阻大 的 1oROH按SN1机理进行反应。
2 经醇与磺酰氯反应为中间阶段来制卤代烃
(1)磺酰氯的制备
C3H
SO 2OH +PC5l C3H
SO 2Cl+P O3 C +lHC
对甲苯磺酸(TSOH)
对甲苯磺酰氯(TSCl)
(2)磺酰氯的应用
H
H
C
CH3CH2CH2
HBr (0oC)
P + I2 HI (0oC)
四 成酯反应
酯:醇与有机酸或含氧的无机酸的失水产物。
1 醇与硝酸、亚硝酸的反应
H +
C H 3 O H + H O N O 2 C H 3 O N O 2 + H 2 O 硝酸甲酯
C H 3 O H + H O N O
C H 3 O N O + H 2 O 亚硝酸甲酯
低级醇与一些无机盐形成的结晶状分子化合物称 之为结晶醇,也称之为醇化物。
MgCl2• 6CH3OH
CaCl2 • 4C2H5OH
注意
许多无机 盐不能作 为醇的干
燥剂。
结晶醇不溶于有 机溶剂而溶于水。 利用这一性质, 可以使醇和其它 有机溶剂分开, 或从反应物中除 去醇类。
工业乙醚常杂
有少量乙醇, 加入CaCl2可 使醇从乙醚中
亲核试剂 碱性试剂
1 2C2H5OH + 2Na
2C2H5ONa + H2
C2H5OH + NaOH
C2H5ONa +H2O
苯乙醇水 =74.118.57.4(64.9)
2 2(CH3)3COH + 2K
2(CH3)3COK + H2
强碱性试剂 亲核性相对弱一些
3 2C2H5OH + Mg (C2H5O)2Mg + H2O
R2COH
R2C=CH2
RC R + HCOOH
CH3
氧化反应一般都是在溶剂中进行的。
醇各类氧化反应的总结-1
氧化剂 KMnO4 冷,稀,中性, 酸性,碱性
一级醇 酸
二级醇
三级醇
特点和说明
酮
小分子酸,酮
K2Cr2O7
40~50%H2SO4
稀 HNO3
浓
醛酸
酮
小分子酸,酮 酸性条件
醛酸
酸
酮
小分子酸,酮 酸性条件
(2)反应方程式
3ROH + PBr3
3RBr + H3PO4
5ROH + PX5
RX + HX + POX3
(3)适用范围
主要应用于1oROH, 2oROH 转化为卤代烷。3oROH很少使用。
(4)反应机理
1oROH (SN2)
Br C3H C2H OH+ P
Br
SN2
Br
HH
Br- +
C
+ O
(欧芬脑尔氧化) 合付反应,不用。) 酮
三级醇 特点和说明
中性 不饱和键不受影响 弱碱,反应条件温和, 不饱和键不受影响。
稀酸,反应条件温和, 不饱和键不受影响。 酸性 (H3PO4) , 其它基团不受影响。
碱性,可逆,分子 内双键不受影响。
欧芬脑尔氧化法的讨论
在三级丁醇铝或异丙醇铝的存在下,二级醇被丙酮(或甲乙酮,环
(C2H5O)2Mg + H2 乙醇镁
2C2H5OH + MgO
乙醇镁可用来除去乙醇中的少量水,以制备无水乙醇 这两个反应在同一体系中完成。
4 6(CH3)2CHOH + 2Al
HgCl2 or AlCl3
2 [(CH3)2CHO]3Al + 3H2
用于氧化还原
醇的酸性强弱的分析
液相测定酸性强弱
该反应的特点是: 反应条件温和,
R O H+S O C l2
b.p. 79oC
R C l +S O 2 +H C l
反应速率快,产 率高,没有副产 Nhomakorabea物。
(2) 反应机理 SNi
醇制卤代烃的方法选择
1oROH 2oROH 3oROH
SOCl2 浓HCl (0oC)
PBr3 or NaBr + H2SO4
第二节 醇的物理性质
一 物理性质 醇分子之间能形成氢键。
固态,缔合较为牢固。液态,形成氢 键和氢键的解离均存在。气态或在非极性溶 剂的稀溶液中,醇分子可以单独存在。
由于醇分子之间能形成氢键,沸点较相 应分子量的烷烃高。
由于醇分子与水分子之间能形成氢键, 三个碳的醇和叔丁醇能与水混溶。
醇化物(结晶醇)
丙三醇(甘油)
醇的结构特点
1 大部分醇的羟基与sp3杂化的碳原子相连。烯 醇中的羟基与sp2杂化的碳原子相连。
2 根据甲醇分子的键长、键角分析,醇羟基中 的氧是sp3杂化。
3 醇的偶极矩在2D左右。甲醇的偶极矩为 u=1.71D。
4 一般地说,相邻两个碳上最大的两个基团处 于对交叉最稳定,但当这两个基团可能以氢 键缔合时,则这两个基团处于邻交叉成为优 势构象。
CH2–O –NO2 CH2–O –NO2
乙二醇二硝酸酯
C H 2–O –N O 2
CH–O –NO2
C H 2–O –N O 2 甘油三硝酸酯 (硝化甘油)
2 磷酸酯的制备
Cl 3C4H9OH + Cl P=O
Cl
CH 2OH
O
CHOH+ HO P OH
CH 2OH
OH
O
CH 2 O P O
Ca++
邻二醇在酸的作用下发生重排生 成酮的反应称为嚬哪醇重排。
(2) 反应式
(CH3)2C C(C3H )2 OHOH 嚬哪醇
H2SO4 或 HCl
(CH3)3C CC3H O
嚬哪酮
Al2O3, 420-470oC (气相)
CH2=C C=C H2 CH3CH3
(3) 反应机理
(C 6H5)2C CH6H C 5 H+
CH3O
CH3
C6H5
Cl
V相对
500
16
12
1
0.7
如迁移基团是烷基,则3o > 2o > 1o
(4) 实例
OH CH 3 HO
CH 3
CH 3
H+
CH 3
O
OH CH 3 CH 3
HO
H3C OH HO
CH 3
H+
CH3
CH3C
O
第六节 醇的制备
一 实验室制备 二 工业制备简介
一 实验室制备
P
Br
H Br
CH3
SN2
BrCH2CH3
+
HO P Br Br
2oROH , 3oROH (SN1)
(C H3)3C
Br OH + P
Br
BrSN2
H3C CH3
Br- +
C
+ O
P
Br
H Br
CH3
SN1 (CH3)3C+ + HOPBr2
Br -
(CH3)3CBr
4 与氯化亚砜的反应
(1) 反应方程式
沉淀下来。
第三节 醇的反应
一 醇反应性的总分析 二 醇羟基中氢的反应 三 碳氧键的断裂,羟基被卤原子取代 四 成酯反应 五 氧化反应 六 脱氢反应 七 多元醇的特殊反应
一 醇反应性的总分析
氧化反应
H CC H
脱 水 反 应
形成氢键 形成金羊盐
酸性(被金属取代)
OH
取 代 反 应
二 醇羟基中氢的反应
2 邻二醇被四醋酸铅氧化
C6H 5OCH 2CHO H
Pb(OAc)4
反
CH 2OH
C 6H 6
应
