氧气的实验室制法
氧气实验室制法

⑦单孔 ⑧双孔 ⑤长颈漏斗 ⑥分液漏斗 橡皮塞 橡皮塞
⑨导管
氧气实验室制法
实验室制取氧气的发生装置: 固液不加热型发生装置
固固加热型发生装置 实验室制取气体选取发生装置的依据?
反应物的状态和反应条件
收集装置的选择
气体
空气
向上排空气法
(密度比空气大)
小资料
空气 气体
向下排空气法
(密度比空气小)
排水法
资料介绍
(1)KMnO4高锰酸钾是一种紫黑色的固体,在加热时能 产生氧气,成本较高。 (2)KClO3氯酸钾是一种白色固体,加热时能产生氧气, 如果混有可燃性杂质可能会发生爆炸。 (3)H2O2过氧化氢又称双氧水,是一种无色的液体,常 温下就可生成氧气和水,反应速度适中,价格低廉。 (4)H2O水在通电的条件下能产生氧气,成本高,反应 速度太慢。 (5)空气制取氧气在实验室条件达不到。 (6)CO2很难分解。
(溶解性小)
通常状况下,氧气不易溶于水,且不与水反应;在 0℃, 1个标准大气压下,其密度为1.429g/L,空气的密度为 1.293g/L。
上述装置 中,适合实验室制取氧气收集装置的是—— 理由是——。
排水法
向上排空气法
实验室收集气体装置的选择依据?
气体的密度和溶解性
或
实验室制取氧气的装置
讨论交流:
否
快
能
获得结论:最适合在实验室制取氧气的方法
是—过—氧。化氢和二氧化锰
温馨提示:为更好地满足您的学习和使用需求,课件在下载后可以自由编辑,请您根据实际情况进行调整!Thank you
小资料
1、将反应后的二氧化锰过滤、干燥、称 量,发现二氧化锰的质量不发生改变
2、将称量后的二氧化锰再次放入过氧化 氢溶液中,发现有大量气泡冒出,该气泡 能使带火星的木条复燃。
氧气的实验室制法课件(鲁教版(五四制))

现有一集气瓶,想要测量该集气 瓶最多能收集气体的体积,请你 写出简便的测量方法(可以选择必 要的器材):
答:在集气瓶中装满水再用量筒 量出水的体积即为最多能收集气 体的体积
通常状况下,氨气是一种无色、有 刺激性气味的气体,密度比空气小, 极易溶于水。收集氨气应采用装置 为
A
B
C
长
用双氧水和二氧化锰混
讨论:1.比较上述几个实验,说 明过氧化氢分解出氧气需要什么 条件?
在二氧化锰存在条件下
2、若在实验前准确称出MnO2质 量,实验后将MnO2回收、干燥、 再称量,会发现它质量不变, 你对MnO2所起的作用有什么看 法?
MnO2能促使H2O2分解,但它 质量不变说明它本身不分解
3、将分离出来的MnO2再放入A 试管中和MnO2在B试管中起相同 作用,这又说明什么? MnO2在化学反应前后化学性质 没有改变
小结:
凡能改变其它物质的化学反应速 率,而本身的质量和化学性质在 反应前后都没有产生变化的物质 叫做催化剂
特点:“一变两不变”
催化剂在生产、生活和科研中有重 要作用。实验室用过氧化氢分解制 氧气,常用MnO2作催化剂。 [提出问题]其他物质能作分解的催 化剂吗? [猜想]甲同学认为CuO或Fe2O3可以代 替MnO2 ,因为按物质的分类MnO2 、 CuO 、Fe2O3都属于__。
[现象]甲同学视察到步骤①中的现象为 _____ ,步骤③中带火星的木条____ 。
[反思]步骤④中进行的“某一操作”是 ______ 。乙同学认为在步骤④后还需 增加一个实验,请你写出该实验的操作 方法和现象_____ 。
[结论]通过以上实验步骤得出的结论是 ______ 。 请你举一个生活中应用催化剂的事例。
氧气的实验室制法流程

氧气的实验室制法流程英文回答:Laboratory Preparation of Oxygen.Materials:Potassium chlorate (KClO3)。
Manganese dioxide (MnO2)。
Test tube.Cork.Delivery tube.Splint.Water trough.Procedure:1. Place a small amount of potassium chlorate and manganese dioxide into a test tube.2. Cork the test tube and insert a delivery tube into the cork.3. Heat the test tube gently using a Bunsen burner.4. Collect the gas produced in the test tube over water in a water trough.5. Test the gas by igniting a splint in the test tube.Chemical Reaction:2 KClO3(s) + 2 MnO2(s) → 2 KMnO4(s) + O2(g)。
Observations:A colorless gas is produced which bubbles out of the test tube and collects over water in the water trough.The splint burns brightly in the gas.Safety Precautions:Potassium chlorate is a strong oxidizing agent and should be handled with care.Do not heat the test tube too strongly, as it may explode.中文回答:氧气的实验室制法。
氧气的制取过程

氧气的制取过程
氧气的制取主要有工业制法和实验室制法两种方式。
工业制氧气采用的是分离液态空气法,其原理是利用氮气和氧气的沸点不同,通过物理变化进行分离。
实验室制氧气则有多种方法,包括分解过氧化氢溶液、加热氯酸钾或加热高锰酸钾等。
在这些反应中,常常需要加入催化剂,如二氧化锰。
实验室制取氧气的一般步骤包括:检查装置的气密性,装入药品并使其平铺在试管底部,把试管固定在铁架台上,点燃酒精灯加热,收集气体,撤离导气管,最后熄灭酒精灯。
在收集氧气时,可以采用排水法或向上排空气法。
验满的方法是,如果使用排水法,当有气泡从集气瓶口冒出时说明已满;如果使用向上排空气法,可以把带火星的木条靠近集气瓶口,如果木条复燃,说明已满。
以上就是氧气的制取过程,具体操作可能因设备和条件的不同而有所差异。
实验室制氧气的五条实验步骤

实验室制氧气的五条实验步骤
实验室制氧气的五条实验步骤如下:
1.检查装置的气密性。
这一步是为了确保实验装置没有漏气,从而确保实验的顺利进行。
2.装入药品。
根据实验的具体要求,装入适量的药品,如高锰酸钾等。
3.将试管固定在铁架台上。
这一步是为了使试管在加热过程中保持稳定,防止药品洒出或试管破裂。
4.给试管加热。
这一步是为了使药品发生化学反应,产生氧气。
加热过程中需要注意火候和加热时间,以防止药品燃烧或产生其他不必要的副产物。
5.收集气体。
当药品发生化学反应产“生氧气时,需要通过适当的装置收集氧气。
常见的收集方法有排水法和向上排空气法等。
以上就是实验室制氧气的五条实验步骤。
在实验过程中,还需要注意安全操作规范,如佩戴防护眼镜、手套等,
以防止意外事故发生。
同时,实验结束后需要及时清理实验现场,保持实验室的整洁和卫生。
制表:审核:批准:。
氧气的实验室制取方法是

氧气的实验室制取方法是
氧气的实验室制取方法有以下几种:
1. 过氧化氢分解:将过氧化氢H2O2注入装有氧化银催化剂的反应器中,加热至80-100摄氏度,过氧化氢分解生成氧气和水。
反应方程式为2H2O2 -> 2H2O + O2。
2. 过氧化锇分解:将过氧化锇K2O8加热至180-200摄氏度分解,生成氧气和金属锇的氧化物。
反应方程式为2K2O8 -> 2K2O + 5O2。
3. 碳酸钠与二氧化锰反应:将碳酸钠Na2CO3与二氧化锰MnO2混合,在加热的条件下反应生成氧气、二氧化碳和锰酸钠。
反应方程式为4Na2CO3 +
2MnO2 -> 4Na2MnO4 + 2CO2 + O2。
这些方法都需要在实验室中进行,注意操作时的安全防护和废气处理。
同时,实验室制取的氧气品质较高,适用于许多化学实验和其他应用。
氧气的实验室制法

氧气的实验室制法
回忆所学知识中得到氧气的方法:
植物光合作用得到氧气。
工业制氧气:分离液态空气法。
通电分解水:水
通电
氢气 + 氧气
——实验室制氧气 ?
一、实验室制取气体的思路分析
1.选择药品并确定制取气体的化学反应
2.确定实验装置:发生装置和收集装置
3.确定实验步骤
氧气的实验室制法
和过氧化 钠反应
氧气的实验室制法
实验室制取氧气常用的办法: 过氧化氢分解制取氧气。
H2O2
O2
氧气的实验室制法 过氧化氢: 化学式为 H2O2,其水 溶液俗称双 氧水,无色 透明液体, 水溶液常用 于消毒等。
鱼池缺氧,造成大量鱼死亡。 渔民损失10万余元
【主要成分】过氧化氢 【含量规格】15% 【作用与用途】 本品在分解过程中释放出活泼的 新生态氧,用于养殖池塘的增氧, 药性温和,使用方便,无残留, 绿色环保。 【用法与用量】 用法:将本品以1000倍水稀释后 直接泼洒于养殖池塘中。 用量:每亩水深1米用本品100~ 150ml,病情严重可加量使用。
)
2.催化剂在化学反应中所起的作用是( C
A.加快化学反应速率 C.改变化学反应速率
)
B.使生成物质量增加 D.减慢化学反应速率
氧气的实验室制法
练一练:过氧化氢溶液在二氧化锰催化下能迅速分解生成氧气和 水。分液漏斗可以通过调节活塞控制液体的滴加速度。观察下 图回答问题。
过氧化氢溶液 • 1.分液漏斗中应放入的物质是____________ _,锥形 二氧化锰 二氧化锰 瓶中应放入的物质是__________
气密性不好
1.实验室制氧气时,忘记加入二氧化锰,则( C ) A.不能产生氧气 B.使氧气质量减少 C.产生氧气的速率慢 D.没什么变化 2.检验氧气的方法是 ( B ) A.用火柴点 B.用带火星木条接近气体 C.闻气味 D.用天平称量 3. 一氧化氮在常温下是一种难溶于水的气体,密度比空 气略大;它在空气中能跟氧气迅速反应生成二氧化氮。现 要收集一氧化氮气体可采用的方法是( B ) A.向上排空气法。 B.排水法。 C.排水法或向上排空气法。 D.排水法或向下排空气法。
氧气的实验室制法基础知识
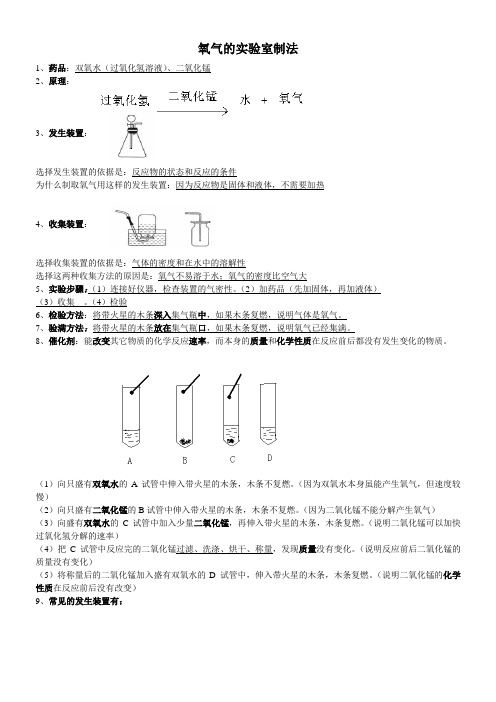
氧气的实验室制法1、药品:双氧水(过氧化氢溶液)、二氧化锰2、原理:3、发生装置:选择发生装置的依据是:反应物的状态和反应的条件为什么制取氧气用这样的发生装置:因为反应物是固体和液体,不需要加热4、收集装置:选择收集装置的依据是:气体的密度和在水中的溶解性选择这两种收集方法的原因是:氧气不易溶于水;氧气的密度比空气大5、实验步骤:(1)连接好仪器,检查装置的气密性。
(2)加药品(先加固体,再加液体)(3)收集。
(4)检验6、检验方法:将带火星的木条深入集气瓶中,如果木条复燃,说明气体是氧气。
7、验满方法:将带火星的木条放在集气瓶口,如果木条复燃,说明氧气已经集满。
8、催化剂:能改变其它物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
(1)向只盛有双氧水的A试管中伸入带火星的木条,木条不复燃。
(因为双氧水本身虽能产生氧气,但速度较慢)(2)向只盛有二氧化锰的B试管中伸入带火星的木条,木条不复燃。
(因为二氧化锰不能分解产生氧气)(3)向盛有双氧水的C试管中加入少量二氧化锰,再伸入带火星的木条,木条复燃。
(说明二氧化锰可以加快过氧化氢分解的速率)(4)把C试管中反应完的二氧化锰过滤、洗涤、烘干、称量,发现质量没有变化。
(说明反应前后二氧化锰的质量没有变化)(5)将称量后的二氧化锰加入盛有双氧水的D 试管中,伸入带火星的木条,木条复燃。
(说明二氧化锰的化学性质在反应前后没有改变)9、常见的发生装置有:选择发生装置的依据是:反应物的状态和反应的条件。
反应物为:固体和固体反应,且需要加热,用A这种发生装置。
反应物为:固体和液体反应,且不需要加热,用BCD三种装置都可。
C和D与B相比较的优点是:便于添加液体药品。
D和C相比较的优点是:可以控制反应速率,节约药品。
怎样检查A和B装置的气密性?把导管的一端浸在水中,双手紧握容器的外壁,如果导管口有气泡冒出,说明装置连接完好不漏气。
怎样检查C装置的气密性?向长颈漏斗中加水到浸没长颈漏斗的末端,把导管的一端浸在水中,双手紧握容器的外壁,如果导管口有气泡冒出,说明装置连接完好不漏气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节性质活泼的氧气(第1课时:氧气的实验室制法)
※学习目标
1、初步学会在实验室里制取氧气的方法(药品、反应原理、实验装置和实验操作);
2、通过探究的过程,进一步熟练科学探究的基本环节,规范化学实验的基本操作,初步形成气体制取的一般思路和方法,并进一步体验对比实验法在实验探究中的应用;
3、通过实验室制取氧气方法的选择过程,学会从简捷、绿色、经济的角度去综合考虑一套方案的优劣,进一步建立可持续发展和绿色化学的观念。
※学习过程
探究任务一:选择合适的方法在实验室制取一瓶氧气(O
)
2
提出问题:在今天的课堂上,我们可以通过哪些方法获得一瓶氧气呢?
收集证据:
1、我们已经学过的可以制得氧气的方法有:
(1)________________________________,能得到大量的氧气,但低温高压的条件高,需要特殊的设备;(2)________________________________,反应的速度比较慢,耗电多,成本高;
2、查阅资料一:
(1)利用酒精灯,加热固体药品氯酸钾(KClO3)(需要加催化剂),可以比较快速的得到氧气。
此种方法制得的氧气会含有少量杂质气体(氯气),氯酸钾中不能混有可燃性的物质,否则加热过程中容易发生爆炸事故。
(2)利用酒精灯,加热粉红色固体氧化汞(HgO)可以得到氧气,在生成氧气的同时,还生成单质汞。
汞俗称水银,是常见金属,常温液态,液体或蒸气都有毒。
(3)利用酒精灯,加热紫黑色的高锰酸钾(KMnO4)固体,可以在较低温度下,很快得到氧气。
高锰酸钾的粉末或烟雾进入人体会引起轻微恶心及神经系统中毒,若高锰酸钾与易燃物混合运输或存放,遇明火或撞击、或未密闭贮存,都会出现不安全事故。
(4)过氧化氢(俗称双氧水,H2O2)的溶液,常温下分解生成氧气,生成物除了氧气外还有水。
在溶液浓度不是很大的情况下,使用相对安全。
3、查阅资料二:制取1L氧气的成本比较表
获得结论:我的结论是选择药品__________来制取氧气,更为合适。
交流评价:
1、关于氧气制取的方法选择,我们需要综合考虑的因素有哪些?通过组内交流初步达成共识。
2、上面涉及的所有方法中,第一种与其它几种,在本质上有什么不同?认真观察各种方法所用的药品,在组成上有什么特点?为什么?
3、还有哪些新的发现或疑问?
探究任务二:过氧化氢制取氧气条件的探究
提出问题:利用过氧化氢溶液来制取氧气,还有什么特殊的条件吗?前面的资料中说到“30% H2O2溶液11.1mL和催化剂0.2g”,什么是催化剂?催化剂起什么作用?选择哪些物质做催化剂呢?
查阅资料:利用带火星的木条复燃或变亮的现象,可以检验较纯净的氧气的存在。
实验探究:
获得结论:比较上述三种方法,我认为最适合于在实验室里制取氧气的方法是第______种。
交流评价:
1、课本93页右边虚线框里有个“催化剂”的概念,跟组内同学交流一下,准确掌握这个概念,需要注意
哪些关键的字或词?
2、为了保证实验结果的客观准确,以上实验过程中我们控制了哪些条件?
3、做完实验后,我们可以用什么方法把催化剂分离出来?怎样知道该物质在反应前后“质量和化学性质”都没有发生改变?
4、对于上述探究过程还有什么收获或疑问吗?
探究任务三:过氧化氢制取氧气的实验装置和具体操作的探究
提出问题:现在在课堂上,我们已经有了理想的快速得到氧气的方法了,要想制得一瓶氧气,需要哪些仪器和具体操作呢?
查阅资料:氧气是一种密度比空气略大,不易溶于水的气体。
气体的收集方法一般分为两种:排空气法和排水法。
另外排空气法又根据所收集气体的密度大小,分为向上排空气法和向下排空气法。
排空气法操作相对简单,但收集到气体的纯度稍低;排水法可以收集得到较为纯净的气体,但要求所收集气体得不易或较难溶于水。
实验方案设计:请组内合作,选择实验台上的仪器,组装出能够产生并收集到一瓶氧气的装置。
交流评价:
1、自己设计的装置,如何检查发生装置的气密性呢?动手试试。
2、利用排水法收集氧气时,什么时候开始收集最好?是一开始就收集呢,还是等导管口气泡连续均匀放出的时候,还是过几分钟以后?为什么?
3、利用排空气法收集氧气时,如何知道已经收集满了?如果用带火星的木条检验,木条是放在集气瓶里
面呢,还是放在集气瓶口?为什么?
4、收集好的一瓶氧气如何放置?瓶口朝上还是瓶口朝下?为什么?
分组实验:组内合作制取一瓶氧气 交流评价:
用此装置制取氧气,有哪些局限性?我们可以如何改进?
※课后小结(关于实验室制取氧气,我学会了哪些知识,学着总结一下,可以参照《同步训练》)
药品: 反应原理: 实验装置: 注意事项: 催化剂与催化作用:
※课后探究
利用加热高锰酸钾或氯酸钾的方法,也是可以在实验室得到氧气的,反应原理如下: 氯酸钾 氯化钾+氧气 高锰酸钾 锰酸钾+二氧化锰+氧气
1、请你设计出一套相应的实验装置,并画出装置图。
2、设计装置的时候,发生装置的选择我们考虑了哪些因素?收集装置的选择我们考虑了哪些因素? 发生装置: 收集装置:
※课后巩固
某研究小组对用H 2O 2分解生成H 2O 和O 2的实验条件进行探究。
他们进行了以下实验: ① 往盛有5 mL 5 % H 2O 2溶液的试管中,伸入带火星的木条,木条不复燃。
② 往盛有5 mL w % H 2O 2溶液的试管中,加入a g MnO 2,伸入带火星的木条,木条复燃。
③ 往盛有5 mL w % H 2O 2溶液的试管中,加入a g Fe 2O 3,伸入带火星的木条,木条复燃。
④ 经检验,②、③ 中反应后试管中仍分别含有a g MnO 2和a g Fe 2O 3。
问题:(1)MnO 2、Fe 2O 3在上述反应中作___________________。
(2)实验 ②、③ 中H 2O 2的浓度(w %)以___________为宜。
研究小组还对溶液浓度....、催化剂的种类......
等实验条件进行了探究。
下表选取了部分实验数据: 用足量等体积H 2O 2溶液制取相同体积O 2所需的时间
二氧化锰
加热 加热
问题:(3)从上表中能得出哪些结论?。
