离子共存 离子的检验和推断
第4课时 微观探离子(3)——离子共存、离子的检验与推断(59张PPT)

H+
SiO32-、 AlO- 2
考点一 离子共存
考点
③生成气体及挥发性物质的离子不能大量共存。 离子 不能大量共存的离子 H+ S2O23-、CO23-、SO32-、HCO- 3 、HSO- 3 、S2-、HS- OH- NH+ 4 (浓溶液并加热)
考点一 离子共存
考点
(2)离子间发生氧化还原反应
考点一 离子共存
考点
(4)离子间发生络合反应 离子间因发生络合反应而不能大量共存,中学常见的反应有 ①Fe3+与 SCN-因生成 Fe(SCN)3而不能大量共存。 ②Ag+与 NH3·H2O 因生成__A_g__N_H__3_2_+__而不能大量共存。 ③Cu2+与 NH3·H2O 因生成_[_C__u__(_N__H__3_)_4_]_2_+_而不能大量共存。
考点一 离子共存
考点
考法精析
考点一 离子共存
考点
考法 一 题干中无限制条件
下的离子共存
考点一 离子共存
考点
1.水溶液中能大量共存的一组离子是
()
A.NH4+、Ba2+、Br-、CO32- C.K+、Na+、SO24-、MnO- 4
B.Cl-、SO32-、Fe2+、H+ D.Na+、H+、NO- 3 、HCO- 3
考点一 离子共存
考点
考法 二 题干中有限制条件下
的离子共存
考点一 离子共存
考点
3.(2019·泉州质检)在溶液中加入过量 Na2O2 后仍能大量共存的是
()
A.NH+ 4 、Ba2+、Cl-、NO- 3
B.K+、SiO23-、AlO- 2 、SO42-
C.Fe2+、Mg2+、SCN-、Cl- D.Na+、HCO- 3 、SO32-、I-
2025届高三化学一轮复习 第3讲 离子共存、离子检验与推断 课件

S2-
MnO- 4 (H+) √
ClO-
√
NO- 3 (H+)
√
Fe3+
√
SO32- I-
√√ √√ √√ √√
Fe2+
√ √ √
×
Br-
Cl-
√
√ 需要Cl-浓度大
√ __√__(酸性)
—
—
××
提醒注意: Fe3+不能氧化Fe2+、Br-、Cl-
考点一 离子共存的判断
④ 四反应:四种反应类型
(4)因发生络合反应不能大量共存
第一章 化学物质及其变化 第3讲 离子共存、离子检验与推断
内容索引
考点一 离子共存的判断 考点二 离子的检验与推断
考点一 离子共存的判断
1. 离子共存的本质
几种离子在同一溶液中能大量共存, 就是指离子之间 不发生任何反应 ; 若 离子之间能 发生反应 , 则不能大量共存。
说明:离子大量共存的问题关键在 “大量” 两个字
K Ca Na
K2S CaS Na2S 易溶于水
Mg Al
MgS Al2S3 与水反应, 发生双水解
Zn Fe
ZnS FeS 白色 黑色 难溶于水 , 可溶与强酸
Sn Pb (H) Cu Hg Ag
PbS CuS Cu2S HgS Ag2S 黑色,难溶于水又难溶于酸
CuSO4 +H2S = CuS↓+H2SO4
提示: “澄清透明溶液”还是“无色透明溶液”。 如: CuSO4溶液为蓝色透明溶液, NaCl为无色透明溶液。
考点一 离子共存的判断
2. 判断离子能否大量共存的 “ 四个要点 ” ② 二性:溶液的酸碱性 ①强酸性溶液中, OH-及弱酸酸根离子(如CO32-、SO32-、S2-、 CH3COO-等)不能大量存在。 ②强碱性溶液中, H+及弱碱阳离子(如NH4+、Al3+、Fe3+等)不能大 量存在。
邳州市第二中学高三化学复习第二章第3讲离子共存离子的检验和推断课件

规律方法·解题指导
第3讲
(2)根据(1)中的实验回答: NO3 存在于________溶液中,理由是___________________; Cl-存在于________溶液中,理由是____________________。 (3)根据(1)中的实验确定,M 溶液中含有的离子为________。
规律方法·解题指导
第3讲
思维模型
离子检验的一般程序与思路
1.常见离子的检验方法 根据离子性质不同而在实验中所表现出的现象不同,可把 检验离子的方法归纳为三种类型:①生成沉淀;②生成气 体;③显现特殊颜色。
规律方法·解题指导
离子
- -
第3讲
试剂
现象
注意
AgNO3 溶 AgCl( 白 色 ) 、 Cl 、 、 Br 液 和 稀 AgBr(淡黄色)、 - I AgI(黄色) HNO3
+
溶 液 和 湿 味的气体,且气 润 的 红 色 体能使湿润的红 石蕊试纸 色石蕊试纸变蓝 稀盐酸和 石灰水 稀 H2SO4 石灰水变沉淀 产生有刺激性气 味的气体,且气 体能使品红溶液 褪色
要加热
气 体 法 CO2- 3
2 SO3-、
HCO - 有干 3 扰
2 SO3-
和品红溶 液
规律方法·解题指导
第3讲
第3讲
离子共存、离子的检验和推断
[考纲解读] 1.应用离子反应发生的条件,正确判断常见离 子在溶液中能否大量共存。2.利用离子的特征反应,能鉴别 常见离子以及进行综合推断。
规律方法·解题指导
第3讲
规律方法〃解题指导
规律方法 溶液中离子能否共存的判断方法 1.离子共存问题是离子反应条件和本质的最直接应用。 所谓几种离子在同一溶液中能大量共存,就是指离子之间 不发生任何反应;若离子之间能发生反应,则不能大量共 存。
专题复习_离子共存、离子的检验和推断
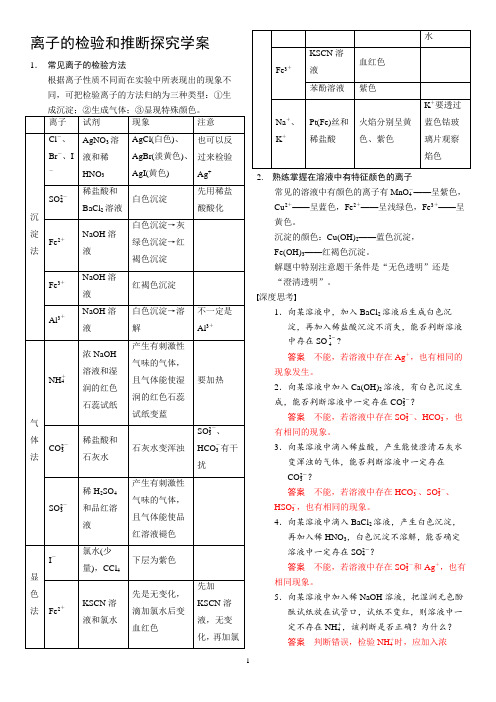
离子的检验和推断探究学案1.常见离子的检验方法根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生2. 熟练掌握在溶液中有特征颜色的离子常见的溶液中有颜色的离子有MnO-4——呈紫色,Cu2+——呈蓝色,Fe2+——呈浅绿色,Fe3+——呈黄色。
沉淀的颜色:Cu(OH)2——蓝色沉淀,Fe(OH)3——红褐色沉淀。
解题中特别注意题干条件是“无色透明”还是“澄清透明”。
深度思考1.向某溶液中,加入BaCl2溶液后生成白色沉淀,再加入稀盐酸沉淀不消失,能否判断溶液中存在SO 24?答案不能,若溶液中存在Ag+,也有相同的现象发生。
2.向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,能否判断溶液中一定存在CO2-3?答案不能,若溶液中存在SO2-3、HCO-3,也有相同的现象。
3.向某溶液中滴入稀盐酸,产生能使澄清石灰水变浑浊的气体,能否判断溶液中一定存在CO2-3?答案不能,若溶液中存在HCO-3、SO2-3、HSO-3,也有相同的现象。
4.向某溶液中滴入BaCl2溶液,产生白色沉淀,再加入稀HNO3,白色沉淀不溶解,能否确定溶液中一定存在SO2-4?答案不能,若溶液中存在SO2-3和Ag+,也有相同现象。
5.向某溶液中加入稀NaOH溶液,把湿润无色酚酞试纸放在试管口,试纸不变红,则溶液中一定不存在NH+4,该判断是否正确?为什么?答案判断错误,检验NH+4时,应加入浓12NaOH 溶液,并加热,且用湿润的红色石蕊试纸。
6.向某溶液中滴加氯水,再加入KSCN 溶液,溶液变红色,则溶液中一定存在Fe 2+,该判断是否正确?为什么?答案 判断错误,检验Fe 2+时,应先加KSCN ,再加氯水,否则,Fe 3+干扰结果的判断。
7.做某溶液的焰色反应实验,火焰呈黄色,则溶液中一定存在钠元素,不存在钾元素,该判断是否正确?为什么?答案 判断错误,钾的焰色反应必须透过蓝色钴玻璃片才能观察到。
离子共存、离子的检验和推断

离子共存、离子的检验和推断在化学中,离子共存也是很常见的现象。
因此,对离子的检验和推断起着至关重要的作用。
下面我们将深入探讨离子共存、离子的检验和推断的相关知识。
离子共存的原因在实验化学中,离子共存较为常见。
离子在其溶液中相互作用,形成共存体系。
通常,离子共存有以下几个原因:1.离子的化学性质:具有相同化学性质的离子,在同一条件下,会倾向于在同一溶液中存在,形成离子共存体系。
2.溶质溶剂间的相互作用:离子与溶质、溶剂之间的相互作用也会导致离子的共存。
3.实验条件:控制不佳、实验条件差等原因,也可能导致离子的共存。
离子的检验离子检验指的是通过化学方法,检测出样品中是否存在某些特定的离子。
其中,常用的离子检验包括:阳离子1.铵离子:加入Nessler试液,若出现黄色,则存在铵离子。
2.钠离子:加入酸性铁氰化钠试液和苯酚红指示剂,若出现红色,则证明存在钠离子。
3.钙离子:加入硫酸铵试液和草酸试液,若出现白色沉淀,则存在钙离子。
4.铁离子:加入硫氰酸钾试液和苯酚红指示剂,若出现红色,则证明存在铁离子。
阴离子1.氯离子:加入银氨试液,若出现白色沉淀,则存在氯离子。
2.硫酸根离子:加入钡盐试液,若出现白色沉淀,则存在硫酸根离子。
3.硝酸根离子:加入密度较大的硝酸银试液,若出现白色沉淀,则存在硝酸根离子。
4.碳酸根离子:加入盐酸,若产生气体,则证明存在碳酸根离子。
离子推断离子推断指的是通过已知的离子检验结果,推测出未知物质样品中的离子种类和数量。
离子的推断通常按照递推法进行。
确定阳离子1.质量作用定律:根据它和阴离子的相对比例,从几个阳离子中确定一组可能的组合。
2.离子比例法:通过阳离子和阴离子的相对比例,推断出组成物质的阳离子的种类。
3.等电点法:根据相对质量和等电点,选择出可能存在的阳离子组合。
确定阴离子1.除去有机酸根离子、硝酸根离子、碳酸根离子:根据阳离子的推断结果,排除掉已知的有机酸根离子、硝酸根离子、碳酸根离子。
高考化学一轮复习第06讲 离子共存、离子的检验与推断(练习)(解析版)

第06讲离子共存、离子的检验与推断(模拟精练+真题演练)1.(2023·广东汕头·统考一模)离子鉴别能让我们感受微观世界的神奇。
下列在透明溶液中能大量共存的离子组是A .2Cu +、24SO -、Na +、3NO -B .4MnO -、Cl -、H +、I-C .3Al +、2S -、4NH +、23CO -D .3Fe +、SCN -、K +、ClO -【答案】A【解析】A .该组离子彼此不23CO -发生反应可以大量共存,故A 正确;B .4MnO -与I -能发生氧化还原反应,不能大量共存,故B 错误;C .3Al +与2S -和23CO -均能发生完全双水解,不能大量共存,故C 错误;D .3Fe +与SCN -能反应,不能大量共存,故D 错误;故选:A 。
2.(2023·安徽合肥·统考一模)下列无色透明的溶液中,离子能大量共存的是A .K +、Na +、3NO -、23CO -B .K +、4NH +、4MnO -、23SO -C .4NH +、3HCO -、3Al +、24SO -D .K +、2Mg +、O H -、Cl -【答案】A【解析】A .K +、Na +、3NO -、23CO -没有颜色,且相互不反应,可以大量共存,A 正确;B .含4MnO -溶液为紫色,且4MnO -、23SO -发生氧化还原反应不能大量共存,B 错误;C .3HCO -、3Al +相互反应不能大量共存,C 错误;D .2Mg +、O H -相互反应生成氢氧化镁沉淀,不能大量共存,D 错误;故选A 。
3.(2023·河南开封·统考二模)对下列粒子组在溶液中能否大量共存的判断和分析均正确的是选项粒子组判断和分析A 透明溶液中:Mg 2+、Cu 2+、Br -、2-4SO 不能大量共存,因为Cu 2+呈蓝色B 能溶解Al 2O 3的溶液中:Na +、+4NH 、Cl -、2-4SO 能大量共存,粒子间不反应C NaCl 溶液中:Fe 3+、I -、Ba 2+、CH 3COO -不能大量共存,Fe 3+和I -会发生氧化还原反应DNaHSO 4溶液中:K +、Cl -、-3HCO 、+4NH 不能大量共存,-3HCO 和+4NH 发生反应【答案】C【解析】A .透明溶液中可以含有色离子,且该组离子彼此不发生反应,可以大量共存,故A 错误;B .能溶解Al 2O 3的溶液的可能是酸溶液,也可能是碱溶液,若为碱性溶液则+4NH 反应,不能大量共存,故B 错误;C .Fe 3+具有强的氧化性、I -具有强的还原性,两者能发生氧化还原反应不能大量共存,故C 正确;D .NaHSO 4溶液中含有大量氢离子,-3HCO 能与氢离子反应不能大量共存,故D 错误;故选:C 。
《离子共存 离子的检验和推断》知识完全归纳与典题分析(解析版)

《离子共存 离子的检验和推断》知识完全归纳与典题分析【核心素养分析】宏观辨识与微观探析:能从宏观和微观相结合的视角理解化学反应和离子反应,并运用离子反应解决实际问题。
证据推理与模型认知:知道可以通过分析、推理等方法认识研究对象的本质特征;能运用正确的模型理解离子的检验与推断的规律。
【重点知识梳理】 知识点一 离子共存所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
发生下列反应而不能大量共存的情况:1、发生复分解反应。
(1)生成难溶物或微溶物:如:Ba 2+与CO 2-3,Ag +与Br -,Ca 2+与SO 2-4等不能大量共存。
(2)生成气体或挥发性物质:如:NH +4与OH -,H +与CO 2-3、HCO -3、S 2-、HS -、SO 2-3、HSO -3 等不能大量共存。
(3)生成难电离物质:如:H +与CH 3COO -、CO 2-3、S 2-、SO 2-3等因生成弱酸不能大量共存;OH -与NH +4因生成的弱碱不能大量共存;H +与OH -生成水不能大量共存。
2、发生氧化还原反应:氧化性离子(如Fe 3+、NO -3、ClO -、MnO -4 (H +)等)与还原性离子(如S 2-、I -、Fe 2+、SO 2-3等)不能大量共存。
3、离子间发生水解相互促进不能共存:弱酸对应的阴离子和弱碱对应的阳离子相互促进双水解进行到底。
如Al 3+、Fe 3+、NH +4与CO 2-3、HCO -3、S 2-、HS -、AlO -2等。
4、络合反应:如Fe3+和SCN-。
【知识拓展】多种离子能否大量共存于同一溶液中,归纳起来就是一句话:一色、二性、三特殊、四反应。
1、一色。
即溶液颜色。
若限定无色溶液,则Cu2+、Fe3+、Fe2+、MnO-4、Co2+、Cr2O2-7、CrO42-、Cr3+等有色离子不能存在。
2、二性。
即溶液的酸性和碱性。
第03讲 离子共存、离子的检验与推断(练习)(教师版) 2025年高考化学一轮复习讲练测新教材新高考

第03讲离子共存、离子的检验与推断题型一离子共存1.(2024·浙江·二模)常温下,在水溶液中能大量共存的离子组是A .+Na 、3NO -、23SiO -、I -B .2Fe +、H +、24SO -、3NO -C .4[Al(OH)]-、3HCO -、+Na 、Br -D .K +、32CH CH COO -、Cl -、H +【答案】A【解析】A .+Na 、3NO -、23SiO -、I -可以大量共存,A 正确;B .H +与3NO -可以氧化2Fe +,不可以大量共存,B 错误;C .4[Al(OH)]-与3HCO -反应生成氢氧化铝和碳酸根离子,不可以大量共存,C 错误;D .32CH CH COO -与H +生成弱电解质丙酸,不可以大量共存,D 错误;故选A 。
2.(2024·浙江·三模)在溶液中能大量共存的离子组是A .4Ti +、HCOO -、Cl -、K +B .24CrO -、Ag +、3NO -、2Zn +C .2Ba +、O H -、Na +、23SO -D .I -、SCN -、K +、4NH +【答案】D【解析】A .4Ti +与HCOO -会发生双水解而不能大量共存,A 项错误;B .24CrO -与Ag +会形成24Ag CrO 沉淀不能共存,B 项错误;C .2Ba +与23SO -会生成3BaSO 沉淀而不能大量共存,C 项错误;D .选项中所给离子相互都不反应,可以大量共存,D 项正确;本题选D 。
3.(2024·江西·一模)下列各组离子中,在给定的环境中一定能大量共存的是A .能使甲基橙变红的溶液:S 2-、2-4SO 、-3NO 、Na +B .常温下,由水电离的c(H +)=10-12的溶液中:Be 2+、-3NO 、K +、Cl -C .在水溶液中:-2AlO 、-3HCO 、Ba 2+、F -D .在漂白液中:OH -、Rb +、2-3CO 、2-4SO 【答案】D【解析】A .能使甲基橙变红的溶液含大量H +与S 2-不共存,酸性条件下,-3NO 有强氧化性,与S 2-会发生氧化还原反应不共存,A 错误;B .常温下,由水电离的c(H +)=10-12的溶液中,水的电离受到抑制,可能是酸性溶液,也可以是碱性溶液,OH -与Be 2+不共存,B 错误;C .-3HCO 与-2AlO 不共存,-3HCO +-2AlO +H 2O=()233CO Al OH -+↓,C 错误;D .在漂白液中:OH -、Rb +、2-3CO 、2-4SO 可大量共存,D 正确;故选D 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点一
C
目 录
ONTENTS
考点二 微专题10 课时作业
【考纲要求】
1.应用离子反应发生的条件,正确判断常见离
子在溶液中能否大量共存。2.利用离子的特征反应,能鉴别常 见离子以及进行综合推断。
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
考点一|离子共存
[知识梳理——抓基础,自主学习]
同一溶液中有多种离子时,若任意两种离子间发生反应,即 为不能大量共存。
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[知识梳理——抓基础,自主学习]
1.复分解反应型 (1)生成难溶物或微溶物的离子不能大量共存。 巧记盐的溶解性口诀 钾、钠、铵盐硝酸盐易溶于水, 硫酸盐不溶铅和钡, 氯化物不溶银亚汞, 微溶物质有四种。
-
+ - 2- ③Fe3+、NH4 、SO2 、 S 4 - ④Fe3+、Cl-、Na+、CO2 3
2- ④Al3+、Fe3+、NO- 、 SO 3 4
- ⑤K+、Na+、AlO- 、 NO 2 3
⑥Na+、H+、Cl-、OH-
⑦Cu2 、Fe2 、Cl 、SO2 4
+ + -
-
- - ⑧K+、Na+、SiO2 、 NO 3 3
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[题组设计——练题组,夯基提能]
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[知识梳理——抓基础,自主学习]
(4)含有大量 NO3 的溶液:H 、Fe2 、Cl 、SO2 4 。
- + + - -
2 NO 在酸性条件下能氧化 Fe 3 _____________________________________________________ 。
+ -
(2)K+、Mg2+、I-、ClO-。
I 能被 ClO 氧化 _____________________________________________________ 。
- -
(3)含有大量 Fe3+的溶液:Na+、SCN-、Cl-、I-。
- - 3+ 3+ Fe 与 SCN 发生络合反应, Fe 与 I 发生氧化还原反应 。 _____________________________________________________
+
2 、Cr2O2 、 FeO 7 4
-
-
SO2 3 、HS 、HSO3
- -
-
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
ቤተ መጻሕፍቲ ባይዱ
[知识梳理——抓基础,自主学习]
3.络合反应型 (1)Fe3 与 SCN 因生成 Fe(SCN)3 而不能大量共存。
+ -
(2)Ag+与 NH3· H2O 因生成[Ag(NH3)2]+而不能大量共存。
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[知识梳理——抓基础,自主学习]
2.氧化还原反应型 A 中的离子与 B 中的离子能发生氧化还原反应 强氧化性离子(A)
- - - + +
还原性离子(B)
+ - -
ClO 、MnO4 、NO3 (H )、Fe3 Fe2 (可与 Fe3 共存)、S2 、I 、
⑥Fe3+、Ca2+、H+、NO- 3
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[题组设计——练题组,夯基提能]
3.下列各组离子因水解相互促进而不能大量共存的是
①②④⑥⑨ 。 ___________
- + ①Al3+、HCO- 、 Cl 、 K 3
②Al3 、SiO2 3 、Na 、Cl
+ - +
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[知识梳理——抓基础,自主学习]
4.水解相互促进型 Al3
+
2 CO2 、 HCO 、 S 、HS 、AlO2 、ClO 3 3
- - - - - - - - - CO2 、 HCO 、 AlO 、 ClO 3 3 2
-
Fe3+
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[知识梳理——抓基础,自主学习]
■多维思考——做一做 1.指出下列离子组不能共存的原因。
- 3+ (1)Na+、OH-、SO2 、 Fe 。 4
Fe3 与 OH 反应生成沉淀 _____________________________________________________ 。
- +
2 2 (5)常温下,pH=12 的溶液:K 、Cl 、SO2 3 、SiO3 、Ca 。
+ - - - +
- 2+ 2- 2- Ca 与 SO 、 SiO 、 OH 反应生成沉淀 3 3 _____________________________________________________ 。
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[知识梳理——抓基础,自主学习]
2.常温下 Fe3+、Al3+在 pH=7 的溶液中能否存在?
3+ 3+ 不能。二者只能存在于酸性溶液中,抑制 Fe 、 Al 的水解。 ______________________________________________________
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[知识梳理——抓基础,自主学习]
说明: ①四种微溶物是指: Ag2SO4、 CaSO4、 MgCO3、 Ca(OH)2。 ②AgCl、AgBr、AgI、BaSO4 及微溶的 CaSO4、Ag2SO4 都难 溶于稀强酸。 (2)生成气体及挥发性物质的离子不能大量共存。 (3)生成难电离物质(水、弱酸、一水合氨等)不能大量共存。
考点一
考点二
微专题10
课时作业
首页
上页 下页
尾页
[题组设计——练题组,夯基提能]
1.下列各组离子在溶液中因发生复分解反应而不能大量共存
①②③⑥。 的是________
①Na+、H+、CH3COO-、OH- ②Ba2 、Na 、CO2 3 、NO3
+ + - + - ③Na+、HCO- 、 H 、 NO 3 3 -
2.下列各组离子在溶液中因发生氧化还原反应而不能大量共
①②③⑤。 存的是________
①H3O 、NO3 、Fe2 、Na
+ - + - 2- ③H+、S2-、SO2 、 SO 3 4
+
②Na 、Fe3 、I 、Cl
+ + -
-
- - + + ④SO2 、 NO 、 Na 、 H 4 3
⑤I-、ClO-、K+、H+
