醛酮alpha位氢的反应
醛酮a氢
CH3-C-H + CH2-C-H 稀碱 CH3-CH-CH-C-H β -羟基醛(仍有活泼氢)
-H2O CH3-CH=CH-CHO (α ,β 不饱和醛)
+ OH-
H3O+ + CH2CHO
O-
② CH3-CHO + CH2CHO
CH3-C-CH2CHO
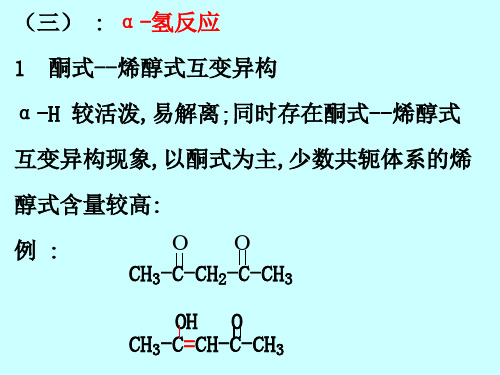
(三) : α-氢反应
1 酮式--烯醇式互变异构
α-H 较活泼,易解离;同时存在酮式--烯醇式
互变异构现象,以酮式为主,少数共轭体系的烯
醇式含量较高:
例:
OO CH3-C-CH2-C-CH3
OH O CH3-C=CH-C-CH3
2: 羟醛缩合反应 (醇醛缩合) : 增长碳链 稀碱条件
O HO
OH H O
H
O-
OH
③ CH3-C-CH2-CHO + H2O
CH3-C-CH2CHO + OH-
H
H
CH3-CH=CH-CHO
特点:① 加成形成 β -羟基醛,再缩合
②产物结构特点: 把羰基碳与另一醛酮的 α -C之间用双键相连。 ③ 醛羰基活泼,酮羰基困难,需在索氏提取器
中进行(及时移出产物) CH3
O -CHO + CH3CH2CHO NaOH H2O
O -CH=C-CHO CH3
72%
②外加法
在稀碱的无α -H 的醛溶液中,从外滴加有α -H 的醛,保持低浓度,只与大量无α -H 的醛反应.
-CHO + CH3CHO 稀 OH外加
-----克莱逊-史密特缩合
-CH=CH-CHO β -苯丙烯醛 (肉桂醛,共轭体系)
CH3COCH3 + CH3COCH3 Ba(OH)2 CH3-C-CH2CO-CH3 索氏提取器 OH
醛酮α-H反应

合成中的重 要中间物。
O –C–CH2CH2COOH
H+/H2O
齐鲁工业大学《有机化学》教学课件—第6讲 (2014.3.24-1/2)
预习主要知识点
1、醛的氧化反应(与酮比较) P345 2、还原成醇和还原成烃 P346 4、歧化反应(坎尼扎罗反应) P350 3
H+
H+
-H+
-
-
轭
H–CH2–CH=O乙醛 CH2=CH–O–H 乙烯醇 (烯醇式) (酮式)
1、酮式—烯醇式的互变异构 P338
一般结构烯醇式不稳定,特殊结构烯醇式可稳定存在。 OH CH2=C–CH3 烯醇式 1.5×10-4% H : O O O O –H O CO C O 动态平衡 O C C CH CH –CCH –CH CH –C–CH CH33–C– CH 3–C=CH 3 CH CH CH 3 3 22 3 3 酮式 24% 烯醇式 76% 即可与羰基试剂反应 如:NaHSO3、H2N–OH O H–CH2–C–CH3 酮式 ≈100%
互 变 异 构
也可与烯醇式试剂反应 如:Na、Br2、FeCl3
2、卤代反应和碘仿反应 P340 O H O X 卤代 X2 R–C—C– R–C—C– 反应 O H O X X2 R–C—C–H R–C—C–X H X
O R–C–O- + CHX3 CHCl3 CHBr3 CHI3
卤仿 反应
注意——酸碱催化条件下,反应位置、反应程度 均有差异。
(1) 醛、酮的自身缩合(以醛为例) CH3CH=O + H–CH2CH=O
HO-
△ 反应机理: 羰基组分 亚甲基组份 HO CH3CH=O + H2–CHCH=O △ CH3CH=CH–CH=O CH2CH=O + H2 O ① HO + H–CH2CH=O ,-丁烯醛 (1) 醛、酮的自身缩合 O OH (巴豆醛) HO CH RCH +H –CHCH=O ② CH CH=O + CH RCH –CH–CH=O 3CHCH 2CH=O 2CH=O 3 2CH=O (2) 二元醛、酮的缩合 2CH R R O OH △ -羟基醛 (3)苯甲醛的交叉缩合 羰基组分 亚甲基组份 - CH CHCH CH=O + HO ③ CH CHCH CH=O +H O HO 3 2 3 2 2 RCH2CH=O + H2–CCH=O RCH CH=C –CH=O 2 △ R ,-不饱和醛 R
醛、酮、羧羧酸及其衍生物的α-碳上的反应

NaOH C6H5CHO
CH3COCH3 C6H5COCH3
C6H5CH=CHCHO C6H5CH=CHCOCH3 C6H5CH=CHCOC6H5
C6H5CH=CHCOCH=CHC6H5
(2) 羧酸及其衍生物α-碳上的反应
脂肪酸α-卤化反应
• 羧酸的-H酸性比醛、酮小,故而羧酸的-H远比醛和酮的-
7.醛、酮、羧酸及其衍生物的α-碳上的反应
(1) 醛和酮α-碳上的反应 (2) 羧酸及其衍生物α-碳上的反应
(1)醛和酮α-碳上的反应
α-氢的酸性
受羰基吸电子效应的影响,其α-氢表现出一酸性。 解离出一个质子形成碳负离子。 经过共振成为烯醇负离子,得到一个质子并形成烯醇。 (1)和(4)相互转化称为互变异构。
O 2 CH3COC2H5
1. EtONa/EtOH 2. H3+O
OO CH3CCH2COC2H5
迪克曼缩合反应
分子内的酯缩合称为迪克曼(Dieckmann)缩合。这个反应特 别适合于合成五元和六元环型-酮酸酯。
CO2C2H5 1. C2H5ONa
CO2C2H5
2.H3+O
CO2C2H5 O
CO2C2H5 1. C2H5ONa
• 这个反应称为卤仿反应。
O
C
加成
R CX3
HO
O
消除
O
R C CX3 OH
C
+ CX3
R OH
(I)
(II)
O
R
C
+ O-
HCX3
酮的烷基化
-烷基化反应
在强碱作用下,一元酮所形成的碳负离子或烯醇负离子是强的亲核试剂,能够与卤代 烷发生亲核取代,生成烷基化产物
醛、酮的亲核加成反应

H
加成
OH H
-H2O
C O+ HN Y
C NY
C NY
上式也可以直接写成:
CO +H 2NY
CNY+H 2 O
反应的结果是在醛和酮与氨的衍生物分子间脱去一 分子水,生成含有C=N双键的化合物。这一反应又叫 做醛和酮与氨的衍生物的缩合反应。
H2 N OH
O+
H2 N NH2 H2 N NH
NH2 NH O2N
2-戊醇 2-戊酮 苯甲醚
卢卡斯试剂
出现混浊 X X
2,4-二 硝基苯肼
生成晶体 X
Backmann重排 酮与羟胺作用生成的酮肟在强酸作用下发生重排,生成取代的 酰胺。这种由肟变为酰胺的重排,叫贝克曼(Backmann)重排。
反应历程:
特点:(1) 在不对称的酮肟中,处于羟基反位的基 团重排到氮上;
1.与氢氰酸加成
C O + HCN
OH C
CN
α 羟基睛
在少量碱催化下,醛和脂肪族甲基酮与氢氰酸加成生成氰醇(或叫
羟基醇)。
应用范围:醛、甲基脂肪酮、C8以下环酮
H2O
(C3H)2CCN H2O/H
OH
H
练习:
CH 3 CH 3OH
C H 3
CH 2=C-CN H CH 2=C-CO3OCH
(C3H)2C C O O H
C H 3 C H O +2 C 2 H 5 O H
利用这一性质在有机合成中常用来保护羰基。
例题: HO 2 CH CHO O HOOC CHO
必须要先把醛基保护起来后再氧化。
HOC 2 H HOOC
CHOCHH 3O CH l HOC 2 H
aldol 反应机理‘

aldol 反应机理‘
Aldol反应,也称为羟醛缩合反应,是一种有机化学反应,指的是含有α-氢原子的醛或酮,在酸或碱的催化下,与另一分子醛或酮发生加成反应,生成β-羟基醛或酮,然后进一步受热失水形成α,β-不饱和醛或酮,以及其它一系列有机化合物的反应过程。
其反应机理如下:
在酸性条件下,羰基化合物(如醛或酮)会异构化成为烯醇,这种烯醇具有很强的亲核性,然后它会与另一分子羰基化合物进行加成,生成β-羟基羰基化合物。
而在碱性条件下,羰基α位氢的酸性较大,可以在碱的作用下去质子化,形成亲核性较强的烯醇负离子,然后与另一分子羰基化合物加成,同样生成β-羟基羰基化合物。
这个反应实际上是一个羰基化合物分子间的亲核加成反应,通过这种反应可以合成碳原子数比原来醛或酮增加一倍的醇或醛。
除了乙醛外,其他醛发生Aldol缩合得到的产物都不是直链的,而是原α-碳原子上带有支链的化合物。
因此,Aldol反应在有机合成中占据着重要地位,是构建β-羟基羰基化合物的一种重要方法。
以上信息仅供参考,建议查阅专业化学书籍或咨询化学专业人士获取更全面准确的信息。
醛酮反应

第12章 活泼亚甲基反应在醛、酮、羧酸及其衍生物中,与羰基相邻的α-亚甲基(1)也受羰基拉电子效应的影响,因此α-碳上的氢也表现出一定的酸性,并可离解出一个质子形成碳负离子(2)。
(2)经过共振成为烯醇负离子(3),得到一个质子形成烯醇式(4)。
(1)式和(4)式之间的互变称为烯醇互变异构。
(1)式称为酮式(keto form ),(4)式称为烯醇式(enol form )。
H+C C O-H+34(酮式)(烯醇式)醛、酮、酸酸及其衍生物的α-亚甲基上的氢受到邻位羰基的活化而呈一定的酸性,因此常称为活泼亚甲基化合物。
活泼亚甲基化合物烯醇化程度越高,α-氢酸性越大,亚甲基越活泼。
而烯醇化程度与分子结构有关,例如,丙酮在液态时含有1.5×10-4%的烯醇(pK a 20),而乙酰丙酮则由于其烯醇式可形成分子内氢键以及共轭效应,在己烷中的烯醇含量高达92%,酸性较丙酮大得多(pK a 9),与苯酚相近(pK a 9.98)。
C H 2C C O C H 3O CH 3H 3(8%) (92%)与羧酸相比(pK a 4.76),烯醇是较弱的酸。
一些活泼亚甲基化合物的酸性见表12.1。
除了含羰基化合物外,其它带有吸电子基团(如硝基、亚硝基、烷氧基等)的化合物均有不同程度的烯醇化作用。
表12.1 一些活泼亚甲基化合物的酸性 化合物 pK a 化合物pK a HCOCH 2CHO CH 3COCH 2COCH 3 RCH 2NO 2 CH 3COCH 2CO 2R NCCH 2CN 5 910 11 11CH 3SO 2CH 2SO 2CH 3EtO 2CH 2CO 2Et RCH 2CHO RCOCH 2R’ RO 2CCH 2R’ RCH 2CN 12.5 13 16 19-29 24.5 25醛、酮、羧酸及其衍生物的羰基活化α-氢的能力有以下次序: -CHO > -COCO 2R > -COPh > -COR > -CN > -COX > -CO 2R > -CO 2H 这些羰基化合物的许多重要反应与它们的α-活泼亚甲基有关。
《醛酮的a氢》课件

例如,植物中的香豆素、黄酮类 化合物等都含有醛酮的结构,通 过对其a氢的处理可以合成出这
些化合物。
醛酮的a氢在天然产物合成中的 重要性在于其能够与许多天然产 物分子发生反应,从而得到具有
生物活性的天然产物。
06
醛酮的a氢研究展望
a氢研究的发展趋势
深入探索醛酮的a氢反应机理
随着实验技术和理论计算的发展,未来将更深入地 揭示醛酮的a氢反应机理,为相关反应的设计和优化 提供理论支持。
拓展醛酮的a氢反应在合成中的应用
随着对醛酮的a氢反应的深入理解和掌握,未来将进 一步拓展其在有机合成中的应用,为药物、材料和 化合物的合成提供新的途径。
开发高效的醛酮的a氢催化剂
针对醛酮的a氢反应,未来将致力于开发更加高效、 选择性好的催化剂,以提高反应的效率和产物的纯 度。
a氢研究的挑战与机遇
01
常用的氧化剂包括氧气、过氧化氢、高锰酸钾等, 这些氧化剂可以将醛酮的a氢氧化成醇或酸。
氧化反应机理通常包括电子转移和质子转移两个步 骤,其中电子转移是决定反应速率的关键步骤。
还原反应机理
醛酮的a氢在还原反应中,通常 会与还原剂发生反应,生成相应
的烃或醇。
常用的还原剂包括氢化铝锂、硼 氢化钠等,这些还原剂可以将醛
详细描述
在还原反应中,常用的还原剂包括氢气、金属催化剂等。在反应过程中,a氢原子获得电子,转化为 负离子,进而与还原剂中的氢原子结合,形成新的烃基或烷基。这种还原反应在有机合成中具有重要 意义,可以用于制备特定结构的烃类化合物。
a氢的取代反应
总结词
醛酮的a氢原子在取代反应中可以被其他基团所取代。
详细描述
培养专业人才
随着醛酮的a氢研究的深入和 应用的拓展,未来将需要更多 的专业人才进行相关研究和工 作,这将促进该领域人才的培 养和发展。
7.醛、酮、羧羧酸及其衍生物的α-碳上的反应

羟醛缩合反应
(1)醛和酮的自身缩合 在碱存在下,醛或酮也可发生类似于酯缩合的反应,称 在碱存在下,醛或酮也可发生类似于酯缩合的反应, 为羟醛缩合( 为羟醛缩合(Aldol condensation)反应。 )反应。
O H C CH3 + OH H O C CH2 + H2O
O R HO C 加成 CX3 R O C OH CX3 消除 R O C OH + CX3 R O C O
-
+
HCX3
(I)
(II)
α-烷基化反应
酮的烷基化
在强碱作用下, 在强碱作用下,一元酮所形成的碳负离子或烯醇负离子是强的 亲核试剂,能够与卤代烷发生亲核取代, 亲核试剂,能够与卤代烷发生亲核取代,生成烷基化产物
coona2hona2h交叉的酯缩合反应两种不同的酯亦可发生缩合反应称为交叉的酯缩合反应一种酯中没有h另一种酯中含有h时它们的缩合反应还是相当有用的hcoc79酮与酯的缩合含有h的酮与酯也可发生交叉缩合反应生成酮酸酯或二酮6271chona2h43贝金反应贝金perkin反应是芳香醛与乙酸酐或取代的乙酸酐在相应的羧酸钠盐或钾盐存在下缩合生成不饱和羧酸的反应
O H C CH2 + H
O C CH3 H
O C CH2
O CH CH3
O H C CH2
O CH CH3 + H2O H
O C CH2
OH CH + OH CH3
羟醛(沸点83 C/20mmHg)在直接蒸馏时, 羟醛(沸点83oC/20mmHg)在直接蒸馏时,或在少量碘或氯化氢存 在下加热, 在下加热,可顺利失水而形成巴豆醛
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(查尔酮)
分子内羟醛缩合反 应
* 分子内羟醛缩合可以用于制备五、六元环酮化合物。
* 分子内缩合反应机理:
醛、酮缩合反应的区域选择性
动力学控制的反应
热力学控制的反应
醛、酮缩合的区域选择性
弱碱促进的 热力学控制 反应
强碱促进的 动力学控制 反应
羟醛缩合反应 VS 羰基-烷基化
* 羟醛缩合需要催化量的碱; * 烷基化需要化学计量的碱使底物全部变成烯醇离子后,再加入卤代烃。
胺催化的醛酮-位的反应
Hajos-Parrish-Eder-Sauer-Wiechert 反应
课间提问(多选题)
下列化合物中,可以通过羟醛缩合反应来制备的是( )。
醛酮 -位氢的反应
主讲人 钟芳锐 华中科技大学化学与化工学院
主讲内容
• 醛、酮-位氢的酸性 • 醛、酮的-位烃基化和酰基化 • 醛、酮的羟醛缩合
醛、酮的-位氢的酸性Fra bibliotek醛、酮的-氢的酸性
丙酮
乙烷
* 诱导效应 * 超共轭效应
醛、酮的烯醇化反应
酸性条件 的烯醇化
碱性条件 的烯醇化
酮的-位烃基化、酰基化
羟醛缩合反应
* 烯醇负离子对羰基亲核加成生成羟醛类化合物,称为羟醛缩合反应。
* 交叉羟醛缩合的产物较复杂,至少有四种,无合成价值。
交叉羟醛缩合反应
* Claisen-Schmidt缩合反应
肉桂醛
* 无α-氢的醛和有α-氢的醛的反应,可以得到单一的产物,具有合成价值。
酮的羟醛缩合反应
* 由于电子和位阻效应,酮自身缩合较慢,常用于和醛进行交错 缩合,产生单一的产物,也具有合成价值。
