山东潍坊精鹰医疗器械有限公司环境影响报告表
医疗器械生产项目环评

医疗器械生产项目环评一、项目背景医疗器械生产项目是指在特定场地,依照一定的工艺、流程,生产各类医疗器械产品的过程。
医疗器械是保障人类健康的重要工具,对医疗行业和生物科技产业的发展起到关键作用。
鉴于医疗器械产业的重要性和市场需求的不断增长,本项目拟在地设立医疗器械生产基地,以满足市场需求。
二、项目规模三、环境影响评价1.大气环境:项目将使用部分化学药品和清洁剂,排放部分废气。
项目将建设专门的排气系统,并进行合理的防护措施,以及安装废气处理设备,确保废气排放符合国家标准。
2.水环境:项目将使用水作为主要的冷却介质和清洁介质,产生一定量的废水。
为保护水资源,项目将建设废水处理设备,以确保废水排放符合国家标准。
3.土壤环境:医疗器械生产过程中产生的固体废弃物将按照国家相关规定进行分类、储存和处理。
防止对土壤环境造成污染。
4.噪声影响:项目将采取隔声措施,确保生产过程中噪声对周边环境和人群的影响尽量降到最低。
四、环境保护措施1.大气环境保护措施:(1)建设环保设施,如制定详细的废气处理方案,安装尾气净化设备。
(2)控制废气排放,设置排气口高度,有效减少对周边环境的影响。
(3)对化学药品和清洁剂储存和使用过程进行规范,防止泄漏和浪费。
2.水环境保护措施:(1)建设废水处理系统,厂区内设立封闭式储存池,废水排放前进行处理。
(2)对生产过程中产生的废水进行分类,采取适当的处理方法。
(3)定期进行废水的监测和检验,确保废水排放符合国家标准。
3.土壤环境保护措施:(1)对生产过程中产生的固体废弃物进行分类、储存和处理,确保不积存和泄漏。
(2)消除污染源,并采用防渗漏的措施,避免污染物渗入土壤。
4.噪声环境保护措施:(1)对生产设备和机械进行噪声控制和减震措施,减少噪声的产生。
(2)合理安排生产过程,尽量降低噪声对周边环境和人群的影响。
五、环境监测计划为确保项目运营中环境污染的控制,项目建成后将进行定期和不定期的环境监测。
环评报告-医疗器械项目

环评报告-医疗器械项目一、项目概况该医疗器械项目计划在市建设一家新的医疗器械生产厂,总投资约为5000万元人民币,占地面积约为2万平方米。
项目主要生产一系列医疗器械产品,包括手术器械、医用耗材等。
二、环境背景分析该医疗器械项目将位于该市工业区,周边主要为工业企业和居民区。
工业企业主要为电子、化工等制造业,存在一定的环境污染风险。
居民区主要为住宅小区,周边居民对环境质量有一定关注。
三、环境影响评价内容1.项目对大气环境的影响评价本项目主要通过生产过程产生废气,其中包括有机溶剂挥发等。
针对此问题,项目提出了使用清洁生产技术,配备废气处理设备等措施,以减少废气排放对大气环境的影响。
在施工期间,对施工车辆进行管理,减少尾气排放。
2.项目对水环境的影响评价本项目对水环境的主要影响是废水排放。
项目提出了设置污水处理设施,并且确保排放的废水符合国家排放标准。
在施工期间,通过合理管理施工工地,防止施工废水进入周边水体。
3.项目对土壤环境的影响评价本项目的生产过程中不直接涉及土壤,但施工期间可能会对土壤环境造成一定的影响。
项目提出了合理管理施工工地、进行土壤保护等措施,以减少对土壤环境的影响。
4.项目对噪声环境的影响评价本项目主要影响是生产过程中产生的噪声。
项目提出了设置隔音设备、规范作业环境等措施,以减少对周边居民的噪声干扰。
5.项目对生态环境的影响评价虽然该项目不直接涉及敏感生态环境,但周边存在一些森林和湿地等生态环境。
项目将采取合理的施工措施,防止施工对周边生态环境的破坏。
四、环境保护措施基于以上的影响评价内容,项目将采取以下环境保护措施:1.废气治理:使用清洁生产技术,配备废气处理设备,确保废气排放符合国家标准。
2.废水处理:设置污水处理设施,确保废水排放符合国家排放标准。
3.土壤保护:合理管理施工工地,采取土壤保护措施,减少对土壤环境的影响。
4.噪声控制:设置隔音设备,规范作业环境,减少对周边居民的噪声干扰。
环境影响评价报告公示医疗器械组装生产车间项目环评报告

环境影响评价报告公示医疗器械组装生产车间项目环评报告一、项目概述医疗器械组装生产车间项目,位于市工业区,占地面积为5000平方米,建筑面积为3000平方米。
该项目主要针对医疗器械的组装生产,并配备一定的检验、包装等相关设施。
二、环境影响评价目标1.确保项目施工过程中对环境的影响最小化,减少对土壤、水体和大气的污染;2.确保项目运营期间的废气、废水、固体废物等排放符合相关法规和标准;3.保护周边的自然生态环境,减少人为活动的对生态系统的破坏;4.提高项目运营过程中的资源利用效率,减少能源和材料的消耗。
三、环境影响评价内容1.项目建设对土地利用的影响:由于项目占地面积较小,对土地利用的影响较小,不会对周边地区的土壤生态系统造成明显影响。
2.项目建设对水资源的影响:项目建设期间会产生一定的废水,但通过合理设计的污水处理设施,可以达到相关标准,不会对周边水体造成污染。
3.项目建设对大气环境的影响:项目建设期间会有一定量的粉尘和废气排放,但通过合理的施工措施和设备的选择,可以减少对大气的污染。
4.项目运营对废物排放的影响:项目运营期间会产生一定量的固体废物和废水,通过合理的分类和处理,可以实现无害化处理,并减少对环境的影响。
5.项目运营对能源消耗的影响:项目运营期间主要消耗电力和一定量的水资源,通过使用高效节能设备和合理的能源管理措施,可以降低能源消耗。
6.项目运营对环境噪声的影响:项目运营期间可能会产生一定的环境噪声,通过合理的隔音和降噪措施,可以减少对周边居民的影响。
四、环境保护措施1.在项目施工期间,加强工地管理,做到防尘、防污染和防噪音,确保施工过程对环境的影响最小化。
2.设置污水处理设施,对项目运营期间产生的废水进行处理,确保排放达到相关标准。
3.合理选择和使用设备,确保废气排放不超过相关标准,减少对大气环境的污染。
4.实施废物分类和无害化处理措施,减少对环境的影响。
5.使用高效节能设备和合理的能源管理措施,降低能源消耗。
纯化水系统的验证报告

*************有限公司文件编码:纯化水系统验证报告编制:审核:批准:年月验证文件审批表注:此表一式二份,验证文件附后。
1.概述1)纯化水系统流程图2)制定依据2.验证目的3.职责1)验证委员会2)质保部3)工程部4)质检中心5)106车间4.验证内容1)纯化水系统安装确认2)纯化水系统运行确认3)纯化水系统性能确认4)纯化水系统清洁与消毒的确认5)纯化水系统过滤器滤芯更换周期的确认5.再验证周期6.验证记录一、概述本设备由******公司生产制造。
该公司是国家定点生产制水设备的企业。
我公司购置的纯化水系统由原水罐、原水泵、多介质过滤器、活性炭过滤器、加药系统(阻垢剂)、精密过滤器(滤芯为5微米)、1#高压泵、一级RO主机、中间储罐、加药系统(NaOH)、2#高压泵、二级RO主机、紫外线灭菌器、纯化水储罐和纯化水水泵等组成。
该纯化水系统可自动运行也可手动运行。
待纯化水罐水位处于高水位触点时系统自动停机,一旦纯化水罐处于低水位时系统又自动制水,反复循环。
原水罐水位过低或纯水罐水位过高,系统也会自动报警和停机。
2、制定依据《药品生产质量管理规范》(1998年修订)、《RO系列二级反渗透水处理机组使用说明书》和《中国药典》2005版二、验证目的为保证制备的纯化水符合《中华人民共和国药典》2005 年版中纯化水的标准,证明制水系统在已有的或未来的操作情况下,工艺用水的质量与预期设计的相一致,能够稳定地生产出一定数量和质量且达到生产工艺要求的合格纯化水。
确认制定的“纯化水系统清洁和消毒规程”正确可靠性。
三、职责1)验证委员会a.负责验证方案的审批。
b.负责验证的协调工作,以保证本验证方案规定项目的顺利进行。
c.负责验证数据及结果的审核。
d.负责验证报告的审批。
e.负责发放验证证书。
f.负责再验证周期的确认。
2)质保部a.负责拟订验证方案。
b.负责组织检测用仪器的校正。
c.负责验证工作的具体组织实施。
纯化水系统的验证报告.doc

有限公司文件编码:纯化水系统验证报告编制:审核:批准:验证文件审批表文件编码:注:此表一式二份,验证文件附后1.概述1)纯化水系统流程图2)制定依据2.验证目的3.职责1)验证委员会2)质保部3)工程部4)质检中心5)106车间4.验证内容1)纯化水系统安装确认2)纯化水系统运行确认3)纯化水系统性能确认4)纯化水系统清洁与消毒的确认5)纯化水系统过滤器滤芯更换周期的确认5.再验证周期6.验证记录、概述本设备由****** 公司生产制造。
该公司是国家定点生产制水设备的企业。
我公司购置的纯化水系统由原水罐、原水泵、多介质过滤器、活性炭过滤器、加药系统(阻垢剂)、精密过滤器(滤芯为5 微米)、1#高压泵、一级RO主机、中间储罐、加药系统(NaOH)、2#高压泵、二级RO 主机、紫外线灭菌器、纯化水储罐和纯化水水泵等组成。
该纯化水系统可自动运行也可手动运行。
待纯化水罐水位处于高水位触点时系统自动停机,一旦纯化水罐处于低水位时系统又自动制水,反复循环。
原水罐水位过低或纯水罐水位过高,系统也会自动报警和停机。
1、主要技术参数2、制定依据《药品生产质量管理规范》(1998 年修订)、《RO 系列二级反渗透水处理机组使用说明书》和《中国药典》2005 版二、验证目的为保证制备的纯化水符合《中华人民共和国药典》2005 年版中纯化水的标准,证明制水系统在已有的或未来的操作情况下,工艺用水的质量与预期设计的相一致,能够稳定地生产出一定数量和质量且达到生产工艺要求的合格纯化水。
确认制定的“纯化水系统清洁和消毒规程”正确可靠性。
三、职责1)验证委员会a.负责验证方案的审批。
b.负责验证的协调工作,以保证本验证方案规定项目的顺利进行。
c.负责验证数据及结果的审核。
d.负责验证报告的审批。
e.负责发放验证证书。
f.负责再验证周期的确认。
2)质保部a.负责拟订验证方案。
b.负责组织检测用仪器的校正。
c.负责验证工作的具体组织实施。
制水工艺规程
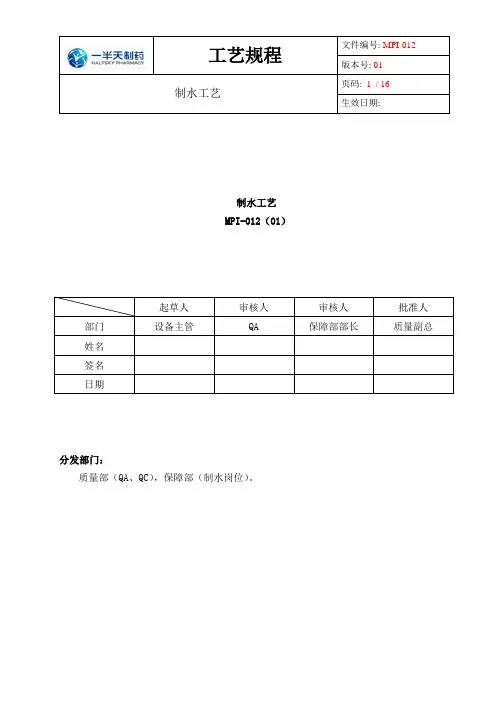
工艺规程文件编号: MPI-012版本号: 01制水工艺页码:1 / 16生效日期:制水工艺MPI-012(01)起草人审核人审核人批准人部门设备主管QA 保障部部长质量副总姓名签名日期分发部门:质量部(QA、QC),保障部(制水岗位)。
1.目的建立纯化水、注射用水生产工艺规程,使产品生产工艺标准化,确保生产有依据,质量有保证。
2.范围纯化水、注射用水生产工艺。
3.职责保障部部长、质量部部长、QA、QC。
4.定义纯化水:为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何添加剂。
注射用水:指去离子水经蒸馏所得的水。
纯蒸汽:指由去离子水经蒸馏产生的蒸汽。
反渗透膜:由高分子材料制成的人工半透膜,在高于溶液渗透压的作用下,依据其他物质不能透过半透膜而将这些物质和水分离开来,能够有效地去除水中的溶解盐类、胶体、微生物、有机物等。
电离子交换(EDI):是将电渗析膜分离技术与离子交换技术有机地结合起来的一种新的制备超纯水(高纯水)的技术,它利用电渗析过程中的极化现象对填充在淡水室中的离子交换树脂进行电化学再生。
5.内容5.1.概述5.1.2.系统简述制水岗位共有两套纯化水和注射用水生产设备,分别由山东潍坊精鹰医疗器械有限公司(以下简称精鹰系统)和广州万冠制药设备有限公司(万冠系统)设计制,万冠系统生成的纯化水可进入精鹰系统纯化水储罐。
具体组成如下:5.1.3.工艺流程图5.1.3.1.纯化水制备工艺流程5.1.3.2. 注射用水制备工艺流程精鹰系统万冠系统5.2.纯化水系统5.2.1.工作原理5.2.1.1.反渗透(RO),即施加压力超过溶液的天然渗透压,则溶剂便会流过半透膜,在相反一侧形成稀溶液,而在加压的一侧形成浓度更高的溶液。
如施加的压力等于溶液的天然渗透压,则溶剂的流动不会发生;如施加的压力小于天然渗透压,则溶剂自稀溶液流向浓溶液。
5.2.1.2.电再生离子交换(EDI)即利用两端电极高压使水中带电离子移动,淡水室中充填离子交换树脂,而树脂的存在可以大大地提高离子的迁移速度。
不同干燥方式对颗粒粉体性质的影响
不同干燥方式对颗粒粉体性质的影响马秀娟ꎬ付清爽ꎬ路静ꎬ成佳慧(山东齐都药业有限公司ꎬ山东淄博255400)摘要:目的㊀探究不同干燥方式对颗粒粉体性质的影响ꎮ方法㊀采用相同的处方进行制粒ꎬ采用真空干燥ꎬ烘箱干燥及流化床干燥ꎬ测定不同干燥方式所得颗粒的流动性指数ꎬ综合评价不同干燥方式所得颗粒的粉体性质ꎮ结果㊀三者中烘箱干燥产物的流动性最好ꎬ可压性无明显区别ꎮ结论㊀不同干燥工艺造成了干燥产物粉体性质的差异ꎮ关键词:真空干燥ꎻ流化床干燥ꎻ烘箱干燥ꎻ粉体性质中图分类号:TQ460.6㊀文献标志码:A㊀文章编号:2095-5375(2023)06-0377-004doi:10.13506/j.cnki.jpr.2023.06.004InfluenceofdifferentdryingmethodsonthepropertiesofgranularpowderMAXiujuanꎬFUQingshuangꎬLUJingꎬCHENGJiahui(ShandongQiduPharmaceuticalCo.ꎬLtd.ꎬZibo255400ꎬChina)Abstract:Objective㊀Exploretheinfluenceofdifferentdryingmethodsonthepropertiesofgranularpowder.Methods㊀Usethesameprescriptionforgranulationꎬvacuumdryingꎬovendryingandfluidizedbeddryingꎬthefluidityindexesoftheparticlesobtainedbydifferentdryingmethodsaremeasuredꎬandthepowderpropertiesoftheparticlesobtainedbydifferentdryingmethodsarecomprehensivelyevaluated.Results㊀Amongthethreeꎬthefluidityofoven-driedproductsisthebestꎬandthereisnoobviousdifferenceincompressibility.Conclusion㊀Differentdryingprocessescausedifferencesinthepowderpropertiesofdriedproducts.Keywords:VacuumdryingꎻFluidizedbeddryingꎻOvendryingꎻPowderproperties㊀㊀干燥是利用热能使物料中的湿份(水分或其他溶剂)汽化除去ꎬ从而获得干燥物品的工艺操作ꎮ干燥常应用于药物的除湿ꎬ新鲜药材的除水ꎬ以及片剂㊁胶囊剂㊁颗粒剂㊁散剂等的工业生产ꎮ干燥的目的在于使物料便于加工运输㊁贮藏和使用ꎬ保证药品的质量和提高药物的稳定性ꎮ干燥方法与设备种类繁多ꎬ常用的干燥方式主要有常压干燥㊁减压干燥及沸腾干燥ꎮ常压干燥最常用的是烘干ꎬ即将物料置于热源装置的烘房㊁烘柜或烘箱内ꎬ利用热源装置供给热能促使物料干燥的方法ꎮ此法干燥温度可以进行控制ꎬ干燥速度较快ꎬ主要用于片剂颗粒㊁胶囊剂颗粒㊁散剂㊁颗粒剂的干燥ꎮ减压干燥常用于需要干燥但又不耐高温的药物ꎮ此法除能够加速干燥ꎬ降低温度ꎬ还能使干燥产品疏松和易于粉碎ꎮ此外ꎬ由于抽去空气ꎬ从而保证了易氧化药物的稳定性ꎮ减压干燥效果取决于负压的高低(真空度)和被干燥物料的堆积厚度ꎮ沸腾干燥又叫流化干燥ꎮ主要用于湿粒状物料的干燥ꎮ此法是利用热空气流使颗粒悬浮ꎬ呈现沸腾状态ꎬ物粒的跳动增加了蒸发面ꎬ热空气在湿颗粒间通过ꎬ在动态下进行热交换ꎬ带走了水气ꎬ达到干燥目的ꎮ具有效率高ꎬ速度快ꎬ产量大的特点ꎬ对单一产品可连续生产ꎬ沸腾干燥室密封性好ꎬ产品纯度易于保证[1]ꎮ制粒作为药品生产中的关键加工单元ꎬ其质量会随着生产工艺传递至最终产品ꎬ进而影响产品质量[2]ꎮ干燥同样是药品生产过程中的关键加工单元ꎬ不同的干燥方式会对颗粒造成不同的影响ꎮ颗粒的物理属性是颗粒质量的重要方面ꎬ包括粒径㊁密度㊁孔隙率等微观特征ꎬ以及由这些微观特征所决定的均一性㊁堆积特性㊁流动性等宏观特性ꎮ其中ꎬ松密度ꎬ振实密度常常作为粉体的质量指标ꎬ休止角㊁压缩度等可以反映粉体的流动性ꎬ颗粒中的水的质㊀作者简介:马秀娟ꎬ女ꎬ主管药师ꎬ研究方向:药物制剂研发ꎬE-mail:348501313@qq.com通信作者:付清爽ꎬ男ꎬ工程师ꎬ研究方向:药物制剂研发ꎬTel:183****4160ꎬE-mail:qdrdfuqingshuang@163.com量分数也是表征粉体质量的重要参数[3]ꎮ粉体学性质不仅可考察物料固有理化性质ꎬ更能为制剂的处方设计和工艺筛选提供指导ꎮ颗粒的流动性好ꎬ可阻止压片过程中各成分的离析ꎬ增加片剂含量的均匀度ꎻ流动性差ꎬ则压片时ꎬ填充㊁混匀效果不理想ꎮ颗粒可压性好ꎬ可使片剂具有适宜的机械性质ꎻ可压性差ꎬ则易发生裂片㊁碎片[4]ꎮ本试验结合质量源于设计(QBD)的理念ꎬ以颗粒质量为目标ꎬ其流动性㊁可压性为关键质量属性ꎬ分析不同干燥方式对颗粒质量的影响ꎬ现介绍如下ꎮ1㊀仪器与试药1.1㊀仪器㊀HLSG-30P高效制粒混合机(浙江明天机械有限公司)ꎻ202型电热恒温鼓风干燥箱(山东潍坊精鹰医疗器械有限公司)ꎻDZF-6020真空干燥箱(北京雅士林实验设备有限公司)ꎻWBF-2G型多功能流化床(重庆英格造粒包衣技术有限公司)ꎻFZB-150粉碎整粒机(浙江小伦制药机械有限公司)ꎻZP10A旋转式压片机(北京国药龙立科技有限公司)ꎻSY-3片剂多用测定仪(上海黄海药检仪器有限公司)ꎻBT-1001智能粉体特性测试仪(丹东百特仪器有限公司)ꎻLHS16-A烘干法水分测定仪(上海精密科学仪器有限公司)ꎻPL403电子天平[梅特勒-托利多仪器(上海)有限公司]ꎮ1.2㊀试药㊀微晶纤维素(安徽山河药用辅料股份有限公司ꎬ批号:200611)ꎻ乳糖(FrieslandCampinaDMVB.V.ꎬ批号:1050FRK)ꎻ聚维酮(安徽山河药用辅料股份有限公司ꎬ批号:200623)ꎻ交联羧甲基纤维素钠(JRSPharmaGmbH&Co.KGꎬ批号:32010193135)ꎻ硬脂酸镁(厂家:安徽山河药用辅料股份有限公司ꎬ批号:210228)ꎮ2㊀方法与结果2.1㊀工艺介绍2.1.1㊀制粒㊀使用HLSG-30P高效制粒混合机进行制粒ꎬ将微晶纤维素㊁乳糖㊁聚维酮㊁交联羧甲基纤维素钠投入制粒机中ꎬ低速搅拌㊁剪切3minꎬ加入适量纯化水ꎬ继续低速搅拌㊁剪切4minꎬ最后ꎬ高速搅拌㊁剪切1minꎬ得湿颗粒ꎮ将湿颗粒均匀分为3份ꎮ2.1.2㊀烘箱干燥㊀将其中一部分湿颗粒使用电热恒温鼓风干燥箱进行干燥ꎬ将湿颗粒均匀分散在托盘上ꎬ采用40ħ进行干燥ꎬ开启鼓风ꎬ15min翻料1次ꎬ干燥至水分为3.2%停止干燥ꎬ记为样品1ꎮ2.1.3㊀减压干燥㊀将其中一部分湿颗粒使用DZF-6020真空干燥箱进行干燥ꎬ将湿颗粒均匀分散在托盘上ꎬ采用40ħ进行干燥ꎬ压力为2.67kPaꎬ干燥至水分为3.0%停止干燥ꎬ记为样品2ꎮ2.1.4㊀流化床干燥㊀将其中一部分湿颗粒使用WBF-2G型多功能流化床进行干燥ꎬ干燥温度为40ħꎬ干燥至水分为3.2%ꎬ停止干燥ꎬ记为样品3ꎮ2.1.5㊀粉碎混合㊀采用FZB-150粉碎整粒机进行粉碎整粒ꎬ样品1㊁样品2与样品3均使用相同的整粒频率㊁整粒筛网进行整粒ꎮ加入相同量的硬脂酸镁后ꎬ采用相同参数进行混合ꎮ2.2㊀粉体特性检测及综合评价2.2.1㊀流动性㊀采用智能粉体特性测试仪测定颗粒的休止角㊁压缩度㊁平板角(也称抹刀角)㊁均齐度等指标ꎬ计算流动性指数ꎬ综合评价颗粒的流动性ꎮ2.2.1.1㊀松密度(D0)㊀松密度(固定体积法):取干净100mL量杯放在天平上进行称量ꎬ读取空杯质量ꎮ将称量后的空杯放到仪器中的接料盘上ꎬ开启进料ꎬ样品通过出料口落入量杯中ꎬ当样品充满量杯并溢出后ꎬ停止进料ꎬ用刮板将多余的料刮出ꎬ并用毛刷将量杯外的粉扫除干净ꎬ用天平称量量杯与粉体的总质量ꎬ仪器自动计算出松密度ꎮ重复上述操作ꎬ测定3次ꎬ数据见表1ꎮ表1㊀样品松密度(g cm-3)样品样品1样品2样品3第一次测量0.57910.52310.5966第二次测量0.58140.51460.5911第三次测量0.57920.52220.5836平均值0.58000.52000.59002.2.1.2㊀振实密度(Df)㊀振实密度(固定体积法):取干净100mL量杯放在天平上进行称量ꎬ将100mL量杯与100mL延长筒连接ꎬ向量杯中加入样品(样品量要达到延长筒的一半以上)ꎬ盖上盖(防止样品飞溅)ꎬ再将量杯固定到振动组件上ꎬ放到仪器指定位置中ꎮ振动5min后ꎬ用刮板将多余的料刮出ꎬ并用毛刷将量杯外的粉扫除干净ꎬ用天平称量量杯与粉体的总质量ꎬ仪器自动计算出振实密度ꎮ重复上述操作ꎬ测定3次ꎬ数据见表2ꎮ表2㊀样品振实密度(g cm-3)样品样品1样品2样品3第一次测量0.67330.67360.6852第二次测量0.67960.66980.6951第三次测量0.68080.67210.6879平均值0.67800.67200.68902.2.1.3㊀休止角㊀将样品添加至加料漏斗中ꎬ启动进料ꎬ样品经出料口洒落到休止角平台上并逐渐形成锥体ꎮ当样品落满样品平台呈对称的圆锥体且在平台周围都有粉体落下时停止加料ꎮ进料完成后ꎬ仪器将自动拍摄图像并计算休止角ꎮ重复上述操作ꎬ测定3次ꎬ数据见表3ꎮ表3㊀样品休止角(ʎ)样品样品1样品2样品3第一次测量35.18641.15838.369第二次测量36.10642.55439.112第三次测量35.22542.72038.899平均值35.50642.14438.7932.2.1.4㊀平板角㊀平板角:用小勺将待测样品轻轻撒在接料盘中埋没平板ꎬ埋没平板粉的厚度要达到或超过堆料组件边沿的高度ꎮ注意加料时保持样品的自然松散状态ꎬ不要压或者整理接料盘中样品堆积的形状ꎮ开始测量后ꎬ接料盘会自动下落ꎬ拍摄平板上的粉体图像并进行分析计算ꎬ然后会进行1次敲击并再次拍摄图像并计算ꎮ重复上述操作ꎬ测定3次ꎬ数据见表4ꎮ表4㊀样品平板角(ʎ)样品样品1样品2样品3第一次测量39.15248.57948.332第二次测量40.01247.98447.321第三次测量39.23650.46047.695平均值39.46749.00847.7832.2.1.5㊀粒度分布㊀按照顺序输入每级筛子的孔径ꎬ从第七层到第一层依次为1400㊁850㊁355㊁250㊁180㊁150㊁75μmꎮ称量每一级筛子的重量ꎬ然后按照顺序安装固定在仪器上ꎮ称取10g样品ꎬ加入最上层ꎬ开启振动ꎮ结束后ꎬ再将每层筛子慢慢取下ꎬ依次在天平上称重ꎮ都读取完成后ꎬ便可得到筛分结果ꎬ数据见表5ꎮ表5㊀样品粒度分布(μm)样品样品1样品2样品3D10D60D10D60D10D60结果89.96255.5376.54244.3655.29220.332.2.1.6㊀压缩度㊀压缩度指粉体被压缩的能力ꎬ根据公式(1)计算压缩度ꎮ压缩度=Df-DoDoˑ100%(1)压缩度反映了粉体的流动性ꎬ压缩度小于20%时ꎬ粉体的流动性好ꎬ压缩度增大时流动性下降[5]ꎬ结果如表6ꎮ表6㊀样品压缩度(%)样品样品1样品2样品3结果14.45429.23116.7802.2.1.7㊀均齐度㊀均齐度指颗粒粒度分布的宽度ꎬ根据公式(2)计算均齐度ꎬ结果如表7ꎮ2.2.1.8㊀流动性评价[6]㊀使用Carr指数法(见表8)计算粉体流动性指数ꎮ根据颗粒休止角㊁压缩度㊁平板角㊁均齐度等指标测定结果ꎬ计算颗粒流动性指数(FW)ꎬ来综合评价颗粒的流动性ꎮ均齐度=D60/D10(2)表7㊀样品均齐度样品样品1样品2样品3结果2.8403.1933.985表8㊀流动性指数流动性评价流动性指数FW休止角/ʎ压缩度(%)平板角(ʎ)均齐度测试值指数F1测试值指数F2测试值指数F3测试值指数F4好90~100<2526~2930252422.5<56~910252322.5<2526~3031252422.512~45252322.580~893132~34352221201112~14152221203233~373822212067822212070~793637~394019.51817.51617~192019.51817.53940~444519.51817.5910~1112191817.560~694142~44451716152122~24251716154647~56601716151314~161717161540~594647~545514.512102627~303114.512106162~747514.512101819~212214.5121020~395657~64659753233~36379.8757677~89909.5752324~26279.575差0~196667~89904.5203839~45>454.5209192~99>994.5202829~35>354.520㊀㊀根据公式(3)计算流动性指数FWꎮFW=F1+F2+F3+F4(3)式中:FW为流动性指数ꎬF1为休止角指数ꎬF2为压缩度度指数ꎬF3为平板角指数ꎬF4为均齐度指数ꎮ使用不同的干燥方式对粉体流动性的影响较大ꎬ使用烘箱干燥颗粒流动性最佳ꎬ使用流化床干燥颗粒流动性次之ꎬ使用减压干燥颗粒流动性最差ꎮ2.2.2㊀可压性㊀可压性与粉体颗粒形变机制㊁颗粒形状大小有关ꎬ颗粒间结合面积越大ꎬ则粉体的压缩性越好[7]ꎮ成型性表示药物粉体在一定压力下紧密结合成片剂的能力ꎬ通常采用一定压力下抗张强度和施加于粉体的压力之间的关系进行评价ꎬ一定压力下ꎬ能形成较高抗张强度的粉体ꎬ具有较好的成型性[8]ꎮ成型性与粉体颗粒表面性质有关ꎬ颗粒间结合强度越高则粉体成型性越好[9]ꎮ表9㊀流动性评价样品样品1样品2样品3流动性指数836775㊀㊀采用ZP10A旋转式压片机进行压片ꎬ采用SY-3片剂多用测定仪对片剂的硬度进行检测ꎬ通过计算抗张强度ꎬ对颗粒进行可压性评价ꎮ2.2.2.1㊀抗张强度㊀抗张强度ꎬ即片剂破裂或断裂前能抵抗的最大张力ꎬ被广泛用来评价片剂的强度ꎬ其大小反映了物料结合力和压缩成型性的好坏ꎬ相同压力下ꎬ抗张强度越大ꎬ成型性越好[10]ꎮ采用ZP10A旋转式压片机在相同的压力下压片ꎬ置于干燥器中24hꎬ待完全弹性复原后测量平片的径向破碎力F㊁直径D㊁厚度Lꎬ利用以下公式(4)计算片剂的抗张强度ꎮ数据如下表(n=6)ꎮTS=2FπDL(4)表10㊀样品抗张强度样品样品1样品2样品3直径/mm999厚度/mm6.186.226.24破碎力/N78.479.177.4抗张强度/MPa0.8980.9000.8782.2.2.2㊀可压性评价㊀通过采用相同的压力㊁相同的冲模进行压片ꎬ并测量径向破碎力及片厚ꎮ通过对比ꎬ样品1㊁样品2及样品3的抗张强度基本一致ꎮ不同的干燥方式不会对物料的可压性造成影响ꎮ3 讨论通过对不同干燥方式获得的粉体进行研究ꎬ对比三者的流动性及可压性ꎮ干燥方式的不同会影响物料的流动性ꎬ烘箱干燥样品流动性最优ꎬ流化床干燥样品流动性次之ꎬ减压干燥样品的流动性最差ꎮ干燥方式对物料的可压性影响较小ꎬ三者的抗张强度几乎没有差异ꎮ烘箱干燥对温度控制准确ꎬ干燥速率较快ꎬ得到的颗粒性质最优ꎬ但效率低于流化床干燥ꎮ流化床干燥具有效率高ꎬ速度快ꎬ产量大的特点ꎬ对单一产品可连续生产ꎬ但得到的颗粒比较小ꎬ流动性一般ꎮ减压干燥常用于不耐高温的样品干燥ꎬ得到的颗粒流动性最差ꎮ参考文献:[1]㊀张炳胜ꎬ王峰.药物制剂技术[M].北京:中国医药科技出版社ꎬ2015:62-65.[2]MADERUELOCꎬZARZUELOAꎬLANAOJM.Criticalfactorsinthereleaseofdrugsfromsustainedreleasehy ̄drophilicmatrices[J].JControlReleaseꎬ2011ꎬ154(3):2-19.[3]刘涛ꎬ付春梅ꎬ唐玉ꎬ等.不同干燥方式对桑枝提取物物理指纹图谱及其总黄酮含量的影响[J].中国实验方剂学杂志ꎬ2018ꎬ24(20):65-69.[4]韩天燕ꎬ刘强ꎬ张万年ꎬ等.仙曲片粉体学性质考察及处方设计[J].中成药ꎬ2020ꎬ42(8):1982-1986. [5]李洁ꎬ杜若飞ꎬ冯怡.中药浸膏粉物理性质与干法制粒工艺的相关性研究[J].中国中药杂志ꎬ2011ꎬ36(12):1606-1609.[6]国家市场监督管理总局.GB/T31057.3-2018颗粒材料物理性能测试第3部分:流动性指数的测量[S].北京:中国标准出版社ꎬ2019.[7]王晨光ꎬ邓丽ꎬ施春阳ꎬ等.药物粉体可压性影响因素及改善策略[J].中国药学杂志ꎬ2013ꎬ48(11):845-849. [8]UPADHYAYPPꎬSUNCCꎬBONDAD.Relatingthetabletingbehaviorofpiroxicampolytypestotheircrystalstructuresusingenergy vectormodels[J].IntJPharmꎬ2018ꎬ543(1/2):46-51.[9]何英蒙ꎬ皮超ꎬ魏郁梦.粉体粒子的物理性质对片剂压缩成型性的影响[J].中国医药工业杂志ꎬ2019ꎬ50(5):478-489.[10]岳国超ꎬ陈丽华ꎬ管咏梅ꎬ等.新型直压辅料的粉体学性质评价[J].中国药房ꎬ2014ꎬ25(9):833-836.(收稿日期:2023-01-14)。
疫苗生产中纯化水与注射用水的质量控制研究
疫苗生产中纯化水与注射用水的质量控制研究方朝东;邱文娜;李磊;饶玲;熊吉滨;李健峰【摘要】Objective To analyze the quality control standard of purified water and water for injection used in biological products as raw materials. Methods The samples were collected from different sampling points respectively and examined referring to the latest regula-tions of ChP 2015 edition, and the quality of water was detected for 3 weeks. Results The quality index of the pure water and water for injection all accorded with the standard. Conclusion Excellent quality of water can be prepared by the water system and fits for the biological products.%目的:研究纯化水和注射用水作为生物制品生产中主要原辅料的质量控制标准。
方法分别在纯化水和注射用水不同水点取样,按2015年版《中国药典(二部)》最新规定进行检测,连续3周对其进行质量监测。
结果纯化水和注射用水的各项质量指标均符合规定。
结论该水系统制备出来的纯化水和注射用水质量优良,可用于疫苗生物制品生产。
【期刊名称】《中国药业》【年(卷),期】2016(025)011【总页数】4页(P69-71,72)【关键词】疫苗生产;纯化水;注射用水;质量控制【作者】方朝东;邱文娜;李磊;饶玲;熊吉滨;李健峰【作者单位】江苏泰州医药高新技术产业园区疫苗工程中心,江苏泰州 225300;江苏泰州医药高新技术产业园区疫苗工程中心,江苏泰州 225300;江苏泰州医药高新技术产业园区疫苗工程中心,江苏泰州 225300;江苏泰州医药高新技术产业园区疫苗工程中心,江苏泰州 225300;江苏泰州医药高新技术产业园区疫苗工程中心,江苏泰州 225300;江苏泰州医药高新技术产业园区疫苗工程中心,江苏泰州 225300【正文语种】中文【中图分类】TQ460.6﹢3纯化水和注射用水是疫苗等生物制品乃至药物制剂行业中用途最广、用量巨大的一种原辅料,其质量好坏将直接影响终产品的质量[1-2]。
纯蒸汽系统验证方案
目录1.0 方案审核及授权2.0 人员3.0 范围4.0概述5.0 职责6.0 方案/计划描述7.0验证目的8.0 验证程序9.0 验证实施9.1安装确认9.2运行确认9.3性能确认10.0 验证原始记录11.0 再验证周期12.0 结论批准附表2偏差表格和纯蒸汽检测记录1.0方案审核及授权。
授权起草人审核人批准人生效日期姓名:职务:签字:日期:姓名职务:签字:日期:姓名:职务:签字:日期:2.0人员所有负责执行此方案的人员必须按如下签字表格中进行签字。
签字内容包括:姓名、职务、日期等。
姓名 职务 签字 日期 李学成 质量部经理 景晓卫 车间主任 叶素芳 QA 主管 工艺员 QC 人员 QA 人员 马月芳 操作工 孙月平 操作工3.0范围3.1此方案适用于小容量注射剂车纯蒸汽系统的验证。
此方案按照GMP 要求,确定验证系统的验证方法及文件编号,保证被验证系统能以正确的方法验证并使系统运行满足使用要求 4.2 有足够的文件系统证明纯蒸汽系统能达到检测要求。
3.2 有足够的文件系统证明纯蒸汽系统能达到检测要求3.3 所有的必须适用性文件将表明验证在这个方案中将被确认和证明其有效性。
3.4 在方案的执行过程中遇到任何短缺的数据或异常情况应被作为偏差记录下来并审核确认。
异常情况将被调查并终止引起该情况的行动。
在执行的同时所有数据应及时记录,该方案中应包括最终的总结。
3.5验证时间: 年 月 日---- 年 月 日4.0概述4.1 制备:将纯水经纯蒸汽发生器制得。
4.2工艺流程图纯化水多效蒸馏机 工业蒸汽纯蒸汽 使用点4.3 设备生产厂家: 山东潍坊精鹰医疗器械有限公司。
出厂日期: 2011年8月设备型号一览表设备名称型号规格数量多效蒸馏水机LD1000-6 一台4.4设备主有技术参数压缩机工作压力 : 0.3MPa蒸馏水产量: 1000kg/h5.0职责职责描述:质量部经理负责验证方案的批准。
车间主任及QA经理负责验证方案的审核。
热原检查中家兔注射细菌内毒素后的升温情况考察
·71·药品评价 Drug Evaluation 2021,18(02)热原检查中家兔注射细菌内毒素后的升温情况考察李杨1,张晓杰1,尹敏1,王立增1,曹大伟1,郑霞2 1.山东泰邦生物制品有限公司,山东 泰安 271000;2.泰安市妇幼保健院,山东 泰安 271000[摘要]目的:考察细菌内毒素剂量与热原检查家兔法家兔体温的关系。
方法:选择未进行任何实验的家兔,每1 kg 家兔体质量分别静脉注射细菌内毒素0.25、0.5、1.0、2.0、2.5、5.0、10.0 EU ,观察家兔注射细菌内毒素后的升温情况。
结果:细菌内毒素注射剂量在0.5 EU/kg 之下时,家兔的体温稳定,在0.5 EU/kg 以上的细菌内毒素注射剂量时,家兔呈现不同温差的升温度数,注射剂量超过2 EU/kg 时,每组有至少一只家兔升温超过0.6 ℃。
结论:热原检查家兔法内毒素剂量>5 EU/kg ,家兔总体均有明显升温;内毒素注射剂量与家兔升温度数存在剂量关系。
[关键词]热原;内毒素类;体温变化;热原检查法;灵敏度;因果律DOI: 10.19939/ki.1672-2809.2021.02.03The Investigation on the Sensitivity of Rabbit Pyrogen TestLI Yang 1, ZHANG Xiaojie 1, YIN Min 1, WANG Lizeng 1, CAO Dawei 1, ZHENG Xia 21. Shandong Taibang Biological Products Co.,Ltd., Taian Shandong 271000, China;2.Taian Maternal and Child Health Care Hospital, Taian Shandong 271000, China.[Abstract] Objective: Investigate the relationship between the dose of bacterial endotoxin and the body temperature of rabbits with pyrogen test. Methods: Rabbits that have not undergone any experiment were selected, and 0.25, 0.5, 1.0, 2.0, 2.5, 5.0, and 10.0 EU were injected intravenously with bacterial endotoxin per 1kg rabbit body weight. Observe that the temperature rise after the rabbits were injected with bacterial endotoxin. Results: The effects of different doses of endotoxin on the body temperature of rabbits are significantly different. When the injection dose of bacterial endotoxin is 0.5 EU/kg, the body temperature of rabbits is stable. When the injection dose of bacterial endotoxin is above 0.5 EU/kg, the rabbits showed different temperature differences 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
项目位置
图 1-1 地理位置图
N 探伤室
大 门
图 1-2 厂区总平面布置图
1.3 产业政策符合性 山东潍坊精鹰医疗器械有限公司主要制造、销售制药机械,不属于《产业结构调整 指导目录(2011 年本) (修正)中限制类和淘汰类,符合国家产业政策。本项目为服务 于公司主体建设项目的辅助项目,因此本项目也符合产业政策。 1.4 利益-代价分析 本项目的建设有利于提高和保证公司产品质量,具有明显的经济效益和社会效益。 本项目总投资 50 万元,其中环保投资 5 万元,占总投资的 10%。本项目 1 座探伤 室,1 台 X 射线探伤机,与同类项目环保投资指标进行比较,环保投资比例合理、适当, 可保证环保措施的落实。根据下文分析,本项目采取辐射防护措施,保证探伤室外剂量 率和人员受照水平控制在标准范围内,具有较为明显的环境效益。 因此,从该项目的代价和利益方面分析,本项目对社会所带来的利益可以弥补其可 能引起的辐射危害,该项目的建设符合实践正当性。
1
(固定场所探伤) 。 本项目属使用 II 类射线装置。 1.2 项目概况 山东潍坊精鹰医疗器械有限公司位于潍坊,创建于 1958 年,有着 50 年的生产制造 历史,是中国国家食品药品监督管理局定点制造、销售制药机械的专业厂家,是中国制 药装备协会成员单位,中国制药设备重点制造企业。 山东精鹰是中国药品制剂制水设备生产线最大的制造企业,主导产品有多效蒸馏水 机、RO+EDI 高纯水设备、纯蒸汽发生器、多功能中药提取罐、板式浓缩器系统、自动 配料系统、各种药用罐体容器设备以及药用卫生管道分配系统的设计、施工;公司技术 中心通过了潍坊市质量技术监督局验收,是国内同行业中资质最全、技术力量雄厚、市 场占有率稳居前列的资深专业设计、制造制药设备厂家。产品除了满足国内广大客户的 需求外,还大量出口俄罗斯、埃及、印度、韩国、阿根廷等 30 几个国家和地区。 公司生产基地坐落于山东省潍坊市奎文区庄检路 2600 号(图 1-1) ,占地 61700 平 方米,建筑面积 51300 平方米,现有员工 460 余人,公司拥有国内一流的各类制水设备 的设计专家、 压力容器设计专家及各类专业人员组成的科研队伍约 70 人; 拥有由技术监 督局培训颁发证书的一流焊接技师组成的产品加工队伍约 40 人。 拥有雄厚的售后服务技 术力量。售后服务有 30 人,其中拥有工程师 8 人,助理工程师 12 人,技术人员 10 人, 是一座按照现代企业标准设计建造的拥有下料中心、数控加工中心、焊接中心、抛光中 心、测试中心的制药设备制造企业。 公司厂区西端车间(图 1-2 厂区总平面布置图)内建有探伤室一座,拟使用 X 射线 探伤机对其产品进行质量检验,探伤机在工作中可能对环境产生影响。根据现场勘察, 探伤室已建成,尚未投入使用。 为了维护公众利益,根据《中华人民共和国放射性污染防治法》 , 《中华人民共和国 环境影响评价法》 、 《建设项目环境保护条例》 、 《放射性同位素与射线装置安全和防护条 例》等法律法规对伴有辐射建设项目环境管理的规定,山东潍坊精鹰医疗器械有限公司 委托济南博瑞达环保科技有限公司对该公司 X 射线探伤机及探伤室应用项目进行辐射环 境影响评价。接受委托后,在进行现场勘察、充分收集和分析有关资料、实地辐射环境 监测等基础上, 依照 《辐射环境保护管理导则 核技术利用建设项目环境影响评价文件的 内容和格式》 (HJ10.1—2016) ,编制了该项目的辐射环境影响报告表。
项目名称:山东潍坊精鹰医疗器械有限公司 X 射线探伤机及探伤室应用项目 评价单位(盖公章) :济南博瑞达环保科技有限公司 法人代表(签章) : 环评项目负责人:杜召梅
编制人员情况 姓名 乔树苓 徐淑新 杜召梅 职 称 工程师 工程师 工程师 证书编号
B24660101000 B24660200400 B24660191200
√ Ⅱ类 □Ⅲ类 □
A E A
非密封放 □销售 射性物质 □使用 □生产 □销售
√ 使用 □
E A
其他 1.1 核技术应用项目的目的和任务
/
山东潍坊精鹰医疗器械有限公司主导产品有多效蒸馏水机、RO+EDI 高纯水设备、 纯蒸汽发生器、多功能中药提取罐、板式浓缩器系统、自动配料系统、各种药用罐体容 器设备以及药用卫生管道分配系统的设计、施工。因生产需要,拟在探伤室中使用 1 台 X 射线探伤机对生产产品进行质量检测,从而判断产品是否存在内部缺陷及缺陷类型, 通过及时检测和信息反馈,及时通知生产线,从而保证产品的生产质量。使用 X 射线探 伤机进行探伤检测,既能检测出产品的内在缺陷,保证产品质量;又对产品自身组织结 构没有任何破坏,做到了无损检测的目的。 本评价项目涉及 1 台 X 射线探伤机和 1 座探伤室。X 射线探伤机用于室内探伤作业
核技术利用建设项目
山东潍坊精鹰医疗器械有限公司 X 射线探伤机及探伤室应 2016 年 6 月
环境保护部监制
核技术利用建设项目
山东潍坊精鹰医疗器械有限公司 X 射线探伤机及探伤室应用项目
环境影响报告表
建设单位名称:山东潍坊精鹰医疗器械有限公司 建设单位法人代表(签名或签章) : 通讯地址:山东省潍坊市奎文区庄检路 2600 号 邮政编码:266520 电子邮箱: 联系人:于文辉 联系电话:18253690571
负责章节
工程分析与源项 辐射安全与防护 环境影响分析 辐射安全管理 结论与建议 审 核
签名
表 1 项目基本概况
建设项目名称 单位名称 法人代表 注册地址 项目建设地址 立项审批部门 建设项目总投 资(万元) 项目性质 放射源 □使用 □生产 应 用 类 型 射线装置
A E A
X 射线探伤机及探伤室应用项目 山东潍坊精鹰医疗器械有限公司 李忠林 联系人 于文辉 联系电话 18253690571
山东省潍坊市奎文区庄检路 2600 号 山东省潍坊市奎文区庄检路 2600 号厂区西端车间内 / 项目环保投 50
√ 新建 □
批准文号 投资比例 (环保 5 □其它 投资/总投资) 占地面积
/ 10% 100m2
资(万元) □改建 □扩建
□销售
□Ⅰ类 □Ⅱ类 □Ⅲ类 □Ⅳ类 □Ⅴ类 □Ⅰ类(医疗使用) □Ⅱ类 □Ⅲ类 □Ⅳ类 □Ⅴ类 □制备 PET 用放射性药物 / □乙 □丙 □Ⅱ类 □Ⅲ类 □Ⅱ类 □Ⅲ类
