GAMP5及计算机化系统验证相关知识课件
基于GAMP5的我国制药企业计算机化系统验证的应用研究

基于GAMP5的我国制药企业计算机化系统验证的应用研究我国2010版GMP第十四章附则第19条对计算机化系统的定义:用于报告或自动控制的集成系统,包括数据输入、电子处理和信息输出。
国际上对计算机化系统的定义绝大多数是引用了PIC/S检察指南PI011-3中的定义:计算机化系统是由计算机系统和被其控制的功能或流程组成。
从以上定义中可以看出,计算机化系统不仅仅包括计算机系统本身,还包括受控的功能和过程,甚至包括系统的运行环境。
图1为计算机化系统关系图。
计算机系统是一个媒介,连接着人员与设备,有资质的且经过培训的人员可以根据计算机系统得到相关设备或工艺的实时监控信息,从而根据操作规程对计算机系统进行操作,控制具体的工艺或设备,实现最终管理。
一、计算机化系统概述计算机化系统的组成在计算机化系统的所有组成部分中,计算机系统的硬件和软件是最重要的组成部分。
其中,把计算机系统软硬件分为标准化软硬件和定制类软硬件两类。
GAMP5中又将硬件分成两类,将软件分成四类,如图2所示。
硬件分为标准硬件与定制硬件。
目前,大部分公司所使用的硬件都属于标准硬件。
硬件具体说明如表1所示。
软件分为四种类别,这四种类别的分类是指导性的,其间并没有严格的分界线。
软件具体分类说明如表2所示。
制药企业计算机化系统的类型狭义的计算机化系统指的是自动化控制系统,但是除了自动化控制系统之外,广义的计算机化系统包括了整个自动化和信息化的系统,它涵盖了一切计算机设施,从简单的I/O设施、PLC可编程逻辑控制器到综合的计算机管理信息系统等,都属于计算机化系统。
据此,制药企业常用的计算机化系统的主要类型如图3所示。
制药企业计算机化系统验证制药企业计算机化系统验证是GMP管理的一个重要组成部分,根据GMP 的要求,制药企业计算机化系统验证是通过建立文件来证明计算机化系统能够提供满足用户需求的功能,并且能够稳定工作,包括应用程序的验证(软件方面的验证)和基础架构的确认(硬件方面的确认)。
个人整理-GAMP5-在仪器上的分类

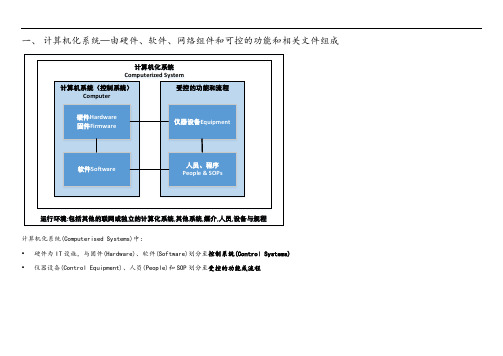
一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程二、GAMP5计算机系统硬件分类三、GAMP5计算机系统软件分类四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规范和验证规范活动有对应的验证步骤以确认是否满足了所有的规范要求。
对于大型的系统可能需要多层级的规范文件,而小型的、简单的或低风险的系统则只需把几个规范结合起来限可。
应该通过合适的验证步骤对规范进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、 类别3:不可配置软件的方法规范基本职责供应商质量管理体系简称:QMS典型的测试包括: ● 正确的安装● 表明系统符合预定用途并按照规定的要求进行系统验收 ● 根据供应商评估和风险评估结果决定进一步测试通常由被监管公司负责必须的规范和核实活动。
个人整理-GAMP5-在仪器上的分类资料

个人整理-G A M P5-在仪器上的分类一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规范和验证规范活动有对应的验证步骤以确认是否满足了所有的规范要求。
对于大型的系统可能需要多层级的规范文件,而小型的、简单的或低风险的系统则只需把几个规范结合起来限可。
应该通过合适的验证步骤对规范进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求七、传统的确认语与GAMP5活动之间的关系1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、 类别3:不可配置软件的方法规范基本职责供应商质量管理体系简称:QMS典型的测试包括:● 正确的安装● 表明系统符合预定用途并按照规定的要求进行系统验收● 根据供应商评估和风险评估结果决定进一步测试 通常由被监管公司负责必须的规范和核实活动。
GAMP5的基本概念和内容

●生命周期方法也有利推动质量源于设计(QbD)方法的推广。 (▲从产品原始设计、研发开始)
●生命周期方法是可以分划为不同的阶段和活动的。 (▲不同阶段,内容要求和不同)
(3)可增减的生命周期活动的概念。 生命周期活动内容可以根据以下三个因素增加或减少:
●系统对患者安全、产品质量和数据完整性三大要素影响的风险性。 ●系统和过程的复杂性和新颖性 ●供应商的能力 (▲从 3“性”分析和供应商方面的保障情况,决定灵活性程度)
(8)质量管理系统 QMS 内的持续改进。 (▲持续性)
(9)注重关键质量属性(CQA) (▲质量重点关键因素)
(10)注重提高 GXP 合规性的效率 (▲效率, 避免重复性工作)
(11) 注重现有文件和知识的利用 (效率,避免重复性工作,)
(12)注重可配置系统与开发模式 (▲考虑到目前大多计算机化系统是基于可配置软件包,重点在第 4 类软
●质量风险管理主要针对可能对患者安全、产品质量和数据完整性密切 有影响的关键质量属性、关键过程参数进行识别、监控和追溯,至少确保使这些 风险最终能被降低到可接受的范围。
(▲风险管理主要是根据对与患者安全、产品质量和数据完整性关系密
切的关键质量属性、关键过程参数的影响。最低目标是使风险可降低到可接受的 范围。)
另外,应该注意的是,虽然在 GAMP 中也提供一些通常性方法上的参考, 但是面对各种类型的计算机化系统,实际是上还是需要我们认真研究和了解被 验证对象及其应用过程以后,才有可能形成真正合理的可操作的验证方案。所 以如何真正理解 GAMP 的概念,根据不同的计算机化系统的特点和要求,分门 别类建立真正科学、合理和可操作的验证模式,将是一个意义重大的课题。只 有这个问题解决好了,所谓的计算机化系统验证才有可能在我国制药行业合理 地普遍展开。
计算机化系统验证培训课件

1.所谓计算机系统验证(CSV) (3)
药品生产厂房
监视・控制设备 指示仪器/记录计 指示 控制系统 控制
计算机系统验证
测定値
测量仪表 (流量、温度、压力、其他)
操作仪器 生产设备/公用设备/设施
校正
关于药品生产厂房仪器控制设备以及验证
1.所谓计算机系统验证(CSV) (5)
总部功能 生产管理系统
3.中国GMP附录计算机化系统4
第十五条 当人工输入关键数据时,应当复核输入记录以确保其准 确性。这个复核可以由另外的操作人员完成,或采用经验证的电 子方式。必要时,系统应当设置复核功能,确保数据输入的准确 性和数据处理过程的正确性。 第十六条 计算机化系统应当记录输入或确认关键数据人员的身份。 只有经授权人员,方可修改已输入的数据。每次修改已输入的关 键数据均应当经过批准,并应当记录更改数据的理由。应当根据 风险评估的结果,考虑在计算机化系统中建立数据审计跟踪系统, 用于记录数据的输入和修改以及系统的使用和变更。 第十七条 计算机化系统的变更应当根据预定的操作规程进行,操 作规程应当包括评估、验证、审核、批准和实施变更等规定。计 算机化系统的变更,应经过该部分计算机化系统相关责任人员的 同意,变更情况应有记录。 第十八条 对于电子数据和纸质打印文稿同时存在的情况,应当有 文件明确规定以电子数据为主数据还是以纸质打印文稿为主数据。
2.美欧日三国CSV相关法规・指南(2)
其他 ICH
International Conference on Harmonization of Technical Requirement for Registration of Pharmaceuticals for Human Use (日美欧发起的人用药品注册技术要求国际协调会议:关于协调新药 申报技术要求的合理化和一致化的国际会议) ICH Q7、Q8、Q9、Q10
个人整理_GAMP5 在仪器上地分类
一、计算机化系统—由硬件、软件、网络组件和可控的功能和相关文件组成计算机化系统Computerized System计算机系统(控制系统)Computer受控的功能和流程硬件Hardware 固件Firmware软件Software 仪器设备Equipment人员、程序People & SOPs运行环境:包括其他的联网或独立的计算化系统,其他系统,媒介,人员,设备与规程计算机化系统(Computerised Systems)中:•硬件为IT设施,与固件(Hardware)、软件(Software)划分至控制系统(Control Systems)•仪器设备(Control Equipment)、人员(People)和SOP划分至受控的功能或流程二、GAMP5计算机系统硬件分类三、GAMP5计算机系统软件分类四、使用系统在整个生命周期实现合规与符合预定用途的通用方法1、计算机化系统生命周期●概念提出●项目实施●系统运行●系统退役2、规和验证规活动有对应的验证步骤以确认是否满足了所有的规要求。
对于大型的系统可能需要多层级的规文件,而小型的、简单的或低风险的系统则只需把几个规结合起来限可。
应该通过合适的验证步骤对规进行确认。
使用系统在整个生命周期实现合规与符合预定用途的通用方法五、USP 1058对实验仪器的分类六、GAMP5 在实验仪器里的应用及验证要求1软件不能进行配置:是指软件模块可根据需求进行配置,并不是指对仪器进行配置。
注意:有关计算机化系统确认术语的使用,特别是运行和性能确认之间的关系,在不同公司之间是不相同。
以上的比较仅仅提供一个一般的解释,而并不是强制性的。
八、 类别3:不可配置软件的方法规范基本职责供应商质量管理体系简称:QMS典型的测试包括: ● 正确的安装● 表明系统符合预定用途并按照规定的要求进行系统验收 ● 根据供应商评估和风险评估结果决定进一步测试通常由被监管公司负责必须的规和核实活动。
采用GMAP5方法的计算机化系统验证的生命周期文件及活动(课件)

科学技术进步
法规变更升版
实践指南生成 与应用
ISPE GAMP5 PIC/S PI011‐3检察指南 FDA Part11工业指南 CFDA 药品GMP指南
GAMP5旨在提供一种切合检察官、制药企业和供应商习惯的计算机化系统验证 及管理的方法平台,从而达到高效合规。
2/80
1
2014/6/24
目录
缩写 TM VSR ISPE GAMP QMS PLC DCS SCADA ERP LIMS MES BMS EMS CSV UPS
英文 Traceability Matrix Validation Summary Report International Society Of Pharmaceutical Engineering Good Automated Manufacturing Practice Quality Management System Programmable Logic Controller Distributed Control System Supervisory Control And Data Acquisition Enterprise Resource Planning Laboratory Information Management System Manufacturing Execution Systems Building Management System Environment Monitoring System Computer System Validation Uninterruptible Power Supply
7/80
CFDA GMP征求意见稿《计算机化系统》
第四条 应使用科学的风险评估方法来决定计算机化系统验证的范 围与程度。应当将验证看作计算机化系统“生命周期”的一个组 成部分。 第七条 软件是计算机化系统的重要组成部分。软件的使用者应当 根据风险评估的结果,对于所采用软件进行分级管理(如针对软 件供应商的审计),保证软件的编制过程符合质量保证系统的要 求。 第十条数据的输入或修改只能由经许可的人员进行。杜绝未经许 可的人员输入数据的手段有:使用钥匙、密码卡、个人密码和限 制对计算机终端的访问。
采用GMAP5方法的计算机化系统验证的生命周期文件及活动(课件)

16/80
8
2014/6/24
计算机化系统验证常见术语2
名称 可追溯矩阵 验证总结报告 国际制药工程协会 良好自动化生产实践指南 质量管理系统 可编程逻辑控制器 集散控制系统 数据采集与监视系统 企业资源计划 实验室信息管理系统 生产执行系统 楼宇管理系统 环境监视系统 计算机系统验证 不间断电源
系统是否控制不良事件或投诉的记录或报告?
系统是否支持药物安全监视?
关键系统做验证,非关键系统GEP调试即可
缩写 VMP QPP URS FS HDS SDS SMS DQ SCR SMT FAT SAT IQ OQ PQ
英文 Validation Master Plan Quality and Project Plan User Requirement Specification Function Specification Hardware Design Specification Software Design Specification Software Module Specification Design Qualification Source Code Review Software Module Test Factory Acceptance Test Site Acceptance Test Installation Qualification Operation Qualification Performance Qualification
Critical Process Parameter 关键工艺参数
Critical Quality Attribute 关键质量属性
Electronic Record; Electronic Signature 电子记录与电子签名
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
软件
硬件 固件
操作规程与人 员
设备
控制系统
受控的功能与流程
计算机化系统
Industry Regulators行业监管机构
- Regulate to ensure safety of drugs that any of us might take!
PART 820 QUALITY SYSTEM REGULATION
质量系统规则第820部分
EMEA
• Validation: The extent of validation necessary will depend on a number of factors including the use to which the system is to be put, whether the validation is to be prospective or retrospective and whether or not novel elements are incorporated. Validation should be considered as part of the complete life cycle of a computer system. This cycle includes the stages of planning, specification, programming, testing, commissioning, documentation, operation, monitoring and modifying. 验证:验证的范围基于一组包含应用于系统的因素,无论验证是预见 性的还是回顾性的,无论有无新元素的使用。验证应该被认为是计算 机系统完整生命周期的部分。这个周期包括设计,规范,编程,测 试,调试,文档,运行,监控和修改。
US FDA
• Automated processes. When computers or automated data processing systems are used as part of production or the quality system, the manufacturer shall validate computer software for its intended use according to an established protocol. All software changes shall be validated before approval and issuance. These validation activities and results shall be documented. 自动化过程。当计算机或自动数据处理系统做为生产或质 量系统的一部分时,制造商需要验证计算机软件系统是按 照预先设计使用的。所有软件变更在准许使用前是可验证 的。这些验证的活动和结果应该被文档记录。
Different Terminology不同的术语
• Computerised Systems计算机系统 • Automation Systems自动化系统 • Control Systems控制系统 • Control Equipment控制设备 • Data Management systems 数据管理系统
FDA中国的 FDA)
EMEA (European Medicines
Evaluation Agency
‐incluБайду номын сангаасes MHRA and
HC‐SC
(Health Canada – Sante Canada)加拿 大卫生部
equivalents from other
EU countries) (欧洲药品管理局‐包括 MHRA 英国药管局和其它 欧盟国家的对等机构)
NIHS (National Institute of Health
FDA (Food and Drug
Science)(国立环境健康科学 研究院)
Administration)
食品与药物监督管理局
MCC (Medicine Control Council) 药品控制委员会
TGA (Therapeutic Goods Administration) 治疗产品管理局
GAMP5及计算机化系统验证相关知识
GAMP5
(Good Automated Manufacturing Practice) 良好自动化生产实践指南
A Risk Based Approach to Compliant GxP Computerised System
遵从GxP计算机化系统监管的风险管理方法
Computerised System: A system including the input of data, electronic processing and the output of information to be used either for reporting or automatic control 计算机系统:系统中包括数据输入,电子化处理和用于报告或自控的信息输出 SFDA: Good Manufacturing Practice for pharmaceutical products (Draft for comment)
-通过管理保证我们任何人都可能用到的药品的安全
- All have the power to refuse imports if their regulations are not met.
-如不符合管理规定,任何人都有权拒绝。 MHRA
SFDA (Chinese
(Medicines and Healthcare Products Regulatory Agency ‐ was previously the MCA) (药品及保健产 品管理局‐前身为药品监督局)
SFDA:药品生产质量管理规范(征求意见稿)
Introduce 简介
GAMP5( Good Automated Manufacturing Practice -Rev5) GAMP是由国际制药工程协会(ISPE)主编的实践指南。自90年代以来,不断 改版的良好自动化生产实践指南被广泛使用并得到国际监管部门的公认。它是 计算机化系统验证的指导方针。GAMP5是GAMP的第5版本。
