举例说明保护基团的作用
第五章保护基团

锂化合物的全部反应。反应完毕,l,3-二噻环己烷化合物可在
高汞离子存在下用酸水解,变为羰基化合物。
43
例3 合成
44
例4 合成
45
例5 合成
46
5.5 羧基常用的保护
形成羧酸酯的形式被保护,
常用甲酯、乙酯、叔丁酯或苄酯。
叔丁酯用酸除去,苄酯用氢解法除去。 还可用酰胺和酰肼来保护羧基 。
甲酯和乙酯可以用羧酸直接与甲醇或乙醇发生酯化反应制得,又 可以被碱水解。 叔丁酯可由羧酸先变为酰氯,再与叔丁醇作用,或者通过羧酸与 异丁烯直接作用而得。它不能氢解,在通常条件下也不被氨解及 碱催化水解 。 苯甲酯可由羧酸与苯甲基卤在碱性条件下反应而得。它除了可在 强酸性或碱性条件下水解,还可以被氢解 。
2-叔丁氧羰基氧亚胺基苯乙腈
N O O N
23
O
NH2 COOH
Boc 2O NaOH, t -BuOH, H 2 O 78%
NH2.HCl HO COOMe
Boc2 O Et3 N 95% HO
NHB
C
H N Boc 2O HN O DMAP, Et N
24
B
N Boc
N
常用脱保护剂:三氟乙酸/CH2Cl2、HF/H2O
25
2、苄氧羰基(Cbz或Z) • 常用保护试剂:苄氧甲酰氯(CbzCl) • 常用脱保护剂:催化氢解、锂氨还原
26
27
3、 9-芴甲氧基羰基(Fmoc):常用于多肽合成 常用保护试剂:Fmoc-Cl(9-fluorenylmethoxycarbonyl-Cl) 常用脱保护剂:NH3, Et2NH(DEA), 哌啶(六氢吡啶) ,吗啡啉
11
5.1.3 生成烷基醚保护基
有机合成课件保护基团

要点二
详细描述
在有机合成中,酮是一种常见的反应物和产物,但它的羰 基容易受到氧化和还原等反应的影响。为了保护酮的羰基 ,可以使用各种保护基团,如甲氧羰基、乙氧羰基、丙氧 羰基等。这些保护基团可以与酮形成稳定的化学键,从而 避免酮参与不必要的反应。
THANKS
谢谢
详细描述
在有机合成中,羧酸是一种常见的反应物和产物,但它的羧基容易受到脱羧和氧化等反应的影响。为了保护羧酸 ,可以使用各种保护基团,如甲酯、乙酯、丙酯等。这些保护基团可以与羧酸形成稳定的化学键,从而避免羧酸 参与不必要的反应。
醛基保护基团的应用实例
总结词
醛基保护基团能够保护醛免受氧化和还原等反应的影响。
保护。
硅氧基
如三甲基硅氧基,常用 于醇的保护,易于脱去
。
磷酸酯基
如磷酸三乙酯、磷酸三 丁酯等,适用于醇的保
护,并可耐强酸。
氨基保护基团
乙酰基
常用于伯胺的保护。
苯磺酰基
适用于仲胺和叔胺的保护,可 在酸性条件下脱去。
甲磺酰基
适用于仲胺的保护,可在酸性 条件下脱去。
丙酮肟基
适用于伯胺的保护,可在酸性 条件下脱去。
羧基保护基团
甲酯基
常用于羧酸的保护,可在碱性条件下脱去。
苯甲酯基
适用于不活泼羧酸的保护,可在碱性条件下 脱去。
乙酯基
适用于羧酸的保护,可在碱性条件下脱去。
氨基甲酸酯基
适用于羧酸的保护,可在酸性或碱性条件下 脱去。
醛基保护基团
烯丙基
常用于醛的保护。
苯甲酰基
适用于醛的保护,可在酸性条件下脱 去。
乙酰基
亲核加成反应
在形成氮-保护基团时,通常发 生亲核加成反应,即试剂进攻有 机物中的硝基、磺酸酯等基团,
有机合成中的保护反应与去保护反应

有机合成中的保护反应与去保护反应有机合成是化学领域中的一个重要分支,广泛应用于药物合成、材料科学等领域。
在有机合成中,保护反应和去保护反应被广泛应用于有机化合物的构建与转化。
保护反应用于保护或掩蔽某些化学官能团,以防止其在反应过程中发生不期望的副反应,而去保护反应则是将保护基去除,还原其原有的化学性质。
本文将介绍有机合成中的保护反应与去保护反应的基本原理、常用的保护基和去保护方法,并阐述其应用的重要性。
一、保护反应的原理与常用保护基保护反应是在有机分子中引入保护基,以保护特定的化学官能团不被反应损伤或发生不期望的副反应。
保护基的引入可通过化学修饰或反应进行,常用的保护基有酯、醚、酮、酮醇、醚醚等。
这些保护基能够形成稳定的结构,避免官能团发生意外的反应。
下面将介绍几种常用的保护基及其原理。
1. 酯保护基:酯是较为常见的保护基之一,它可通过酸催化下的酯化反应引入。
酯保护基通常通过酸催化下的脱保护反应去除,恢复原有的官能团。
2. 醚保护基:醚保护基通常是通过醚化反应引入。
醚保护基可以通过酸或碱的催化下的脱保护反应去除。
3. 酮保护基:酮保护基通过酮化反应引入。
酮保护基的脱保护反应多数需要强酸或强碱的催化。
二、去保护反应的原理与常用方法去保护反应是将有机化合物中的保护基去除,还原其原有的化学性质。
常用的去保护反应方法有酸催化、酸加热、碱催化、金属还原等。
1. 酸催化:酸催化下的脱保护反应常用于酯、醚等保护基的去除。
酸催化下保护基的脱除可以通过加热或追加其他试剂实现。
2. 酸加热:有些保护基在酸性条件下通过加热即可脱除。
这种方法常用于有机分子中的酮保护基的去除。
3. 碱催化:碱催化下的去保护反应常用于醚、酮醇等保护基的脱除。
碱的选择要根据官能团的稳定性和反应条件来确定。
4. 金属还原:金属还原法是通过金属还原剂将有机分子中的保护基还原为相应的官能团。
这种方法可应用于一些特殊的保护基脱除,例如醛酮的去保护反应。
举例说明保护基团的作用
word 格式-可编辑-感谢下载支持
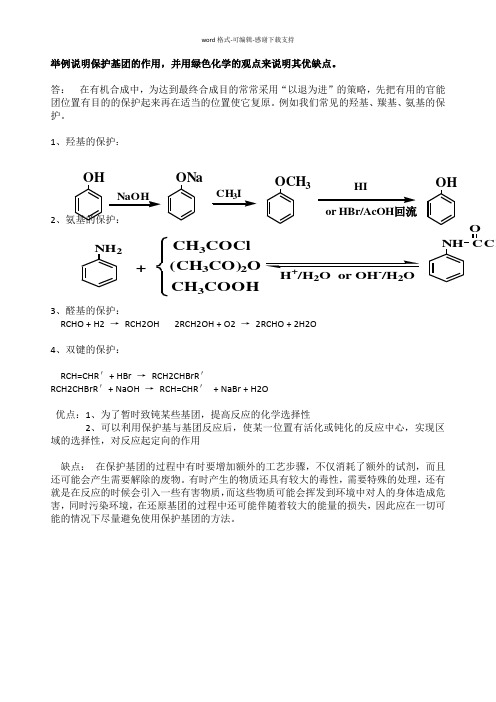
举例说明保护基团的作用,并用绿色化学的观点来说明其优缺点。
答: 在有机合成中,为达到最终合成目的常常采用“以退为进”的策略,先把有用的官能团位置有目的的保护起来再在适当的位置使它复原。
例如我们常见的羟基、羰基、氨基的保护。
1、羟基的保护:
2
、氨基的保护:
3、醛基的保护:
RCHO + H2 →
RCH2OH 2RCH2OH + O2 → 2RCHO + 2H2O
4、双键的保护:
RCH=CHR '+ HBr → RCH2CHBrR ' RCH2CHBrR '+ NaOH → RCH=CHR ' + NaBr + H2O
优点:1、为了暂时致钝某些基团,提高反应的化学选择性
2、可以利用保护基与基团反应后,使某一位置有活化或钝化的反应中心,实现区域的选择性,对反应起定向的作用
缺点: 在保护基团的过程中有时要增加额外的工艺步骤,不仅消耗了额外的试剂,而且还可能会产生需要解除的废物。
有时产生的物质还具有较大的毒性,需要特殊的处理,还有就是在反应的时候会引入一些有害物质,而这些物质可能会挥发到环境中对人的身体造成危害,同时污染环境,在还原基团的过程中还可能伴随着较大的能量的损失,因此应在一切可能的情况下尽量避免使用保护基团的方法。
NH 2+CH 3COCl (CH 3CO)2O CH 3COOH NH CCH
O H /H 2O or OH /H 2O OH ONa OCH 3HI or HBr/AcOH 回流OH。
有机合成基团保护

有机合成中基团保护的综述提要:有机基团的保护是有机合成中很重要的反应方法之一。
本文综述了基团保护的基本原理,从基团的结构和反应活性的角度, 对羟基、羰基和氨基的保护进行了分析并介绍了常用的保护方法, 阐明了基团保护在有机合成中的重要作用。
关键词:有机合成基团保护在有机合成中,对于含有多个官能团的化合物, 除特定部位或基团发生预期反应外, 还常常导致其他部位或基团发生变化, 结果不仅使得反应产物变得复杂, 而且有时还会导致所需反应的失败。
最理想的合成路线是希望只在所需要的部位上发生反应,而其它部位不受任何干扰,为了解决这一问题,常常采取保护基团的策略,将作用物分子中不希望反应的敏感部位如羟基、羰基、氨基等用合适的保护基团掩蔽起来,待反应完成后再恢复原来的基团,这种方法就是有机合成中的基团保护。
1 、基团保护与保护基所谓基团保护,就是在合成时先将要保护的基团反应掉,待条件适宜时,再将其复原。
基团保护一般采用基团保护基的方法, 即用保护试剂与被保护的基团发生反应, 使其在某一条件下失去反应活性, 从而使不希望发生的副反应不能进行或活性降低。
一般来说, 基团保护的目的是为了拉大主副反应的活性差距, 使希望发生的反应活性更高, 而使不希望发生的反应活性降低。
根据被保护基团的性质不同,需要采取不同的方法加以保护。
由于亲核试剂的活性取决于其富电子程度, 一些亲核试剂如氨基、羟基等的保护, 是围绕着降低其中心元素的电子云密度进行的。
对于典型的亲电试剂如羰基, 为了使其免受亲核试剂的进攻, 采取的措施是使羰基碳的电子云密度增加, 亲电活性降低。
有机合成若需要基团保护,须给两类信息:基团保护的反应;被保护基团的“还原”反应。
去保护基是在反应后, 选择合适的反应条件将保护基去除。
例如, 为了防止酚羟基被氧化, 常常是使它生成酚醚, 完成反应之后再与氢碘酸反应生产原来的酚。
基团保护需要选择使用合适的保护基。
从基团保护的角度考虑,理想的保护基标准为:(1) 在温和的条件下, 保护基容易有选择性地与被保护基团反应;(2) 保护基引入到被保护的基团上后, 其性质在保护阶段的各种反应条件下应该是稳定的, 能够防御其他试剂的“侵袭”, 在反应过程中不发生变化;(3) 保护基在完成保护任务之后, 在不破坏分子其他部位的条件下,保护基易于在温和条件下除去;(4) 保护基的引入和去除应操作简单, 收率要高;(5) 若需要对两个或两个以上的基团进行保护时, 在选择保护基时必须注意保护基团的引入和去除互不干扰。
第7章基团的保护

CH2Cl O OH 砒 啶 或 Ph 3CCl 苄醚 O CPh3 CH2
H2
/ Pd-C 催化氢 解
或 Na / C2H5OH
OH H2O, HOAc r. t. 易水解
三 苯甲醚
(5)叔丁基醚 叔 丁 基 醚 对 强 碱 性 条 件 稳 定, 但 可 以 为 烷 基 锂 和
Grignard 试 剂 在 较 高 温 度 下 进 攻 破 坏。 它 的 制 备 一 般 用
2、缩醛和缩酮衍生物
(1)四氢吡喃醚
O OH , TsO H O O 混合型缩醛结构 H2O , H+ OH
Et 2O
H+ O O
RO H RO H O
-H
+
RO
O
一元醇在TsOH存在下与二氢吡喃作用生成四氢吡喃醚。 对碱、格氏试剂、烷基锂、氢化铝锂、烃化剂和酰化剂均稳定。
缺点是:不能用于在酸性介质中进行反应。此外,若用于旋光性醇, 由于引入了一个新的手性中心,将导致生成非对映异构体的混合物, 分离困难,造成产率降低。然而它在室温条件下,即能进行催化水解。
O R R'
(MeO)3CH, MeOH InCl3(5mol%) Cyclohexane reflux HO(CH2)nOH InCl3(5mol%)
第二节 羟基的保护
①
RR'C-CH2CH2OH OH R'H + RCOCH2CH2OMgX
H2O
+
RCOCH2CH2OH + R'MgX
③ Na R''X ②
RCOCH2CH2OR''
④ R'MgX H3O
有机物官能团保护

保护基与被保护的官能团反应,起到“钝化”保护作用,反应后,保护基在温和条件下与外加修饰试剂反
和Ars—作磷酸的—oH保护基,可分别用py、I z和cucl
z
在温和条件下活化,形成活性反应中心。在毗啶作用下,氯甲基变成吡啶翁甲基吸电子基团,使苯氧基易离去,在特定位置上 形成反应活性中心这种方法已成功地用于舍成,并且使合成过程大大简化。例如利用此法可晟简便地合成胆碱—∞P。
RNHa・pheoeH2S02Cl
——*RNHs02cHtcoph塑竺望竖型兰:Q}
昶一二=NH
》勘eH。e。pn跫等哥虽NH
州/Ns。2eH2e。ph—I西南
4、c=c的保护
c=c双键易发生加成,氧化反应,在合成中有时需要保护。常用的保护方法有二卤代反应,一般是加溴, 还可以使c=c形成环氧化合物,脱保护基时可在乙酸中使用锌处理,使双键再生。
CH2~o卜{
eH20Cph
o
己H:-。H
咛!i璺曼!,6H:旬i
亡H2。cp秘
e15H3{8一cI
CH2一oCp魏3 CH—oCoCl 5H3{ eH2一oCpn3
6H2一。H戮7
墼器:慧c洲。,
eH,一oH
以上例子中两个羟基能够被选择性地保护反应和脱除,同样利用不同保护基可实现同时用于六羟基化合
加以掩蔽,待反应完成后,再恢复原来的基团,这就是官能团的保护。 官能团保护一般采用官能团保护基的策略,引入保护基后,当经过必须反应后,不得损坏其它官能团,反应选择性高,收 率要尽可能好,同时易被除去。随着有机合成的技术不断发展,保护基在合成中的作用除所谓只是暂时使之“钝化”外,还有 高选择性区域反应的保护基等。下面将这两类主要的保护基分别介绍:
有机化学试题库及答案

有机化学试题库及答案一、选择题1. 下列化合物中,哪一个是醇?A. 甲烷B. 乙醇C. 乙酸D. 甲酸答案:B2. 哪个反应是酯化反应?A. 醇与酸反应生成酯和水B. 醇与碱反应生成盐和水C. 醇与卤素反应生成卤代烃D. 醇与醇反应生成醚答案:A3. 以下哪个是芳香族化合物?A. 甲烷B. 乙炔C. 苯D. 丙烯答案:C4. 哪个是碳正离子的稳定化效应?A. 诱导效应B. 共轭效应C. 场效应D. 氢键效应答案:A5. 以下哪个是亲核取代反应?A. 卤代烃的水解B. 醇的脱水C. 醛的氧化D. 酯的水解答案:A二、填空题6. 芳香族化合物的特点是含有______个π电子的环状共轭系统。
答案:4n+27. 碳正离子的稳定性与其电荷分布有关,其中______位碳正离子最为稳定。
答案:叔8. 有机反应中,亲核试剂通常攻击底物的______原子。
答案:碳9. 碳链异构体是指具有相同分子式但______不同的化合物。
答案:碳链结构10. 有机化合物的命名通常遵循IUPAC规则,其中“醇”的后缀是______。
答案:-ol三、简答题11. 简述什么是SN1和SN2反应机制,并说明它们的主要区别。
答案:SN1反应是单分子亲核取代反应,反应过程中底物首先发生碳正离子的形成,然后亲核试剂攻击碳正离子形成产物。
SN2反应是双分子亲核取代反应,亲核试剂同时攻击底物的碳原子,导致底物的离去基团被取代。
主要区别在于SN1反应有碳正离子中间体,反应速率只与底物浓度有关;而SN2反应没有中间体,反应速率与底物和亲核试剂的浓度都有关。
12. 描述什么是共轭效应,并举例说明其在有机化学中的重要性。
答案:共轭效应是指在含有交替单双键的分子中,π电子可以在整个共轭系统中分布,从而降低分子的能量,增加稳定性。
例如,在丁二烯中,由于共轭效应,分子的能量比两个分开的乙烯分子的总和要低,这使得丁二烯比预期的更稳定。
四、计算题13. 某醇与足量的羧酸反应生成酯和水,已知醇的摩尔质量为46g/mol,羧酸的摩尔质量为60 g/mol,反应生成的酯的摩尔质量为106 g/mol。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
举例说明保护基团的作用,并用绿色化学的观点来说明其优缺点。
答: 在有机合成中,为达到最终合成目的常常采用“以退为进”的策略,先把有用的官能团位置有目的的保护起来再在适当的位置使它复原。
例如我们常见的羟基、羰基、氨基的保护。
1、羟基的保护:
2、氨基的保护:
3、醛基的保护: RCHO + H2 → RCH2OH 2RCH2OH + O2 → 2RCHO + 2H2O
4、双键的保护:
RCH=CHR '+ HBr → RCH2CHBrR '
RCH2CHBrR '+ NaOH → RCH=CHR ' + NaBr + H2O
优点:1、为了暂时致钝某些基团,提高反应的化学选择性
2、可以利用保护基与基团反应后,使某一位置有活化或钝化的反应中心,实现区域的选择性,对反应起定向的作用
缺点: 在保护基团的过程中有时要增加额外的工艺步骤,不仅消耗了额外的试剂,而且还可能会产生需要解除的废物。
有时产生的物质还具有较大的毒性,需要特殊的处理,还有就是在反应的时候会引入一些有害物质,而这些物质可能会挥发到环境中对人的身体造成危害,同时污染环境,在还原基团的过程中还可能伴随着较大的能量的损失,因此应在一切可能的情况下尽量避免使用保护基团的方法。
NH 2
+
C H 3C O C l (C H 3C O )2O C H 3C O O H NH CCH O H +/H 2O or OH -/H 2O O H O Na NaOH CH 3I O CH 3HI or HBr/AcOH 回流O H。
