镁—过氧化氢半燃料电池简易装置
高考化学电化学腐蚀讲义

高考化学—-电化学腐蚀—-讲义(1)对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
(2)对同一金属来说,在不同溶液中腐蚀速率的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。
(3)活动性不同的两种金属,活动性差别越大,腐蚀速率越快。
(4)对同一种电解质溶液来说,电解质浓度越大,金属腐蚀越快。
两种保护方法的比较外加电流的阴极保护法保护效果大于牺牲阳极的阴极保护法。
例题解析1、如图所示,各烧杯中盛有海水,铁在其中被腐蚀的速度由快到慢的顺序为A。
②①③④⑤⑥B。
⑤④③①②⑥C、⑤④②①③⑥D。
⑤③②④①⑥2、利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀B、若X为锌棒,开关K置于M处,铁电极的反应:Fe−2e−Fe2+C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀D。
若X为碳棒,开关K置于N处,铁电极的反应:2H++2e−H2↑3、利用如图装置进行实验,开始时,左右两管液面相平,密封好,放置一段时间、下列说法正确的是A、左管中O2得到电子,右管中H+得到电子B。
一段时间后,左管液面低于右管液面C、a、b两处具有相同的电极反应式:Fe−3e−Fe3+D、a处溶液的pH增大,b处溶液的pH减小4、铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。
下列说法不正确的是A、因铁的金属性比铜强,因此铁铆钉被氧化而腐蚀B、若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小C、铜极上的反应是2H++2e−H2↑、O2+4e−+4H+2H2OD、在金属表面涂一层油脂,能防止铁铆钉被腐蚀巩固练习1、[2019江苏][双选]下列说法正确的是A、反应N2(g)+3H2(g)2NH3(g)的ΔH< 0,ΔS >0B、地下钢铁管道用导线连接锌块能够减缓管道的腐蚀C。
江西省宜丰二中2020届高三化学一轮强化训练《化学电池》能力提升试题卷 Word版含答案

江西宜丰二中2017届高三化学一轮强化训练《化学电池》能力提升试题卷第I卷选择题一、选择题1、镍氢电池比碳锌或碱性电池有更大的输出电流,更适合用于高耗电产品。
镍氢电池的总反应式是。
下列叙述错误的是( )A.电池充电时,氢元素被还原B.电池放电时,镍元素被氧化C.电池放电时,氢气在负极反应D.电池放电时,电池负极周围溶液的碱性减弱2、某燃料电池的装置如下图所示,在工作中石墨A电极反应生成一种氧化物Y,下列说法正确的是( )A.石墨A极为正极,石墨B极为负极B. Y的化学式可能为NOC.石墨B极上发生氧化反应D.石墨A极的电极反应式为3、下列说法中正确的是( )A.锌锰干电池是二次电池B.铝片、锌片、导线和高橙组成的水果电池,负极是锌片C.锂电池的电解质可选择KOH溶液D.氢氧燃料电池工作时O2为正极,发生还原反应。
4、一种充电电池放电时的电极反应为H2+2OH—2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是( )A. H2O的还原B. NiO(OH)的还原C. H2的氧化D. NiO(OH)2的氧化5、某氢氧燃料电池的电解液是热的KOH溶液,在正极上氧气被还原,在负极上氢气被氧化,下列有关该电池的叙述正确的是( )A.负极反应式为:H2+2OH- -2e- =2H2OB.正极反应式为:O2 +4H+十4e- =2H2OC.工作一段时间后,KOH溶液的浓度不变D.电池工作时,电子由正极通过外电路流向负极6、燃料电池是燃料(例如CO,H2,CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质通常是KOH溶液。
下列关于甲烷燃料电池的说法不正确的是( )A.负极反应式为CH4+10OH--8e=CO32-+7H2OB.正极反应式为O2+2H2O+4e=4OH-C.随着不断放电,电解质溶液碱性不变D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大7、镁―过氧化氢燃料电池具有能量高、安全方便等优点,其结构示意图如图所示。
镁过氧化氢电池电极反应式

镁过氧化氢电池电极反应式镁过氧化氢电池是一种新型的电池技术,它的电极反应式是镁与过氧化氢发生氧化还原反应。
这种电池利用镁作为负极材料,过氧化氢作为正极材料,通过电解质的传导来实现电子流动,从而产生电能。
在镁过氧化氢电池中,负极为镁,正极为过氧化氢。
镁是一种常见的金属元素,具有良好的电导性和化学稳定性。
而过氧化氢则是一种氧化剂,它能够与镁发生氧化还原反应,产生电子。
镁过氧化氢电池的电极反应式可以表示为:镁 + 过氧化氢 -> 镁离子 + 氧气 + 水这个反应式表示了镁在电池中的氧化反应和过氧化氢的还原反应。
在这个反应中,镁被氧化为镁离子,同时过氧化氢被还原为水和氧气。
在这个反应中,镁起到了负极的作用,它释放出电子,从而形成了电流。
过氧化氢则起到了正极的作用,它接受了电子,并与镁发生反应。
通过这个反应,电子从负极流向正极,从而产生了电能。
镁过氧化氢电池具有很多优点。
首先,镁是一种丰富的资源,相比于其他电池中常用的金属材料,镁的成本更低。
其次,镁过氧化氢电池具有较高的能量密度,可以提供更长的使用时间。
此外,镁过氧化氢电池还具有较低的自放电率和良好的环境友好性。
然而,镁过氧化氢电池也存在一些挑战和限制。
首先,镁在水中容易发生氧化反应,导致镁的利用率低。
其次,镁的离子在电池中移动速度较慢,限制了电池的放电速率。
此外,镁过氧化氢电池的正极材料过氧化氢也不易获取,制备过程较为复杂。
为了解决这些问题,研究人员一直在努力改进镁过氧化氢电池的性能。
他们通过改变电解质的组成和浓度,优化负极和正极的结构,以提高电池的性能。
同时,他们还在探索新的材料和技术,以进一步提高镁过氧化氢电池的能量密度和稳定性。
镁过氧化氢电池的电极反应式为镁与过氧化氢的氧化还原反应。
这种电池利用镁作为负极材料,过氧化氢作为正极材料,通过电解质的传导实现电子流动,产生电能。
尽管镁过氧化氢电池存在一些挑战和限制,但研究人员仍在不断努力改进电池的性能,以推动其在能源领域的应用。
高中化学(新人教版)选择性必修一课后习题:化学电源(课后习题)【含答案及解析】

化学电源课后篇素养形成必备知识基础练1.下列有关电池的叙述正确的是()A.手机用的锂离子电池属于一次电池B.锌锰干电池中,锌电极是负极C.氢氧燃料电池工作时氢气在负极被还原D.太阳能电池的主要材料为二氧化硅,A项错误;锌锰干电池中锌失去电子,发生氧化反应,作负极,B 项正确;氢氧燃料电池工作时,氢气在负极失电子被氧化,C项错误;太阳能电池的主要材料为硅,光导纤维的主要材料是二氧化硅,D项错误。
2.据报道,锌电池可能取代目前广泛使用的铅酸蓄电池,因为锌电池容量更大,而且没有铅污染,其电池总反应为2Zn+O22ZnO,原料为锌粒、空气和电解质溶液。
则下列叙述正确的是()A.锌为正极,空气进入负极反应B.电池中有1 mol 电子转移时消耗Zn的质量为65 gC.正极发生氧化反应D.电解质溶液肯定不是强酸溶液ZnO生成,故电解质溶液不可能为强酸溶液,否则ZnO会溶解。
3.碱性电池具有容量大、放电电流大的特点,故得到广泛应用。
锌锰碱性电池以KOH溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)Zn(OH)2(s)+2MnO(OH)(s)。
下列说法错误的是()A.电池工作时,锌失去电子B.电池正极的电极反应式为2MnO2(s)+2H2O(l)+2e-2MnO(OH)(s)+2OH-(aq)C.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g解析根据题意,该电池的负极材料是锌。
电池工作时,锌本身失去电子而发生氧化反应,失去的电子由负极通过外电路移向正极;正极上,MnO2获得电子发生还原反应生成MnO(OH):2MnO2+2H2O+2e-2MnO(OH)+2OH-。
反应中,外电路每通过0.2 mol电子,消耗掉0.1 mol锌,质量为6.5 g。
4.(2019浙江4月选考)化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是()A.甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加B.乙:正极的电极反应式为Ag2O+2e-+H2O2Ag+2OH-C.丙:锌筒作负极,发生氧化反应,锌筒会变薄D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降解析Zn比Cu活泼,为负极,Zn失电子变Zn2+,电子经导线转移到铜电极,铜电极负电荷变多,吸引了溶液中的阳离子,因而Zn2+和H+迁移至铜电极,H+氧化性较强,得电子变H2,因而Cu极附近溶液中c(H+)减小,A项错误;Ag2O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH作电解质溶液,故电极反应式为Ag2O+2e-+H2O2Ag+2OH-,B项正确;Zn为较活泼电极,作负极,发生氧化反应,电极反应式为Zn-2e-Zn2+,锌溶解,因而锌筒会变薄,C项正确;铅酸蓄电池总反应式为PbO2+Pb+2H2SO42PbSO4+2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项正确。
原电池金属的腐蚀和防护
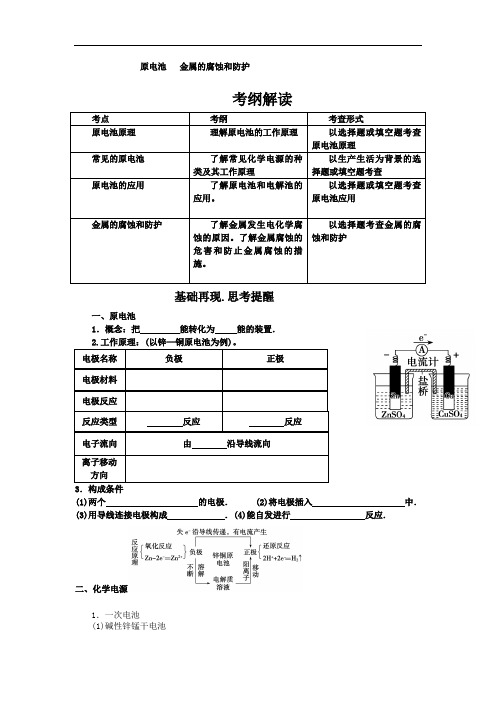
原电池金属的腐蚀和防护考纲解读考点考纲考查形式原电池原理理解原电池的工作原理以选择题或填空题考查原电池原理常见的原电池了解常见化学电源的种类及其工作原理以生产生活为背景的选择题或填空题考查原电池的应用了解原电池和电解池的应用。
以选择题或填空题考查原电池应用金属的腐蚀和防护了解金属发生电化学腐蚀的原因。
了解金属腐蚀的危害和防止金属腐蚀的措施。
以选择题考查金属的腐蚀和防护基础再现.思考提醒一、原电池1.概念:把能转化为能的装置.2.工作原理:(以锌—铜原电池为例)。
电极名称负极正极电极材料电极反应反应类型反应反应电子流向由沿导线流向离子移动方向3.构成条件(1)两个的电极. (2)将电极插入中.(3)用导线连接电极构成.(4)能自发进行反应.二、化学电源1.一次电池(1)碱性锌锰干电池负极反应:________________________________________________________________________;正极反应:2MnO 2+2H 2O +2e -===2MnOOH +2OH -; 总反应式:Zn +2MnO 2+2H 2O===2MnOOH +Zn(OH)2。
(2)锌银电池 负极反应:________________________________________________________________________;正极反应:Ag 2O +H 2O +2e -===2Ag +2OH -; 总反应式:Zn +Ag 2O +H 2O===Zn(OH)2+2Ag 。
2.二次电池(可充电,可多次重复使用) 如铅蓄电池:H 2SO 4作电解质溶液 负极反应:________________________________________________________________________;正极反应:PbO 2+2e -+4H ++SO 2-4===PbSO 4+2H 2O ; 总反应式:Pb +PbO 2+2H 2SO 42PbSO 4+2H 2O 。
2023年福建省福州市第十九中学中考三模化学试题(含答案)

2023年福建省福州市第十九中学中考三模化学试题学校:___________姓名:___________班级:___________考号:___________一、单选题1.分类是研究物质的常用方法。
下列物质属于纯净物的是A.洁净的空气B.液氮C.石油D.赤铁矿2.中华文字博大精深,下列成语的本意主要涉及化学变化的是A.火上浇油B.滴水成冰C.刻舟求剑D.春风化雨3.中国菜肴讲究色、香、味、形、器,一代代厨师研究出五花八门的菜式也是极受大众喜爱,例如北京烤鸭、兰州拉面、福州牛滑等,其中福州牛滑主要富含的营养成分是A.无机盐B.维生素C.蛋白质D.糖类4.2023年全国两会政府工作报告中指出今年要推动发展方式绿色转型,持续打好蓝天、碧水、净土保卫战。
“爱护自然、保护环境”是永恒的主题。
下列做法不利于保护环境的是A.日常生活垃圾分类处理B.农业上提倡合理使用农药和化肥C.工厂加高烟囱,直接排放废气D.积极植树造林,增大绿化面积5.古代“打火机”—火折子是将少量硫磺、土纸和棉花等混合物点燃后置于竹筒中,使火种不熄灭(仅剩火星)。
使用时拔下竹帽,对着竹筒吹气,即刻出现火苗。
下列有关说法不正确的是A.竹筒和竹筒内的填充物均属于可燃物B.吹气降低了“火折子”中可燃物的着火点C.吹气增加了竹筒里的氧气的含量,火种才重新燃烧D.盖上竹帽竹筒里仍有少量的空气,火种才没有熄灭6.正确的实验操作是实验成功的保证,下列实验操作正确的是A.称量氢氧化钠固体B.给氧气验满.测定溶液.蒸发.茶是中华传统文化的重要裁体之一,茶叶的化学成分主要是茶碱(说法正确的是.茶碱中含有4种非金属元素.茶碱充分燃烧的产物只有二氧化碳和A .甲物质的溶解度大于乙物质的溶解度B .在t 1°C 时,甲、乙两物质溶液溶质质量分数相等C .在t 2°C 时,H 点表示甲物质的饱和溶液D .由t 1°C 升温到t 2°C 时,甲物质溶液溶质质量分数不变9.下列实验方案设计不合理的是8C10.某研究小组进行空气中氧气含量的验证实验。
镁燃料电池
镁燃料电池的研究进展摘要:镁燃料电池具有高比能量、安全和成本低等特点,在军事和民用方面有良好的应用前景。
综述了各种镁燃料电池系统的工作原理,概括了近年来在镁阳极、阴极电催化剂与结构、电解质添加剂等方面的研究与进展。
关键词:镁燃料电池;镁阳极;阴极;添加剂(1. Meilin chemical factory, Zunyi Guizhou 563003, China; 2. Harbin Institute of Technology, Harbin Heilongjiang 150001, China)Abstract: Magnesium fuel cell has a favorable application potential in military and civilian fields because of its high energy density, safety and low cost. The working mechanisms of several kinds of magnesium fuel cell systems were summarized. In addition, the research progress on magnesium anode, electrocatalyst and structure of cathode, electrolyte additive were also discussed.Key words: magnesium fuel cell; magnesium anode; cathode; additive1 引言镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运、可使用温度范围宽(–20℃~80℃)及污染小等特点[1]。
作为一种高能化学电源,拥有良好的应用前景,因此很多研究学者与单位对其进行了研究。
2020届高考化学二轮题型对题必练——镁电池(强化练习题)
2020届高考化学二轮题型对题必练——镁电池(强化练习题)1 / 182020届高考化学二轮题型对题必练——镁电池(强化练习)1. 2009年,美国麻省理工学院的唐纳德•撒多维教授领导的小组研制出一种镁一锑液态金属储能电池。
该电池工作温度为700摄氏度,其工作原理如图所示:该电池所用液体密度不同,在重力作用下分为三层,充放电时中间层熔融盐的组成及浓度不变。
下列说法正确的是( )A. 该电池放电时,正极反应式为Mg 2+−2e −=MgB. 该电池放电时,Mg(液)层生成MgCl 2,质量变大C. 该电池充电时,Mg −Sb(液)层中Mg 发生氧化反应D. 该电池充电时,熔融盐中的Cl −进入Mg −Sb(液)层2. 锂—铜空气燃料电池是一种“高容量、低成本”的新型电池。
该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li +Cu 2O +H 2O =2Cu +2Li ++2OH -。
下列说法不正确的是( )A. 通空气时,铜腐蚀表面产生Cu 2OB. 整个过程中,铜相当于催化剂C. 放电时,正极的电极反应式为Cu 2O +H 2O +2e −=2Cu +2OH −D. 放电时,电子透过固体电解质向Cu 极移动3.镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-.下列有关说法正确的是()A. 电池工作时,正极a附近的pH将增大B. 电池工作时,C溶液中的溶质是MgCl2C. 负极反应式:ClO−+2e−+H2O=Cl−+2OH−D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1 mol Cl−4.电化学在日常生活中用途广泛,图①是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O的工业废水的处理,下列说法正确的是()A. 图②中离子向惰性电极移动,与该极附近的OH−结合转化成Cr(OH)3除去B. 图②的电解池中,有0.084g阳极材料参与反应,阴极会有33.6mL的气体产生C. 图①中发生的还原反应是:Mg2++ClO−+H2O+2e−=Cl−+Mg(OH)2D. 若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀5.交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。
2013-2014学年度深圳中学化学暑假作业(九)
2013-2014学年度深圳中学化学暑假作业(九)电化学说明:此卷仅为竞赛体系理科学生作业,其他体系学生不做。
1.下列关于写图所示原电池的叙述中,正确的是A.质量减轻的一极是铜极B.负极反应为Fe—2e→ Fe2+C.该装置将电能转变为化学能D.电流由负极经导线流向正极2.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是()A.a电极是负极B.b电极的电极反应为:4OH--4e-==2H2O+O2↑C.氢氧燃料电池是一种具有应用前景的绿色电源D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置3.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。
电池总反应为:4Al + 3O2 + 6H2O = 4Al(OH)3,下列说法不正确...的是()A.正极反应式为:O2 + 2H2O + 4e- = 4OH-B.电池工作时,电流由铝电极沿导线流向铂电极C.以网状的铂为正极,可增大与氧气的接触面积D.该电池通常只需更换铝板就可继续使用4.某课外活动小组用如图所示装置进行实验(电解液足量)。
下列说法中错误的是A.圈l中,若开始实验时开关K与a连接,则B极的电极反应式为B.图l中,若开始实验时开关K与b连接,则一段时间后向电解液中通入适量HCl气体可恢复到电解前的浓C.图2中,若开始实验时开关K与a连接,则电解液的溶质质量分数变小D.图2中,若开始实验时开关K与b连接,则A极减少的质量等于B极增加的质量5.下列叙述正确的是A.在电解池的阴极和原电池的负极上都发生氧化反应B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2D.用惰性电极电解饱和NaCl溶液,若有lmol电子转移,则生成l molNaOH6.用质量均为100g的铜作电极,电解硝酸银溶液(足量),电解一段时间后,两电极的质量差为28g,此时两电极的质量分别为( )A.阳极100g,阴极128g B.阳极93.6g,阴极121.6gC.阳极91.0g,阴极119.0g D.阳极86.0g,阴极114.0g7.将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如下图所示)。
高中化学实验装置图汇总(带图示)
高中化学实验装置图汇总(带图示) 人教版高中化学实验装置图汇总(必修一)第一章第一节:化学实验基本方法实验装置仪器药品清单备注过滤:漏斗、烧杯、玻璃板、铁架台(带铁圈)、滤纸,药品:固液混合物。
蒸发:蒸发皿、酒精灯、玻璃棒、铁架台,药品:食盐水溶液。
蒸馏:蒸馏瓶、酒精灯、铁架台、冷凝管、锥形瓶,药品:液体混合物。
分液:分液漏斗、烧杯、铁架台(带铁圈),注意:蒸发过程中要不断搅拌,在加热至有大量固体析出时要用余温加热。
加热前一定要检验装置的气密性。
实验名称实验原理过滤:固体与液体混合物的分离。
蒸发:分离溶剂中的溶质。
蒸馏:混合物中各组分的沸点不同。
分液:物质在互不相容的溶剂里的溶解度不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来。
进行分液操作之前一定要进行检漏。
萃取:仪器:容量瓶、量筒、烧杯、玻璃棒、胶头滴管、托盘天平,药品:氯化钠固体、蒸馏水。
第一章第二节:化学计配制一定量浓度的溶液量在实验中的应用C=n/V:计算溶液的浓度。
XXX效应:当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路”。
第二章第一节:物质的分类加热金属钠:钠受热后,与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体,过氧化钠。
仪器:小刀、铁架台(带铁圈)、酒精灯,药品:金属钠。
金属钠和水的反应:活泼金属和水的剧烈反应。
仪器:小刀、烧杯,药品:蒸馏水、金属钠、酚酞。
铝与盐酸和氢氧化钠溶液的反应:铝是两性金属,既能和酸反应又能和碱反应。
仪器:试管、架子,药品:盐酸溶液、氢氧化钠溶液。
注意检查生成的气体。
第三章第一节:金属的化学性质过氧化钠可以与水反应生成氧气。
仪器:试管,药品:过氧化钠、蒸馏水。
鉴别碳酸钠与碳酸氢钠:酸式碳酸盐和正盐的通过加热来鉴别。
仪器:大试管、铁架台、试管、酒精灯,药品:碳酸钠粉末、碳酸氢钠粉末、澄清石灰水。
焰色反应:仪器:酒精灯、铂丝,药品:盐酸、各种溶液。
很多金属或它们的化合物在燃烧时会产生特殊的颜色。
