2018-2019学年福建省厦门双十中学高二上学期第二次返校考试化学试题(扫描版)
福建省厦门双十中学2017-2018学年高二下学期期中考试化学试题(含答案)
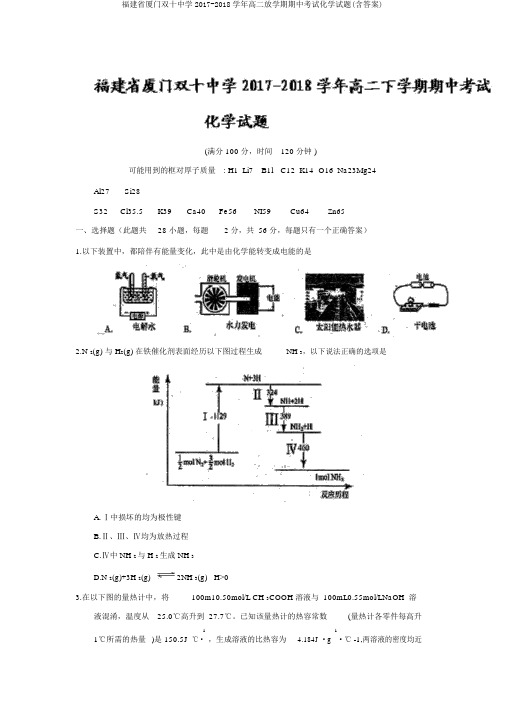
(满分 100 分,时间120 分钟 )可能用到的框对厚子质量: H1Li7B1l C12K14O16Na23M g24 Al27Si28S32Cl35.5K39Ca40Fe56NI59Cu64Zn65一、选择题(此题共28 小题,每题 2 分,共 56 分,每题只有一个正确答案)1.以下装置中,都陪伴有能量变化,此中是由化学能转变成电能的是2.N 2(g) 与 H2(g) 在铁催化剂表面经历以下图过程生成NH 3,以下说法正确的选项是A.Ⅰ中损坏的均为极性键B.Ⅱ、Ⅲ、Ⅳ均为放热过程C.Ⅳ中 NH 2与 H 2生成 NH 3D.N 2(g)+3H 2(g)2NH 3(g) H>03.在以下图的量热计中,将100m10.50mol/L CH 3COOH 溶液与 100mL0.55mol/LNaOH 溶液混淆,温度从25.0℃高升到 27.7℃。
已知该量热计的热容常数(量热计各零件每高升1℃所需的热量)是 150.5J-1,生成溶液的比热容为-1℃· 4.184J ·g·℃ -1,两溶液的密度均近似为 lg/mL. 以下说法错误的选项是A. 若量热计的保温瓶绝热成效不好,则所测△ H偏大B.该实验测得反响放出的热量为2665.7JC.该实验测得的中和热ΔH为-45.2KJ/molD.所加 NaOH 溶液过度,目的是保证CH 3COOH 溶液完整被中和4.硼化钒 VB 2空气电池是当前储电能力最高的电池,电池表示图以下图,该电池工作时反应为 4VB 2+ 11O2===4B 2O3+ 2V 2O5。
以下说法正确的选项是A. 电极 a 为电池负极,发生复原反响每耗费 1molVB 2转移 6mol 电子C.电池工作时,OH-向电极 a 挪动D.VB 2极发生的电极反响为2VB 2+22OH -- 22e- =V 2O5+2B 2O3+11H 2O5.已知 C(s)+H 2O(g)=CO(g)+H 2(g)H=AKJ/mol2C(s)+O2(g)=2CO(g)H=-220KJ/mol若 H-H 、O=O 和 O-H 键的键能分别为436/496 和 462Kj/mol, 则 a 为A.+130B.+350C.-332D.-1186.用以下图装置除掉含CN -、Cl -废水中的CN -时,控制溶液的 PH 为 9-10, 阳极产生的 ClO -将 CN -氧化为两种无污染的气体。
福建省厦门双十中学2018_2019学年高二化学暑假第一次返校考试试题

厦门双十中学201&—2019 学年高二(上)暑假第一次返校适应性考试化学试卷(本试卷共100 分,完成时间:90 分钟)可能用到的相对原子质量:H-1 C-12 N-14 0-16 Na-23 Cl-35.5 Fe-56 Cu-64 S-32—、单选题(本大题共5小题,共10 分)1. 《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生批就置火上,以器覆之,令础烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。
”文中涉及的操作方法是A. 蒸馏B.升华C.干馏D.萃取2. 下列说法错误的是A. 1H、2H、H+和Ha是氢元素的四种不同粒子B. 2400Ca 和2402Ca 、石墨和金刚石均为同位素C. 11H 和12H 是不同的核素D. 12C 和14C 互为同位素,物理性质不同,但化学性质几乎完全相同3. 目前已知化合物中数量、品种最多的是碳的化合物,下列关于其原因的叙述中不正确的是A. 碳原子之间,碳原子与其他原子(如氢原子)之间都可以形成4 个共价键B. 碳原子性质活泼,可以与多数非金属元素原子形成共价键C. 碳原子之间既可以形成稳定的单键,又可以形成双键和三键D. 多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合4. 下列叙述正确的是A. 煤经过气化、液化等物理变化可转变为清洁燃料B. 棉、麻、丝、有机玻璃都是天然高分子材料C. 颗粒(微粒直径约为2.5 x10 -6m分散在空气中形成气溶胶D. 青铜、黄铜、碳素钢都属于合金5. 下列对于反应3N02 + H 20 = 2HNO3+N0的说法中正确的是A. 氧化剂与还原剂的质量比为1:2B. N02是氧化剂水是还原剤C. 生成IMolNO则有6mol电子发生转移D.氧化剂与还原剂的物质的量比为 2:1二、单选题(本大题共 30小题,共90分) 6.根据下列短周期元素性质的数据判断,下列说法正确的是①d】③ !④⑤r® ⑧原子半矽疔% 0.661.36 113140 1 0.99 LS4124最厲价或最低价-2+ 2+ 1'+5 -3+ 7 -1+ 1P +5”3 + 3A. 元素④⑤形成的化合物是离子化合物B. 元素⑦位于第二周期第 V 族C. 元素①⑧形成的化合物具有两性D. 元素③的最高价氧化物对应水化物的碱性最强 7. 如图为元素周期表中短周期的一部分。
福建省厦门双十中学2018-2019学年高二下学期第二次月考化学试题含解析

厦门双十中学2018—2019学年高二 (下)第二次月考化学试卷可能用到的相对霣子成量:H-l C-12 N-14 0-16 Na-23 Cl-35.5 Fe-56 Cu-64 S-32一、单选题(本大雇共16小共48分)1.磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A. 合理处理废旧电池有利于保护环境和资源再利用B. 从“正极片”中可回收的金属元素有Al、Fe、LiC. “沉淀”反应的金属离子为Fe3+D. 上述流程中可用硫酸钠代替碳酸钠【答案】D【解析】分析:正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶,过滤后滤渣是炭黑,得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,滤液中加入碳酸钠生成含锂的沉淀,据此解答。
详解:A、废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再利用,A正确;B、根据流程的转化可知从正极片中可回收的金属元素有Al、Fe、Li,B正确;C、得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是Fe3+,C正确;D、碳酸锂沉淀,硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠,D错误。
答案选D。
点睛:本题以废旧电池的回收为载体考查金属元素的回收,明确流程中元素的转化关系是解答的关键,题目难度不大。
2.高温高压液态水具有接近常温下弱酸的c(H+)或弱碱的c(OH−),油脂在其中能以较快的反应速率水解。
与常温常压水相比,下列说法不正确...的是A. 高温高压液态水中,体系温度升高,油脂水解反应速率加快B. 高温高压液态水中,油脂与水的互溶能力增强,油脂水解反应速率加快C. 高温高压液态水中,c(H+)增大,可催化油脂水解反应,且产生的酸进一步催化水解D. 高温高压液态水中的油脂水解,相当于常温下在体系中加入了相同c(H+)的酸或相同c(OH−)的碱的水解【答案】D【解析】【详解】A.对于任何化学反应,体系温度升高,均可加快反应速率,A项正确;B.由于高温高压液态水中,c(H+)和c(OH−)增大,油脂水解向右移动的倾向变大,因而油脂与水的互溶能力增强,反应速率加快,B项正确;C.油脂在酸性条件下水解,以H+做催化剂,加快水解速率,因而高温高压液态水中,c(H+)增大,可催化油脂水解反应,且产生的酸进一步催化水解,C项正确;D.高温高压液态水中的油脂水解,其水环境仍呈中性,因而不能理解成相当于常温下在体系中加入了相同c(H+)的酸或相同c(OH−)的碱的水解,而是以体系升温、增加水和油脂的互溶以及提高水中H+浓度的方式,促进油脂的水解,D项不正确。
最新-福建省厦门双十中学2018学年(上)高二质量检测化学必修+选修5试题 精品

厦门双十中学2018—2018学年(上)高二质量检测化学必修+选修5试题(本试卷分Ⅰ、Ⅱ两卷,满分100分考试时间90分钟)相对原子质量:H:1 C:12 O:16 Cu:64第Ⅰ卷(选择题48分)一、选择题:(本题共16小题,每小题3分,共48分,每小题只有一个选项符合题意)1.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。
在地球上,氦元素主要以42He的形式存在。
下列说法中正确的是A.42He原子核内含有4个质子B.32He和42He互为同位素C.32He原子核内含有3个中子D.42He的最外层电子数为2,所以42He具有较强的金属性2.下列实验操作中,有错误的是A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出B.蒸馏时,温度计水银球应浸没在液体中C.蒸馏时,冷却水应从冷凝管的下口通入,上口流出D.把适量FeCl3饱和溶液加入200ml 沸水中煮沸一会而制取Fe(OH)3胶体3.下列试剂中能用来区分Fe2+和Fe3+的是A.KSCN B.FeCl3C.H2SO4D.NH4Cl 4.下列物质的溶液中通适量CO2气体,不产生白色沉淀的是A.AlCl3B.C6H5O Na C.NaAlO2D.Na2SiO3 5.下列变化中,不属于水解反应的是A.吃馒头或米饭,多咀嚼后产生甜味B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色C.鱼虾放置过久产生难闻的腥臭气味D.油脂与氢氧化钠溶液共煮制得肥皂6.互称为同分异构体的物质不可能A.具有相同的相对分子质量B.具有相同的熔、沸点和密度C.具有相同的分子式D.具有相同的组成元素7.下列物质均有漂白作用,其漂白原理相同的是①次氯酸②臭氧③二氧化硫④活性炭A.①②B.①③C.③④D.①②③8.下列有机物分子中所有的原子..一定处于同一平面的是A.CH3CH=CH2B.CH3CH2CH=CH2C.CH2=CH—CH=CH2D.C6H5—C≡CH9.二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调、冰箱和冷冻库等中的致冷剂。
福建省厦门双十中学高二地理上学期第二次返校考试试题(扫描(2021年整理)

福建省厦门双十中学2018-2019学年高二地理上学期第二次返校考试试题(扫描版)
编辑整理:
尊敬的读者朋友们:
这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(福建省厦门双十中学2018-2019学年高二地理上学期第二次返校考试试题(扫描版))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为福建省厦门双十中学2018-2019学年高二地理上学期第二次返校考试试题(扫描版)的全部内容。
福建省厦门双十中学2018_2019学年高二化学下学期第二次月考试题(含解析)

厦门双十中学2018—2019学年高二 (下)第二次月考化学试卷可能用到的相对霣子成量:H-l C-12 N-14 0-16 Na-23 Cl-35.5 Fe-56 Cu-64 S-32一、单选题(本大雇共16小共48分)1.磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A. 合理处理废旧电池有利于保护环境和资源再利用B. 从“正极片”中可回收的金属元素有Al、Fe、LiC. “沉淀”反应的金属离子为Fe3+D. 上述流程中可用硫酸钠代替碳酸钠【答案】D【解析】分析:正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶,过滤后滤渣是炭黑,得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,滤液中加入碳酸钠生成含锂的沉淀,据此解答。
详解:A、废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再利用,A正确;B、根据流程的转化可知从正极片中可回收的金属元素有Al、Fe、Li,B正确;C、得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是Fe3+,C正确;D、碳酸锂沉淀,硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠,D错误。
答案选D。
点睛:本题以废旧电池的回收为载体考查金属元素的回收,明确流程中元素的转化关系是解答的关键,题目难度不大。
2.高温高压液态水具有接近常温下弱酸的c(H+)或弱碱的c(OH−),油脂在其中能以较快的反应速率水解。
与常温常压水相比,下列说法不正确...的是A. 高温高压液态水中,体系温度升高,油脂水解反应速率加快B. 高温高压液态水中,油脂与水的互溶能力增强,油脂水解反应速率加快C. 高温高压液态水中,c(H+)增大,可催化油脂水解反应,且产生的酸进一步催化水解D. 高温高压液态水中的油脂水解,相当于常温下在体系中加入了相同c(H+)的酸或相同c(OH−)的碱的水解【答案】D【解析】【详解】A.对于任何化学反应,体系温度升高,均可加快反应速率,A项正确;B.由于高温高压液态水中,c(H+)和c(OH−)增大,油脂水解向右移动的倾向变大,因而油脂与水的互溶能力增强,反应速率加快,B项正确;C.油脂在酸性条件下水解,以H+做催化剂,加快水解速率,因而高温高压液态水中,c(H+)增大,可催化油脂水解反应,且产生的酸进一步催化水解,C项正确;D.高温高压液态水中的油脂水解,其水环境仍呈中性,因而不能理解成相当于常温下在体系中加入了相同c(H+)的酸或相同c(OH−)的碱的水解,而是以体系升温、增加水和油脂的互溶以及提高水中H+浓度的方式,促进油脂的水解,D项不正确。
福建省厦门双十中学2018-2019学年高二上学期第一次返校考试化学试题 Word版含解析
建省厦门双十中学2018-2019学年高二上学期第一次返校考试化学试题1.1.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。
”文中涉及的操作方法是A. 蒸馏B. 升华C. 干馏D. 萃取【答案】B【解析】“将生砒就置火上,以器覆之,令砒烟上飞,着覆器,遂凝结”,属于固体直接转化为气体,类似于碘的升华,因此涉及的操作方法是升华,答案选B。
2.2.下列说法错误的是A. 、、H+和H2是氢元素的四种不同粒子B. 和、石墨和金刚石均为同位素C. 和是不同的核素D. 和互为同位素,物理性质不同,但化学性质几乎完全相同【答案】B【解析】【详解】A.、、H+和H2分别表示:质子数为1,中子数为0的氢原子、质子数为1,中子数为1的氢原子、带一个单位正电荷的氢离子、氢气单质,同属于氢元素的四种不同粒子,A 正确;B.同一元素的不同原子互称同位素,和都是Ca元素的不同原子,所以互称同位素,金刚石、石墨都是由碳元素组成的不同单质,不属于同位素,B错误;C.和的质子数均为1,中子数不同,是不同的核素,C正确;D.有相同质子数,不同中子数的原子互为同位素,元素的原子的最外层电子数决定了元素性质,而同位素的外层电子数相等,所以它们的化学性质几乎完全相同,而原子不同,则物理性质不同,和质子数都为6,互为同位素,物理性质不同,但化学性质几乎完全相同,D 正确;答案选B。
【点睛】本题考查了微粒符号表示的意义,题目难度不大,明确质子数、中子数、质量数、核外电子数之间的关系以及元素符号的左下角表示质子数,左上角表示质量数是解答本类题型的关键。
3.3.目前已知化合物中数量、品种最多的是碳的化合物,下列关于其原因的叙述中不正确的是()A. 碳原子之间,碳原子与其他原子(如氢原子)之间都可以形成4个共价键B. 碳原子性质活泼,可以与多数非金属元素原子形成共价键C. 碳原子之间既可以形成稳定的单键,又可以形成双键和三键D. 多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合【答案】B【解析】A、碳原子最外层有4个电子,有机物中碳原子以4个共价键的形式存在,故A说法正确;B、碳原子最外层有4个电子,不易得到,也不易失去,性质不活泼,故B说法错误;C、如烷烃中碳原子以单键形式存在,乙烯中碳碳以双键的形式存在,乙炔中碳碳以叁键的形式存在,故C说法正确;D、有机物中的碳原子可以形成链状,也可以形成环状,也可以链状与环状相结合,故D说法正确。
