不同的晶体类型分解共26页
六角晶体结构PPT课件

原子的密排面的形式: 在平面上每个原子
与六个原子相切。
hcp中为(0001)面,按 –ABABABABAB-方式堆垛 Fcc中为{111}面, 按 –ABCABCABCABC-方式堆垛
第28页/共67页
第三节 纯金属常见的晶体结构
五、其他晶体结构
将两个原子为一组,满足面心立方关系。
5. 放在方括号[uvw]中,不加逗号,负号记在
上方 。
第9页/共67页
第二节 晶系晶向与晶面指数
一、晶向与立方晶系晶向指数
晶向指数特征:与原点位置无关;每一指数对应一组 平行的晶向。
晶向族:原子排列情况相同,但空间位向不同的一组 晶向的集合。
表示方法:用尖括号<uvw>表示 。 举例:
可见任意交换指数的位置和改变符号后的所 有结果都是该族的范围。
一、材料的结构(Architecture)
材料的结构 有两个层次,一种是原子尺度的结构 (atomic-scale architecture),在材料学中常称 为晶体结构或相结构(Crystalline/lattice structure),对应有晶体(crystal)和非晶体 (non-crystal);另一种是微观尺度的结构 (microscopic-scale architecture),在材料学 科中常称为显微组织(microstructure),对应于 金相(morphology)。
2. 黏度为其力学性能的基本参数,能保持自己形 状的为固体,不能保持自己形状的为液体;
3. 随温度的升高黏度减小,在液体和固体之间没 有明显的温度界限。
第4页/共67页
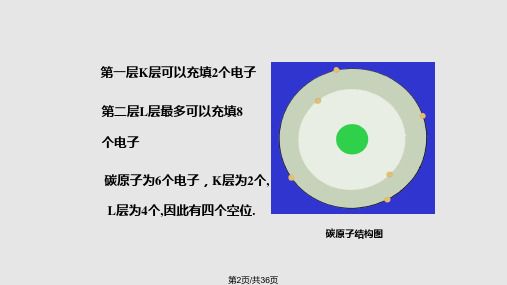
一、原子的排列方 式 2. 晶体
原子排列:粒子(原子、离子或分子)在三维空间呈周 期性的规则重复排列。
晶体结构的类型分类

晶体结构的类型分类晶体是由原子、离子或分子按照一定的规律排列而成的固体物质,其结构具有高度的有序性和周期性。
根据晶体内部原子、离子或分子的排列方式和结构特征,可以将晶体结构分为几种不同的类型。
下面将介绍几种常见的晶体结构类型分类。
1. 根据晶体的周期性分为:- 长程有序晶体:具有长程有序性,即晶体中原子、离子或分子的排列呈现出明显的周期性,如立方晶系、四方晶系、六方晶系等。
- 短程有序晶体:具有短程有序性,即晶体中只有一部分原子、离子或分子的排列呈现出周期性,而整体结构并不呈现规则的周期性。
2. 根据晶体的原子、离子或分子排列方式分为:- 离子晶体:由正负离子按照一定比例排列而成,如氯化钠晶体。
- 共价晶体:由共价键连接的原子或分子构成,如金刚石晶体。
- 金属晶体:由金属原子通过金属键连接而成,如铜晶体。
- 分子晶体:由分子之间通过范德华力或氢键等相互作用力连接而成,如冰晶体。
3. 根据晶体的结构特征分为:- 离子晶体:具有高度的电荷平衡,通常硬度较大,熔点较高,易溶于水。
- 共价晶体:具有坚硬的结构,通常硬度很大,熔点也很高。
- 金属晶体:具有电子云海结构,通常具有良好的导电性和热导性。
- 分子晶体:分子之间的相互作用力较弱,通常易溶于有机溶剂,熔点较低。
4. 根据晶体的晶体系统分类:- 立方晶系:包括立方晶体、体心立方晶体、面心立方晶体。
- 四方晶系:包括四方晶体。
- 六方晶系:包括六方晶体。
- 斜方晶系:包括斜方晶体。
- 单斜晶系:包括单斜晶体。
- 单轴晶系:包括单轴晶体。
总的来说,晶体结构的类型分类是根据晶体内部原子、离子或分子的排列方式、结构特征以及晶体系统等因素进行划分的。
不同类型的晶体结构具有不同的性质和特点,对于研究物质的性质和应用具有重要意义。
通过对晶体结构的分类和研究,可以更深入地了解物质的结构和性质,为材料科学和化学领域的发展提供重要参考。
聚合物晶态结构PPT课件

6-2-1 平面锯齿结构(plane zigzag)
• 没有取代基(PE)或取代基较小的(polyester,polyamide,POM,PVA等)的碳氢链中为了使分子 链取位能最低的构象,并有利于在晶体中作紧密而规整的堆砌,所以分子取全反式构象,即:取平面锯齿 形 构 象 ( P. Z ) 。
阵。 • 点阵结构中,每个几何点代表的是具体内容,称为晶体的结构单元。 • 所以,晶体结构=空间点阵+结构单元
第4页/共124页
6-1 基本概念
• 直线点阵——分布在同一直线上的点阵 • 平面点阵——分布在同一平面上的点阵
• 空间点阵——分布在三维空间的点阵
晶
胞
第5页/共124页
6-1 基本概念
例如:全同PP(H31), 聚邻甲基苯乙烯(H41 ) , 聚甲基丙烯酸甲酯PMMA(H52), 聚4-甲基戊烯- 1 (H72), 聚间甲基苯乙烯 ( H11 8 )等。
第17页/共124页
Hale Waihona Puke • 例如:聚丙稀,PP的C—C主链并不居于同一平面内,而是在三维空间形成螺旋 构象,即:它每三个链节构成一个基本螺圈,第四个链节又在空间重复,螺旋等 同周期l=6.50A。l相当于每圈含有三个链节(重复单元)的螺距。 用符号H31表示 H:Helix(螺旋) 3:3个重复单元 1:1圈
不同的 结 晶90条o 件可以得9到9.不2o同的晶形: α,β,γ,δ4种变态,性能各异 。
第22页/共124页
6-2-3大分子排列方式
• 不管是取平面锯齿形构象还是螺旋构象,它们在结晶中作规整密堆积时,都只能 采取使其主链的中心轴相互平行的方式排列。
• 与主链中心轴方向就是晶胞的主轴,通常约定为C方向。显然,在C方向上,原 子间以化学键键合,而在空间其它方向上,则只有分子间力,在分子间力的作用 下,分子链将相互靠近到链外原子或取代基之间接近范氏力所能吸引的距离。
钻石结构及晶体特征.pptx
立方体面纹理示意图
第29页/共36页
八面体纹理示意图
3)十二面体晶体
在十二面体晶体上,纹 理平行菱面体长轴方向, 只有一个纹理方向。
十二面体纹理示意图
第30页/共36页
4、结节 在三角薄片双角中, 纹理方向发生改变的地方称为结节, 结节对于 钻石加工来讲会产生困难。
5、凹角和青鱼骨刺纹 指两个晶面的接合处 形成的凹角,凹角大 于180° 凹角顶端的纹理,形
第8页/共36页
石墨是碳的另一种单质晶体, 碳原子 与邻近的三个碳原子形成共价单键, 排列成六角平面的网状结构,呈互相 平行的层状结构。
石墨的晶体结构
由于原子结构不同,形成两种性质完全不同的物质, 将钻石 和石墨称为碳元素的同质异体或同质多象。
第9页/共36页
钻石与石墨晶体结构对比
钻石属六方晶系,碳原 子为等间距的结构(CC健长0.154nm),原子 间结合牢固;石墨属六 方晶系,碳原子形成牢 固的六方环形状网的极 薄层。环中的原子间距 为0.142nm,而层间原 子间距为0.335nm。
晶胞 立方面心格子,C 原子
占据立方体的一半角顶,六 个面的中心以及相间排列的 小立方体中心。
钻石单位晶胞:立方面心格子
第5页/共36页
三、钻石晶体结构
钻石的晶体结构可以视为以角顶相连接的四面体 结合, 规则重复和三维排列。
第6页/共36页
由四面体组成的钻石, 常见 有立方体、八面体、菱形十 二面体晶体。
2、 烟雾钻石 表面有一极薄的半透明的无光泽表层,呈暗淡或糖状, 由于搬运过程中被磨蚀或金伯利岩岩浆熔蚀所致。 3、氧化钻石 在钻石的裂隙中充填氧化铁、锰质所致。氢氟酸中煮沸 可以除去杂色。
第33页/共36页
陶瓷材料的结构.pptx
综上所述,金
属材料的成分、 工艺、组织结构 和性能之间有着 密切的关系。
图2-11 两种晶粒大小不同的纯铁示意图
第12页/共35页
2.2 高分子材料的结构与性能
• 2.2.1 高分子材料的结构 • 1.大分子链的构成 • (1)化学组成 • 组成大分子链的化学元素,主要是碳、氢、氧,
另外还有氮、氯、氟、硼、硅、硫等,其中碳 是形成大分子链的主要元素。 • 大分子链根据组成元素不同可分为三类,即碳 链大分子、杂链大第13分页/共子35和页 元素链大分子。
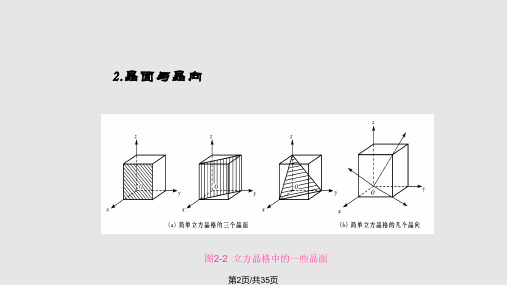
2.晶面与晶向
图2-2 立方晶格中的一些晶面
第2页/共35页
3.金属晶体的类 (型1)体心立方晶格 (2)面心立方晶格 (3)密排六方晶格
图2-3 体心立方晶胞
图2-4 面心立方晶胞
第3页/共35页
图2-5 密排六方晶胞
2.1.2 金属的实际晶体结构
1.单晶体和多晶体
图2-6 单晶体和多晶体结构示意图
图2-20 蠕变前、后分子构象变化示意图 ●应力松弛 如图2-21所示。
图2-21 应力松弛过程中分子构象变化示意图
第22页/共35页
●滞后与内耗 高聚物受周期性载荷时,产生 伸-缩的循环应变,如图2-22所示。
图2-22 橡胶在一个承载周期中的应力-应变曲线
第23页/共35页
图2-23可以看出高聚物的变形特点。A点为 初始状态,B点为屈服点,C点为断裂点。
第25页/共35页
陶瓷的典型组织结构包括: 晶体相(莫来石和石英) 玻璃相 气相
1.晶体相
(1)硅酸盐
硅酸盐基本结构具有以下特点: ①构成硅酸盐的基本单元为硅氧四面 体结构,如图2-24所示; ②硅氧四面体只能通过共用顶角而相 互结合; ③ Si4+通过 O2-结合, Si—O—Si 的结合键在氧上的键角接近于145° ; ④稳定的硅酸盐结构中,硅氧四面体 采取最高空 间维数互相结合; ⑤硅氧四面体采取比较紧密的结构结 合; ⑥同一结构中硅氧四面体最多只相差 1个氧原子。
1-3常见晶体结构

对于FCC
2
r a
rx /r=0.414 即八面体4间隙的相对大小
红球为间隙原子
黑球为晶胞原子
第13页,共39页。
三、常见晶体结构及其几何特征
3 常见晶体中的重要间隙
3.1 FCC结构 (2)四面体间隙
数量: 8
与原子数比为8:4=2:1
rx /r=0.225
三、常见晶体结构及其几何特征
2 几何特征 2.2 一个晶胞中的原子数 简写n
体心立方结构
n=2
第6页,共39页。
三、常见晶体结构及其几何特征
2 几何特征
2.2 一个晶胞中的原子数 简写n
密排六方结构 n =6
第7页,共39页。
三、常见晶体结构及其几何特征
2 几何特征 2.3 堆垛密度 又称紧密系数 致密度 简写
属于六方密堆积的金属有: IIIB,IVB及 Be、 Mg、Tc、Re、Ru、Os 等。
③ 面心立方紧密堆积(Face-centred Cubic clode
Packing)
第一层、第二层与六方密堆积相同。但是,第三层 排布与六方密堆积的排布不同。采取第二种方式:ABC ABC ABC重复的堆积方式,形成面心立方紧密堆积。 (第一层有7个质点,第二层有3个质点,第三层有3个质 点、方向与二层不同。)
2.1 配位数 简写CN 一个原子周围最邻近的原子数
➢ 纯元素金属 这些最邻近的原子到所论原子的距离是相等的
➢ 多元素晶体 不同元素的最邻近原子到所论原子的距离不一定相等
➢这里,“最邻近”是就同种元素的原子相比 较而言,而配位数则是一个原子周围的各元素 的最近邻原子数之和。 ➢ 配位数通常用 CN 表示。例如,CN 12 表 示配位数为12。
晶体的对称性及晶体的分类

= AB (1-2cosθ)
(2-15)
对照式(2-15)、(2-14);有 即
所以有下表结果:
N=1-2 cosθ cos θ = 1 − N ;|cosθ|≤1
2
(2-16)
N=-1
0
1
2
3
cosθ=1
0.5
0
-0.5
-1
θ=360º
60º
90
120º
180º
n=1
6
4
3
2
从上表结果可知,θ 只能取 5 种角度。因为 360° =n 就是旋转对称轴的轴次,因此 n 只能有 θ
25
将图形绕 x 轴转动 θ 角后,经 x=0 的平面反映,图形中的任一点(xyz)变成(x’y’z’), 如图 2-5 所示,变换关系
x’=-x y’=y cosθ - z sinθ
(2-13)
z’=y sinθ + z cosθ
z (xlylzl)
y
θ
(xyz)
பைடு நூலகம்
x 图 2-5 转动加反映
因此有
z’ ;
a31 a32 a33 ; z
(2-3)
操作前后,两点间的距离应保持不变,这就要求
O
r M
2
=
r OM
12
即x12+y12+z12=x2+y2+z2 也就是要求
T~'T ' = T~T
因为(2-5)式左边可变成
T~'T ' = ( AT ) AT
= T~A~AT
(2-4) (2-5) (2-6)
国际符号用 1 2346 表示之。数字上的一字读一横,不要读作负号。 晶体中许可的轴次为 5 种,因此倒反轴也只有五种。但是不难证明,五种倒反轴中,只
晶体结构

1第3章晶体结构固体可分为晶体(crystal)和非晶体(noncrystal)两大类。
无定形态物质(amorphous solids)。
晶体物质的质点(分子、原子、离子)做有规则的排列,而无定性物质的质点呈混乱分布。
3-1 晶体3-1-1 晶体的宏观特征1、晶体的自范性:晶体能够自发地呈现封闭的规则凸多面体的外形。
2依晶体的凸多面体的数目对晶体的分类:单晶、双晶、晶簇、多晶。
见书123页图3-1。
金刚石单晶34磷酸盐双晶5天然白水晶晶簇。
6因生长条件不同,同一晶体可能有不同的几何外形。
见书124页图3-2、3-3、3-4。
晶面夹角不变定律:同一晶体的相同晶面有相同的晶面夹角。
见书124页图3-2。
晶体的习性:一种晶体经常呈现的外形。
72、晶体的对称性:晶体具有宏观对称性。
3、晶体的均一性:晶体的质地均匀,具有确定的熔点。
4、晶体的各向异性:晶体的某些物理性质随晶体的取向不同而异。
见书124-125页例。
晶体的宏观特征是晶体的微观特征的表象。
83-1-2 晶体的微观特征——平移对称性晶体的平移对称性:构成晶体的质点呈现周期性的整齐排列。
见书125页图3-5。
晶体的宏观对称性是晶体的微观对称性的体现。
见书126页图3-6。
非晶态物质不具有平移对称性。
见书126页图3-7。
3-2 晶胞3-2-1 晶胞的基本特征9晶胞(unit cell):晶体结构中具有代表性的最小重复单位。
1、晶体是由完全等同的晶胞无隙并置地堆积而成的。
A 、完全等同:a 、化学上等同:晶胞里原子的数目和种类完全相同。
b 、几何上等同:晶胞的形状、取向、大小、质点的排列及其取向完全相同。
B 、无隙并置:见书127页。
晶胞具有平移性。
102、晶胞的种类:见书128页图3-9。
习惯选用的晶胞是三维的平行六面体,称为布拉维晶胞。
3-2-2 布拉维系1、晶胞参数:晶角:α、β、γ。
晶柱:a 、b 、c 。
2、布拉维系的种类:见书129页及图3-12。
