高一化学知识小卡片_“18电子”微粒小结
高一化学知识小卡片·1~18号元素原子的结构特征34(1)

6、最外层电子数是次外层电子数4倍的原子有:__________;
7、次外层电子数是最外层电子数2倍的原子有:__________;
8、最外层电子数是次外层电子数2倍的原子有:__________;
9、电子层数跟最外层电子数相等的原子有:__________;
3、最外层电子数为2的原子有:_____________;
4、最外层电子数跟次外层电子数相等的原子有:__________;
5、最外层电子数是次外层电子数3倍的原子有:__________;
6、最外层电子数是次外层电子数4倍的原子有:__________;
7、次外层电子数是最外层电子数2倍的原子有:__________;
高一化学知识小卡片(34)_____班姓名_________
知识点:1~18号元素原子的结构特征:
1、原子核内只有质子无中子的原子:__________;
2、最外层电子数为1的原子有:_____________;
3、最外层电子数为2的原子有:_____________;
4、最外层电子数跟次外层电子数相等的原子有:__________;
10、电子层数是最外层电子数2倍的原子有:__________;
11、最外层电子数是电子层数2倍的原子有:__________;
高一化学知识小卡片(34)_____班姓名_________
知识点:1~18号元素原子的结构特征:
1、原子核内只有质子无中子的原子:__________;
2、最外层电子数为1的原子有:_____________;
8、最外层电子数是次外层电子数2倍的原子有:__________;
高中化学必背重要知识点三

必背重要知识点(7)“10电子”、“18电子”的微粒及微粒半径的比较一、“10电子”、“18电子”的微粒小结1.“10电子”的微粒:分子离子一核10电子Ne N3−、O2−、F−、Na+、Mg2+、Al3+二核10电子HF OH−、三核10电子H2O NH2−四核10电子NH3H3O+五核10电子CH4NH4+2.“18电子”的微粒分子离子一核18电子Ar K+、Ca2+、Cl‾、S2−二核18电子F2、HCl HS−三核18电子H2S四核18电子PH3、H2O2五核18电子SiH4、CH3F六核18电子N2H4、CH3OH注:其它诸如C2H6、N2H5+、N2H62+等亦为18电子的微粒。
二、微粒半径的比较:1.判断的依据电子层数:相同条件下,电子层越多,半径越大。
核电荷数:相同条件下,核电荷数越多,半径越小。
最外层电子数相同条件下,最外层电子数越多,半径越大。
1.具体规律:1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.2、同主族元素的原子半径随核电荷数的增大而增大。
如:Li<Na<K<Rb<Cs3、同主族元素的离子半径随核电荷数的增大而增大。
如:F-<Cl-<Br-<I-4、电子层结构相同的离子半径随核电荷数的增大而减小。
如:F->Na+>Mg2+>Al3+5、同一元素不同价态的微粒半径,价态越高离子半径越小。
如Fe>Fe2+>Fe3+必背重要知识点(8)常见的重要氧化剂、还原剂反应条件对氧化-还原反应的影响氧化剂还原剂活泼非金属单质:X 2、O 2、S 活泼金属单质:Na 、Mg 、Al 、Zn 、Fe某些非金属单质:C 、H 2、S 高价金属离子:Fe 3+、Sn 4+不活泼金属离子:Cu 2+、Ag +其它:[Ag(NH 3)2]+、新制Cu(OH)2低价金属离子:Fe 2+、Sn 2+非金属的阴离子及其化合物:S 2-、H 2S 、I -、HI 、NH 3、Cl -、HCl 、Br -、HBr含氧化合物:NO 2、N 2O 5、MnO 2、Na 2O 2、H 2O 2、HClO 、HNO 3、浓H 2SO 4、NaClO 、Ca(ClO)2、KClO 3、KMnO 4、王水低价含氧化合物:CO 、SO 2、H 2SO 3、Na 2SO 3、Na 2S 2O 3、NaNO 2、H 2C 2O 4、含-CHO 的有机物:醛、甲酸、甲酸盐、甲酸某酯、葡萄糖、麦芽糖等既作氧化剂又作还原剂的有:S 、SO 32-、HSO 3-、H 2SO 3、SO 2、NO 2-、Fe 2+及含-CHO 的有机物1.浓度:可能导致反应能否进行或产物不同8HNO 3(稀)+3Cu==2NO↑+2Cu(NO 3)2+4H 2O S+6HNO 3(浓)===H 2SO 4+6NO 2↑+2H 2O4HNO 3(浓)+Cu==2NO 2↑+Cu(NO 3)2+2H 2O 3S+4HNO 3(稀)===3SO 2+4NO↑+2H 2O 2.温度:可能导致反应能否进行或产物不同Cl 2+2NaOH=====NaCl+NaClO+H 2O 3Cl 2+6NaOH=====5NaCl+NaClO 3+3H 2O3.溶液酸碱性.2S 2-+SO 32-+6H+=3S↓+3H 2O 5Cl -+ClO 3-+6H +=3Cl 2↑+3H 2OS 2-、SO 32-,Cl -、ClO 3-在酸性条件下均反应而在碱性条件下共存.Fe 2+与NO 3-共存,但当酸化后即可反应.3Fe 2++NO 3-+4H +=3Fe 3++NO↑+2H 2O一般含氧酸盐作氧化剂,在酸性条件下,氧化性比在中性及碱性环境中强.故酸性KMnO 4溶液氧化性较强。
高中化学常见的10电子和18电子微粒总结学习资料
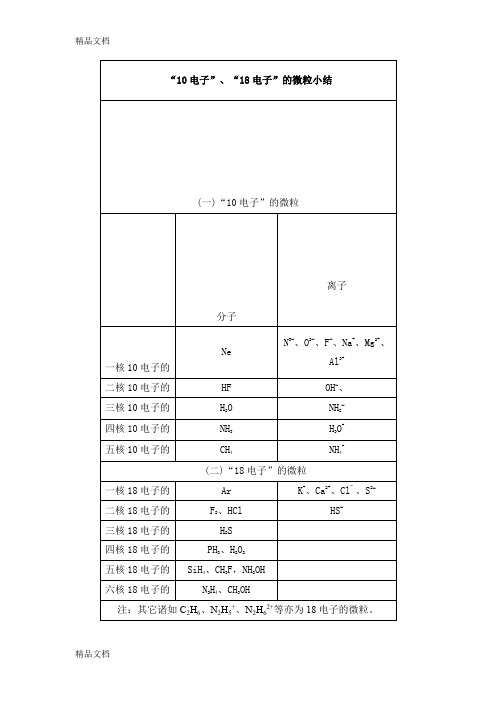
NH2−
四核10电子的
NH3
H3O+
五核10电子的
CH4
NH4+
(二)“18电子”的微粒
一核18电子的
Ar
K+、Ca2+、Cl‾、S2−
二核18电子的ຫໍສະໝຸດ F2、HClHS−三核18电子的
H2S
四核18电子的
PH3、H2O2
五核18电子的
SiH4、CH3F,NH2OH
六核18电子的
N2H4、CH3OH
民族性手工艺品。在饰品店里,墙上挂满了各式各样的小饰品,有最普通的玉制项链、珍珠手链,也有特别一点如景泰蓝的手机挂坠、中国结的耳坠,甚至还有具有浓郁的异域风情的藏族饰品。离子
1、DIY手工艺市场状况分析一核10电子的
Ne
N3−、O2−、F−、Na+、Mg2+、Al3+
二核10电子的
HF
OH−、
三核10电子的
1、购买“女性化”
据调查统计在对大学生进行店铺经营风格所考虑的因素问题调查中,发现有50%人选择了价格便宜些,有28%人选择服务热情些,有30%人选择店面装潢有个性,只有14%人选择新颖多样。如图(1-5)所示
附件(二):调查问卷设计2003年,全年商品消费价格总水平比上年上升1%。消费品市场销售平稳增长。全年完成社会消费品零售总额2220.64亿元,比上年增长9.1%。分子
C.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
注:其它诸如C2H6、N2H5+、N2H62+等亦为18电子的微粒。
典型题目:
甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
高中化学元素周期表总结.docx

《必修 2 元素周期表 元素周期律》知识总结一. “10电子 ”、 “18电子 ”的微粒小结1. “ 10电子 ”的微粒:分子 离子单核 Ne N 3- 、O 2- 、 F - 、 Na +、 Mg 2+、 Al 3+双核 HF OH -、三核H 2O NH 2 -四核NH 3 3 +CH 4H O+五核NH 42. “ 18电子 ”的微粒分子 离子单核Ar K +、 Ca 2+ 、Cl  ̄、S 2-双核 F 2、 HClHS -三核H 2 S四核 PH 3、 H 2 O2五核 SiH 4、 CH 3F 六核 N 2H 4 、CH 3OH八核CH 3CH 3注:其它诸如C 2H 6、 N 2H 5+、 N 2H 62+ 等亦为 18 电子的微粒。
二.微粒半径的比较:1.判断的依据 电子层数: 相同条件下,电子层越多,半径越大。
核电荷数: 相同条件下,核电荷数越多,半径越小。
最外层电子数相同条件下,最外层电子数越多,半径越大。
2. 具体规律:( 1)同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如: Na>Mg>Al>Si>P>S>Cl.(2)同主族元素的原子半径随核电荷数的增大而增大。
如: Li<Na<K<Rb<Cs(3)同主族元素的离子半径随核电荷数的增大而增大。
如:F -- <Cl --<Br --<I --(4)电子层结构相同的离子半径随核电荷数的增大而减小。
如:F -> Na + >Mg 2+>Al 3+(5)同一元素不同价态的微粒半径,价态越高离子半径越小。
如Fe>Fe 2+>Fe 3+三.原子结构与元素的性质1.元素性质的范畴原子半径判断金属性的方法元素的性质判断非金属性方法元素的主要化合价 元素的第一电离能 元素的电负性2.同周期:从左到右( 1)元素原子结构: 电子层数相同,核电荷数增多( 2)元素性质:元素的金属性减弱,非金属性增强; 原子半径减小;金属单质的还原性减弱,非金属单质的氧化性增强;金属阳离子的氧化性增强,非金属阴离子的还原性减弱。
2022届高三化学考前复习微专题一 10电子微粒和18电子微粒 讲义(知识梳理+检测)

微专题一10电子微粒和18电子微粒➢巧记“10电子微粒”和“18电子微粒”1、10电子微粒2、18电子微粒➢跟踪训练1.具有9个质子和10个电子的微粒是()A.NaB.O2C.F-D.Ne2.下列说法错误的是()①质子数相同的微粒一定属于同一种元素①同一元素的核素种数由中子数决定①Cl2中35C1与37Cl两种核素的个数之比与HCl中35Cl与37C1的个数之比相等①18gH2O中含有的中子数为10N A①标况下,等体积CH4和HF所含的电子数相同①只有活泼金属元素与活泼非金属元素之间才能形成离子键①等物质的量的CN-和N2含有的共用电子对数相等①通过化学变化可以实现16O与18O间的相互转化A.2个B.3个C.4个D.5个3.下列有关化学用语表示正确的是()A.具有16个质子、18个中子和18个电子的微粒:1634S2−B.硝基苯的结构简式:C.过氧化氢的电子式:D.乙酸乙酯的分子式:CH3COOCH2CH34.下列化学用语错误的是()A.中子数为10的氧原子: 818OB.氯化钠的电子式:C.CH4的比例模型:D.乙炔的结构式:H-C≡C-H5.下列化学用语描述正确的是()A.40Ca的一种同位素为40KB.中子数为10的氧原子:1018OC.S2-的结构示意图:D.18个电子的氢的氧化物的分子式:H2O26.下列化学用语正确的是()A.甲基的电子式是B.硫的原子结构示意图是C.818O表示中子数是18的氧原子D.过氧化氢的结构式是H—O—O—H7.设X、Y、Z代表元素周期表中前4周期的三种元素,已知X+和Y-具有相同的电子层结构;Z元素的原子核内质子数比Y元素的原子核内质子数少9;Y和Z两种元素可形成含4个原子核、42个电子的负一价阴离子。
下列说法错误的是()A.元素Z的气态氢化物分子中含有10个电子B.元素Y的气态氢化物分子中含有18个电子C.元素Z与元素X形成的化合物X2Z中离子都达到稳定结构D.元素Y、Z组成的化合物属于离子化合物8.下列化学用语书写正确的是()A.S2﹣离子的结构示意图:B.H2O2的电子式:C.CO2的比例模型:D.有8个质子、10个中子的核素:188O答案解析1.【答案】 C【解析】A. Na原子中含有11个质子和11个电子,故A不符合题意;B. O原子含有8个质子和8个电子,则O2分子中含有16个质子和16个电子,故B不符合题意;C. F-含有9个质子和10个电子,故C符合题意;D. Ne原子含有10个质子和10个电子,故D不符合题意;答案选C。
十电子微粒和18电子微粒

十电子微粒和18电子微粒
有机物是由原子组成的物质,它们是以电子为基本结构的。
当一个原子失去或获得电子时就会形成一个离子,而不同的离子有不同的性质。
下面我们来叙述10
电子微粒和18电子微粒的特性。
1、10电子微粒
10电子微粒出现失去电子的原子经过作用而形成的离子,其包含的电子数量仅仅
是原子的电子的一半,它的10个电子都集中在八个桥面内,而不会出现其他位置。
此外,10电子微粒除去它处在几何中心以外所有的电子,留下一个空洞,本质上
其看起来像是一个八面体电离子,经常被称为“八面体”电离子。
2、18电子微粒
18电子微粒是指某种具有18个电子的离子,除了几何中心的六个电子之外,其余
的12个电子均分布在八个桥面上。
它也发出了八个桥面的周期性信号,也可以被
称为“十八原子”离子。
此外,它还可以表示为“八元素”电离子,其本质上也是一种电离子,只不过其位于八元素封面上。
综上所述,10电子微粒和18电子微粒均是经历电子失去或获得而产生的离子,不同之处在于10电子微粒只有10个电子,而18电子微粒则有18个电子,有着不同的特性。
两者都有其独特的用途,广泛应用在化学领域,如电影暗室的投影等。
专题四 稳定结构“10电子微粒”和“18电子微粒”

专题4稳定结构“10电子微粒”和“18电子微粒”知识梳理1.巧记“10电子微粒”和“18电子微粒”(1)10电子微粒(2)18电子微粒2.“8电子稳定结构”的判断方法(1)经验规律法①分子中的氢原子不满足8电子结构;②一般来说,在AB n型分子中,若某元素原子最外层电子数+|化合价|=8,则该元素原子的最外层满足8电子稳定结构。
如CO2分子中,碳元素的化合价为+4,碳原子最外层电子数为4,二者之和为8,则碳原子满足最外层8电子稳定结构,同理知氧原子也满足最外层8电子稳定结构。
(2)成键数目法若该原子达到所需成键数目,则为8电子结构,若未达到或超过所需成键数目则不为8电子结构,如PCl5中的P,BeCl2中的Be。
3.记忆其他等电子微粒(1)“14电子”微粒:Si、N2、CO、C2H2、C2-2(2)“16电子”微粒:S、O2、C2H4、HCHO(3)“9电子”微粒:—OH、—NH2、—CH3(取代基)(4)“2电子”微粒:He、H-、Li+、Be2+、H2(5)质子数及核外电子总数均相等的微粒:①Na+、NH+4、H3O+;②HS-、Cl-;③F-、OH-、NH-2;④N2、CO、C2H2等。
强化训练1.与OH -具有相同电子总数和质子总数的微粒是( )A .K +B .Na +C .F -D .Ne答案 C2、下列各微粒:①H 3O +、NH +4、Na +;②OH -、NH -2、F -;③O 2-2、Na +、Mg 2+;④CH 4、NH 3、H 2O 具有相同质子数和电子数的一组是( )A .①②③B .①②④C .②③④D .①③④ 答案 B3.核外电子层结构相同的一组粒子是( )A .Mg 2+、Al 3+、Cl -、ArB .Na +、F -、S 2-、NeC .K +、Ca 2+、S 2-、ArD .Mg 2+、Na +、Cl -、K + 答案 C4.下列分子中所有原子最外层都满足8电子结构的是________(填序号)。
高一化学知识小卡片·“18电子”微粒小结43
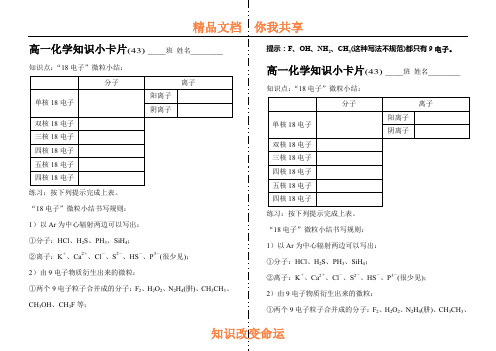
2)由9电子物质衍生出来的微粒:
①两个9电子粒子合并成的分子:F2、H2O2、N2H4(肼)、CH3CH3、CH3OH、CH3F等;
提示:F、OH、NH2、CH3(这种写法不规范)都只有9电子。
高一化学知识小卡片(43)_____班姓名_________
2)由9电子物质衍生出来的微粒:
①两个9电子粒子合并成的分子:F2、H2O2、N2H4(肼)、CH3CH3、CH3OH、CH3F等;
提示:F、OH、NH2、CH3(这种写法不规范)都只有9电子。沁园春·雪<毛泽东>
北国风光,千里冰封,万里雪飘。
望长城内外,惟余莽莽;
大河上下,顿失滔滔。
山舞银蛇,原驰蜡象,
高一化学知识小卡片(43)_____班姓名_________
知识点:“18电子”微粒小结:
分子
离子
单核18电子
阳离子
阴离子
双核18电子
三核18电子Байду номын сангаас
四核18电子
五核18电子
四核18电子
练习:按下列提示完成上表。
“18电子”微粒小结书写规则:
1)以Ar为中心辐射两边可以写出:
①分子:HCl、H2S、PH3、SiH4;
知识点:“18电子”微粒小结:
分子
离子
单核18电子
阳离子
阴离子
双核18电子
三核18电子
四核18电子
五核18电子
四核18电子
练习:按下列提示完成上表。
“18电子”微粒小结书写规则:
1)以Ar为中心辐射两边可以写出:
①分子:HCl、H2S、PH3、SiH4;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
①两个9电子粒子合并成的分子:F2、H2O2、N2H4(肼)、CH3CH3、CH3OH、CH3F等;
提示:F、OH、NH2、CH3(这种写法不规范)都只有9电子。
②离子:K+、Ca2+、Cl-、S2-、HS-、P3-(很少见);
2)由9电子物质衍生出来的微粒:
①两个9电子粒子合并成的分子:F2、H2O2、N2H4(肼)、CH3CH3、CH3OH、CH3F等;
提示:F、OH、NH2、CH3(这种写法不规范)都只有9电子。
高一化学知识小卡片(43)_____班姓名_________
知识点:“18电子”微粒小结:
分子
离子
单核18电子
阳离子
阴离子
双核18电子
三核18电子
四核18电子五核18电子来自四核18电子练习:按下列提示完成上表。
“18电子”微粒小结书写规则:
1)以Ar为中心辐射两边可以写出:
①分子:HCl、H2S、PH3、SiH4;
②离子:K+、Ca2+、Cl-、S2-、HS-、P3-(很少见);
高一化学知识小卡片(43)_____班姓名_________
知识点:“18电子”微粒小结:
分子
离子
单核18电子
阳离子
阴离子
双核18电子
三核18电子
四核18电子
五核18电子
四核18电子
练习:按下列提示完成上表。
“18电子”微粒小结书写规则:
1)以Ar为中心辐射两边可以写出:
①分子:HCl、H2S、PH3、SiH4;
