实验一 MS培养基的配制和灭菌
实验一 培养基的配制与灭菌

铁盐
有机物质 2,4-D
200倍液
100倍液 1.0 mg/ml
5 ml
10ml 1ml
——
5 ml
10ml ——
5 ml
10ml 1ml
NAA
KT 蔗糖
1.0 mg/ml
1.0 mg/ml 30 g
0.2ml
1.0ml 30 g
——
—— 30 g
0.1ml 30 g
琼脂
pH值
8g
5.8
8g
5.8
8g
五、作业要求:完成实验报告,回答下面的思考题 1、根据以下所给母液浓度、蔗糖和琼脂量,配制烟草愈伤组织诱 导和培养的培养基(MS1),按MS配方(Murashige and Skoog, 1962)计算各种母液吸取量或药品的直接称量量。 2、简述高压蒸气灭菌的步骤;培养基采用高压蒸气灭菌应注意哪 些事项?
药品名称
母液倍或母 液浓度 (mg/ml)
配制1 L培养基 配制0.25 L培养基所需母液量(ml) 所需母液量(ml) 或质量(g) 或直接称量量(g) MS 1 MS 2 MS 3
大量元素 微量元素 铁盐 有机物质 2,4-D NAA KT 蔗糖 琼脂 pH值
10倍液 100倍液 200倍液 100倍液 1.0 mg/ml 1.0 mg/ml 1.0 mg/ml 30 g 8g 5.8
5.8
——
5.8
1)在烧杯内放入一定量的蒸馏水,用量筒或移液枪按上述表 格内配方加入各种母液及激素。 2)加入蔗糖30g,待蔗糖溶解后(可搅拌)加水定容至1L。 3)调节PH值,用酸度计测量PH值至5.8,常用1mol/l的HCl或 NaOH调整。 4)在MS1和MS2中加入琼脂8g,加热溶解,溶解过程中不断 搅拌,加热时烧杯口上盖上锡箔纸,防止水分过度蒸发。 5)分装:将配好的培养基及时分装到小三角瓶中,防止凝固 ,每瓶约30ml-40ml(约覆盖瓶底),分装时不要沾壁口。 6)封口:用封口膜将将三角瓶封口。
实验一MS培养基的配制

实验一MS培养基的配制一、实验目的:了解MS培养基的配制原理和方法,掌握其配制过程和分装方法。
二、实验材料与仪器:电子天平、量筒、烧杯、玻璃棒、组培瓶、移液器、6种母液、白沙糖、琼脂、氢氧化钠、盐酸、酸度计或pH试纸。
三、实验方法与步骤1、母液配制(1)大量元素(母液Ⅰ) (2) 微量元素(母液Ⅱ) (3) 铁盐(母液Ⅲ) (4) 有机成分(母液Ⅳ) ⅣA 和ⅣB (5) 植物生长调节物质(6-BA,NAA)以上各种营养成分的用量,除了母液Ⅰ为20倍浓缩液外,其余的均为100倍浓缩液。
2、1 L固体MS培养基配制(1)用电子天平称出8 g琼脂粉和 30 g蔗糖放在烧杯中,加入少量的蒸馏水在微波炉中加热使之溶解。
(2)用量筒从各种母液中分别取出所需的用量:母液Ⅰ为50 ml,母液Ⅱ、Ⅲ、ⅣA和ⅣB 各10ml。
(3)最后用蒸馏水定容到1 L;用 2 mol/L NaOH 或 2 mol/LHCL 溶液调节培养基的 pH 值至 5.8~6.0。
(4)用量筒量取100ml液体培养基分装在组培瓶里,再用移液器取适量的6-BA和NAA放入组培瓶里。
(5)在 1.1kg/cm2 压力(约 121℃)高压灭菌锅中灭菌 15~20 min;灭菌后,放置于室温自然冷却凝固待用。
3、实验分组本实验分五组,每组负责配制一组培养基组合:(1)MS+0.1mg/L 6-BA+0.1mg/L NAA(2)MS+0.5mg/L 6-BA+0.5mg/L NAA(3)MS+1mg/L 6-BA+0.1mg/L NAA(4)MS+2mg/L 6-BA+0.1mg/L NAA(5)MS+3mg/L 6-BA+0.1mg/L NAA4、其他需要灭菌的实验材料剪刀、镊子、蒸馏水、滤纸、培养皿、组培瓶。
四、分析1.MS母液分得更加细,一般实验室只分大量元素、微量元素、铁盐、有机成分四大类。
这里将大量元素中钙离子与硫酸根离子分开配,避免产生不溶物,将硼酸也单独列出来。
实验一培养基的配制与灭菌

实验一培养基的配制与灭菌一、目的掌握培养基母液的配制方法;培养基的配制和灭菌技术;不同质地实验用品的灭菌方法。
二、方法步骤1、母液配制一般大量元素、微量元素和其它成分分别配制成100-200倍母液,使用时按比例稀释即可。
配好的母液需贮存于2~4℃的冰箱中,定期检查有无沉淀和微生物污染,如果出现沉淀或微生物污染,则不能使用。
2、植物激素配制植物激素一般配制成浓度为0.1—1.0mg/ml的溶液,贮存在2~4℃下备用。
由于多数激素难溶于水,所以配制时应按下面步骤进行:IAA:先用少量95%乙醇使之充分溶解,再加蒸馏水定容至需要浓度的体积。
NAA:可溶于热水中,也可采用与IAA同样的方法配制。
2,4-D:先用少量1mol/L的NaOH溶液充分溶解,然后缓慢加入蒸馏水定容至需要浓度体积。
细胞分裂素类:KT和BA等细胞分裂素类物质均溶于稀盐酸,应先用少量1mol/L的HCl溶解后再稀释至需要浓度。
赤霉素:赤霉素的水溶液稳定性较差,一般用95%的乙醇配制成5~10mg/ml的母液低温保存,使用时再稀释。
3、培养基配制按实际配制培养基体积,取各母液的需要量加入一适当体积的烧杯或其它配制培养基的容器中,再加入实际配制培养基体积约2/3—3/4的蒸馏水,然后以每升所用蔗糖的量称取放入培养基并使其溶化。
用0.1mol/L的NaOH或0.1mol/L的HCl调整pH至5.6—5.8,以0.6%—0.8%的比例加入琼脂,并搅拌加热使琼脂完全溶化,用蒸馏水定容至终体积,混合均匀后分装于培养器皿中,然后进行高压灭菌。
4、培养基灭菌分装好的培养基置于高压蒸汽灭菌锅中灭菌,灭菌条件为温度121℃,压力0.105MPa,灭菌时间与培养基容量的关系如下表所示。
培养基体积与灭菌时间的关系三、结果与分析1、培养基的母液配制情况。
2、培养基配制时的注意事项。
四、提交实验报告附:MS培养基配方。
组织培养实验MS培养基及配制注意事项
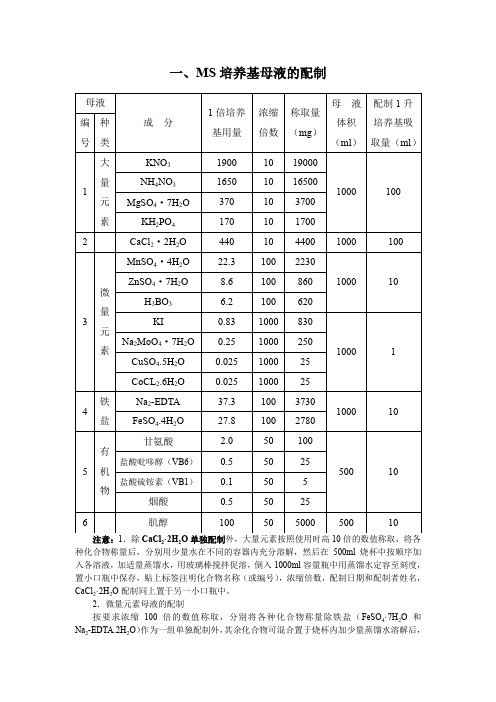
一、MS培养基母液的配制注意:1.除CaCl2·2H2O单独配制外,大量元素按照使用时高10倍的数值称取,将各种化合物称量后,分别用少量水在不同的容器内充分溶解,然后在500ml烧杯中按顺序加入各溶液,加适量蒸馏水,用玻璃棒搅拌促溶,倒入1000ml容量瓶中用蒸馏水定容至刻度,置小口瓶中保存,贴上标签注明化合物名称(或编号),浓缩倍数,配制日期和配制者姓名,CaCl2·2H2O配制同上置于另一小口瓶中。
2.微量元素母液的配制按要求浓缩100倍的数值称取,分别将各种化合物称量除铁盐(FeSO4·7H2O和Na2-EDTA.2H2O)作为一组单独配制外,其余化合物可混合置于烧杯内加少量蒸馏水溶解后,定容在1000ml容量瓶中,置小口瓶中保存,贴上标签。
3.铁盐配制将FeSO4·7H2O和Na2-EDTA.2H2O分别溶于450ml蒸馏水中,加热,(很重要)不断搅拌,溶解后,两液混合,调PH至5.5加水定容至1000ml,置于小口瓶中,贴上标签。
4.有机物母液配制,按母液要求浓缩50倍,除蔗糖按3%单独临时称量外,其余分别称量后,溶解,定容在500ml容量瓶中,置于小口瓶中保存,贴上标签。
5.母液最好在2~4℃的冰箱中贮存,特别是有机类物质,贮存时间不宜过长,无机盐母液最好在一个月内用完,如发现有霉菌和沉淀产生,就不能再使用。
A.制备母液和营养培养基时,所用蒸馏水或无离子水必须符合标准要求,化学药品必须是高纯度的(分析纯)。
B.称量药物采用高灵敏度的天平,每种药品专用一药匙。
二、培养基配制和灭菌一.养培养基配制程序(一).母液吸取量的计算配制培养基的升数母液吸取量= 母液体积(CC)×——————————母液浓缩倍数(二)各种母液按顺序编号排列A.大量元素;B.CaCl2.2H2O;C.微量元素;D.铁盐;E.有机物;F.生长素萘乙酸(NAA):配制0.5mg/ml的NAA称取50mg , NAA用少量95% 酒精溶解后加蒸馏水定容至1000ml;G..细胞分裂素、激动素(KT)配制0.5mg/ml的KT 称50mgKT 用少量1N HCL溶解后,加蒸馏水定容至100ml。
实验1-1MS培养基母液和常用试剂的配制

其他常用试剂的保存
配制好的其他试剂应保存在密封的玻璃瓶中 ,并放置在阴凉干燥处。避免阳光直射和高 温环境,以防变质。对于一些易挥发或易氧 化的试剂,应特别注意密封保存和使用。
04
实验操作流程与注意事项
03
04
配制好的培养基应尽快使用,避 免长时间存放。
实验安全须知
避免直接接触培养基和化学试剂,如不慎接 触,应立即用大量清水冲洗。
对于有毒有害的化学试剂,应遵循相关规定 进行操作和处理,不得随意倾倒或排放。
在实验过程中,应注意防范火灾、爆炸等安 全事故,遵循实验室安全规定。
05
实验结果与数据分析
03
常用试剂的配制与保存
植物生长调节剂的配制与保存
植物生长调节剂的配制
根据实验需求,将植物生长调节剂溶解于相应的溶剂中,如 水、乙醇等。按照所需的浓度进行配制,并充分摇匀。
植物生长调节剂的保存
配制好的植物生长调节剂应保存在低温、避光、干燥的环境 中,避免长时间暴露在空气中,以防氧化失效。
无机盐与微量元素的配制与保存
实验过程中严格控制了操作步 骤和试剂质量,确保了实验结 果的准确性和可靠性。
实验结果符合预期,证明了实 验方案的有效性和可行性。
实验中存在的问题与改进建议
实验中存在试剂配制误差和操 作不规范的问题,可能导致实
验结果的不准确。
建议加强实验操作规范性培 训,提高实验人员的操作水 平,确保试剂配制的准确性
熟悉实验操作流程与注意事项
实验操作流程
准备所需试剂和器材→按照配方配制 母液和常用试剂→过滤除菌→分装→ 储存。
MS培养基的配制

MS 培养基的配制1、配制几种母液(1)配制MS 大量元素母液一般将大量元素分别配制成100倍的母液,使用时再分别稀释100倍。
倍。
分别称取分别称取名称名称 重量重量 名称名称 重量重量 NH 4NO 3 165g 82.5 KH 2PO4 17g 8.5 KNO 3 190g 95 CaCl 2·2H 2O 44g 22 MgSO 4·7H 2O37g18.5各自配成1L 1L((500ml 500ml)的母液。
各自倒入)的母液。
各自倒入1L 1L((500ml 500ml)试剂瓶中,存放于冰箱中。
)试剂瓶中,存放于冰箱中。
)试剂瓶中,存放于冰箱中。
(2)配制MS 微量元素母液一般将微量元素配制成100倍母液。
倍母液。
依次称取(注:溶好一个后,再加下一个)依次称取(注:溶好一个后,再加下一个)名称名称 重量重量 名称名称 重量重量 KI 0.083g Na 2MoO 4·2H 2O 0.025gH 3BO 3 0.62g CuSO 4·5H 2O 0.0025g MnSO 4·H 2O 1.69g CoCl 2·6H 2O 0.0025g ZnSO 4·7H 2O0.86g配成配成1L 母液,倒入1L 试剂瓶中,存放于冰箱中。
试剂瓶中,存放于冰箱中。
注:注:CuSO CuSO 4·5H 2O 和CoCl 2·6H 2O O 由于称取量很小,如果天平精确度没有达到万分之一,由于称取量很小,如果天平精确度没有达到万分之一,可先配成调整液。
可先配成调整液。
分别称取CuSO 4·5H 2O 0.05g O 0.05g,,CoCl 2·6H2O ·6H2O 0.05g 0.05g各自配成100ml 的调整液,然后取5ml 就还有0.0025g 的量。
的量。
(3)配制MS 有机母液一般配制成100倍MS 有机母液。
配制ms培养基实验报告

配制ms培养基实验报告配制MS培养基实验报告引言:培养基是生物学实验中必不可少的一种工具,它提供了细胞生长所需的营养物质和环境条件。
在植物细胞培养中,MS培养基是最常用的一种基础培养基,它由Murashige和Skoog于1962年首次提出,并被广泛应用于植物组织培养和植物生理研究中。
本实验旨在通过配制MS培养基,深入了解其成分及配制方法。
一、材料与方法:1. 材料:- 水溶性盐类:硝酸钙、硝酸钾、硫酸镁、硫酸亚铁、硼酸、锰酸钾、锌硫酸、硫酸铜、钼酸铵- 无机盐类:硝酸铵、磷酸二氢钾、硝酸钠、硫酸钾、硫酸铵- 有机物:肌酸、葡萄糖、维生素B5、天门冬氨酸、吲哚乙酸- 植物激素:植物生长素、植物生长素酸、植物生长素酯、植物生长素酸钠- pH调节剂:氢氧化钠、盐酸- 琼脂:用于凝固培养基2. 方法:1) 将硝酸钙、硝酸钾、硫酸镁、硫酸亚铁、硼酸、锰酸钾、锌硫酸、硫酸铜、钼酸铵分别称取适量,溶解于蒸馏水中,得到无机盐溶液A。
2) 将硝酸铵、磷酸二氢钾、硝酸钠、硫酸钾、硫酸铵分别称取适量,溶解于蒸馏水中,得到无机盐溶液B。
3) 将肌酸、葡萄糖、维生素B5、天门冬氨酸、吲哚乙酸分别称取适量,溶解于蒸馏水中,得到有机物溶液。
4) 将植物生长素、植物生长素酸、植物生长素酯、植物生长素酸钠分别称取适量,溶解于蒸馏水中,得到植物激素溶液。
5) 将无机盐溶液A、无机盐溶液B、有机物溶液、植物激素溶液按一定比例混合,加入适量的琼脂,调节pH值至适宜范围。
6) 高压灭菌培养基,使其达到无菌状态。
二、结果与讨论:通过以上步骤,我们成功配制出了MS培养基。
MS培养基的配方中包含了多种无机盐类、有机物和植物激素,这些成分为细胞生长提供了必要的营养物质和信号物质,保证了细胞的正常生长和分化。
其中,无机盐类的添加对于细胞的生长起到了重要的作用。
硝酸钙、硝酸钾等提供了细胞所需的氮源和钾源,硫酸镁和硫酸亚铁则提供了细胞所需的镁和铁等微量元素。
MS培养基的配制与灭菌

植物组织培养中常用的一种培养基是MS培养基。MS培养基的配制包括以下步骤。
培养基母液的配制和保存 MS培养基含有近30种营养成分,为了避免每次配制培养基都要对这几十种成分进行称量,可将培养基中的各种成分,按原量的20倍或200倍分别称量,配成浓缩液,这种浓缩液叫做培养基母液。这样每次使用时,取其总量的1/20(50 mL)或1/200(5 mL),加水稀释,制成培养液。现将制备培养基母液所需的各类物质的量列出,供配制时使用。
大量元素(母液Ⅰ) mg/L
NH4NO3 33 000
KNO3 38 000
CaCl2·2H2O 8 800
MgSO4·7H2O 7 400
配制培养液 用量筒或移液管从各种母液中分别取出所需的用量:母液Ⅰ为50 mL,母液Ⅱ、Ⅲ、ⅣA和ⅣB各5 mL。再取2,4D 5 mL、NAA 1 mL,与各种母液一起放入烧杯中。
配制培养液时应注意:①在使用提前配制的母液时,应在量取各种母液之前,轻轻摇动盛放母液的瓶子,如果发现瓶中有沉淀、悬浮物或被微生物污染,应立即淘汰这种母液,重新进行配制;②用量筒或移液管量取培养基母液之前,必须用所量取的母液将量筒或移液管润洗2次;③量取母液时,最好将各种母液按将要量取的顺序写在纸上,量取1种,划掉1种,以免出错。
各种母液配完后,分别用玻璃瓶贮存,并且贴上标签,注明母液号、配制倍数、日期等,保存在冰箱的冷藏室中。
MS培养基中还需要加入2,4-二氯苯氧乙酸(2,4-D)、萘乙酸(NAA)、6苄基嘌呤(6BA)等植物生长调节物质,并且分别配成母液(01 mg/mL)。其配制方法是:分别称取这3种物质各10 mg,将2,4-D和NAA用少量(1 mL)无水乙醇预溶,将6BA用少量(1 mL)的物质的量浓度为0.1 mol/L的NaOH溶液溶解,溶解过程需要水浴加热,最后分别定容至100 mL,即得质量浓度为01 mg/mL的母液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(七)倒出、沥去最后一次清洗用水,开始进行植 物材料的切割及接种。 逐一取出经上述灭菌处理的植物材料,置于 下面垫有经灭菌处理的培养皿(或小白瓷碟)的无 菌纱布或滤纸上,左手拿小镊子,右手拿解剖刀, 切除各切段或切块上被灭菌剂毒坏的部分。如有必 要,也可再行切分。在完成切割后,将解剖刀和小 镊子在95%乙醇中浸蘸一下,在酒精灯焰上灼烧灭 菌之后放回原处,以便待冷却后下一切割再用。
实验三 外植体材料的预处 实验三 外植体材料的预处 消毒及接种 理、消毒及接种
一、实验目的: 实验目的: 熟悉外植体材料的预处理, 熟悉外植体材料的预处理,掌 握其消毒和接种方法。 握其消毒和接种方法。
二、方法步骤: 方法步骤: 酒精消毒→消毒剂消毒 预处理 →酒精消毒 消毒剂消毒 酒精消毒
(一)对采来的植物材料进行适当的预处理。除去 不需要的部分,将所需部分切割至适当大小,置自 来水龙头下流水冲洗几分钟至几小时,主要视植物 材料清洁程度而定。这在污染严重时特别有用。 (二)用洗衣粉水(1~2角匙洗衣粉/100 ml水)等 浸洗上述植物材料约5 min,再用自来水冲净洗衣粉 水。这是进一步减少污染的处理。 同时配制消毒液:50%次氯酸钠溶液。
(九) 在完成了该第一只培养容器的外植体接种操 作后,用70%乙醇对超净工作台的台面进行擦拭灭 菌,接着再进行第二只培养容器的外植体接种及超 净台台面的灭菌,直至全部完成。
作业:练习无菌操作;统计植物材料表 面灭菌结果;分析污染原因;、沥干水的植物 材料放入广口瓶或烧杯,向其中倒入新鲜配制、 浓度一定并且加有一定量(通常为灭菌剂消毒液 的0.5%,或每100 mL消毒液滴加10~15滴) Tween-80(土温-80)等表面活性剂的消毒液适量 (液面高度超出植物材料至少0.5 cm),开始计 算灭菌时间。也可在使用上述灭菌剂之前,先将 植物材料浸于70%乙醇灭菌10~30秒。
(三) 将接种用具、无菌水等从80℃烘箱中或直 接从高压灭菌器中取出,置于超净工作台上。打开 超净工作台中的紫外灯,在进行紫外线灭菌处理至 少30 min后关掉紫外灯。 (四) 操作人员洗手擦干,换上洁净工作服,戴 上帽子以免头发散落以及带来污染。坐到超净台前, 并将装有经湿热灭菌培养基的培养瓶、配好的消毒 液、洗净沥干的植物材料置于超净工作台上,用 70%酒精棉球擦手与器具外壁,即可对经上述预处 理的植物材料进行表面灭菌处理,自此以后各步均 须在超净工作台上操作。
实验一 MS培养基的配制和灭菌 实验一 MS培养基的配制和灭菌
一、实验目的: 实验目的: 学习、 学习 、 掌握植物组织固体 培养基的配制和灭菌方法。 培养基的配制和灭菌方法。 配制 方法
二、实验步骤: 实验步骤: 称量→混合 混合→调 值 灭菌 称量 混合 调pH值→灭菌
称量:按每瓶培养基终体积50mL计,称取适量的 称量: 琼脂粉(6g/L)和蔗糖(30g/L),置于2L大烧杯 中,加蒸馏水至需配培养基终体积的3/4左右,加 热使之溶解。 混合: 混合:分别加入一定量的贮备液I、Ⅱ、Ⅲ、Ⅳ和 生长调节物质及其它特殊补加物,再加蒸馏水直至 需配培养基的终体积。 调pH值:充分混合后,0.1mol/L的NaOH调节培养 pH值 基的pH值至5.8。 灭菌: 灭菌:封严培养容器口后,120℃灭菌20min后, 将培养基取出,置于水平台子上,在室温下冷却, 备用。
(六)在持续灭菌时间内定时用玻璃棒轻轻搅动, 以促进植物材料各部分与消毒液充分接触,驱除气 泡,使灭菌彻底。在灭菌时间结束前1 min时,即可 开始用玻璃棒等轻轻压住植物材料将消毒液慢慢倒 入废物缸,注意勿使植物材料滑出。接着立即倒入 适量无菌水,轻搅植物材料以清洗去除灭菌剂残留。 一般表面灭菌时间的计算是从倒入消毒液开始,到 倒入无菌水为止。无菌水的清洗时间每次约3 min; 清洗5次。
(八)接着,左手拿培养瓶,将培养容器口外壁在 靠近酒精灯外焰处转燎数秒,以将其可能带有的微 生物等固定于原处;在酒精灯焰附近处,用右手拇 指与食指配合将瓶塞打开,并将其夹于左手无名指 与最小指之间;再将培养瓶口在酒精灯焰上轻转灼 烧灭菌;以右手拇指与食指配合,用大镊子夹紧一 外植体准确送入培养容器,并将其轻轻地半插入固 体培养基;将大镊子在95%乙醇中浸蘸一下,在酒 精灯焰上灼烧灭菌之后放回原处,以便待冷却后下 一操作再用;将培养瓶口及瓶塞分别在酒精灯焰上 小心地轻转灼燎数秒;盖好瓶塞,旋紧,将其置于 超净工作台的适当位置。
