总甲状腺素校准品产品技术要求mairui
总甲状腺素测定试剂盒(磁微粒化学发光法)产品技术要求总甲状腺素测定试剂盒(磁微粒化学发光法)
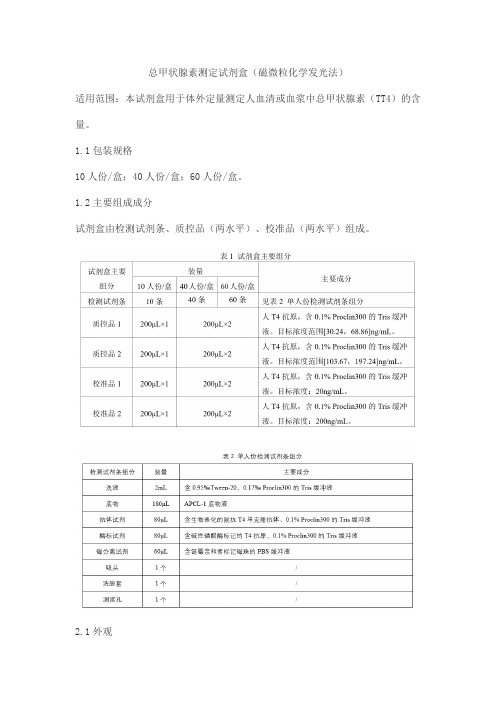
总甲状腺素测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人血清或血浆中总甲状腺素(TT4)的含量。
1.1包装规格10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分试剂盒由检测试剂条、质控品(两水平)、校准品(两水平)组成。
2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至国家标准品150551。
2.3准确性在试剂盒规定的测量范围内检测国家标准品150551,其实测值与理论值之比,应该0.850~1.150之间。
2.4空白限应不高于5ng/mL。
2.5线性在[8, 300] ng/mL的线性范围内,相关系数r的绝对值(|r|)应不低于0.9900。
2.6精密度2.6.1分析内精密度CV≤8%。
2.6.2批间精密度CV≤20%。
2.7质控品测定值测定结果应在本试剂盒规定的范围内。
2.8 特异性浓度不低于500ng/mL的TT,在本试剂盒上的测定结果应不高于315.0ng/mL。
浓度不低于50ng/mL的rT3,在本试剂盒上的测定结果应不高于15.0ng/mL。
2.9校准品和质控品瓶间差校准品瓶间差CV≤10%。
质控品瓶间差CV≤10%。
2.10稳定性2.10.1效期末稳定性试剂盒2℃~8℃条件下保存至效期末,检验结果应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
2.10.2 质控品开瓶稳定性质控品开瓶后,在2℃~8℃密封避光保存,在7天后检测质控品分析内精密度和质控品测定值,应符合2.6.1和2.7的要求。
2.10.3 校准品开瓶稳定性校准品开瓶后,在2℃~8℃密封避光保存,在7天后检测准确性、线性,应符合2.3、2.5的要求。
总三碘甲状腺原氨酸校准品产品技术要求mairui

2.性能指标
2.1外观和性状
2.1.1颜色性状
校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为白色塑料瓶,盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、校准卡应完整、清晰牢固。
塑料外盖与塑料瓶身配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.2装量
每瓶校准品容量应不少于2.0 mLo
2.3溯源性
2.3.1校准信息卡
校准品应可提供一份校准卡,包含校准品有效期和校准品各浓度水平的信息。
2.3.2赋值准确性
经校准品校准的迈瑞全自动化学发光免疫分析仪检测由国家标准品制备的两个浓度水平的正确度控制品,结果的偏倚应在土8.0%范围内。
2.3.3程序文件
应提供相应的赋值程序文件、至少一个批次的赋值记录,测量不确定度计算及校准品的互换性技术文件。
技术文件中计算的校准品测量不确定度应不大于8%。
2.4均一性
2.4.1 瓶内均一性
校准品瓶内均一性以变异系数CV或标准偏差SD为指标,其中之一满足表2的要求即可。
表2校准品瓶内均一性的指标要求
2.4.2 瓶间均一性
校准品瓶间均一性以变异系数CV或标准偏差SD为指标,其中之一满足表3的要求即可。
表3校准品瓶间均一性的指标要求
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(H1V-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
甲状腺素测定试剂盒(磁微粒化学发光法)产品技术要求利德曼
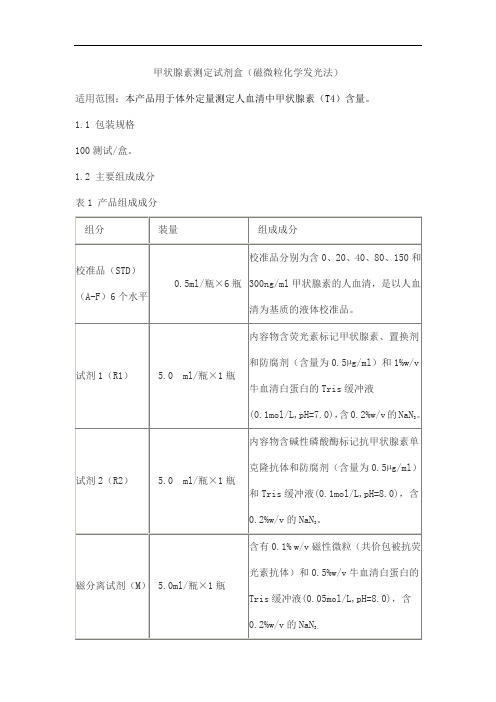
甲状腺素测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量测定人血清中甲状腺素(T4)含量。
1.1 包装规格100测试/盒。
1.2 主要组成成分表1 产品组成成分校准品和质控品浓度具有批特异性,具体浓度见瓶标签。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,易识别。
2.2 净含量不得低于标示体积。
2.3 特异性试剂盒与表中有关潜在交叉反应物应无显著的交叉反应2.4 准确度用国家标准品(编号:150551)作为样本进行检测,其测量结果的相对偏差应不超过±10%。
2.5 空白限应不大于5 ng/ml。
2.6 线性在[5,300]ng/ml的测量范围内,试剂盒的相关系数r应不小于0.990。
2.7 重复性用(50±10)ng/ml和(150±30)ng/ml 的样本各重复检测10次,其变异系数(CV)应不大于10%。
2.8 质控品的赋值有效性质控品的测量值应在质控范围内。
2.9 批间差用三个批号试剂盒检测同一份样本,每一批试剂重复检测样本10次,其变异系数(CV)应不大于15%。
2.10效期稳定性该试剂盒置于2℃~8℃储存,有效期为12个月,在有效期满后一个月内检测试剂盒的准确度,空白限,线性和重复性,应符合2.4~2.7的要求。
2.11溯源性根据GB/T 21415及有关规定提供校准品的来源、赋值过程以及不确定度等内容,甲状腺激素抗体校准品溯源至有证参考物质IRMM-468。
总甲状腺素(TT4)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk

总甲状腺素(TT4)测定试剂盒(电化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人体血清样本中总甲状腺素(TT4)的含量。
1.1产品型号/规格:100人份/盒、200人份/盒。
1.2主要组成试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(TT4-Cal)(选配)组成。
组成及含量如下:2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.420μg/dL 。
2.3 准确度用T4国家标准品(150551)进行检测,实测值与理论值之比应在0.850-1.150之间。
2.4 线性在[1.0,24.86]μg/dL范围内,线性相关系数的绝对值(|r|)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(5.0±1.0μg/dL)和(20.0±4.0μg/dL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(5.0±1.0μg/dL)和(20.0±4.0μg/dL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 特异性2.6.1与三碘甲状腺原氨酸(T3)测定浓度不低于500ng/mL的T3样品,其测定结果应不高于1.5μg/dL;2.6.2 与反三碘甲状腺原氨酸(rT3)测定浓度不低于50ng/mL的rT3样品,其测定结果应不高于1.5μg/dL。
2.7 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.8 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至国家标准品(编号150551)。
甲状腺球蛋白抗体校准品产品技术要求mairui

2性能指标
2.1外观和性状
2.1.1颜色性状
校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为白色塑料瓶,盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、校准卡应完整、清晰牢固。
塑料外盖与塑料瓶身配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.2装量
每瓶校准品容量应不少于 2.0 mL。
2.3溯源性
2.3.1校准信息卡
校准品应可提供一份校准卡,包含校准品有效期和校准品各浓度水平的信息。
2.3.2赋值准确性
经校准品校准的迈瑞全自动化学发光免疫分析仪检测由国家标准品制备的两个浓度水平的正确度控制品,结果的偏倚应在±10.0% 范围内。
2.4均一性
2.4.1瓶内均一性
校准品瓶内均一性C0以标准偏差SD为指标,满足SD≤0.32 IU/mL;C1和C2以变异系数CV为指标,满足CV≤8.0%。
2.4.2瓶间均一性
校准品瓶间均一性C0以标准偏差SD为指标,满足SD≤0.20 IU/mL;C1和C2以变异系数CV为指标,满足CV≤5.0%。
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
促甲状腺激素测定试剂盒产品技术要求国赛

促甲状腺激素测定试剂盒产品技术要求国赛摘要:促甲状腺激素(TSH)测定试剂盒是一种通过化学发光免疫分析法来测定人体内促甲状腺激素水平的产品。
本文将从试剂盒的基本原理、技术指标、操作方法、结果判断等方面进行详细介绍,并提出了一些改进方案,以进一步提高其准确性和可靠性。
1.试剂盒的基本原理2.技术指标(1)测定范围:0.1-100mIU/L(2)灵敏度:0.1mIU/L(3)精密度:CV≤10%(4)准确度:与国家标准方法比较,差异不超过±10%3.操作方法(1)样品准备:采集血清样本,离心去除红细胞沉淀。
(2)试剂盒开封:将试剂盒从冰箱取出,放置室温下30分钟使其恢复平衡。
(3)标准曲线制备:用不同浓度的标准品配制标准曲线,按照试剂盒使用说明进行操作。
(4)样品测试:取适量血清样本,按照试剂盒使用说明进行操作,加入发光试剂后进行混匀,开始计时。
(5)数据处理:根据标准曲线上的吸光度值,计算出样品中促甲状腺激素的浓度。
4.结果判断(1)阳性结果:样品中促甲状腺激素浓度超过设定的参考范围上限。
(2)阴性结果:样品中促甲状腺激素浓度在参考范围内。
(3)结果异常:样品中促甲状腺激素浓度超过参考范围上下限,需要进一步检测。
5.改进方案(1)优化抗体:选择更具特异性的抗体,提高试剂盒的选择性。
(2)增加质控品:引入质控品,增加结果的稳定性和可靠性。
(3)提高灵敏度:通过改进试剂盒中的光学材料和化学试剂,提高试剂盒的灵敏度。
(4)缩短操作时间:优化操作流程,减少操作时间,提高实验效率。
(5)降低价格:通过技术改进和成本优化,降低试剂盒的价格,提高产品的竞争力。
总结:促甲状腺激素(TSH)测定试剂盒是一种重要的医学检验试剂,可以用于评估甲状腺功能的正常与否。
本文对其技术要求进行了详细介绍,并提出了一些改进方案,以进一步提高其准确性和可靠性。
希望上述内容能够为促甲状腺激素(TSH)测定试剂盒的开发和优化提供参考。
总甲状腺素测定试剂盒(化学发光法)产品技术要求巨东生物

2.性能指标
2.1外观和物理检查
试剂盒各组分应齐全、完整,液体无渗漏;中文包装标签应清晰,无磨损。
磁珠试剂组分为含棕色固体微粒的液体,磁珠无板结,液体无絮状物,无异物;其他试剂组分应为清澈均匀的液体,无沉淀,无絮状物。
2.2线性
在线性范围0.8~25 μg/dL 内,用lg-logit 数学模型拟合,剂量-反应曲线线性相关系数的绝对值|r|应≥0.990。
2.3最低检出限
应不高于0.40 μg/dL。
2.4准确性
测定工作校准品和相应浓度国家标准品,用lg-logit 数学模型拟合,工作校准品剂量-反应曲线和国家标准品建立的剂量-反应曲线不显著偏离平行;
以国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100 之间;
以国家标准品2 个浓度为样本,其实测值与理论值之比应在0.850~1.150 之间。
2.5精密度
2.5.1分析内精密度
精密度参考品测定结果的变异系数(CV)应不大于8.0%。
2.5.2批间精密度
精密度参考品测定结果的变异系数(CV)应不大于20.0%。
2.6特异性
2.6.1与三碘甲状腺原氨酸(TT3)
浓度不低于500 ng/mL 的TT3 在本试剂盒上的测定结果应不高于1.5 μg/dL。
2.6.2与反三碘甲状腺原氨酸(rT3)
浓度不低于50ng/mL 的rT3 在本试剂盒上的测定结果应不高于 1.5 μg/dL。
1 / 1。
多项免疫复合定值质控品产品技术要求mairui

性能指标
2.1外观和性状
2.1.1颜色性状
质控品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为透明塑料管,应盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、参考值表应完整、清晰牢固。
塑料外盖与塑料管身配合后应无渗漏;塑料外盖应无明显划痕、崩缺。
2.2装量
每瓶质控品容量应不少于2.0 mL。
2.3测量准确度
2.3.1质控参考值表
质控品应可提供一份参考值表,包含适用型号的迈瑞化学发光免疫分析系统
的检测项目参考值及参考范围。
2.3.2赋值准确性
经校准的迈瑞全自动化学发光免疫分析仪检测质控品所包含的检测项目,结果应在参考范围内(不同批次的质控品参考范围参见参考值表)。
2.4均一性
2.4.1瓶内均一性
质控品瓶内均一性应满足变异系数CV≤8.0%。
2.4.2瓶间均一性
质控品瓶间均一性应满足变异系数CV≤5.0%。
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂
灵敏度的检测试剂,对质控品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.1外观和性状
2.1.1 颜色性状
校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
包装
分装瓶应为白色塑料瓶,盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、校准卡应完 清晰牢固。
塑料外盖与塑料瓶身配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
每瓶校准品容量应不少于2.0 mLo
2.3.1 校准信息卡
校准品应可提供一份校准卡,包含校准品有效期和校准品各浓度水平的信息。
赋值准确性
经校准品校准的迈瑞全自动化学发光免疫分析仪检测由国家标准品制备的两个浓度水 平的正确度控制品,结果的偏倚应在±7.0%范围内。
程序文件
应提供相应的赋值程序文件、至少一个批次的赋值记录,测量不确定度计算及校准品 的互换性技术文件。
技术文件中计算的校准品测量不确定度应不大于8%0
2.4 均一性
整、 2.2 装量
2.3 溯源性
2.4.1 瓶内均一性
校准品瓶内均一性以变异系数CV或标准偏差SD为指标,其中之一满足表2的要求即
可。
校准品瓶间均一性以变异系数CV或标准偏差SD为指标,其中之一满足表3的要求即可。
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
