硅酸盐分析课后答案newest
硅酸盐分析(2)
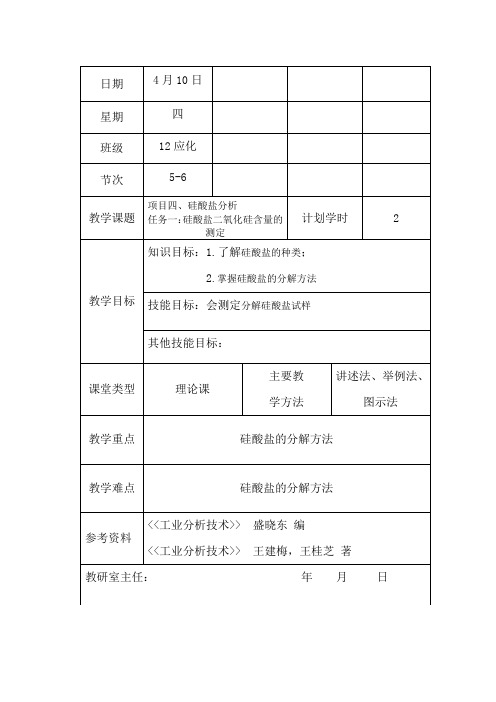
日期4月10日星期四班级12应化节次5-6教学课题项目四、硅酸盐分析任务一:硅酸盐二氧化硅含量的测定计划学时 2教学目标知识目标:1.了解硅酸盐的种类;2.掌握硅酸盐的分解方法技能目标:会测定分解硅酸盐试样其他技能目标:课堂类型理论课主要教学方法讲述法、举例法、图示法教学重点硅酸盐的分解方法教学难点硅酸盐的分解方法参考资料<<工业分析技术>> 盛晓东编<<工业分析技术>> 王建梅,王桂芝著教研室主任:年月日教学内容及过程设计一、水分的测定水分可分为吸附水和化合水。
1、吸附水吸附水在105 ~110℃下烘2h,称重测定。
2、化合水化合水包括结晶水和结构水两部分。
结晶水是以H2O分子状态存在于矿物晶格中,如石膏CaSO4·2H2O。
结晶水通常在300 ℃以下灼烧即可排出。
结构水是以化合状态的氢或氢氧根存在于矿物的晶格中,需加热到300 ~1300℃才能分解而放出。
化合水的测定方法有重量法、气相色谱法、库仑法等。
二、烧失量的测定烧失量又称为灼烧减量,是试样在1000 ℃灼烧后所失去的质量。
烧失量主要包括化合水、二氧化碳、和少量的硫、氟、氯、有机质等。
烧失量是试样中各组分在灼烧时的各种化学反应所引起的质量增加和减少的代数和。
因此,当试样较为复杂时,一般不测烧失量。
三、二氧化硅含量的测定1、氯化铵重量法(1)原理试样用无水Na2CO3烧结,使不溶的硅酸盐转化为可溶性的硅酸钠,用盐酸分解熔融块。
Na2SiO3+2HCl=H2SiO3+2NaCl再加入固体氯化铵,在沸水浴上加热蒸发,使硅酸脱水析出,沉淀用滤纸过滤后,灼烧,得到含有铁、铝等杂质的不纯二氧化硅。
用HF处理沉淀,使其中的SiO2以SiF4形式挥发,失去的质量即为纯SiO2的质量。
SiO2 + 6HF = H2SiF6 + 2H2OH2SiF6 = SiF4 ↑+ 2HF再用分光光度法测定滤液中可溶性的SiO2的量,二者之和即为SiO2的总量(GB/T176-1996中规定的基准法)。
工业分析第四章_硅酸盐分析

二、氟硅酸钾容量法
1、基本原理 2、条件及注意事项
1、基本原理
在强酸介质中,在KF、KCl存在下,可溶性硅酸盐与F-作用,
定量的析出氟硅酸钾沉淀,该沉淀在沸水中水解析出氢氟酸, 可用NaOH标准溶液滴定,并间接计算样品中二氧化硅的含量。
强 H (3 mol L 浓HNO3)
+ -1
样品
KOH NaOH 熔融
b)脱水时间 10 ~15 分钟
太长脱的太干:增加吸附量不易洗净,偏高 太短脱水不完全:可溶 转化 不溶性硅酸不完全,易透过滤纸损失, 使结果偏低并且过滤慢
对熟料,直接固体样加上NH4Cl再加HCl及几滴 HNO3 ,分解,沸水浴加热近干(10 ~15min)—— 小米粒(较干)状. 对生料等需碱熔的样品、熔块被HCl分解后,体 积太大,应先蒸发至糊状后,再加NH4Cl沸水浴加热 近干(约15分钟)
2 KF + H2SiO3 + 4 HF
NaF + H2O
4 HF 4 NaOH
滴定反应: HF + NaOH
为使上述反应进行完全必须控制好条件。
2、条件及注意事项 K2SiF6法测SiO2关键两步 (1)掌握沉淀这一步 酸度、温度、体积 KCl、KF 加入量尽可能使所有H2SiO3全部转化为K2SiF6 ↓ (2)沉淀的洗涤和中和残余酸,防止K2SiF6的水 解损失。
2) 过滤与洗涤
a) 过滤 为缩短过滤时间,加10 mL 3 : 97热稀HCl先将可溶 性盐溶解。 (3 : 97 HCl作洗涤剂作用?) 中速滤纸(蓝条)过滤,并迅速进行,放时间太长, 温度降低后,可能使:
转 水凝胶 转
胶冻不好过滤 水溶胶透过滤纸结果偏低
高考考点完全解读练习答案硅酸盐工业新型无机非金属材料

22、硅酸盐工业新型无机非金属材料1.复习重点水泥工业和玻璃工业的基本原理;新型无机非金属材料的特性及主要用途2.难点聚焦1.硅酸(H2SiO3)酸性很弱(弱于碳酸)溶解度很小,由于SiO2不溶于水,硅酸应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得。
Na2SiO3+2HCl == H2SiO3+2NaCl硅胶多孔疏松,可作干燥剂,催化剂的载体。
四.硅酸盐硅酸盐是由硅、氧、金属元素组成的化合物的总称,分布广,结构复杂化学性质稳定。
一般不溶于水。
(Na2SiO3、K2SiO3除外)最典型的代表是硅酸钠Na2SiO3 :可溶,其水溶液称作水玻璃和泡花碱,可作肥皂填料、木材防火剂和黏胶剂。
常用硅酸盐产品:玻璃、陶瓷、水泥。
2.硅单质与碳相似,有晶体和无定形两种。
晶体硅结构类似于金刚石,有金属光泽的灰黑色固体,熔点高(1410℃),五.氯元素:位于第三周期第ⅦA族,原子结构:容易得到一个电子形成氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在。
3.例题精讲[例1]熔融氢氧化钠反应选用的器皿是 [ ]A.陶瓷坩埚B.石英坩埚 C.普通玻璃坩埚 D.生铁坩埚分析:陶瓷的成分中含有SiO2,石英的成分就是SiO2,玻璃的主要成分中也含有SiO2,而SiO2在高温下可以跟NaOH发生如下反应:SiO2+2NaOH Na2SiO3 所以A、B、C的器皿都不能选用,只能内生铁坩埚。
[例2]下列溶液中可以盛放在玻璃瓶中,但不能用磨口玻璃塞的是 [ ]。
A.硅酸钠溶液B.氢氟酸C.氢氧化钠溶液 D.氯化钠溶液分析:玻璃的主要成分之一二氧化硅,它能跟氢氟酸迅速反应,所以,氢氟酸不能盛放在玻璃、陶瓷容器中,只能保存在铅皿或塑料瓶中。
氢氧化钠溶液与二氧化硅在常温下反应十分缓慢,所以可以盛放在玻璃瓶中,但瓶的磨口处的二氧化硅跟氢氧化钠缓慢反应后,生成的硅酸钠是一种矿物胶,使瓶塞与瓶口粘在一起,因此不能用磨口玻璃塞。
硅酸钠溶液可以用玻璃瓶盛放,只是不能用磨口玻璃塞(原因同氢氧化钠溶液)。
第五章 硅酸盐分析1

4. 称取空气干燥煤样1.2000g,测定挥发分时失去质
量0.142g,测定灰分时残渣的质量为0.1125g。
如已知煤样的分析水分为4%,求煤样的挥发分, 灰分产率和固定碳的含量。 挥发分产率:7.83% 灰分产率:9.38%
固定碳含量:78.79%
2019/2/20
1
作业评讲
5. 称取分析基煤样1.2000g。灼烧后残余物的质量是
2019/2/20 20
§3.2 硅酸盐试样的分解
试样的分析过程:
采样 制样 溶样(熔样) 测定 报结果
方法选择及 干扰元素的消除
一、试样的分解
硅酸盐分析过程中遇到的样品,绝大多数为固体试样。 1、试样分解的目的
转 固体试样转变成 试样溶液(即试样 试液)
应在铂金器皿或塑料器皿,不能用玻璃器皿
2019/2/20 26
三、熔融法 将试样与熔剂混合在高温下加以熔融,使欲测组分 变为可溶于水或酸中的化合物(K、Na盐、硫酸盐、氯 化物)
熔融法分类:
碱熔法:用碱性熔剂,熔酸性试样,如Na2CO3
酸熔法:用酸性熔剂,熔碱性试样,如K2S2O7
2019/2/20
[Be3Al2(Si6O18)]、石英[SiO2]、蛋白石[SiO2nH2O]、锆
英石[ZrSiO4]等。
2019/2/20 11
滑石
辉石
正长石
金云母
锆石
2019/2/20
绿柱石
12
玻
璃
2019/2/20
陶 瓷
13
分子式:
硅酸盐需用复杂的分子式表示 通常将硅酸酐分子(SiO2)和构成硅酸盐
的所有氧化物的分子式分开来写,如:
第六章 硅酸盐分析

硅酸盐分析的意义
重要工业原料;许多元素如Li、Be、B、Zr等 也大多取之于硅酸盐矿物。
组成复杂,组成元素众多。
1.4 试样分解
1.4.1 酸溶法
1.4.1.1 盐酸溶解 只对少数样品有用,大多数样品分解不完全; 有时用于单项分析。 1.4.1.2 氢氟酸分解
氢氟酸是分解硅酸盐惟一最有效的溶剂。硅酸 盐矿物大部分可分解完全,其它难溶物也可以通过 加盖、延长分解时间或加压使之分解完全。 分解需用铂皿,有时可通过加数滴HNO3、 H2SO4或HClO4使分解效果更好。
地壳中的各种已成岩石,因地球内力影响下, 所处的物理、化学环境发生变化,导致原来的岩石 在结构和成分上发生变化,这种作用称为变质作用。 变质岩即为经过变质作用的岩石。
从地表起到16公里深处,各种岩石所占的百分 比如下:
岩浆岩(包括变质岩浆岩)
沉积岩(包括变质沉积岩)
95%
5%
岩石在地表的分布面积:沉积岩75%,岩浆岩 和变质岩合为25%。
变质岩
岩浆岩又称为火成岩,在岩浆活动的过程中冷 却凝固而成。组成的基本元素是Si、Al、Ca、Na、 K、Fe、Mg、H、O,最主要的成分是SiO2和Al2O3, 此外还有S、P、B、H2S、CO2、F、Cl等。绝大多 数火成岩主要由橄榄石、辉石、角闪石、长石、云 母和石英等六种矿物组成。 沉积岩又称水成岩,是地球最上部的成层岩石。 在地表的各种已成岩石受到各种地质作用于原地或 由经过流水、风、冰川及其它外力搬运,最后在海 洋、低地或海陆之间按照一定的方式沉积下来而成。 化石的形成是典型的沉积作用。煤、石油等化石燃 料矿产只存在于沉积岩中。
4HF+SiO2=SiF4+2H2O
再灼烧至恒重,差减计算SiO2的含量。
硅酸盐分析课后答案newest

三
章
硅
酸
盐
分
析
1. 填空题
(1) 用氯 化铵 重 量法 测定 硅 酸盐 中的 二 氧化 硅 时, 加入 氯 化铵 的作 用
是
。
( 2)可溶性二氧化硅的测定方法常采用
。
( 3)可以将硅钼黄还原为硅钼蓝的还原剂有
。
( 4)氟硅酸钾酸测定硅酸盐中的二氧化硅时,若采用氢氧化钾为熔剂,应在
坩埚中熔融;若以碳酸钾作熔剂,应在
色变为亮黄色,消耗 3.30 mL 。
( 2)在滴定完铁的溶液中,加入 15.00 mLEDTA标准溶液,加热至 70 ~ 80 ℃,
加热 pH = 4.3 的缓冲溶液,加热煮沸 1 ~ 2 min ,稍冷后以 PAN为指示剂,
用 0.01000 mol/L 的硫酸铜标准溶液滴定过量的 EDTA至溶液变为亮紫色,
坩埚中熔融;若采用氢氧化钠做熔
剂时,应在
坩埚中熔融。
( 5 ) 用 EDTA 滴 定 法 测 定 硅 酸 盐 中 的 三 氧 化 二 铁 时 , 使 用 的 指 示 剂
是
。
( 6)硅酸盐水泥及熟料可采用
法分解试样,也可以采用
发测定水泥熟料中的 Al O 2 3 时,使用的滴定剂和指示剂分别为
250
100%
1 2 C V M EDTA EDTA Fe2O3
m 25 250
100%
1T 2 M (CaO ) VEDTA M Fe2 O3
m 25 250
100%
5.28% ( 2 )由
题中可知,测定的是铝的含量,则:
( 3 )由题中可知,测定的是钙的含量,则:
( 4 )由题中可知,测定的是镁的含量,则:
人教版化学必修一讲义:第4章 第1节 课时2 硅酸盐和硅单质 含答案

课时2 硅酸盐和硅单质目标与素养:1.了解硅酸盐的组成和性质及应用;知道硅的性质和用途。
(宏观辨识与变化观念)2.了解无机非金属材料的生产及用途。
(宏观辨识与社会责任)一、硅酸盐1.概念由硅、氧和金属组成的化合物的总称。
2.组成的表示通常用二氧化硅和金属氧化物的组合形式表示其组成。
例如:硅酸钠(Na 2SiO 3):Na 2O·SiO 2。
3.最简单的硅酸盐——Na 2SiO 3二、硅酸盐产品——无机非金属材料产品原料主要设备主要成分水泥石灰石、黏土水泥回转窑硅酸二钙 2CaO·SiO 2硅酸三钙 3CaO·SiO 2铝酸三钙 3CaO·Al 2O 3普通玻璃纯碱、石灰石、石英砂玻璃窑Na 2O·CaO·6SiO 2陶瓷黏土——三、其他含硅物质1.SiC:俗称金刚砂,类似金刚石的结构和性能。
2.含4%硅的硅钢具有导磁性,用作变压器铁芯。
3.硅橡胶:既耐高温又耐低温。
4.人造分子筛:作吸附剂和催化剂。
四、硅单质1.形态和结构2.单质硅的性质(1)物理性质①晶体硅是一种带有金属光泽的灰黑色固体,根据其结构分析可知,晶体硅熔点高、硬度大、有脆性。
②导电性介于导体和绝缘体之间,是良好的半导体材料。
(2)化学性质:常温下化学性质稳定,除氢氟酸和强碱外,不与其他物质发生反应。
Si与氢氟酸、NaOH溶液发生反应的化学方程式分别为Si+4HF===SiF4↑+2H2↑、Si+2NaOH+H2O===Na2SiO3+2H2↑。
3.重要用途(1)半导体材料,如硅芯片等。
(2)新型能源,如光电池等。
1.判断正误(正确的打“√”,错误的打“×”)(1)硅酸钠可以改写为Na2O·SiO2,故硅酸钠是混合物,含有Na2O和SiO2。
( )(2)硅酸钠俗称水玻璃,是一种防火剂。
( )(3)硅酸盐是一大类结构复杂的固态物质。
( )(4)普通玻璃和水泥的生产原料均含石灰石。
无机材料科学基础硅酸盐课后作业答案

3-13对于刃位错和螺位错,区别其位错线方向、伯氏矢量和位错运动方向的特点。
解:刃位错:位错线垂直于 位错线垂直于位错运动方向;螺位错:位错线平行于 位错线平行于位错运动方向。
3-14图3-1是晶体二维图形,内含有一个正刃位错和一个负刃位错。
(1)围绕两个位错伯格斯回路,最后得伯格斯矢量若干?
影响形成间隙型固溶体影响因素:(1)杂质质点大小:即添加的原子愈小,易形成固溶体,反之亦然。(2)晶体(基质)结构:离子尺寸是与晶体结构的关系密切相关的,在一定程度上来说,结构中间隙的大小起了决定性的作用。一般晶体中空隙愈大,结构愈疏松,易形成固溶体。(3)电价因素:外来杂质原子进人间隙时,必然引起晶体结构中电价的不平衡,这时可以通过生成空位,产生部分取代或离子的价态变化来保持电价平衡。
3-5试分析形成固溶体后对晶体性质的影响。
解:影响有:(1)稳定晶格,阻止某些晶型转变的发生;(2)活化晶格,形成固溶体后,晶格结构有一定畸变,处于高能量的活化状态,有利于进行化学反应;(3)固溶强化,溶质原子的溶入,使固溶体的强度、硬度升高;(4)形成固溶体后对材料物理性质的影响:固溶体的电学、热学、磁学等物理性质也随成分而连续变化,但一般都不是线性关系。固溶体的强度与硬度往往高于各组元,而塑性则较低,
Ni3+2yNi2+1-3yO Ni3+/Ni2+=2y/(1-3y)=10-x
则y=5×10-5,x=1-y=0.99995, Ni0.99995O
每m3中有多少载流子即为空位浓度:[ ]=y/(1+x)=2.5×10-5。
3-26在MgO-Al2O3和PbTiO3-PbZrO3中哪一对形成有限固溶体,哪一对形成无限固溶体,为什么?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硅酸盐分析课后答案
n e w e s t
SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#
第三章硅酸盐分析
1. 填空题
(1)用氯化铵重量法测定硅酸盐中的二氧化硅时,加入氯化铵的作用
是。
(2)可溶性二氧化硅的测定方法常采用。
(3)可以将硅钼黄还原为硅钼蓝的还原剂有。
(4)氟硅酸钾酸测定硅酸盐中的二氧化硅时,若采用氢氧化钾为熔剂,应在
坩埚中熔融;若以碳酸钾作熔剂,应在坩埚中熔融;若采用氢氧化钠做熔剂时,应在坩埚中熔融。
(5)用EDTA滴定法测定硅酸盐中的三氧化二铁时,使用的指示剂
是。
(6)硅酸盐水泥及熟料可采用法分解试样,也可以采用法溶解试样。
(7)用EDTA发测定水泥熟料中的Al
2O
3
时,使用的滴定剂和指示剂分别为
和。
(1)使得H
2SiO
3
迅速脱水析出
(2)硅钼蓝分光光度法
(3)硫酸亚铁、氯化亚锡、抗坏血酸。
(4)镍铂银
(5)磺基水杨酸或其钠盐
(6)碱熔酸熔
(7)EDTA PAN和等物质的量的EDTA-Cu(直接滴定法)/ PAN(铜盐返滴定法)
2. 称取某岩石样品1.000 g,以氟硅酸钾容量法测定硅的含量,滴定时消耗 mol/L NaOH标准溶液 mL,试求该试样中SiO
2
的质量分数。
由于SiO
2~4F~4NaOH,则W(SiO
2
)=M?V(NaOH)?c(NaOH)÷4×250/50×100%/m
其中M代表二氧化硅的分子量,V代表消耗NaOH的体积,c(NaOH)代表消耗NaOH的浓度,m为样品质量。
故计算得:W=×19×10-3×÷4×5×100%/1=%。
3. 称取含铁、铝的试样0.2015 g,溶解后调节溶液pH = ,以磺基水杨酸作指示剂,用 mol/LEDTA标准溶液滴定至红色消失并呈亮黄色,消耗 mL。
然后加入EDTA 标准溶液 mL,加热煮沸,调pH = ,以PAN作指示剂,趁热用 mol/L硫酸铜标准溶
液返滴,消耗 mL。
试计算试样中Fe
2O
3
和Al
2
O
3
的含量。
由题意可知,用EDTA滴定Fe3+,故:
n(Fe
2O
3
)=
2
1
n(Fe3+)=
2
1
C
EDTA
V
4. 采用配位滴定法分析水泥熟料中铁、铝、钙和镁的含量时,称取0.5000 g试样,碱熔后分离除去SiO
2
,滤液收集并定容于250 mL的容量瓶中,待测。
(1)移取 mL待测溶液,加入磺基水杨酸钠指示剂,快速调整溶液至pH = ,用T (CaO/EDTA) = mg/mL的EDTA标准溶液滴定溶液由紫红色变为亮黄色,消耗mL。
(2)在滴定完铁的溶液中,加入 mLEDTA 标准溶液,加热至70 ~ 80 ℃,加热pH =
的缓冲溶液,加热煮沸1 ~ 2 min ,稍冷后以PAN 为指示剂,用 mol/L 的硫酸铜标准溶液滴定过量的EDTA 至溶液变为亮紫色,消耗 mL 。
(3)移取 mL 待测溶液,掩蔽铁、铝、钛,然后用KOH 溶液调节溶液pH > 13,加入
几滴CMP 混合指示剂,用EDTA 标准溶液滴至黄绿色荧光消失并呈红色,消耗 mL 。
(4)移取 mL 待测溶液,掩蔽铁、铝、钛,加入pH = 的氨性缓冲溶液,以KB 为指
示剂,用EDTA 标准溶液滴定至纯蓝色,消耗 mL 。
若用二安替比林甲烷分光光度计法测定试样中TiO 2的含量为%,试计算水泥熟料
中Fe 2O 3、Al 2O 3、CaO 和MgO 的质量分数。
(1)由题中所知,测定的是铁的含量,则:
%28.5%100250
25)(21%1002502521%10025025)(32323232=⨯⨯=⨯⨯=⨯⨯=m M V CaO M T m M V C m O Fe m O Fe O Fe EDTA O Fe EDTA EDTA )(ω(2)由题中可知,测定的是铝的含量,则:
(3)由题中可知,测定的是钙的含量,则:
(4)由题中可知,测定的是镁的含量,则:。
