工业催化--第5章+金属氧化物和金属硫化物催化剂及其催...
工业催化基础5

第一节 金属催化剂的结构
以Ni为例,Ni原子的价电子结构为3d84s2,假定spd轨道杂化时需要的能量是 由不同电子结构之间发生共振提供的,那么最稳定的spd轨道共振会发生 在d2sp3(状态A)和d3sp2(状态B)之间 Ni的两种电子状态
根据Ni的价电子结构,状态A是在2个3d电子和一个4s电子被激发到4p轨道后 形成的,d轨道的分数为2/6;状态B是在1个3d电子和1个4s电子被激发到 4p轨道后形成的。d轨道的分数为3/7。根据Ni的饱和磁矩和统计权重,状 态A和状态B的统计分布分别为30%和70%。因此计算出的d%为:
第五章:金属催化剂及催化作用
主要内容:
理解金属催化剂的结构特性; 掌握金属催化剂的催化作用原理; 理解负载型金属催化剂的特点; 理解和掌握催化加氢和脱氢、合成氨工业等催化过程的
基本特征。
化工资源有效利用国家重点实验室
1
第一节 金属催化剂的结构
(1)晶体结构
由于金属元素的电负荷较小,电离能也不高,在金属原子结合成晶体时,原 来属于各原子的价电子很容易脱离原子的束缚,而在金属晶体中比较自由 的运动,形成“自由电子”或“离域电子”。这样,在晶体内部,一部分是由 共有化电子形成负电子云,而另一部分则是浸在这个负电子云中的带电正 电荷的各原子实。
,原来的直线台阶将变为折线台阶,台阶的转折处称为扭折。
面心立方金属Pt [557]表面台阶结
下图是面心立方金属Pt的台阶结构示意图:
构是可表示为: Pt(s) – [6 (111) × (100)] – [011] 台 面 指 标 (111) 有 6 个 原 子 列 宽 ,
台阶侧面指标(100)高度为一个原
金属催化剂金属表面模型示意图
第二节 金属催化剂的催化作用
《工业催化》课程教学大纲
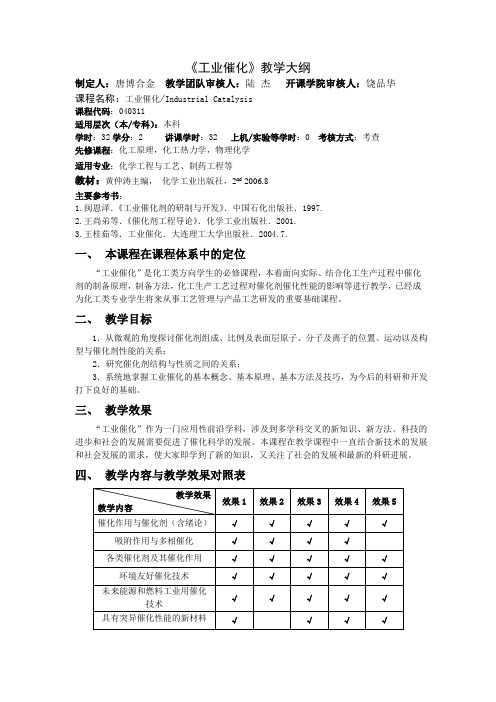
《工业催化》教学大纲制定人:唐博合金教学团队审核人:陆杰开课学院审核人:饶品华课程名称:工业催化/Industrial Catalysis课程代码:040311适用层次(本/专科):本科学时:32学分:2 讲课学时:32 上机/实验等学时:0 考核方式:考查先修课程:化工原理,化工热力学,物理化学适用专业:化学工程与工艺、制药工程等教材:黄仲涛主编,化学工业出版社,2nd 2006.8主要参考书:1.闽恩泽.《工业催化剂的研制与开发》.中国石化出版社.1997.2.王尚弟等.《催化剂工程导论》.化学工业出版社.2001.3.王桂茹等.工业催化.大连理工大学出版社.2004.7.一、本课程在课程体系中的定位“工业催化”是化工类方向学生的必修课程,本着面向实际、结合化工生产过程中催化剂的制备原理,制备方法,化工生产工艺过程对催化剂催化性能的影响等进行教学,已经成为化工类专业学生将来从事工艺管理与产品工艺研发的重要基础课程。
二、教学目标1.从微观的角度探讨催化剂组成、比例及表面层原子、分子及离子的位置、运动以及构型与催化剂性能的关系;2.研究催化剂结构与性质之间的关系;3.系统地掌握工业催化的基本概念、基本原理、基本方法及技巧,为今后的科研和开发打下良好的基础。
三、教学效果“工业催化”作为一门应用性前沿学科,涉及到多学科交叉的新知识、新方法。
科技的进步和社会的发展需要促进了催化科学的发展。
本课程在教学课程中一直结合新技术的发展和社会发展的需求,使大家即学到了新的知识,又关注了社会的发展和最新的科研进展。
四、教学内容与教学效果对照表五、教学内容和基本要求第一章催化作用与催化剂(含绪论)教学内容:绪论主要介绍课程的性质和任务、课程的主要内容和教学安排。
第一章主要讲述催化作用的定义与特征、催化剂的组成与功能、工业催化剂的特点。
并简要介绍均相催化与均相催化剂。
要求一般理解与掌握的内容有:催化作用的定义与特征、催化剂的组成与功能、工业催化剂的特点。
《工业催化》课程大纲(doc 7页)

《工业催化》教学大纲课程编号:S132022 课程类型:专业课课程名称:工业催化英文名称:Industrial Catalysis学分:2 适用专业:化学工程与工艺、应用化学第一部分大纲说明一、课程的性质、目的和任务本课程属于化学工程与工艺专业和应用化学专业的专业必修课程,主要介绍工业催化技术的应用以及催化剂设计、制备、表征的一般知识和规律。
通过教学使学生掌握催化作用原理、催化剂设计、催化剂制备与催化剂活性评价等基本知识,了解催化过程的应用与发展趋势,为培养化工专业技术人才提供坚实的理论基础。
二、课程的基本要求1、知识要求:通过本课程的学习,使学生了解催化作用的基本规律和基本原理,了解热力学平衡原理对催化作用的制约。
了解催化剂的组成、制备原理和方法,催化实验用的反应器和检测仪器、手段等。
了解工业催化技术的基本要求和特性。
掌握一些重要催化剂,如固体酸碱催化剂、分子筛催化剂、金属催化剂、络合催化剂、金属氧化物剂和金属硫化物催化剂的催化作用和制备方法。
2、能力要求:本课程是一门实践性很强的课程,在学习过程中要使学生多实践、多观察、多思考,从而提高其自学能力、分析能力和动手能力。
使学生能够运用所学有关催化剂的基本知识,进行简单催化剂的设计和制备;能够对催化剂作简单表征。
三、本课程与相关课程的联系本课程应在《物理化学》、《化工原理》等课程之后开设。
四、学时分配本课程学分为2学分,建议开设32学时(在保证学分的前提下可以微调)。
五、教材与参考书建议教材:《工业催化》(第二版),黄仲涛,化学工业出版社,2006年参考书目:1、《工业应用催化剂》,金杏妹,华东理工大学出版社,2004年2、《工业催化剂研制与开发》,闵恩泽,中国石化出版社,1997年3、《工业催化剂设计与开发》,黄仲涛,华南理工大学出版社,1992年4、《催化剂工程导论》,王尚弟、孙俊全,化学工业出版社,2001年5、《工业催化原理》,李玉敏,天津大学出版社,1996年六、教学方法与手段建议本课程以讲授为主,部分内容采用课堂讨论的形式。
工业催化 -第五章 金属催化剂及其催化过程

一些具有催化活性的过渡金属 的d空穴和d%
2021/7/21
金属表面的几何构造
2021/7/21
金属表面的几何构造
• X射线衍射研究证实,除少数例外,所有的金 属的晶体结构都分属于三种:面心立方晶格、 体心立方晶格 、六方密堆晶格。
• 晶格包含不同的晶面,结晶学上用三个简单的 整数标明不同的晶面。
• 空穴可以通过磁化率测量测出 。2N021i/7的/21 3d能带有0.6个空穴。
d空穴与化学吸附的关系
• d带空穴愈多,末配对的d电子愈多,对反应分子的 化学吸附也愈强。
• 有d带空穴,就能与被吸附的气体分子形成化学吸 附键,生成表面中间物种,具有催化性能。
• 对于Pd和IB族(Cu、Ag、Au)元素d轨道是填满的, 但相邻的S轨道上没有填满电子。在外界条件影响 下,如升高温度时d电子可跃迁到S轨道上,从而形 成d空穴,产生化学吸附。
• 要求催化剂原子和反应物分子结构在几何尺寸上
接近的理论称之为几何对应理论。
2021/7/21
乙烯在Ni表面上的吸附
2021/7/21
2021/7/21
• 反过来以=109o28’倒算出的a= 0.273nm,也就是说在a=0.273nm的 晶格上吸附时,分子内完全没有张力。
• 于是预测a在0.24nm-0.28nm之间的Re ,Ni,Co,Cu,Pt,V,Pd,Mo,W 等均可吸附乙烯,实验证实了这个预言 。
2021/7/21
点缺陷引起晶格的畸变
• 内部缺陷的存在引起晶格的畸变(1)空 位;(2)间隙质点;(3)杂质。
2021/7/21
线缺陷
• 线缺陷是指一排原子发生位移,又称位错 ;
第五章_金属氧化物和金属硫化物催化剂及其催化作用 [修复的]
![第五章_金属氧化物和金属硫化物催化剂及其催化作用 [修复的]](https://img.taocdn.com/s3/m/c67bccfcf90f76c661371ab8.png)
9
b.铁铬系催化剂催化乙苯脱氢制苯乙烯
10
1
相:Bi2O3MoO3(Bi/Mo=2/1) BO AO BO AO BO AO
2
B.烯丙基型反应机理
a.烯丙基型分子与氧化物催化剂作用,烃被氧化, 氧化物被还原
b.氧化物催化剂重新被气相氧氧化,催化剂复原 为起始状态
3
C. 丙烯氨氧化合成丙烯腈
4
起催化作用的是表面或表面若干层的鏌氧和铋离 子组成的活性中心,内部并不参与反应
5.6.1.钼铋系复氧化物催化剂的丙烯胺氧化制丙烯腈 A.钼铋系复氧化物的晶体结构与活性部位
催化活性相: 相:Bi2O33MoO3(Bi/Mo=2/3) BO AO AO AO BO AO AO AO
相:Bi2O32MoO3(Bi/Mo=1/1) BO AO AO BO AO AO(活性和选择性最高) 相:Bi2O3MoO3(Bi/Mo=2/1) BO AO BO AO BO AO
5
5.6.2.钒系复氧化物催化剂催化C4烃选择性氧化制顺酐
A.V2O5的晶体结构及其活性部位
6
B.V2O5催化剂催化C4烃选择氧化制顺丁烯二酸酐 催化剂为:V2O5:P2O5:TiO2:CuO:Li2O =23.8:25.9:49.6:0.51:6.29
7
V2O5:P2O5系催化剂:Fra bibliotek8C.尖晶石型复氧化物催化剂催化乙苯脱氢 a.尖晶石型复氧化物催化剂的晶体结构
第5章过渡金属氧(硫)化物催化剂及其催化作用(9学时)教材

第5章过渡金属氧(硫)化物催化剂及其催化作用5.1过渡金属氧(硫)化物催化剂的应用及氧化物的类型5.2金属氧化物中的缺陷和半导体性质5.3半导体催化剂的化学吸附与半导体电子催化理论5.4过渡金属氧化物催化剂的氧化•还原机理5.5过渡金属氧化物中晶体场的影响5.6过渡金属氧化物催化剂典型催化过程分析5.1.1过渡金属氧(硫)化物催化剂的应用及其特点1.过渡金属氧化物催化剂的应用主要用于氧化还原型催化反应过程过渡族元素IB、IIB和IVB-VDIB副族元素的氧化物,多由两种及以上氧化物组成,又称为半导体催化剂(具有半导体性质)过渡金属氧化物的电子结构特征决定了其催化性能。
1 C G H G+M S 〜VQ 5- (Ag > Si,Ni, P )等氧化v2o B Ag、Si、Ni、P 等氧化物< ALO3栽C4H2O3 二 2HQ+2COZ 体)CioHs • -T7-O2 —* C A H I034^H20+2C02VQs-CT,Ti, Ag, K)等代化物 -硫酸盐+藻土v2O5P、Ti、Ag、K 等氣化物-硫酸盐(硅藻上)莪体2.过渡金属氧化物的电子特性1)金属阳离子的d电子层容易失去或得到电子,具有较强的氧化还原性。
轨道被电子占有,对反应物分子有亲核性,起还原作用。
轨道未被电子占有,对反应物分子有亲电性,起氧化作用。
2)过渡金属氧化物具有半导体性质。
合成受到气氛和杂质的影响,容易产生偏离化学计量组成,或由于引入杂质原子或离子使其具有半导体性质。
2.过渡金属氧化物的电子特性3)过渡金属氧化物中金属离子内层价轨道保留原子轨道特性,与外来轨道相遇时可重新分裂,组成新轨道,在能级分裂过程中产生的晶体场稳定化能可对化学吸附做出贡献,影响催化反应。
4)过渡金属氧化物比过渡金属具有耐热、抗毒性强,还具有光敏、热敏、杂质敏感性,便于催化剂的调变。
5.1.2过渡金属氧化物催化剂的结构类型1. M2。
和MO 型氧化物 1) M,O 型(Ag 2O> Cu 2O )M :直线型2配位(sp 杂化),O : 4配位(sp3杂化)图屮虚线不是C10O 结构屮真实单位品胞的大小,真实Cu,O 是co 加%合成甲醇 的优良雇化剂。
工业催化之金属氧化物和硫化物催化剂及其催化作用

反应物分子的电离势(I)和催化剂材料电子的逸
出功(Φ)的相对大小,紧密关联着反应物分子在催化 剂表面的吸附态与化学键合情况。
⑴ Φ>I 时,电子从反
应物分子向催化剂表
费米能级(Ef)的理解: ⑴费米能级是绝对零度时电子能够排布的最高
能级;
⑵在费米能级Ef,被电子填充的几率和不被填充 的几率是相同的,也就是说费米能级是电子填充几 率一半时的能级;
⑶费米子按照一定的规则(如Paul原理等)填充在 各个可供占据的量子能态上,并且填充过程中每个 费米子都首先抢占能量最低的可供占据的量子态。 最后一个费米子占据着的量子态,即被认为是费米 能级。
▪ n-型半导体,指依靠与金属离子结合的电子导电 的半导体,故又称电子型半导体;
▪ n-型半导体金属氧化物属非计量化合物。如非计 量ZnO1-x,存在Zn2+过剩,处于晶格的间隙中;由 于晶格要保持电中性,过剩的Zn2+离子拉住一个电 子在附近,形成eZn2+,在靠近空带附近形成一附 加能级,该电子可以认为是施主,所在的能级称为 施主能级;温度升高时,eZn2+拉住的电子释放出 来,跃迁到空带,形成导带。
▪ 应用
可在多种不同的工艺中使用,其中主要催化的类型 是烃类的选择性氧化反应
▪ 类型(用于烃类选择性氧化的金属氧化物催化剂) ①晶格氧型,过渡金属氧化物,含有2种以上价态
可变的阳离子且阳离子常交叉互溶为非计量化合物, 易从晶格中传递出氧给反应物分子
②化学吸附氧型,金属氧化物,用于氧化的活性 组分为化学吸附型氧种(分子态、原子态或间隙氧)
第五章金属氧化物催化剂.

EC
e E受 EF
EV
+
+ + +
P型半导体 :靠空穴导电 导电靠受主能级产生正穴而来。 特点 a) 易接受电子的杂质掺入。 b) 受主能级。 c) 价带电子接受电子,正穴导电。 例:FeO中含有Fe3+,可看成Fe2+束 缚一个空穴 + ,变成Fe3+,T升高, 空穴在固体表面迁移,成为FeO导 电来源。
丙酮 + + + +
苯 + + + +
把表面吸附的反应物分子看作半导体的施主或受主杂质。 给出电子,如丙烯,是施主;接受电子,如O2,是受主。
三、半导体催化剂理论
1、半导体催化剂的化学吸附
吸附气体对半导体性质影响
杂质 类型
气体 性质
吸附中 心
费米 能级
逸出 功
电导率 n p
施主
受主
给电 子
接受 电子
不能使满带电子激发到空带中
半导体:禁带窄,满带电子可激发到空带而导电 本征半导体:化学计量氧化物
EF ee e 具有电子、空穴两种载流体传导 如:Fe3O4 禁带宽度: △E 0.16 — 3.6 eV 不重要,激发电子所需温度为300700 oC 非本征半导体:
n 电子导电 p 正穴导电
由杂质或非化学计量而产生
能带示意图
二、氧化物中的能带结构和半导体性质
1、金属、半导体、绝缘体能带结构 满带: 已充满电子,不导电 导带: 部分填充,可导电 空带: 未填充 禁带: 满带与空带间的区域,无能级, 不能填充电子
二、氧化物中的缺陷和半导体性质
1、金属、半导体、绝缘体能带结构 金属:有充填大量自由电子导带
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3) 当I时
• 半导体与吸附物之间无电子转移,此时形成 弱化学吸附,吸附粒子不带电。 • 无论对N型或P型半导体的电导率都无影响。
例子
• 对于某些吸附物如O2,由于电离势很大,无 论在哪种半导体上的化学吸附总是形成负 离子; • 有些吸附物,如CO、H2,由于电离势小,容 易形成正离子。
半导体催化剂的催化活性
没有完全被电子充满的能带称为导带,导带中的电子能跃
迁,能导电。
没有填充电子的能带称为空带。 导带和满带之间没有能级,不能填充电子称为禁带。 导体、半导体、绝缘体最大差别在于禁带宽度不同。
导体、半导体、绝缘体的能带结构
金属的能带结构
导体都具有导带,能带没
有被电子完全充满,在外
电场的作用下,电子可从
第一种类型
• 逸出功靠近IA,EA<EB。此时
B得电子比A给出电子到催化剂容
易,于是A的吸附成为决定反应速 度步骤,属于P型反应。为了加快 反应速率,必须提高催化剂的 以使EA增加,必须降低费米能级
EF,加入受主杂质对反应有利。
第二种类型
• 靠近 IB, EB<EA。此时 A 给出电子到催化剂比 B 从催
杂质对费米能级、逸出功和电导率的影响
费米能级EF是半导体中价电子
的平均位能。
本征半导体中,EF在满带和导 带之间;
N型半导体中,EF在施主能级和 导带之间;
P型半导体中,EF在受主能级和 满带之间。
• 电子逸出功:将一个具有平均位能的电子从半导体内 部拉到半导体外部所需的最低能量 • 掺入施主杂质使费米能级提高,从而导带电子增多。
(1) 当 I <时
• 电子从吸附物转移到半导体催化剂上,吸 附物带正电荷。 • 如果催化剂是 N 型半导体其电导增加,而 P 型半导体则电导减小。 • 这种情况下的吸附相当于增加了施主杂质, 所以无论 N 型或 P 型半导体的逸出功都降低 了。
(2) 当I>时
• 电子从半导体催化剂转移到吸附物,于 是吸附物是带负电荷的粒子吸附在催化 剂上,可以把吸附物视作为受主分子。 • 对 N 型半导体其电导减小,而 P 型半导体 则电导增加,吸附作用相当于增加了受 主杂质从而增加了逸出功。
晶格氧选择氧化
用氧化物或复合氧化物催化剂的晶格氧作为烃类选择 氧化的氧化剂,按还原-氧化 (Redox)模式,采用循环 流化床提升管反应器,将烃原料和空气分开进料,在 提升管反应器中烃分子与催化剂的晶格氧反应生成氧 化产物,失去晶格氧的催化剂被输送到再器中用空 气氧化到初始高价态,然后送入提升管反应器完成还 原 -再氧化循环。
掺杂对2N2O=2N2十O2 反应的影响
• 适当加入一些杂质使费米能级下降,即加入一些受主杂质会
有助于加速反应。
• 但是反应的决定反应速度步骤随条件而变化,当受主杂质加 得太多到一定程度已严重影响到第一步要求电子的速率,这 样反过来第一步会成为决定反应速度步骤。 • 事实上对P型半导体NiO加一些Li2O证实了上述的推论,适当
• 加氢脱硫(HDS)、加氢脱氮(HDN)、加氢脱金属(HDM);
• 硫化物催化剂:单组分和复合组分。
过渡金属氧化物催化剂的电子特性
1)金属阳离子的d电子层容易失去或得到电子,具有较 强的氧化还原性能; 2)过渡金属氧化物具有半导体性质; 3)过渡金属氧化物中金属离子内层轨道可以重新劈裂, 组成新轨道,影响化学吸附。
• 催化剂的活性与反应物、催化剂表面局部原
子形成的化学吸附键性质密切相关。
• 化学吸附键的形成和吸附键的性质与多种因
素有关,对半导体催化剂而言,其导电性是
影响活性的主要因素之一。
例子
• 对于2N2O=2N2十O2反应在金属氧化物催化剂上 进行时,实验发现:
–P型半导体氧化物(Cu2O,CoO,NiO,CuO,CdO, Cr2O3,Fe2O3等)活性最高 –其次是绝缘体(MgO,CaO,Al2O3) –N型半导体氧化物(ZnO)最差;
度步骤也往往不一样。
• 若A A+十e是慢过程,反应为施主反应或P型反应,增
加催化剂空穴,能增加反应速率。
• 若B十e B-是慢过程,反应为受主反应或N型反应,增
加催化剂自由电子则能增加反应速率。
慢过程的确定
• 究竟哪一步为决定反应速度步骤?取决于反应物 A 、B的电离势(IA、IB)和催化剂的电子逸出功由的相 对大小。 • 对上述反应,催化剂的逸出功 必须介于 IA 和 IB 之 间,且IA<<IB才是有效的催化剂。
出功降低,电导率减小
5.3半导体催化剂的化学吸附与半
导体电子催化理论
半导体催化剂的化学吸附
• 催化作用电子理论把表面吸附的反应物分 子看成是半导体的施主或受主。
• 半导体催化剂上的化学吸附:
–对催化剂来说,决定于逸出功的大小; –对反应物分子来说,决定于电离势I的大小。
• 由和I的相对大小决定了电子转移的方向 和限度 。
加入一些Li2O可以增加空穴浓度,提高反应速率,但当Li2O
的量超过0.1%时,反应速率反而降低。因为此时空穴浓度太 高,使第一步吸附产生O-成为困难。所以添加Li2O有一个最
佳值。
半导体催化剂的选择原则
• 设反应为 A+B=C • A为施主分子,B为受主分子。其电子转移 过程如图:
• 由于A、B的吸附速率常常是不一样的,所以决定反应速
一个能级跃迁到另一个能
级,因此能够导电。
绝缘体的能带结构
• 绝缘体的满带己被电 子完全填满,而禁带 很宽(>5eV),满带 中的电子不能跃迁到
空带上去,所以不能
导电。
半导体
• 半导体的禁带很窄,在绝对零度时,电子不发生跃迁与绝
缘体相似;
• 当温度升高时,部分电子从满带激发到空带上去,空带变
成导带,电子导电;
• 复合氧化物多相共存,MoO3-Bi2O3,有,,相
• 耐热、抗毒性能强、光敏、热敏、杂质敏感性
金属硫化物催化剂的概述
• 金属硫化物与金属氧化物相似,是半导体型化合物。 • 多为过渡金属硫化物,如Mo、W、Ni、Co、Fe等的金属硫
化物,具有加氢、异构、氢解等催化活性,用于油品的加
氢精制;
就可推断反应的活性大小
氧化物表面的M=O键性质与催化剂活 性与选择性的关联
• 晶格氧起催化作用
– 选择性氧化涉及有效的晶格氧;
– 无选择性完全氧化反应,吸附氧和晶格氧都参加反 应; – 有两种不同阳离子参与的复合氧化物催化剂,一种 阳离子M n+承担对烃分子的活化与氧化功能,再氧 化晶格氧,使另一种金属阳离子处于还原态,接受 气相氧。
晶格氧选择氧化特点
这种工艺是在没有气相氧分子的条件下进行反 应,可避免气相和减少表面的深度氧化反应, 大幅度提高烃类选择氧化的选择性,而且因不 受爆炸极限的限制可提高原料浓度,使反应产 物容易分离回收,是控制深度氧化、节约资源 和保护环境的有效催化新技术。
丁烷氧化 循环流化床提升管反应器
催化膜反应示意图
第五章 金属氧(硫)化物催化剂及其催 化作用
本章主要内容:
半导体的能带结构及其催化活性;
从能带结构出发,讨论催化剂的电导率、逸出功
与催化活性的关系;
氧化物表面的 M=O 键性质与催化剂活性选择
性的关联
金属硫化物催化剂及其催化作用
5.1.氧化物的应用和氧化物类型
• 主要用于氧化还原催化反应。 • 有的组分是主催化剂,有的组分作为助催化剂 或 者 载 体 。 MoO3-Bi2O3 中 MoO3 是 主 催 化 剂 ; Bi2O3(铋)是助催化剂,作用是调控电子迁移
• 在导带和满带之间另有一个能级,
并有电子填充其中,该电子很容易
激发到导带而引起导电,这种半导
体就称为N型半导体。
p型半导体
含有易于接受电子的杂质,
半导体满带中的电子输入杂
质中产生空穴,该杂质叫受
主杂质。产生受主能级,有
空穴存在,接受满带中跃迁 的电子,产生空穴导电。
n型、p型半导体比本征半导体更易导电
n型、p型半导体的电子跃迁所克服的电离能小于本征半导体 大陽能光伏板是由 P 型與 N 型 半導體構造而成的矽晶板。它 的運作原理是利用 P 型半導體 的電洞,與 N 型半導體多了一 個自由電子的電位差來產生電 流。當太陽光照射時,光能將 矽原子中的電子激發出來,而 產生電子和電洞的對流,這些 電子和電洞均會受到內建電位 的影響,分別被 N 型及 P 型半 導體吸引,而聚集在兩端。此 時外部如果用電極連接起來, 形成一個迴路,產生電流。
• 实验研究还发现,在P型半导体上进行分解反应 时,催化剂的电导率增加,而在N型半导体上进 行时电导下降。
2N2O=2N2十O2的反应机理
• 据此可以推测:N2O在半导体表面上吸附时是受
主分子。 • 若N2O分解分两步进行
2N2O=2N2十O2 在P型半导体上反
应活性较高的解释
• 反应机理中的第一步是不可逆快反应,第二步是 慢反应,是决定反应速度步骤。 • 催化剂的电导率应该由第一步所引起,总的结果 为N型电导下降,P型电导上升。这与实验结果一 致。 • 反应速率由第二步控制,所以要加快反应速率, 必须提高催化剂接受电子的速率。由于 P 型半导 体的空穴能位比 N 型半导体的导带能位更低,所 以接受电子的速率快得多,这就解释了 P 型半导 体的活性较高的原因。
– 对N型半导体来说,电导率增加了;
– 对P型半导体而言,电导率降低;
• 掺入受主杂质其作用正好相反。
#费米能级和逸出功用于衡量半导体给出电子的难易#
杂质对半导体催化剂的费米能级、逸 出功和电导率的影响
(1)n型半导体:加入施主杂质,费米能级升高、逸 出功降低,电导率变大 (2)p型半导体:加入施主杂质,费米能级升高、逸
