(完整版)常见阳离子的分离及鉴定
常见阳离子的分离与鉴定

生成黑色沉淀。
(1)Hg2+和Cu2+、Pb2+的分离
在所得沉淀上加5滴1 mol·L-1Na2S溶液,水浴 加热3min,并不时搅拌。再加3~4滴水,搅拌 均匀后离心分离。沉淀用Na2S溶液再处理一次, 合并清液,并编号溶液3。沉淀用饱和NH4Cl溶 液洗涤,并编号沉淀3。观察溶液3的颜色, 讨论反应历程。
[实验目的]
1、学会混合离子分离的方法, 进一步巩固离子鉴定的条件和方 法。2、熟练运用常见元素(Ag、 Hg、Pb、Cu、Fe)的化学性质。
[实验原理]
离子混合溶液中诸组分若对鉴定不 产生干扰,便可以利用特效应直接 鉴定某种离子。若共存的其它彼此 干扰,就要选择适当的方法消除干 扰。通常采用掩蔽剂消除干扰,这 是一种比较简单、有效的方法。但 在很多情况下,没有合适的掩蔽剂, 就需要将彼此干扰组分分离。沉淀 分离法是最经典的分离方法。
再用KI和HCl重复处理沉淀。合并两次离心 液,往离心液中加1滴0.2mol·L-1CuSO4和少许 Na2CO3固体,有什么生成?说明有哪种离子 存在?
反应方程式如下: HgS22-+2H+=HgS↓+H2S↑ HgS+4I-+2H+=[HgI4]2-+H2S
[HgI4]2-+Cu2+=Cu2[HgI4]↓
常 用 的 沉 淀 有 HCl 、 H2SO4 、 NaOH 、 NH3·H2O、(NH4)2CO3、(NH4)2-S溶液等。 由于元素在周期表中同时产生沉淀。这 种沉淀剂称为产生沉淀的元素的组试剂。 组试剂将元素划分为不同的组,逐渐达 到分离的目的。
试验二十四常见阳离子的分离与鉴定

实验二十四 常见阳离子的分离与鉴定(一)一、主要教学目标(一)巩固和进一步掌握一些金属元素及其化合物的性质(二)了解常见阳离子的分离和检出方法,以及巩固检出离子的操作 二、教学的方法及教学手段:讲解法,学生实验法,巡回指导法 三、教学重点:常见阳离子的分离和检出方法,以及巩固检出离子的操作 四、教学难点:常见阳离子的分离和检出方法,以及巩固检出离子的操作 五、实验设备:离心机 六、实验内容(一)碱金属,碱士金属离子的鉴定1、Na +的鉴定①用饱和六羟基锑(V )酸钾KSb(OH)6溶液↓=+66)()(OH NaSb OH KSb NaCl假若没有沉淀,可以摩擦试管内壁②用醋酸铀酰锌与Na+在醋酸缓冲溶液中生成淡黄色结晶状醋酸铀酰锋钠沉淀↓•••=++++-+++O H Ac UO Ac Zn NaAc O H Ac UOZnNa 222222229)(3)(9932、K +的鉴定:①用饱和洒石酸氢钠NaHC 4H 4O 6NaCl O H KHC O H NaHC KCl +↓+644644—3、Mg 2+的鉴定 用镁试剂:蓝色沉淀滴镁试剂加入白滴入1)()(22↓OH Mg NaOH MgCl Mg 2+与镁试剂工在碱性溶液中生成蓝色螯合物沉淀 4、Ca 2+的鉴定(用草酸铵)Cl NH O CaC O C NH CaCl 442422422)()(+↓=+白5、Ba 2+的鉴定:用K 2CrO 4溶液在HAc 和NaAc 缓冲液中+↓=+24422Ba BaCrO CrO K BaCl 示有(二)P 区和ds 区部分金属离子的鉴定 1、Al 3+的鉴定,用HAC 酸化的铝试剂红色絮状沉淀滴氨水再加水浴加热搅拌滴铝试剂→2~1,2%1.03AlCl2、Sn 2+的鉴定+↓22222)(nS Cl Hg HgCl SnCl 示有变黑变灰白透量的 3、Pb 2+的鉴定NaOHPbCrO CrOPbNaOH PbCrO CrO LK mol NO Pb 可溶于黄沉淀溶解溶液黄)()(/1)(424244223↓=+↓-+4、Sb 3+的鉴定++353,2,)(3Sb BSb SbCl 示有苯层显紫色滴罗丹罗明加加数滴苯并释放出气体变为数粒亚销酸钠滴浓盐酸溶液5、Bi 3+的鉴定 用硫脲鲜黄色配合物硫脲→+33)(NO Bi6、Cu 2+的鉴定沉淀])([])([62264CN Fe Cu CuCl CN Fe K =+7、Ag +的鉴定↓•↓AgCl HNO Cl NH Ag O H NH AgCl HCl AgNO 323233)()(白 8、Zn 2+的鉴定42444244)()(])([])([)(SO NH SCN Hg Zn SCN Hg NH ZnSO +↓→+白9、Cd 2+的鉴定:32232)()(NaNO CdS S Na NO Cd +↓=+黄 10、)(2:222示有灰色白的鉴定++Hg SnCl HgCl Hg (三)部分混合离子的分离和鉴定。
常见阳离子的分离与鉴定(一)

软亲软中的反馈键
M
dd反馈键
AA
d *反馈键
配合物的生成引起物质性质变化
• 溶解度变化:增大或沉淀生成,如Zn(OH)2/NH3、 Fe3+、Fe2+/CN-
• 酸碱性变化:使酸的酸性增强,使碱的碱性增强; 如HF/Al3+、Cu(OH)2/NH3
• 颜色改变:配位场的改变引起d-d跃迁光谱变化, 配体光谱也会因此而变;如Cu2+/NH3
物质的溶解度规律
• 盐的溶解度规律: ➢ 大体积的阳离子与大体积的阴离子结合水溶性小; ➢ 小体积的阳离子与小体积的阴离子结合水溶性小; ➢ 复盐的溶解度比单盐小; ➢ 除碱金属及铵以外的盐一般强酸盐大都易溶而弱酸
盐大都难溶。
• 小分子的相溶性规律:分子间作用力的种子的分离与鉴定(一)
• 配合物的生成与软硬酸碱理论:供电子的是碱; 接受电子的是酸。
• 硬酸:正氧化态高、离子半径小、不易变形; • 硬碱:负氧化态低、原(离)子半径小、不易变形。 • 软酸:正氧化态低、价层d电子数多、易变形; • 软碱:负氧化高、半径大、易变形、有价d空轨
道或低能量的*空分子轨道。
• 二2中改为HgCl2中加入SnCl2才会出书上的 现象。
• 做分离时在离心试管中进行;每次沉淀时 沉淀剂都是稍过量的;离心后清液用专用 滴管吸出留后用,沉淀经洗涤(加水后用 尖玻棒搅动,再离心,水洗液弃去)后再 用;滴管每吸液一次后都要用去离子水清 洗(三个烧杯都分盛去离子水,每个烧杯 吸三次都弃去)!
• 6 Cu2+ + [Fe(CN)6] 4- = Cu2 [Fe(CN)6]
• 7 Ag+ + Cl- = AgCl
实验常见阳离子的分离与鉴定-V1

实验常见阳离子的分离与鉴定-V1实验常见阳离子的分离与鉴定阳离子是指带正电荷的离子,常见的有盐酸中的K+、Na+、Mg2+、Ca2+等。
在实验室中对这些阳离子的分离和鉴定是一项比较常见的实验操作,下面将对此进行重新整理。
一、分离NH4+和Fe3+实验操作步骤:1.将NH4+和Fe3+混合,并加入NaOH,出现棕色沉淀;2.将沉淀过滤,并加入HCl,沉淀消失;3.将所得溶液加入HgCl2,出现白色沉淀。
实验操作目的:该实验可用于检测食品和饲料中的氨盐等。
二、分离Ba2+和Fe3+实验操作步骤:1.将Ba2+和Fe3+混合,并加入NaOH,出现棕色沉淀;2.将沉淀过滤,得到沉淀和过滤液;3.将所得沉淀加入Na2CO3,在锅炉中加热,轻轻搅拌,直到溶解;4.将溶液冷却,加入硫酸钠,出现白色沉淀。
实验操作目的:该实验可用于检测水中钙、铁的含量。
三、分离Mg2+和Fe2+实验操作步骤:1.将Mg2+和Fe2+混合,加入氨水,pH值达到9.5~10.2;2.将所得溶液加入EDTA,出现蓝色沉淀。
实验操作目的:该实验可用于检测水或者土壤中的镁和铁的含量。
四、分离Ca2+和Ba2+实验操作步骤:1.将Ca2+和Ba2+混合,加入Na2SO4;2.出现白色沉淀。
实验操作目的:该实验可用于检测食品和饲料中的钙盐。
五、分离Na+和K+实验操作步骤:1.将Na+和K+混合,并加入Na2CO3;2.加热,溶解后冷却,加入二甲基黄。
3.观察产生的沉淀,小型重沉。
实验操作目的:该实验可用于检测水中钠、钾的含量。
常见阳离子的分离与鉴定.

6mol· L-1NO3 +
沉淀溶解
6mol· L-1NH4· H2O
☺ Zn2+的鉴定:
3滴0.2mol· L-1ZnSO4 + 2滴2mol· L-1HAc + 白色沉淀 3滴(NH4)2[(SCN)4]
11
☺ Hg2+的鉴定:
2滴0.2mol· L-1HgCl2 + 逐滴加0.5mol· L-1SnCl2 继续加
硫化氢法。 两酸两碱法是以最普通的酸 (盐酸、硫酸 ) 和碱 ( 氨水、 氢氧化钠 ) 作试剂,根据各离子氯化物、硫酸盐、氢氧化物 的溶解度不同进行分离鉴定; 硫化氢法依据各离子硫化物以及它们的氯化物、碳酸盐 和氢氧化物的溶解度不同进行分离鉴定。
3
【实验原理】
与HCl溶液反应:
Ag+、Hg22+、Pb2+等
Ag+ 、 Pb2+ 、 Cu2+ 、 Cd2+ 、 Bi3+ 、 Hg+ 、 Hg22+ 、 Sb3+、Sn2+等
5
【仪器与试剂】
仪器:
试管(10ml),离心管(10ml),离心机
试剂:
HCl、H2SO4、HNO3、HAc、NaOH、NH3· H2O、 MgCl2、CaCl2、BaCl2、AlCl3、PbNO3、SnCl2、 HgCl2、Bi(NO3)3、CuCl2、AgNO3、ZnSO4、镁试
与稀H2SO4溶液反应: Ba2+、Sr2+、Ca2+ 、Pb2+ 、Ag+ 等 与NaOH溶液反应: Al3+、Zn2+、Pb2+ 、Sb2+ 、Sn2+等 与NH3溶液反应: Ag+、 Cu2+、Cd2+ 、Zn2+等
常见阳、阴离子的分离与鉴定
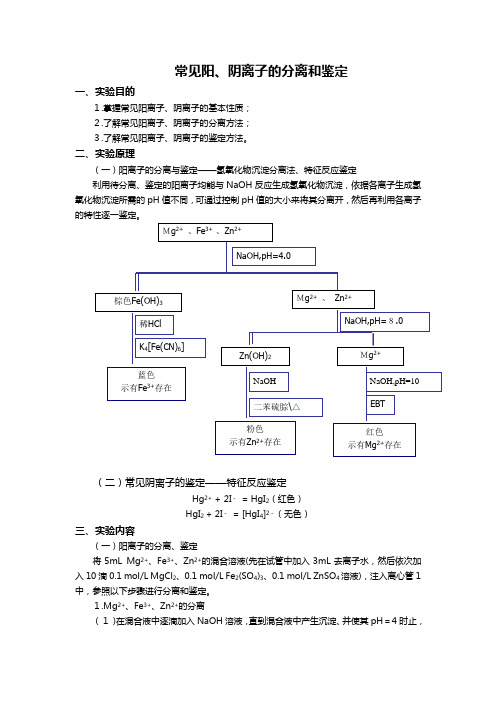
常见阳、阴离子的分离和鉴定一、实验目的1.掌握常见阳离子、阴离子的基本性质; 2.了解常见阳离子、阴离子的分离方法; 3.了解常见阳离子、阴离子的鉴定方法。
二、实验原理(一)阳离子的分离与鉴定——氢氧化物沉淀分离法、特征反应鉴定利用待分离、鉴定的阳离子均能与NaOH 反应生成氢氧化物沉淀,依据各离子生成氢氧化物沉淀所需的pH 值不同,可通过控制pH 值的大小来将其分离开,然后再利用各离子的特性逐一鉴定。
(二)常见阴离子的鉴定——特征反应鉴定Hg 2+ + 2I - = HgI 2(红色) HgI 2 + 2I - = [HgI 4]2-(无色)三、实验内容(一)阳离子的分离、鉴定将5mL Mg 2+、Fe 3+、Zn 2+的混合溶液(先在试管中加入3mL 去离子水,然后依次加入10滴0.1 mol/L MgCl 2、0.1 mol/L Fe 2(SO 4)3、0.1 mol/L ZnSO 4溶液),注入离心管1中,参照以下步骤进行分离和鉴定。
1.Mg 2+、Fe 3+、Zn 2+的分离(1)在混合液中逐滴加入NaOH 溶液,直到混合液中产生沉淀、并使其pH =4时止,Mg 2+ 、Fe 3+ 、Zn 2+Mg 2+ 、 Zn 2+棕色Fe(OH)3稀HCl NaOH,pH=4.0蓝色 示有Fe 3+存在K 4[Fe(CN)6] NaOH,pH=8.0 Zn(OH)2Mg 2+NaOH 粉色示有Zn 2+存在二苯硫腙\△ NaOH,pH=10 红色示有Mg 2+存在EBT然后离心分离。
把上清液移到另一离心管2中;沉淀用去离子水洗涤二遍后,记为沉淀1,留待下面分析。
(2)往离心管2的上层清液中继续逐滴加入NaOH溶液,直到溶液中产生沉淀、并使其pH=8时止,把上清液移到另一离心管3中;沉淀用去离子水洗涤二遍后,记为沉淀2,留待下面分析。
2.Mg2+、Fe3+、Zn2+的鉴定(1)Fe3+的鉴定取沉淀1加入去离子水及几滴盐酸,振荡试管使沉淀溶解。
(完整版)常见阳离子的检验方法

离 子
检验 试剂
实验步骤
实验现象
离子方程式
H+
1酸 度计
2pH
试纸
3石 蕊试 液
①将酸度 计的探头 浸泡在待 测液中② 用玻璃棒 醮取少量 待测液滴 到干燥的pH试纸上 ③取样,滴
加石蕊试 液
、②pH<7
③石蕊变
红
K+
焰色
反应
①铂丝用 盐酸洗涤 后在火焰
浅紫色
(通过蓝 色钻玻璃
SO32-+2H+=H2
O+SO2?
气体
离 子
检验试
剂
实验步骤
实验现
象
离子方程式
Cl
AgN03
溶液、 稀硝酸 或稀盐 酸
取少量待 测溶液于 试管中, 加入
AgNO3
溶液,再 向沉淀中 加入稀盐 酸。
生成不 溶于稀 硝酸或 稀盐酸 的白色 沉淀
Ag++CI――
AgClJ
Br
AgNO3
溶液、 稀硝酸 或稀盐 酸
③(无 其它 还原 性物 质如
SO32-)酸性
取少量待 测溶液于 试管中,加 入酸性高 锰酸钾溶 液
加入酸性 高锰酸钾 溶液紫色 褪去
高锰 酸钾
AI3
+
NaOH
溶液
取少量待 测溶液于 试管中,逐 滴加入
NaOH溶
液至过量
加入适量
NaOH溶 液后生成 白色沉
淀,该沉 淀溶于过 量NaOH溶液中
AI3++3OH――
Ba2++ CO32-=BaCO$BaCO3+2H+=Ba2++CO2f +H2 O
实验二十六常见阳离子的分离和鉴定-2022年学习资料

5.Ba2+的鉴定-●取2滴0.5mol.L1BaC1,于试管中,加-入2mol-L-1HAc和2mol1NaAc各-2滴,然后滴加2滴1moL-1K2Cr○4-有黄色沉淀生成,示有Ba2+存在。-写出反应式
●2.Sn2+的鉴定-取5滴0.5mol-L-1SnCl,试管中,逐滴-o.-加入0.2molL-1HgC 2溶液,边加边-振荡,若产生的沉淀由白色变为灰-色,然后变为黑色,示有Sn2+存在。
·二、p区和ds区部分金属离子的鉴定-1.A13+的鉴定-取2滴0.5mol.L1A1C13溶液于小试管中 -加2~3滴水,2滴2mol-L-1HAc及2滴-0.1%铝试剂,搅拌后,置水浴上加热片-刻,再加入1~2 6mol.L1氨水,有红-色絮状沉淀产生,示有A]3+存在。
Pb2+的'鉴定-·取5滴0.5molL1PbNO32试液于离-心试管中,加2滴1molL1KCrO4 -液,如有黄色沉淀生成,在沉淀上-滴加数滴2mol.L1NaOH溶液,沉淀-溶解,示有Pb2+存在。
。因此,除了要熟悉离子的有关性质外,还要学-会运用离子平衡(酸碱、沉淀、氧化还原、络-合等平衡的规律控制反 条件。这对于我们-进一步了解离子分离条件和检出条件的选择将-有很大帮助。-。用于常见阳离子分离的性质是指常 阳离子与-常用试剂的反应及其差异,重点在于应用这种-差异性将离子分离。
[实验用品]见教材P169。
8.Zn2+的鉴定-取3滴0.2mol-L1ZnSO试液于试管中,-加2滴2mol.L1HAc溶液酸化,再 入-等体积硫氰酸汞铵NH4HgSCN4]-溶液,-摩擦试管壁,生成白色沉淀,示-有Zn2+存在。
9.Cd2+的鉴定-·取3滴0.2molL1CdNO2试液于小-试管中,加入2滴0.5molL1Na2S溶 液,生成亮黄色沉淀,示有Cd2+存-在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020/4/14
(8)Mn2+的鉴定 5BiO3- + 2Mn2+ + 14H+
═ 5Bi3+ + 2MnO4— (紫红色溶液)+7H2O
(9)Co2+的鉴定 Co2+ + 4SCN— = [Co(SCN)4]2—( 蓝色)
试 HCl)
(NH4)2S (NH3-NH4Cl)
(NH4)2CO3 (NH3-NH4Cl)
硫化物 难溶于水
分 组 依 据
两酸两碱系统分析法
分别检出NH4+、Na+、Fe3+、Fe2+
氯化物易溶于水
硫酸盐 难溶于水
硫酸盐易溶于水
氢氧化物难溶于水及 氨水
氨性条件下不生成沉淀
2020/4/14
(2)Pb2+的鉴定 Pb2+ + CrO42—→ PbCrO4↓(黄色沉淀) (3) Cu2+的鉴定 2Cu2++ [ Fe(CN)6]4- → Cu2Fe(CN)6↓ (红棕色)
2020/4/14
(4)Fe3+的鉴定 ①Fe3++ nSCN — == Fe(SCN)nn-3 (血红色溶液) ②K+ + Fe3++ [ Fe(CN)6]4- →[K Fe(CN)6 Fe] ↓
2020/4/14
硫化氢系统分析法
硫化物不溶于水
硫化物溶于水
在稀酸中生成硫化物沉淀
分
组
氯化物溶于热水
依 据
氯化物 不溶于 热水
硫化物不溶 于硫化钠
硫化物溶 于硫化钠
在稀酸中不生成 硫化物沉淀
碳酸盐不溶于水
碳酸盐溶于水
相 Ag+
应 离
Hg22+
子 Pb2+
组 第一组 名 银组
称 盐酸组
Pb2+ Bi3+ Cu2+ Cd2+
2020/4/14
(10)Ni2+离子的鉴定
Ni2+ +
H3C C H3C C
OH
N
N —
OH
H
O
H3C C N Ni
H3C C N O
H
O N C CH3 N C CH3 O
(11)Zn2+的鉴定
Zn2+依次加入6~7滴的2mol·L1- NaOH和0.01%二苯 硫腙-CCl4溶液,若水溶液层呈粉红色 ,CCl4层由
CO
COONH4
O
2020/4/14
(7)Cr3+的鉴定 Cr3+ + OH—→ Cr(OH)3(灰绿色沉淀)
Cr(OH)3 + OH-(过量)→ [Cr(OH)4]- (亮绿色溶液) 2Cr(OH)4- + 3H2O2 + 2OH- → 8H2O + 2CrO42- (黄色溶液)
Pb2+ + CrO42— → PbCrO4↓(黄色沉淀)
(蓝色沉淀)
2020/4/14
(5)Fe2+的鉴定
①K++ Fe2++ [ Fe(CN)6]3- → [K Fe(CN)6 Fe] ↓ (蓝色沉淀)
②邻二氮菲法:在弱酸性溶液中与试剂生成 桔红色络合物(溶解水)。
2+
3
N
N
+ Fe2+
N
N
N Fe N
NN
2020/4/14
(6) Al3+的鉴定
①在试管中加入0.1 mol·L-1 AlCl3 5滴,用NH3·H2O 调节pH=4~9,滴加0.1%茜素磺酸钠溶液,若生成
绿色变成棕色表示有Zn2+。
NH NH C6H6
NH
N
C6H6
Zn2+ + S C
—— C S
Zn2+/2
NH N C6H6
N
N
C6H6
Cu(OH)2 Co(OH)3 Ni(OH)2 Mg(OH)2 Cd(OH)2
Zn(OH)42K+ Na+
NH4+
第三组 氨 组 第四组 碱 组 第五组可溶组
H2SO4
NH3-NH4Cl H2O2
NaOH
-
• 常见的方法除系统分析法外,还有分别鉴定法。 • 分别鉴定法:分别取一定量的试液,设法排除相
系统分析法:利用一定的步骤和顺序将离子加以逐 步分离的分析方法。
2020/4/14
二、实验原理
• 用系统分析法分析阳离子时,要按照一定的顺序 加入若干种试剂,将离子按组逐一地沉淀出来。 这些分组用的试剂称为组试剂。
• 常见阳离子有23个元素共28个离子,鉴定反应的 相互干扰较大,常采用系统分析法。
分
离 AgCl
后 Hg2Cl2
形 态
PbCl2
组 名
第一组 盐酸组
称
组
试
HCl
PbSO4 BaSO4 SrSO4 CaSO4
第二组 硫酸组
氢氧化物难溶于 过量氢氧化物
强碱条件下 不生成沉淀
Fe(OH)3, Al(OH)3 MnO(OH)2, Cr(OH)3
Bi(OH)3 , Sb(OH)5 HgNH2Cl, Sn(OH)4
应的干扰,而后加入特征试剂,直接进行鉴定的 方法。 • 本实验以“两酸两碱系统分析法”为基础,选取
若干种常见阳离子进行分离和鉴定实验。
2020/4/14
三、常见阳离子的鉴定
1. Ag+的鉴定: Ag+ + Cl- = AgCl ↓
(白色凝乳状,遇光变紫、变黑) AgCl + 2NH3H2O → Ag(NH3)2+ + 2H2O +ClAg(NH3)2+ + Cl- + 2H+ = AgCl ↓ +2 NH4+
二A组
Hg2+ As(Ⅲ,Ⅴ) Sb(Ⅲ,Ⅴ Sn2+ 、
Sn4+
二B组
第二组、铜锡组、硫化氢 组
Fe3+ Fe2+ Al3+ Mn2+ Cr3+ Zn2+ Co2+ Ni2+
第三组 铁组、硫化铵组
Ba2+ Sr2+ Ca2+
Mg2+ Na+ K+ NH4+
第四组
第五组
钙组、碳酸铵组 钠组、可溶组
组
常见阳离子的分离及鉴定
2020/4/14
一、实验目的
1.熟悉常见阳离子的性质。 2.掌握常见阳离子的分离、鉴定的原理及方法。 3.掌握试剂的取用、水浴加热、离心分离和沉淀 的洗涤等基本操作技术。
2020/4/14
二、实验原理
无机定性分析: 分离和鉴定无机阴、阳离子。就 阳离子的分析:一般是利用阳离子的某些共同特 性,先把离子分成若干组,然后在各组内根据各 个阳离子的特性进一步分离和鉴定。
红色沉淀,表示有Al3+存在。
Al/3
Al3+ +
O OH
C
OH
——
C
SO3Na
O
O
C
OH
C
SO3Na
C
C
2020/4/14
② Al3+和铝试剂在乙酸及乙酸盐缓冲溶液体系 pH4~5的条件下生成红色配合物。
H4NOOC
Al3+ + HO
C
COONH4
H4NOOC
OH
→ HO
C
O
COONH4 OH
O Al/3
