高中化学——配合物的几何结构与异构现象
9.2 配位化合物空间结构及几何异构现象
9.2 配位化合物空间结构及几何异构现象
9.2.1 配位化合物的空间结构
配位体在中心原子周围,趋向于相互远离,也就是说配位体倾向于比较对称地分布在中心原子的周围。
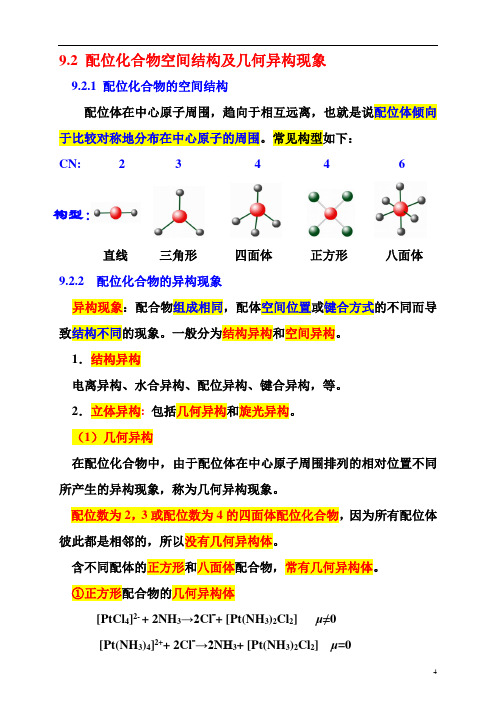
常见构型如下:
CN: 2 3 4 4 6
构型:
直线三角形四面体正方形八面体9.2.2 配位化合物的异构现象
异构现象:配合物组成相同,配体空间位置或键合方式的不同而导致结构不同的现象。
一般分为结构异构和空间异构。
1.结构异构
电离异构、水合异构、配位异构、键合异构,等。
2.立体异构:包括几何异构和旋光异构。
(1)几何异构
在配位化合物中,由于配位体在中心原子周围排列的相对位置不同所产生的异构现象,称为几何异构现象。
配位数为2,3或配位数为4的四面体配位化合物,因为所有配位体彼此都是相邻的,所以没有几何异构体。
含不同配体的正方形和八面体配合物,常有几何异构体。
①正方形配合物的几何异构体
[PtCl4]2- + 2NH3→2Cl-+ [Pt(NH3)2Cl2] μ≠0
[Pt(NH3)4]2++ 2Cl-→2NH3+ [Pt(NH3)2Cl2] μ=0
4。
2012-第二章 配合物的结构及异构现象

六配位 化合物
八面体 几何异构体数目
例
MA2B2C2
5
[Pt(NH3)2(OH2)2Cl2]
八面体配合物几何异构体数目 类型 MA6 MA5B MA4B2 MA3B3 MA4BC 数目 1 1 2 2 2
类型 MA3B2C
数目 3
MA2B2C2
5
MABCDEF
15
几何异构体的鉴别方法 (1) 偶极矩
量研究工作,随着各种现代结构测定方法的建立,配合
物的结构和异构现象更成为配位化学的重要方面。 配位多面体:把围绕中心原子的配位原子看作点,以线 按一定的方式连接各点就得到配位多面体。 用来描述中心离子的配位环境。
早在1893年维尔纳(瑞士)建立配位理论时,
就已经提出了使中心离子周围配体之间的静电斥力 最小,配合物最稳定,即配体间应尽力远离,从而 采取对称性分布,而实际测定结构的结果证实了这 种设想。 配合物的配位数与其空间结构有一定的联系,
例:Pt(II)配合物的偶极矩(Debye):
顺式 [Pt(PPr3n)2Cl2] 11.5 反式 0
[Pt(PEt3)2Cl2]
(2) X射线衍射法
10.7
0
该方法可确定原子在空间的确切位置(三维坐 标),因此可用来鉴定几何异构体。 例:trans-[Cu(py)2Cl2] (平面正方形)。
如:[HgI3]-、[Pt(PPh3)3]
N C Cu C N Cu C N C
N C Cu C N Cu C
KCu(CN)2
已经确认的如 KCu(CN)2, 它是一个聚合的阴离子, 其中每个Cu (I)原子与两个C原子和一个N原子键合。
化学式为 ML3 化合物并不一定都是三配位. 如 AlCl3、AuCl3为四配位(确切的分子式为Au2Cl6);
无机化学-配位化学基础-配合物的同分异构现象

violet
green
八面体配合物MA3B3异构体
经式
meridional (mer-)
面式
facial (fac-)
八面体配合物MA2B2C2
PtCl2(OH)2(NH3)2 [二氯•二羟•二氨合铂(IV))], 5 种异构体
C A| B
╲╱
M ╱╲ B| A
C 全反
C A|C
╲╱
M ╱╲ B| A
紫色 亮绿色 暗绿色
(4) 配位异构:
[Co(en)3][Cr(ox)3] [Cr(en)3][Co(o在空间排列位置不同引起的异构现象 ➢空间几何异构
➢旋光异构(光学异构)
9.2.2.1 空间几何异构
• 顺反异构
顺式 cis - PtCl2(NH3)2
极性
0
水中溶解度 0.2577 / 100 g H2O
1. 两种异构体互为镜象,但永远不能完全重叠(类 似左、右手关系),称为一对“对映体”, 也称 “手性分子”。 2. 平面偏振光通过这两种异构体时,发生相反方向 的偏转(右旋 d, 左旋 l )。
[Co(en)3]3+
[Co(C2O4)3]4-
l-尼古丁(天然)毒性大 d-尼古丁(人工)毒性小
(1) 键合异构
[Co(NO2)(NH3)5]Cl2 硝基, nitro 黄褐色, 酸中稳定
[Co(ONO)(NH3)5]Cl2 亚硝酸根, nitrito 红褐色, 酸中不稳定
(2) 电离异构
[Co(SO4)(NH3)5]Br [CoBr(NH3)5] SO4
(3) 水合异构
• [Cr(H2O)6]Cl3 • [CrCl(H2O)5]Cl2 ·H2O • [CrCl2(H2O)4]Cl ·2H2O
2012-第二章配合物的结构及异构现象

这两种构型易于互相转化, 热力学稳定性相近, 例如在 Ni(CN)53-的结晶化合物中, 两种 构型共存。这是两种构型具有相 近能量的有力证明。
应当指出,虽然有相当数目的配位数为5的分子 已被确证,但呈现这种奇配位数的化合物要比配位数 为4和6的化合物要少得多。
如PCl5,在气相中是以三角双锥的形式存在,但 在固态中则是以四面体的PCl4+离子和八面体的PCl6- 离子存在的。因此,在根据化学式写出空间构型时, 要了解实验测定的结果,以免判断失误。
H3C
H C* COOH OH
COOH
HOOC
C
C
H
OH HO
H
H3C
CH3
旋光异构 从几何异构看,下图中1、2确为同一化合物. 但
它们却互为“镜像”,不存在对称面,不能重叠,这 称为“旋光异构现象”。
过渡金属的四配位化合物既有四面体形, 也有平面正方 形, 究竟采用哪种构型需考虑下列两种因素的影响。
(1) 配体之间的相互静电排斥作用。 (2) 配位场稳定化能的影响。
一般地,当4个配体与不含有d8电子构型的过渡金 属离子或原子配位时可形成四面体构型配合物。
而d8组态的过渡金属离子或原子一般是形成平面 正方形配合物, 但具有d8组态的金属若因原子太小, 或 配位体原子太大, 以致不可能形成平面正方形时, 也可 能形成四面体的构型。
矩形面上)
可以发现: ① 中心离子周围的7个配位原子所构成的几何体远
比其它配位形式所构成的几何体对称性要差得多。 ② 这些低对称性结构要比其它几何体更易发生畸
变, 在溶液中极易发生分子内重排。 ③ 含7个相同单齿配体的配合物数量极少, 含有两
个或两个以上不同配位原子所组成的七配位配合物更 趋稳定, 结果又加剧了配位多面体的畸变。
配合物的立体结构-(2)PPT课件

➢ 配合物的异构现象 所谓配合物的异构现象: 所谓配合物的异构现
象是指分子式(或实验式)相同,而原子的连接方 式或空间排列方式不同的情况。异构现象是由配位 键的刚性和方向性所决定的。
一般而言,只有那些反应很慢的配合物才能表 现出异构现象,因为快反应配合物易发生重排而仅 生成最稳定的异构体。
H2O
N
Cu
N
H2O H2O
N
O
O
N
O H2O
H2O O
N
N-O 对位
O-O 对位
32
洛阳师范学院
④ 对称双齿配体形成手性分子 [M(AA)3](如[Co(en)3])和[M(AA)2x2]型的六配位
螯合物, 其不对称中心是金属本身。
e n
e n
C e n e n o Co
e n [Co(en)3])
(AA)与(AB)分别代表对称和非对称的双齿配 体, c,d代表单齿配体。
[M(AA)2b2]
2
[M(AB)2c2]
5
[M(AB)2cd ]
6
18
洛阳师范学院
2-3 旋光异构现象
一、手征构型与旋光性质 1. 光学异构体:
旋光异构体的一般物理化学性质相同,但对偏振 光的旋转方向不同。由于这两种异构体分别具有 对偏振光平面向右旋或向左旋性质,故称这为光 学异构体。 2. 右旋异构体:右旋异构体使偏振光平面向右旋, 用符号 d 或(+) 3. 左旋异构体:左旋异构体使偏振光平面向左旋, 用符号l或(-)表示。 一个化合物的右旋和左旋异构体称为对映异构体。
9
6×2
15
Ma2b2c2
5
1×2
6
Ma2b2cd
配位化学(第二章)

有三种水合异构体。 [ Cr Cl (H2O)5 ] Cl2 · H2O
蓝绿色
[ Cr Cl2 (H2O)4 ] Cl · 2H2O
绿色
(6)聚合异构 具有相同的化学式,各个聚合异构体的化学 式是最简式的 n 倍。例如: [ Co(NH3)3(NO2)3 ] n =1 [ Co(NH3)6 ] [ Co(NO2)6 ] n =2 [ Co(NH3)4(NO2)2 ] [ Co(NH3)2(NO2)4 ] n =2 [ Co(NH3)5(NO2) ] [ Co(NH3)2(NO2)4 ] 2 n =3 [ Co(NH3)6 ] [ Co(NH3)2(NO2)4 ] 3 n =4 [ Co(NH3)4(NO2) 2 ] 3 [ Co(NO2)6] [ Co(NH3)5(NO2) ] 3 [ Co(NO2)6] 2 n =4 n =5
可见,多原子配体分别以不同种 配位原子与中心离子键合的现象称为 键合异构。
[ CoBr (NH3)5 ]SO4 → [ CoBr (NH3)5]2+ + SO42暗紫色
[ Co SO4(NH3)5 ] Br → [ Co SO4(NH3)5]+ + Br紫红色
(5)水合异构 凡是化学组成相同,但水分子在内界和外界 分布不同的配合物,互为水合异构。 例如:CrCl3· 6H2O [ Cr(H2O)6 ] Cl3
Co
Cl
H3 N H3 N
NH3
Co
Cl
NH3
面式-三氯· 三氨合钴(Ⅲ) fac-[ Co(NH3)3Cl3
Cl
经式-三氯· 三氨合钴(Ⅲ) mer-[ Co(NH3)3Cl3 ]
2.2.2 旋光异构现象
旋光异构又叫对映异构。 对映异构:组成相同,空间构型相同,互为不 可重叠的镜像关系,就象人的左右手一样,这样的 异构体叫对映异构体。 例如: Ma2b2 c2型八面体配合物有一对对映 异构体。
5配合物的异构现象
O 配位
[Co(NH3)5(ONO)]2+
亚硝酸根·五氨合钴(III),红褐色
PPT编号13-2-2-11
旋光异构
两个配合物不能重合,二者互成镜像,就像人的左 右手一样,它们能使偏振光的偏转角度相同,但是偏转 方向相反,这种异构现象称为旋光异构。
旋光异构体分左旋(–)和右旋(+)异构体。
问题:如何判断一个配合物是否有旋光异构体存在? 通常是看该配合物的几何构型中有没有对称面或
如: [Co(NH3)6][Cr(C2O4)3] [Cr(NH3)6][Co(C2O4)3]
PPT编号13-2-2-10
(3)键合异构
在由两可配体形成的配合物中,由于配位原子的不同 而引起的异构现象成为键合异构。
两可配体 NO2-
N 配位
[Co(NH3)5(NO2)]2+
硝基·五氨合钴(III),黄褐色
反式 - [Pt(NH3)2Cl2]
棕黄色 μ=0 无抗癌活性
PPT编号13-2-2-4
对于 6 配位的八面体配合物而言,异构现象比较复杂, 取决于配体的种类和数目。
例 1: 通式为 MA2B4 的正八面体配合物,有 2 种顺反 异构体。
Cl
H3N
Cl
Cr
H3N
NH3
NH3
顺式 - [Cr(NH3)4Cl2]+ 紫色
Cl
H3N
NH3
Cr
H3N
NH3
Cl
反式 - [Cr(NH3)4Cl2]+ 绿色
PPT编号13-2-2-5
例 2: 通式为 MA2B2C2 的正八面体配合物,有 5 种顺反 异构体。
A
C
C
知识点2 配合物的空间构型
第三章配合物结构第一节配合物的空间构型、异构现象和磁性配合物的空间构型配合物分子或离子的空间构型与配位数的多少密切相关。
直线形四面体平面正方形八面体配位数 2 4 6空间构型例+23)Ag(NH-24NiCl-24)Ni(CN-36Fe(CN)例:-3HgI -25SbCl5Fe(CO)三角形 四方锥 三角双锥配位数 3 5空间构型配合物的异构现象1.几何异构现象:按照配体对于中心离子的不同位置区分。
顺式棕黄色,极性分子 反式淡黄色,非极性分子顺式Pt(Ⅱ)配合物显示治癌活性。
cis-[PtCl 2(NH 3)2] trans-[PtCl 2(NH 3)2]思考:① 配位数为4的正四面体结构的配位化合物是否有顺、反异构体? ② 配位数为6的八面体结构的配位化合物是否有顺、反异构体?cis-[CrCl 2(NH 3)4]+,trans-[CrCl 2(NH 3)4]+•[MX 4A 2]型八面体配合物 :cis-trans-面式(fac-) 经式 (mer-)A XA | X A | A ╲ ╱ ╲ ╱ M M ╱ ╲ ╱ ╲ A | X A | X X Xfac-[CoCl 3 (NH 3)3] (右上) mer-[CoCl 3 (NH 3)3Cl 3] (右下)•[MX 3A 3]型八面体配合物 :fac-mer-2. 旋光异构现象旋光性和分子结构的关系--- 手性把左手放到镜子前,左手的镜像与右手相同,左、右手的关系----相对映而不重合。
手性分子:具有手性的分子称为手性分子。
非手性分子:不具有手性的分子称为非手性分子。
判断分子的手性: 无对称因素无对称中心无对称面旋光性:平面偏振光通过这两种异构体时,发生相反方向的偏转(右旋 d , 左旋 l )旋光性手性分子(不对称分子) 无对称因素无对称中心无对称面旋光异构:由于分子的特殊对称性形成的两种异构体而引起的旋光性相反的现象。
两种旋光异构体互成镜像关系。
配合物的结构及异构现象
第二章配合物的结构及异构现象第一节配位数与配位多面体配位多面体:把围绕中心原子的配位原子看作点,以线按一定的方式连接各点就得到配位多面体。
用来描述中心离子的配位环境。
1、配位数为2理想构型为直线型结构,大多限于Cu(I)、Ag(I)、Au(I)和Hg(II)的配合物。
如:[Ag(NH3)2]+2、配位数为3理想构型为等边三角形结构。
如:[HgI3]−3、配位数为41)四面体构型 2) 平面正方形构型[NiCl4]2−[Ni(CN)4]2−[Zn(NH3)4]2+ [Pt(NH3)4]2+4、配位数为51)三角双锥构型2) 四方锥构型[Fe(CO)5][InCl5]2−[CuCl5]3−5、配位数为6八面体构型三棱柱构型[Co(NH3)6]3+Re(S2C2Ph2)36、配位数为71)五角双锥构型如[ZrF7]3−2)单面心三棱柱构型3)单面心八面体构型7、配位数为81)四方反棱柱。
如[Sr(H2O)8]2+2)三角十二面体。
如[Co(NO3)4]2-8、配位数大于8的情况多出现在镧系及锕系金属配合物中。
为什么?N H N NNNNHN H NNNHNOOOONHNNNHNLa第二节几何异构现象(geometrical isomerism)几何异构:由于配体在空间的位置不同而产生的异构现象。
1.平面正方形配合物 1)[Pt(NH 3)2Cl 2]PtCl ClH 3NH 3NPtNH 3ClClH 3N顺式反式ClNH 3H 3N Cl2)[Pt(NH 3)(py)ClBr]PtPy BrClH 3NPt PyNH 3ClBrH平面正方形配合物几何异构体数目配合物类型 MA 4 MA 3B MA 2B 2 MA 2BC MABCD异构体数目 1 1 2 2 32.八面体构型的配合物[Co(NH3)4Cl2]+的几何异构体:有两种几何异构体:NH3NH3Cl NH3ClNH3NH3NH3H3NNH3ClCl顺式(绿色)反式(紫色)[Rh(py)3Cl3]:Py PyCl ClClPyPyPyClPyClCl面式(facial)经式(meridional))[Co(en)2Cl2]+ (en = H2NCH2CH2NH2):N H2H2 NN H2NH2ClClNH2NH2Cl ClH2NH2N反式顺式八面体配合物几何异构体数目类型MA6MA5B MA4B2 MA3B3MA4BC数目 1 1 2 2 2类型MA3B2C MA2B2C2 MABCDEF数目 3 5 153、几何异构体的鉴别方法1)偶极矩偶极矩:μ= q x l如:例:Pt(II)配合物的偶极矩(Debye): 顺式反式[Pt(NH 3)2Cl 2] 8.7 02)红外光谱cis-[PtCl 2(NH 3)2]NH 3NH 3ClPtCltrans-[PtCl2(NH3)2] cis-[PtCl2(NH3)2]trans-[PtCl2(NH3)2] 3)紫外-可见光谱法cis-和trans-[Co(en)2Cl(NO2)]+的紫外-可见光谱4) X射线衍射法可确定原子在空间的三维坐标。
配合物的结构异构与立体异构
3、多形异构体
分子式相同,立体结构不同的异构体。
P
Cl
P
Ni
Cl
ph
P CH2 C6H5
ph
P
Cl
Ni
Cl
P
红色,反磁性
蓝绿色,顺磁性
正方形,有顺反异构
四面体
4、顺反异构体
顺反异构是最常见的几何异构。 18世纪Werner出色的完成了配位数为4和6的配 合物的顺反异构的合成与分离,为确立配位理 论提供了最令人信服的证明。
化学式相同但结构和性质不同的化合物
配合物的异构现象是配合物的重要性质之一, 它是指配合物化学组成相同,但原子间联结方 式或空间排列方式不同而引起结构和性质不同 的一些现象。
配合物的异构现象由配合物配位键的刚性和方 向性决定。
2、异构的分类
结构异构:
异 电离异构、水合异构、配位异构、键合异构等 构
a、配位原子与中心原子的软硬度影响
b、其它配体的影响
c、配体空间因素的影响
a、配位原子与中心原子的软硬度影响
配体以哪一端配位原子与中心原子成键与二者 的软硬度有关
软硬酸碱法则:硬亲硬,软亲软
硬酸-硬碱
软酸-软碱
[Ta(NCS)6] [VO(NCSe)4]3
[Pt(SCN)6]2 [Ag(SeCN)2]
乙酰丙酮根(acac) 半胱氨酸根
H3C C CH C CH3
O
O
HS CH2 CH COOH
NH2
半胱氨酸可以生成以下三种配合物
HS CH2 CH CO NH M O
NH2 CH2 CH CO SH M O
HS CH2 CH COOH
M
NH2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节配合物的几何结构与异构现象
一.知识储备
1.配离子或配分子的空间结构
根据配合物的配位数,可以判断配离子或配分子的空间结构。
不同配位数的配离子或配分子的空间结构
2.配合物的异构现象
化学式相同而结构不同的化合物其性质必然不同,此现象称为异构现象,这类化合物彼此称为异构体。
异构分为结构异构和立体异构。
结构异构——电离异构、水合异构、键合异构、配位异构。
立体异构——几何异构、旋光异构。
1.结构异构:组成相同但因原子之间连接方式不同所引起的异构现象。
(1)电离异构:具有相同化学组成的配合物,在溶液中电离时若能生成不同的离子,则这些配合物互为电离异构。
例如:[PtCl2(NH3)4]Br2与[PtBr2(NH3)4]Cl2。
(2)水合异构:当电离异构配合物分子中有一个配体换成水分子时就成为水合异构。
例如:[Cr(H 2O)6]Cl 3(紫色)、[CrCl(H 2O)5]Cl 2.H 2O(亮绿色)与[CrCl 2(H 2O)4]Cl.2H 2O(暗绿色)。
(3)键合异构:有一些配体能够以二种或多种不同方式与中心离子键合。
例如:[Co(NO 2)(NH 3)5]Cl 2(黄褐色)与[Co(ONO)(NH 3)5]Cl 2(红褐色);[Cr(SCN)(H 2O)5]2+与[Co(NCS)(H 2O)5]2+。
(4)配位异构:在由配阳离子和配阴离子组成的盐里,因配体在配阳离子和配阴离子中分配不同而引起的异构现象。
例如:[Co(NH 3)6][Cr(CN)6]与[Cr(NH 3)6] [Co(CN)6];[Cr(NH 3)6]
2.立体异构:配体在中心原子周围因排列方式不同而产生的异构现象,称为立体异构。
立体异构分为几何异构和旋光异构。
(1)几何异构(顺—反异构)
四配位数的平面四边形配合物可能形成几何异构,而四面体构型的配合物不存在几何异构现象。
几何异构体之间不仅物理性质不同,而且某些化学性质也差别很大。
①平面四边形配合物
MA 2B 2型平面四边形配合物有顺式和反式两种异构体。
M
B
A
A
M
A
B
B
A
M
B
D
C
A M
B C
A M
D
C
B A 顺式
反式
含有四个不同配体的[MABCD]配合物有三种异构体,这是因为B 、C 、D 都可以是A 的反位基团。
记作[M<AC><BD>] [M<AD><BC>] [M<AB><CD>],其中的角括弧表示相互成反位。
②八面体配合物
在八面体配合物中, MA 6和MA 5B 显然没有异构体。
在MA 4B 2型八面体配合物则有顺式和反式的两种异构体:
A B
A
A
A
B
A
B
A
A
A
B
顺式 反式
MA 3B 3型配合物也有两种异构体,一种是三个A 占据八面体的一个三角面的三个顶点,称为面式;另一种是三个A 位于正方平面的三个顶点,称为经式或子午式(八面体的六个顶点都是位于球面上,经式是处于同一经线,子午式意味处于同一子午线之上)。
B
A A B
A
B 面式
B
B A B A A
A
B B A
B A 面式
B
B B A A A
经式
A
A C B
D
A 面式
A
A C A D
B
经式
对六配位的八面体配合物来讲,异构现象比较复杂,决定于配体的种类和数目,如下表所示。
八面体形配合物的顺反异构情况
旋光异构又称光学异构。
旋光异构是由于分子中没有对称因素(对称面和对称中心)而引起的旋光性相反的两种不同的空间排布。
数学上已经严格证明,手性分子的必要和充分条件是不具备任意次的旋转反映轴Sn 。
当分子中存在有一个不对称的碳原子时,就可能出现两种旋光异构体。
旋光异构体能使偏振光左旋或右旋,而它们的空间结构是实物和镜象不能重合,尤如左手和右手的关系,彼此互为对映体。
具有旋光性的分子称作手性分子。
COOH C H OH
H 3C
C
H
HO
CH 3
HOOC
旋光异构体构型
不难看出,上面两种结构虽然均为全顺式,但却不能重合。
两者互成镜影,就象人的左右手一样,因此人们将这种性质称为手性。
手性化合物的特征性质是可使平面偏振光发生偏转,而且互成镜影的异构体使偏振光的偏转角度相同但偏转方向相反。
所以,又将这种异构现象称为旋光异构,使偏振光沿顺时针方向旋转的异构体称为右旋(d-)异构体,使偏振光沿逆时针方向旋转的异构体称为左旋(l-)异构体。
旋光异构通常与几何异构有密切的关系。
一般地反式异构体没有旋光活性,顺式-可分离出旋光异构体来。
Co
Co
en
en en en
Co NO 2
en
en
O 2N
NO 2NO 2
NO 2
O 2N
反式-[Co(en)2(NO 2)2] 顺式-[Co(en)2(NO 2)2]
无旋光对映体 有旋光对映体
Co Co
en
en
en
en en
en
A
A
M
A
A A A
X
M
A
A
X
X
X
[Co(en)3]) [M(AA)2X 2]
顺-[Co(en)2(NO 2)2]+的旋光异构体
右旋性的 左旋性的
二.真题再现
例题1(2004年全国化学初赛第八题) 今有化学式为Co(NH 3)4BrCO 3的配合物。
1.画出全部异构体的立体结构。
H 2O NH 3H 2O
Br
NH 3
Cr Br
+
N OH 2Br
OH 2
NH 3
Cr Br
+
H 3
2.指出区分它们的实验方法。
解析:
全部异构体包括结构异构和立体异构,CO3-既可做单齿配体,也可做双齿配体。
结构不同,必然性质不同,分析其性质差异,自然可找到区分它们的方法。
1.三种。
立体结构如下:
I ⅡⅢ
2.配合物III可通过其离子特性与另两个配合物区分开:滴加AgNO3溶液,Br-立即被沉淀下来(而直接与钴配位的溴相当缓慢地沉淀)。
也可通过测定电导将III与I、II区分(用红外光谱法区分也可)I的偶极矩比II的偶极矩小,因此测定极性可将两者区分开。
