测定磷酸二氢钠和磷酸氢二钠混合体系中各组分的含量(精)
磷酸氢二钠含量的测定

磷酸氢二钠含量的测定磷酸氢二钠含量的测定容量法1. 方法提要在试样中准确加人过量的盐酸标准滴定溶液,用氢氧化钠标准滴定溶液滴定过量的盐酸标准滴定溶液,以酸度计指示突跃点,根据氢氧化钠标准滴定溶液的消耗量,计算磷酸氢二钠含量。
2. 试剂和材料盐酸标准滴定溶液:c(HCl)约为1mol/L。
氢氧化钠标准滴定溶液:c(NaOH)约为1mol/L。
3. 仪器、设备酸度计配有玻璃电极和饱和甘汞电极,分度值为0.02pH单位。
电磁搅拌器:配有搅拌转子。
4. 分析步骤a) 试样的制备称取适量样品于称量瓶中,在105℃干燥4h ,置于干燥器中冷却至室温。
此样品为试样A,用于磷酸氢二钠、砷、重金属、氟化物、水不溶物含量的测定。
b) 测定称取约6.5g试样A(精确至0.0002 g),置于250mL的烧杯中,用移液管移取50.0mL盐酸标准滴定溶液和50mL水。
置于电磁搅拌器上,放人搅拌转子,搅拌至样品完全溶解。
将已校准的pH计的电极放人试验溶液中,用氢氧化钠标准滴定溶液滴定过量的盐酸标准滴定溶液,直至p H≈4出现突跃点。
记录滴定读数,计算样品消耗的盐酸标准滴定溶液的体积(V1)用氢氧化钠标准滴定溶液继续滴定至pH≈8.8 出现突跃点,记录滴定读数,计算在这两个突跃点(pH4~pH8.8)之间滴定消耗的氢氧化钠标准滴定溶液的体积(V2)5. 分析结果的表述样品消耗的盐酸标准滴定溶液的体积(V1)按式(1)计算V1= (1)式中:V—滴定至Ph≈4出现突跃点时消耗氢氧化钠标准滴定溶液的体积,mL;c1—盐酸标准滴定溶液的实际浓度,mol/L;c2—氢氧化钠标准滴定溶液的实际浓度,mol/L。
当V1c1等于或小于V2c2时,以质量百分数表示的磷酸氢二钠(以Na2HPO4计)含量(X1)按式(2)计算:X1= (2)当V1c1大于V2c2时,以质量百分数表示的磷酸氢二钠(以Na2HPO4计)含量(X2)按式(3)计算X2= (3)式中:V1—滴定至Ph≈4出现突跃点时,样品消耗的盐酸标准滴定溶液的体积,mL;V2—pH4^-pH8.8 之间滴定消耗的氢氧化钠标准滴定溶液的体积,mL;c1—盐酸标准滴定溶液的实际浓度,mol/L;c2—氢氧化钠标标准滴定溶液的实际浓度,mol/L;m—试样的质量,g;0.1420 —与 1.00 mL氢氧化钠标准滴定溶液[c(NaOH)=1.000mol/L]相当的以克表示的磷酸氢二钠的质量。
酶样品测定方法

酶样品待测酶液制备方法磷酸缓冲液的制备中性蛋白酶(pH=7.5)准确称取磷酸氢二钠6.02g和磷酸二氢钠0.5g,加水定容至1000ml,配好后用pH计校正。
淀粉酶(pH=6)称取磷酸氢二钠45.23g,柠檬酸8.07g,用水溶解并定容于1000ml,配好后用pH计校正。
脂肪酶(pH=7.5)称取磷酸二氢钾1.96g,十二水磷酸氢二钠39.62g,用水溶解并定容于500ml,配好后用pH计校正。
酶液的制备称取样品1.000g至10ml试管中,加入磷酸缓冲液5ml,置于高速匀浆机捣碎,然后连残渣一起倒入100ml容量瓶中定容,室温静置1h,期间反复震荡3次,然后取4ml在16000r/min下离心5分钟,取上清液4℃保存待测。
酶活测定淀粉酶、脂肪酶、胰蛋白酶采用建成生物工程研究所试剂盒测定,中性蛋白酶采用福林酚法测定。
淀粉酶原理:淀粉酶能水解淀粉生成葡萄糖、麦芽糖及糊精,在底物浓度已知并且过量的情况下,加入碘液与未水解的淀粉结合生成蓝色复合物,根据蓝色的深浅可推算出水解的淀粉量,从而计算出淀粉酶的活力。
单位定义:在37℃、pH6.0下,与底物作用30分钟,水解10mg淀粉定义为1个淀粉酶活力单位。
分析方法:计算:酶活力(U/g)= (空白管吸光度-测定管吸光度)/空白管吸光度×(0.4×0.5/10) ×(30分钟/7.5分钟) ÷(取样量×酶液浓度)脂肪酶原理:甘油三酯和水制成乳化液,因其胶束对入射光的吸收及散射而具有乳浊性状,胶束中的甘油三酯在脂肪酶的作用下发生水解,使胶束分裂,散射光或浊度因而降低,降低的速率与脂肪酶活力有关。
单位定义:在37℃条件下,在反应体系中与底物反应1分钟,每消耗lμmol 底物为1个脂肪酶活力单位。
分析方法:1、将分光光度计在420nm处以Tris缓冲液调零。
2、将底物缓冲液在37℃预温5分钟。
3、在试管中加入0.025ml待测样本,再加入试剂四0.025ml,然后加入4ml预温的底物缓冲液,盖住管口,颠倒混合5次,在420nm处比浊,读取吸光度值A1。
混合磷酸盐含量测定
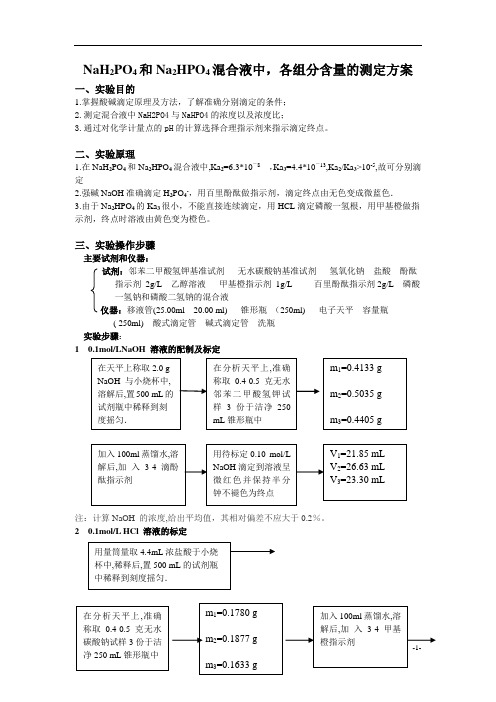
NaH 2PO 4和Na 2HPO 4混合液中,各组分含量的测定方案一、实验目的1.掌握酸碱滴定原理及方法,了解准确分别滴定的条件;2.测定混合液中NaH2PO4与NaHPO4的浓度以及浓度比;3.通过对化学计量点的pH 的计算选择合理指示剂来指示滴定终点。
二、实验原理1.在NaH 2PO 4和Na 2HPO 4混合液中,Ka 2=6.3*10-8 ,Ka 3=4.4*10-13,Ka 2/Ka 3>10-5,故可分别滴定2.强碱NaOH 准确滴定H 2PO 4-,用百里酚酞做指示剂,滴定终点由无色变成微蓝色.3.由于Na 2HPO 4的Ka 3很小,不能直接连续滴定,用HCL 滴定磷酸一氢根,用甲基橙做指示剂,终点时溶液由黄色变为橙色。
三、实验操作步骤主要试剂和仪器:试剂:邻苯二甲酸氢钾基准试剂 无水碳酸钠基准试剂 氢氧化钠 盐酸 酚酞指示剂 2g/L 乙醇溶液 甲基橙指示剂 1g/L 百里酚酞指示剂2g/L 磷酸一氢钠和磷酸二氢钠的混合液仪器:移液管(25.00ml 20.00 ml) 锥形瓶 (250ml) 电子天平 容量瓶( 250ml) 酸式滴定管 碱式滴定管 洗瓶实验步骤:1 0.1mol/LNaOH 溶液的配制及标定注:计算NaOH 的浓度,给出平均值,其相对偏差不应大于0.2%。
2 0.1mol/L HCl 溶液的标定在天平上称取2.0 g NaOH 与小烧杯中,溶解后,置500 mL 的试剂瓶中稀释到刻度摇匀. 在分析天平上,准确称取0.4-0.5克无水邻苯二甲酸氢钾试样3份于洁净250 mL 锥形瓶中 m 1=0.4133 g m 2=0.5035 g m 3=0.4405 g 加入100ml 蒸馏水,溶解后,加 入3-4滴酚酞指示剂 用待标定0.10 mol/L NaOH 滴定到溶液呈微红色并保持半分钟不褪色为终点 V 1=21.85 mL V 2=26.63 mL V 3=23.30 mL 用量筒量取4.4mL 浓盐酸于小烧杯中,稀释后,置500 mL 的试剂瓶中稀释到刻度摇匀. 在分析天平上,准确称取0.4-0.5克无水m 1=0.1780 g 加入100ml 蒸馏水,溶解后,加 入3-4甲基注:加入的指示剂不能过多,否则会误差较大3 混合液中磷酸二氢根含量的测定:4混合液中磷酸一氢根含量的测定:注:若d >0.2%,可以继续滴定,直至连续三次d <0.2%为止四、实验数据记录,数据处理过程及其结果表一 0.1mol/LNaOH 溶液的配制及标定数据序号项目 数据123m 邻苯二甲酸氢钾/g0.4133 0.5035 0.4405 V NaOH 终读数/ml 21.85 26.63 23.30 V NaOH 初读数/ml0.00 0.00 0.00 V NaOH /ml 21.85 26.63 20.10 C NaOH /mol.L -1 0.092720.09268 0.09267C NaOH /mol.L -1的平均值0.09269相对偏差d 0.03% 0.01% 0.02%相对平均偏差0.02%表二 0.1mol/L HCl 溶液的标定 数据用待标定0.10 mol/LHCl滴定到溶液由黄色变为橙色,并半分钟不褪色为终点 V 1=30.10 mLV 2=31.60 mLV 3=27.59 mL移取混合液25.00 mL 于锥形瓶中,加2-3滴百里酚酞 用已标定的NaOH 溶液滴定至浅蓝保持半分钟不褪色既为终点,纪录数据平行滴定三次.V 1=28.03mL V 2=28.05 mL V 3=28.05 mL移取混合液25.00mL 于锥形瓶中,加2-3滴甲基橙已标定的HCl 溶液滴定至红色变为无色且保持半分钟不褪色既为终点,纪录数据平行滴定三次 V 1=24.20mL V 2=24.20mL V 3=24.22 mL序号项目数据 1 2 3m(Na2CO3)/g0.1780 0.1877 0.1633V HCL终读数/ml 30.10 31.60 27.59V HCL初读数/ml 0.00 0.00 0.00 V HCL/ml 30.10 31.60 27.59C HCL/mol.L-1L0.1116 0.1120 0.1117C HCL/mol.L-1的平均值0.1118相对偏差d 0.17% 0.17% 0.08%相对平均偏差0.14%表三混合液中磷酸二氢根含量的测定数据序号项目数据 1 2 3 V混合液25.00 25.00 25.00 V NaOH终读数/ml 28.03 28.05 28.05V NaOH初读数/ml0.00 0.00 0.00 V NaOH/ml28.03 28.05 28.05 c(H2P04-)/mol.L-10.1039 0.1040 0.1040 c(H2P04-)/mol.L-1的平均值0.1040相对偏差d 0.06% 0.03% 0.03%相对平均偏差0.04%表四混合液中磷酸一氢根含量的测定数据序号项目数据 1 2 3 V混合液25.00 25.00 25.00 V HCL终读数/ml 24.20 24.20 24.22V HCL初读数/ml0.00 0.00 0.00 V HCL/ml24.20 24.20 24.22C (HP042-)/mol.L-10.1082 0.1082 0.1083 C(HP042-)/mol.L-1的平均值0.1082相对偏差d 0.03% 0.03% 0.06%相对平均偏差0.04%五.实验结论测定得混合磷酸盐溶液中,c(H2P04-)=0.1040 mol/Lc(HP042-)=0.1082 mol/Lc(H2P04-)/ c(HP042-)=0.9612六.问题与讨论1.氢氧化钠和盐酸的标准溶液为何在配制后不能直接用还有再标定?答:在分析化学中要求的值是非常精确的,若要直接配置标准溶液,溶质必须为基准物质。
磷酸氢二钠(15版中国药典公示稿)

磷酸氢二钠L i n s u a n q i n ge r n a D i s o d i u m H y d r o g e nP h o s p h a t eD o d e c a h yd r a te N a 2H P O 4㊃12H 2O358.14[10039-32-4]本品按干燥品计算,含N a 2H P O 4不得少于98.0%㊂ʌ性状ɔ本品为无色或白色结晶或块状物;无臭;常温置空气中易风化㊂本品在水中易溶,在乙醇中几乎不溶㊂ʌ鉴别ɔ本品的水溶液显钠盐与磷酸盐的鉴别反应(﹏附录﹏﹏Ⅲ通则﹏﹏﹏﹏0301)㊂ʌ检査ɔ碱度 取本品1.0g,加水20m l 溶解后,依法测定(附录﹏﹏﹏﹏V IH 通则﹏﹏﹏﹏0631),p H 值应为9.0~9.4㊂溶液的澄清度与颜色 取本品1.0g,加水10m l ,充分振摇使溶解,溶液应澄清无色㊂氯化物 取本品5.0g ,依法检査(附录Ⅷ﹏﹏﹏﹏A ﹏﹏通则﹏﹏0801),与标准氯化钠溶液5.0m l 制成的对照液比较,不得更浓(0.001%)㊂硫酸盐 取本品2.0g ,依法检査(附录Ⅷ﹏﹏﹏﹏B ﹏﹏通则﹏﹏0802),与标准硫酸钾溶液2.0m l 制成的对照液比较,不得更浓(0.01%)㊂碳酸盐 取本品2.0g,加水10m l ,煮沸,冷却后,加盐酸2m l,应无气泡产生㊂水中不溶物 取本品20.0g ,加热水100m l 使溶解,用经105ħ干燥至恒重的4号垂熔坩埚滤过,沉淀用热水200m l 分10次洗涤,在105ħ干燥2小时,遗留残渣不得过10m g (0.05%)㊂还原物质 取本品5.0g ,加新沸过的冷水溶解并稀释至50m l ,摇匀,量取5.0m l ,加稀硫酸5m l 与高锰酸钾滴定液(0.02m o l /L )0.25m l ,在水浴加热5分钟,溶液的紫红色不得消失㊂磷酸二氢钠 取含量测定项下测定结果并按下式计算,含磷酸二氢钠应不得过2.5%㊂N 2-N 3N 3-N 1ˑ100%干燥失重 取本品,在130ʎC 干燥至恒重,减失重量应为55.0%~64.0%(附录Ⅷ﹏﹏﹏﹏L 通则﹏﹏﹏﹏0831)㊂铁盐 取本品0.50g ,加水20m l 使溶解,加盐酸溶液(1ң2)l m l 与10%磺基水杨酸溶液2m l ,摇匀,加氨试液5m l ,摇匀,如显色,与标准铁溶液(附录Ⅷ﹏﹏﹏﹏G 通则﹏﹏﹏﹏0807)1.0m l 用同一方法制成对照液比较,不得更深(0.002%)㊂重金属 取本品2.0g ,加水15m l 溶解后,加盐酸适量调节溶液p H 值约为4,加醋酸盐缓冲液(p H 3.5)2m l 与㊃892㊃磷酸氢二钠水适量使成25m l ,依法检査(附录ⅧH ﹏﹏﹏﹏﹏﹏﹏第一法通则﹏﹏﹏﹏0821﹏﹏﹏第一法),含重金属不得过百万分之十㊂砷盐 取本品1.0g ,加水23m l 溶解后,加盐酸5m l ,依法检査(附录ⅧJ ﹏﹏﹏﹏﹏﹏第一法通则0822﹏﹏﹏﹏﹏﹏﹏第一法),应符合规定(0.0002%)㊂ʌ含量测定ɔ取本品约4.0g ,精密称定,加新沸过的冷水25m l 溶解后,精密加入盐酸滴定液(1m o l /L )25m l ,照电位滴定法(附录Ⅶ﹏﹏﹏﹏A 通则﹏﹏﹏﹏0701),用氢氧化钠滴定液(l m o l /L )滴定,记录第一突跃点消耗氢氧化钠滴定液体积N 1与第二突跃点消耗氢氧化钠滴定液总体积N 2,以第一个突跃点消耗的氢氧化钠滴定液体积计算含量,并将滴定的结果用空白试验校正N 3㊂每1m l 盐酸滴定液(1m o l /L )相当于142.0m g 的N a 2H P O 4㊂ʌ类别ɔ药用辅料,p H 值调节剂和缓冲剂等㊂ʌ贮藏ɔ密封保存㊂㊃992㊃磷酸氢二钠。
磷酸氢二钠-磷酸二氢钠缓冲液(0.2molL,pH5.8-8.0)

北京雷根生物技术有限公司
Hale Waihona Puke 磷酸氢二钠—磷酸二氢钠缓冲液(0.2mol/L,pH5.8-8.0)
简介:
磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L,pH5.8-8.0)由磷酸氢二钠和磷酸二氢钠按不 同比例混合而得,磷酸根浓度为 0.2mol/L,客户根据需要可选 pH 5.8、5.9、6.0、 6.1、 6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、 7.9、8.0。
组成:
编号 名称 R00406 500ml Storage
磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L,pH5.8-8.0) 使用说明书
RT 1份
操作步骤(仅供参考) :
1、根据实验具体要求操作。 1、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
设计实验磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定

设计实验磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#设计实验:磷酸二氢钠(NaH2PO4)与磷酸氢二钠(Na2HPO4)混合液中各组分含量的测定实验者:XXX[1]指导老师:XXX[2]([1]武汉大学化学与分子科学学院20XX级XXX班学号:XXXX[2]武汉大学化学与分子科学学院分析实验指导老师)摘要:以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝或溴甲酚绿为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4),分别确定其含量。
关键词:酸碱滴定混合液含量测定一、实验目的实验测定混合液中NaH2PO4与Na2HPO4的含量。
二、实验基本原理磷酸(H3PO4)的解离常数Ka1=*10-3 Ka2=*10-8 Ka3=*10-13NaH2PO4中[H+]=(Ka1*Ka2)1/2=*10-5,pH=Na2HPO4中[H+]=(Ka2*Ka3)1/2=*10-10,PH=PH变色范围,酚酞~,溴酚蓝~,溴甲酚绿~所以可以以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4)。
三.主要实验试剂和仪器1.浓HCl溶液2.固体NaOH3.甲基橙溶液(1g*L-1)4.酚酞溶液(2g*L-1,乙醇溶液)5.两用滴定管(50ml)6.锥形瓶(250ml)7.移液管(25ml)8.百里酚酞9.溴酚蓝10.烧杯(100ml)四、实验操作步骤1.NaOH,HCl溶液的配置称取约2gNaOH于洁净的烧杯中,加水溶解,转移至塑料瓶中,稀释至约500mL,待标定。
另取约5mLHCl于洁净的烧杯中,加水溶解,转移至玻璃瓶中,稀释至约500mL,待标定。
《医用基础化学》平时作业(含新答案)

医用基础化学平时作业学生姓名:学生学号:分校、工作站:教学班:重庆广播电视大学制医用基础化学第1次平时作业通过本次作业使学生掌握第一、二和三章的有关概念及一些常见计算。
一、单项选择题(每小题1分,共25分)1.配制300ml 0.10mol L-1NaOH(M r=40)需称取固体NaOH的质量为(A)(A)1.2g (B)1.2mg(C)4.0g (D)4.0mg(E)12 .00g2.人体血液中平均每100 ml中含有19mg K+(M=39),则血液中K+的浓度是(D)(A)0.49 mol • L-1(B)4.9 mol • L-1(C)4.9×10-2 mol • L-1(D)4.9×10-3 mol • L-1(E)4.9×10-3 mmol •ml-13.中和50ml 0.20mol• L-1HCl溶液,需要某NaOH溶液25ml,该NaOH溶液的浓度是(C)(A)0.1mol /L(B)0.2mol /L(C)0.4mol /L(D)0.8mol /L(E)2.0 mol /L4.血红细胞置在下列哪个溶液中,将会引起溶血(细胞破裂)现象(D)(A)9.0g •L-1 NaCl (B)90.0g •L-1NaCl (C)50.0g •L-1葡萄糖(D)生理盐水的10倍稀释液(E) 100.0g •L-1葡萄糖溶液5.会使红细胞发生皱缩的溶液是(E)(A)1.0g·L-1NaCl(Mr=58.5) (B)10.0g·L-1CaCl2·2H2O(Mr=147)(C)12.5g·L-1NaHCO3(Mr=84.0) (D)9.0g·L-1NaCl(Mr=58.5)(E)112g·L-1C3H5ONa(Mr=80)6.在室温下把青蛙的筋肉细胞放在0.2mol/LNaCl水溶液中,观察到细胞皱缩,由此可得到的结论是(C)(A)细胞内液的渗透浓度大于NaCl水溶液的渗透浓度(B)NaCl水溶液的浓度大于细胞内液的浓度(C)NaCl水溶液的渗透浓度大于细胞内液的渗透浓度(D)两者的浓度相等7.当AgNO3的稀溶液与KI的稀溶液混合时,若AgNO3溶液过量,所形成溶胶的胶团和胶粒分别带(C)(A)正电荷负电荷(B)负电荷正电荷(C)电中性正电荷(D)电中性负电荷8.溶胶可暂时稳定存在的主要因素有(B)(A)布朗运动(B)胶粒带电(C)胶粒扩散(D)胶粒对光的散射作用9.对于胶团[(AgI)m ·nAg+·(n-x)NO3-]x+·xNO3-,下列说法不正确的是(D)(A )(AgI )m 是胶核 (B ) Ag +为吸附离子 (C ) NO 3-为反离子(D ) m = n + x (E )[(AgI )m ·nAg + · (n-x)NO 3-]x+为胶粒10.将0.01mol/LAgNO 3溶液与0.10mol/LKI 溶液等体积混合制备AgI 溶胶,下列电解质中对该溶胶聚沉能力最强的是( B )(A )K 2SO 4 (B )Al(NO 3)3 (C )MgCl 2 (D )K 3[Fe(CN)6] (E )NaCl11.关于活化能,下列说法正确的是( C )(A) 活化能越大,反应速度越大 (B )反应速度相同的反应,活化能一定相同(C )活化能越小,一般反应速度越快 (D )正、逆反应的活化能相同(E) 活化能是活化分子具有的能量12.在化学反应中,催化剂的作用在于( A )(A )降低了活化能 (B )增加了分子间碰撞 (C )改变反应的平衡常数 (D )分子运动速度加快 (E )增大了活化分子的分数13.某温度下,下列反应已达平衡:CO(g)+H 2O(g) === CO 2(g) +H 2(g) (放热反应),为提高CO 的转化率,可采取的方法是( A )(A )通入更多的水蒸气 (B )增加体系的总压力 (C )加入催化剂(D )降低体系的总压力 (E )升高体系的温度14.下列关于化学平衡的叙述中,正确的是( E )(A )升高温度,平衡向放热反应方向移动 (B )降低温度,平衡向吸热反应方向移动(C )温度改变不能使化学平衡发生移动(D )改变浓度可引起平衡的移动,故K 也随之发生改变(E )改变浓度可引起平衡的移动,但不会改变K15.已知HCN 的Ka = 5.0×10-10 mol/L ,则CN -的碱常数Kb 为( D )(A )5.0×10-14 (B )5.0×10-10 (C ) 2.0×10-6 (D )2.0×10-5 (E )2.0×10-416.往氨水溶液中加入一些固体NH 4Cl ,会使( B )(A )溶液PH 增大 (B )溶液PH 减小 (C )溶液PH 不变(D )NH 3的Kb 增大 (E )NH 3的Kb 减小17.由等体积的HX 和NaX 组成的缓冲体系,如果HX 的电离常数Ka=10-5,则此缓冲溶液的PH 值为( B )(A ) 7 (B )5 (C )8 (D )9 (E )1418.将0.10mol/L 的HAc 溶液加水稀释至原体积的二倍时,其[ H +]和PH 值的变化趋势各为( B )(A )增加和减小 (B )减小和增大 (C )减小和减小(D )为原来的一半和增大 (E )为原来的一倍和减小19.根据酸碱质子理论,在化学反应NH 3+H 2O =NH 4++OH -中,属于酸的物质是( B )(A ) NH 3和H 2O (B )NH 4+和H 2O (C )NH 4+和OH- (B ) (D )NH 3和OH - (E )NH 3和NH 4+20.若要制备PH=7的缓冲溶液,较为合适的缓冲对是( D )(A )甲酸钠和甲酸 (Ka=1.8×10-4) (B )醋酸钠和醋酸 (Ka=1.8×10-5 )(C )氯化铵和氨水 (Kb=1.8×10-5 ) (D )磷酸氢二钠和磷酸二氢钠 (Ka=6.3×10-8)21.有一难溶强电解质M 2X ,其溶度积Ksp 和其在饱和溶液中的溶解度S 的关系式为( E )(A )S =Ksp (B )S=SP K (C )S=3Ksp (D )S=32/Ksp (E )S=34/Ksp22.有一难溶强电解质Fe 2S 3,其溶度积Ksp 表达式是( D )(A )Ksp =[Fe 3+] [S 2-] (B )Ksp =[Fe 23+] [S 32-](C )Ksp =[2Fe 3+]2 [3S 2-]3 (D )Ksp =[Fe 3+]2[S 2-]3 (E )Ksp =2[Fe 3+]2 •3[S 2-]323.250C 时CaCO 3饱和溶解度为9.3 ⨯ 10-5mol/L ,则CaCO 3的溶度积Ksp 为( A )(A)8.6×10-9(B)9.3×10-5(C)1.9×10-5(D)9.6×10-2(E)1.9×10-4 24.25℃时PbI2的Ksp为8.49×10-9则其饱和溶液I-浓度约为(C)(A)2.04×10-3 mol/L(B)4.08×10-3 mol/L(C)2.57×10-3 mol/L(D)1.28×10-3 mol/L(E)3.03×10-3 mol/L25.250C时Ag2CrO4饱和溶液中,[CrO42-]=6.0×10-5mol/L,则Ag2CrO4的溶度积Ksp为(C)(A)6.6×10-9(B)2.2 ×10-13(C)8.64×10-13 (D)5.4×10-14(E)1.9×10-10二、填空题(每小题1分,共30分)1.100ml 0.1mol/LH2SO4(Mr=98)溶液中,H2SO4的物质的量是_0.01_mol,质量浓度是_9.8g/L_。
NaH2PO4和Na2HPO4混合液中各组分含量测定 2

NaH2PO4和Na2HPO4混合液中各组分含量测定高新隆2012301040217 指导老师:林毅摘要:弱酸的滴定是分析实验中不可或缺的一部分,熟练地掌握弱酸的分步滴定不仅有利于在往后的分析实验中更简单精确的得到实验结果,其在实际生活中应用也十分的广泛。
本文设计了通过已知浓度的强酸强碱分别滴定混合液并测得混合液中各组分的含量。
关键字:酸碱滴定 NaH2PO4 Na2HPO4 组分含量实验部分:1.1实验试剂及仪器:试剂:邻苯二甲酸氢钾基准试剂,无水碳酸钠基准试剂,氢氧化钠,盐酸,甲基橙,酚酞,磷酸一氢钠和磷酸二氢钠的混合液。
仪器:25.00mL移液管,250mL锥形瓶3个,电子天平,容量瓶( 250ml),酸式滴定管,碱式滴定管,洗瓶。
1.2实验原理:在NaH2PO4和Na2HPO4混合液中,Ka2=6.3*10-8,Ka3=4.4*10-13,Ka2/Ka3>105故可分别滴定,可用NaOH准确滴定磷酸二氢根,用酚酞做指示剂,滴定终点由无色变成微红色。
由于Na2HPO4的Ka3很小,不能直接连续滴定,用HCl滴定磷酸一氢根,以甲基橙作为指示剂,终点时溶液由黄色变为橙色。
1.3.1 0.1mol/L NaOH 溶液的配制及标定在天平上称取2gNaOH 与小烧杯中,溶解后,置500ml的试剂瓶中稀释到刻度摇匀。
在分析天平上准确称取0.4-0.6克无水邻苯二甲酸氢钾试样3份,分别加入250ml锥形瓶中加入40~50ml蒸馏水,溶解后,加入2~3滴酚酞指示剂。
用待标定的0.10mol/L NaOH滴定到溶液呈微红色并保持半分钟不褪色为终点。
计算NaOH 的浓度,给出平均值,其相对偏差不应大于0.2%。
1.3.2 0.1mol/L HCl 溶液的标定量取约4.2mL浓盐酸,转移至500mL试剂瓶中加适量水稀释至刻度摇匀。
称取1.3到1.5克无水碳酸钠加水溶解,定量转移到250ml容量瓶,用移液管取25ml该液于锥形瓶中,再加1-2滴甲基橙指示剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
测定磷酸二氢钠和磷酸氢二钠混合体系中各组分的含量
2010-11-13 05:50:24| 分类:现行工作资料收集 | 标签:|字号大中小订阅
在实际工作中,常常会遇到混合酸(碱体系的测定问题。
如何才能设计出一个既准确又简便的分析方案来呢?
例如,要用滴定分析的方法,测定磷酸二氢钠和磷酸氢二钠混合体系中各组分的含量,涉及分析方案时要如何入手?要考虑些什么问题呢?
首先,必须判断各组分能否用酸(或碱标准溶液进行滴定。
根据磷酸的离解平衡,查出三级离解平衡酸 (或碱常数(pK a1=2.12 , pK a2=7.20, pK a3=12.36; pK b1=1.64 , pK b2=6.80, pK b3=11.88。
应用弱酸、弱碱能否被准确滴定的判式:cK ≥ 10-8判断。
显然 ,磷酸二氢钠可用氢氧化钠标准溶液直接滴定到 HPO 42-。
而 HPO 42-继续用氢氧化钠滴定则不可能,但是可用盐酸标准溶液来直接滴定它;也可以先加入适量氯化钙固体,定量置换出氢离子,再用氢氧化钠标准溶液滴定:
2Na 2HPO 4 + 3CaCl 2=== Ca3(PO4 2↓ + 4NaCl + 2HCl
如果要采用直接滴定的方式 , 滴定的方法也不是唯一的。
例如 , 可用上述方法 , 在同一份试液中分别用 NaOH 和 HCl 标准溶液进行两次滴定;也可以取两分等量的试液,分别用 NaOH 和 HCl 标准溶液进行滴定。
至于指示剂,一般是根据滴定反应达计量点时产物溶液的 pH 值来选择的。
如果等量点时产物为 HPO 42-, 其溶液的 pH=9.7,则可选用酚酞(变色范围为 pH=8.2~10.0或百里酚酞(变色范围为
pH=9.4~10.6为指示剂;当产物为 H 2PO 4-时,其溶液的 pH=4.7,则可选用甲基红(变色范围为 pH=4.2~6.2或溴甲酚绿 (变色范围为 pH=3.8~5.4为指示剂。
磷酸二氢钠 --磷酸氢二钠混合物各组份含量测定 (Sodium Phosphate Monobasic and Sodium Phosphate Dibasic
作者 :佑木
单位 : 武汉大学化学与分子科学学院化学类专业
发布时间 : 2006. 10.21
[引言 ]
本次实验在于培养学生查阅有关部门书刊的能力 ; 能够运用所学知识及有关参考资料对实际试样写出实验方案设计 ; 能够在教师的指导下对各种混合酸碱体系的组成含量进行分析 , 陪样一种分析问题 , 解决问题的能力 , 以提高素质 .
[关键词 ]
准确分步滴定的判别滴定剂的选择计量点 pH 的计算
指示剂的选择分析结果的计算公式标准溶液的配制
标准溶液的标定待测混合溶液的确配制
[实验摘要 ]
1 .H3PO4 → H+ + H2PO4- Ka1 = 7.5 X 10 -3
H2PO4- → H+ + HPO42- Ka2 = 6.3 x 10 -8
HPO42- → H+ + PO43- Ka3 = 4.4 X 10-13
准确滴定的条件 : Ka .c >=10 -8 , 所以 , 磷酸二氢钠 --磷酸氢二钠中的各组份不能够准确分步滴定 .
2 . H2PO4- + OH - → HPO42- 以酚酞做指示剂 , 用标准 NaOH 溶液进行准确滴定 , 滴定终点溶液颜色变化为 : 无色→ 淡红色 (半分钟内不褪色 ,pH=9.0 实验过程中 , 设所消耗 NaOH 的量为 VNaOH ,浓度为本 CNaOH ,则混物中磷酸二氢钠的含量 CNaOH .VNaOH X MNaH2PO4 X 1O
WNaH2PO4= ———————————— -------X 100%
ms
3. HPO42- + OH- → H2PO4- 以甲基橙为指示剂 , 用标准 HCl 溶液进行准确标定,滴定终点溶液颜色变化为:黄色→ 橙色 (滴定终点 pH=
4.0实验过程中 , 设所消耗 HCl 的量为 VHCl , 浓度为 CHCl , 则混物中磷酸氢二钠的含量
CHCl.VHCl X M N a2HPO4 X 1O WNa2HPO4= ———————————————————— X 100 %
ms
4. 实验设计流程图
标准 NaOH 溶液的配制标准 HCl 溶液的配制
↓ (KHC8H4O4↓(Na3CO3
标准 NaOH 溶液的标定标准 HCl 溶液的标定↓ (酚酞指示剂↓ (甲基橙指示剂
得WNaH2PO4→ NaH2PO4-Na2HPO4← 得 WNaH2PO4 [实验内容 ]
1. 标准 NaOH 溶液的配制急标定
用烧杯在天平上称取约 2g 固体 NaOH, 加入新鲜或煮沸除去 CO2的蒸馏水 , 溶解完后转去带有橡皮塞的试剂瓶中 , 家水稀释至 500ml, 充分摇匀 . 在称量瓶中以差减法称取邻苯二甲酸氢钾 (KHC8H4O4 3份 , 每份 0.4---0.6 g,分别倒入 250ml 锥形瓶中 , 加入 40--50 ml 蒸馏水 , 待试剂完全溶解后 , 加入 2~3滴酚酞指示剂 , 用标定的 NaOH 溶液滴定至呈微红色并保持半分钟即为终点 , 计算 NaOH 溶液的浓度和平均浓度
.2 .标准 HCl 溶液的配制及标定
用量杯取原装的浓盐酸 4.5ml (12 mol .L-1 ,倒入试剂瓶中 , 加水稀释至 500ml ,充分摇匀称 (配制过程应在通风橱中操作 . 用称量准确称取 0.15-0.20 g 无水
NaCO33份 , 分别倒入 250ml 锥形瓶中 . 称量样品时称量瓶一定要带盖 , 以免吸湿 .
然后加入 20~30ml 水使之充分溶解 , 再加 1~~2滴甲基橙指示剂 , 用待标定的 HCl 溶液滴定至溶液由黄色变为橙色即为终点 . 分别计算出每次的 HCl 溶液浓度并计算平均浓度 .
3. 混合溶液中各组份的含量测定
1 用电子天平准确称量约 7g 混合固体 , 加入适量饿水使之充分溶解 , 将溶解后的溶液全部转移到 250ml 的容量瓶中定容 , 充分摇匀 , 待用 .(一定要充分洗涤用语溶的玻璃棒和烧杯 , 以免增大误差
(2 用 25ml 的移液管平行移取 3组混合溶液于 3个 250ml 的锥形瓶中 (移液管一定先用蒸馏水洗三遍 , 再用混合溶液洗涤三次 , 然后分别向锥形瓶中加入 1~2滴酚酞指示剂 , 用标准 NaOH 溶液进行准确滴定 , 滴定终点时溶液颜色变化为 : 无色→ 淡红色 (半分钟内不褪色 , 记下三次滴定中的标准 NaOH 溶液的用量 , 再根据公式计算出各次的混合物中 NaH2PO4的含量 . 分别向锥形瓶中加入 1~2滴甲基橙指示剂 , 用标准 HCl 溶液进行准确标定,滴定终点时 , 溶液颜色变化为:黄色→ 橙色(滴定终点 pH= 4.0.记录下三次滴定中标准 HCl 溶液的用量 , 再根据公式计算出各次的混合物中 Na2HPO4的含量 .
[实验表格与数据记录 , 数据处理 ]
项目编号 1 2 3
M(KHC8H4O4 /g 0.4742 0 .4835 0.4718
VNaOH /ml 23.10 23.61 23.07
CNaOH /mol.l-1 0.1006 0.1004 0.1002
CNaOH(平均 /mol.l-1 0.1004
V(NaH2PO4-Na2HPO4/ml 25.00 25.00 25.00
VNaOH '' /ml 20.52 20.52 20.50
WNaH2PO4 37.57% 37.57% 37.53%
WNaH2PO4(平均 37.56%
相对偏差 d 0.0266% 0.0266% 0.0799%
平均相对偏差 d 0.0430%
M (NaCO3 /g 0.1625 0.1674 0.1607
VHCl. /ml 25.05 25.87 24.82
CHCl. /mol.l-1 0.1224 0.1221 0.1222
CHCl. (平均 /g o.1222
V NaH2PO4-Na2HPO4 25.00 25.00 25.00
VHCl. ' /ml 19.60 19.62 19.59
WNa2HPO4 51.68% 51.73% 51.63%
WNa2HPO4(平均 51.69%
相对偏差 d 0.0193% 0.0774% 0.0774%
平均相对偏差 d 0.0580%
M (NaOH = 2..o1 g VHCl.(浓 =4.5 ml M(混合物 = 6.5812 g
[问题与讨论 ]
因为本设计实验所检测的是一种缓冲溶液 , 固由于缓冲溶液的特性 , 其对酸或碱都具有一定的缓冲作用 , 造成滴定重点不易确定 . 而且在滴定过程 , 发现少量的
标准溶液再加入到已经变色的混合溶液中 , 颜色几乎不变 , 所以 , 是否可以断定缓冲溶液滴定的差范围会较大 ? 对于缓冲溶液是否存在更好的方法 , 来减小误差 ?。
