高考化学二轮复习 必考部分 专题四 常见有机物及其应用 第2讲 有机物的性质及其应用课件
2024届高三化学二轮复习+++有机物性质++课件

有机物性质
一、重要的物理性质 1.有机物的溶解性 (1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数 高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧 酸等。 (2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、 (酮)、羧酸及盐、氨基酸及盐、单糖、二糖。(它们都能与水形 成氢键)。
OHC-CHO + 4Cu(OH)2+2NaOH
NaOOC-COONa + 2Cu2O↓+ 5H2O
CH2OH(CHOH)4CHO + 2Cu(OH)2+2NaOH
CH2OH(CHOH)4COONa + Cu2O↓+ 3H2O
(6)定量关系: —COOH~½ Cu(OH)2~½ Cu2+ —CHO~2Cu(OH)2~Cu2O HCHO~4Cu(OH)2~2Cu2O
②苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇 等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分 层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳 浊液。苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的 钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液 还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于 闻到乙酸乙酯的香味。
易断裂
(Mr:88)
1.发生水解反应 生成羧酸和醇 2.也可发生醇解 反应生成新酯和 新醇
类 别
通式
官能团 代表物 分子结构结点 主要化学性质
硝
硝酸酯
酸 RONO2 酯
基— ONO2
不稳定
易爆炸
硝
基 化 合
R—NO2
硝基— NO2
高考化学必考知识点有机

高考化学必考知识点有机高考化学必考知识点:有机化学在高中化学学习中,有机化学是一个非常重要的部分,也是高考化学必考的内容之一。
有机化学主要研究有机物的性质、结构和合成,是现代化学研究的重要分支之一。
以下将介绍一些高考必考的有机化学知识点。
一、有机物的分类有机物是以碳为主要元素,由碳、氢和其他元素(如氧、氮、硫等)通过共价键连接而成的化合物。
根据有机物的结构特点,可以将其分为饱和碳氢化合物、不饱和碳氢化合物和含氧、氮、硫等其他元素的有机物。
1. 饱和碳氢化合物:其分子中只有碳碳单键和碳氢单键,没有碳碳双键或碳碳三键。
饱和碳氢化合物的通式为CnH2n+2,例如甲烷(CH4)和乙烷(C2H6)。
2. 不饱和碳氢化合物:其分子中含有碳碳双键或碳碳三键,不饱和碳氢化合物的通式为CnH2n或CnH2n-2,例如乙烯(C2H4)和丙烯(C3H6)。
3. 含氧、氮、硫等其他元素的有机物:除了碳、氢外,还包含其他元素的有机物。
常见的有机物有含氧的醇、醛、酮、酸、酯,含氮的胺、腈,含硫的硫醇、硫醚等。
二、有机化合物的命名有机化合物的命名是有机化学的基本技能之一,也是高考常考的内容。
有机化合物的命名涉及到结构、功能团和取代基等。
1. 结构命名:根据有机化合物分子结构的复杂程度,可以采用正规命名、临时命名、保留显性基团命名等方法。
2. 功能团和取代基命名:有机化合物中的功能团是指赋予有机分子特定性质和化学反应活性的基团,例如烯烃、醇、酮、酸等,而取代基则是指分子中取代了氢原子的基团,例如甲基(CH3)和乙基(C2H5)。
三、有机反应类型有机化学中存在多种反应类型,包括加成反应、消旋反应、取代反应、消除反应等。
下面将介绍一些常见的有机反应。
1. 加成反应:加成反应是指两种或两种以上的有机物分子相互结合生成较复杂的化合物。
常见的加成反应有羟基化反应、羰基化反应、卤代烷基化反应等。
2. 消旋反应:消旋反应是指光学活性物质由一个旋光异构体转化为另一个旋光异构体的反应。
高考化学考前13天常见有机物及其应用课件

常见有机物及其应用
01
核心速记
目录
02
易错剖析
03
自我检测
一、常见有机物的结构与性质
物质 甲烷 乙烯
苯
结构简式
特性或特征反应
CH4
与氯气在光照下产生取代反应(注意:甲烷与盐酸不 能产生取代反应)
①加成反应:使溴水褪色 CH2 CH2 ②加聚反应
③氧化反应:使酸性KMnO4溶液褪色
①加成反应 ②取代反应:与溴(溴化铁作催化剂)反应,与浓硝酸 (浓硫酸作催化剂)反应
【纠错训练1】下列有关说法正确的是( C )。
A.蔗糖、淀粉的水解产物相同 B.间二甲苯只有一种结构证明苯环没有单双键 C.蛋白质和麦芽糖都能产生取代反应 D.分子式为C5H12O且能与金属钠反应的有机物有6种
【解析】蔗糖的水解产物为果糖和葡萄糖,淀粉水解的最 终产物为葡萄糖,A项错误;邻二甲苯只有一种结构可证明苯 环不存在单双键,B项错误;蛋白质水解和麦芽糖水解产生的 都是取代反应,C项正确;C5H11OH有8种结构,D项错误。
饱和一元酯 (5)组合法
酯
,—R1有m种,—R2有n种,共有m×n种
(6)分类讨
论法
C5H12O2与氢氧化钠溶液反应,它可能是羧酸,还可能是酯类
一、常见易错点 1.误认为有机物均易燃烧。 如四氯化碳不易燃烧,而且是高效灭火剂。 2.误认为二氯甲烷有两种结构。 由于甲烷不是平面结构而是正四面体结构,故二氯甲烷只有一 种结构。 3.误认为碳原子数超过4的烃在常温常压下都是液体或固体。 新戊烷是例外,沸点为9.5 ℃,常温常压下为气体。
返回题目
2.化学与生活密切相关。下列说法正确的是( B )。
A.福尔马林可作食品保鲜剂 B.乙烯可作水果的催熟剂 C.等质量的葡萄糖和果糖在人体内完全氧化释放的能量相等 D.用于磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了 氨基酸
高考化学二轮复习 1312常见有机化合物的性质及应用课

2.等效氢法判断同分异构体数目 (1)同一碳原子上的H是等效的。 (2)同一碳原子上所连甲基上的H是等效的。 (3)处于镜面对称位置上的氢原子是等效的。 三、常见有机反应类型
1.取代反应:(1)烷烃的卤代;(2)苯的硝化;(3)酯化反 应;(4)酯类水解。
2.加成反应 3.加聚反应 4.氧化反应:(1)燃烧;(2)催化氧化;(3)酸性KMnO4的氧 化;(4)特征氧化(银镜反应)。
答案:B
3.(2014·天津卷)对如图两种化合物的结构或性质描述正确 的是( )
A.不是同分异构体 B.分子中共平面的碳原子数相同 C.均能与溴水反应 D.可用红外光谱区分,但不能用核磁共振氢谱区分
解析:二者分子式相同,结构不同,是同分异构体,A项 错误;左侧有机物具有苯环,右侧有机物没有苯环,二者分子 中共平面的碳原子数不同,B项错误;左侧有机物中含有酚羟 基,发生加成反应,C项正确;二者既可以用红外光谱区 分,也可以用核磁共振氢谱区分,D项错误。
答案:B
考向二 常见有机物的反应类型 【自主回顾】 1.(2014·福建卷)下列关于乙醇的说法不正确的是( ) A.可用纤维素的水解产物制取 B.可由乙烯通过加成反应制取 C.与乙醛互为同分异构体 D.通过取代反应可制取乙酸乙酯
考向一 常见有机物的结构和性质 【自主回顾】 1.(2014·四川卷)化学与生活密切相关。下列说法不正确的 是( ) A.乙烯可作水果的催熟剂 B.硅胶可作袋装食品的干燥剂 C.福尔马林可作食品的保鲜剂 D.氢氧化铝可作胃酸的中和剂
解析:乙烯具有催熟功效,A项正确;硅胶具有吸水性且 无毒,B项正确;福尔马林虽然具有防腐作用但有毒,不能作 为食品的保鲜剂,C项错误;Al(OH)3能中和胃酸,D项正确。
答案:C
高考化学考点解读——常见有机物的性质和应用
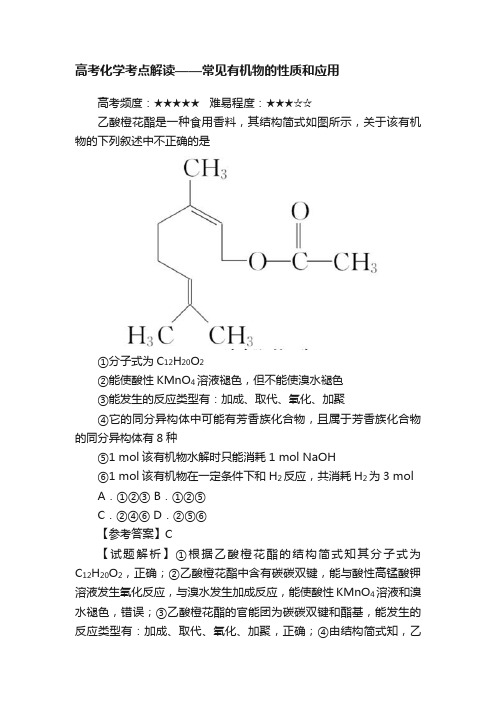
高考化学考点解读——常见有机物的性质和应用高考频度:★★★★★难易程度:★★★☆☆乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是①分子式为C12H20O2②能使酸性KMnO4溶液褪色,但不能使溴水褪色③能发生的反应类型有:加成、取代、氧化、加聚④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种⑤1 mol该有机物水解时只能消耗1 mol NaOH⑥1 mol该有机物在一定条件下和H2反应,共消耗H2为3 molA.①②③ B.①②⑤C.②④⑥ D.②⑤⑥【参考答案】C【试题解析】①根据乙酸橙花酯的结构简式知其分子式为C12H20O2,正确;②乙酸橙花酯中含有碳碳双键,能与酸性高锰酸钾溶液发生氧化反应,与溴水发生加成反应,能使酸性KMnO4溶液和溴水褪色,错误;③乙酸橙花酯的官能团为碳碳双键和酯基,能发生的反应类型有:加成、取代、氧化、加聚,正确;④由结构简式知,乙酸橙花酯的不饱和度为3,而苯环的不饱和度为4,故它的同分异构体不存在芳香族化合物,错误;⑤1 mol该有机物含有1 mol酯基,水解只能消耗1 mol NaOH,正确;⑥碳碳双键能与氢气加成,酯基中的碳氧双键不能与氢气加成,故1 mol该有机物在一定条件下和H2反应,共消耗H2为2 mol,错误,选C。
1.整合:常见有机代表物的性质物质结构简式特性或特征反应甲烷CH4与氯气在光照下发生取代反应乙烯CH2=CH2①加成反应:使溴水褪色②加聚反应③氧化反应:使酸性KMnO4溶液褪色苯①加成反应②取代反应:与溴(溴化铁作催化剂),与硝酸(浓硫酸催化)乙醇CH3CH2OH①与钠反应放出H2②催化氧化反应:生成乙醛③酯化反应:与酸反应生成酯乙酸CH3COOH①弱酸性,但酸性比碳酸强②酯化反应:与醇反应生成酯乙酸乙酯CH3COOCH2CH3可发生水解反应,在碱性条件下水解彻底油脂可发生水解反应,在碱性条件下水解彻底,被称为皂化反应淀粉(C6H10O5)n①遇碘变蓝色②在稀酸催化下,最终水解成葡萄糖③在酒曲酶的作用下,生成乙醇和CO2蛋白质含有肽键①水解反应生成氨基酸②两性③变性④颜色反应⑤灼烧产生特殊气味2.有机反应中的几个定量关系(1)在卤代反应中1 mol卤素单质取代1 mol H,同时生成1 mol HX。
高考化学: 有机物的性质、反应类型及应用

D.在催化剂存在下可以制得聚苯乙烯
1 2 3 4 5 6 7 8 9 10
解析
与氯化氢的反应是发生在碳碳双键上的加成反
应,产物是氯代苯乙烷,C项错误;
“铁粉”“液溴”是苯乙烯( 的条件,A项正确;
)在苯环上发生溴代反应
正确;
含有碳碳双键,能使酸性高锰酸钾溶液褪色,B项
4.有机反应类型归纳 反应类型
反应部位、反应试剂或条件
加成反应
与X2(混合即可反应);碳碳双键与H2、HBr、
H2O,以及
与H2的反应均需在一定条件下进行
加聚反应
单体中有
或—C≡C—等不饱和键
取 烃与卤
饱和烃与X2反应需光照
代 素单质 苯环上氢原子可与X2(催化剂)或HNO3(浓硫酸催化)发生
取代反应
1 2 3 4 5 6 7 8 9 10
5.(2020·全国卷Ⅲ,8)金丝桃苷是从中药材中提取的一种具有抗病毒作用 的黄酮类化合物,结构简式如右: 下列关于金丝桃苷的叙述,错误的是 A.可与氢气发生加成反应 B.分子含21个碳原子 C.能与乙酸发生酯化反应
√D.不能与金属钠反应
1 2 3 4 5 6 7 8 9 10
2.有机物的结构特点及主要化学性质
物质
结构特点
主要化学性质
甲 只有C—H键,正四面 烷 体分子
在光照条件下发生取代反应
平面分子,官能团是 乙 烃 烯
可与X2、H2、H2O、HX加成;能被酸性 KMnO4溶液或酸性K2Cr2O7溶液氧化;能 发生加聚反应
平面分子,碳碳键性 苯
在催化剂存在下:与X2、HNO3发生取代
C12H22O11+H2O―稀―H――2S―O→4 C6H12O6+C6H12O6
高二化学有机第二节 有机物的物理和化学性质
有机第二节有机物的物理和化学性质一、有机物的物理性质1、溶解性。
有机物一般都难溶于水,但如果含有亲水的基团,例如、、,将会导致有机物溶解性增强,而且亲水基所占比例越大,该有机物就越易溶于水。
2、密度:烃的密度都比水要。
3、熔沸点:直链烷烃碳原子数为气体,常温为气体的烷烃有种,烷烃如果连接了卤素,羟基等官能团,将会导致密度和熔沸点都增大。
二、有机物的化学性质知识点一:烃的化学通性----都可以燃烧----氧化反应(一)烃的燃烧及其计算1、烷烃在点燃条件可以燃烧,燃烧的通式为2.某气态烷烃20 mL,完全燃烧时,正好消耗同温同压下的氧气100 mL,该烃的化学式是()A.C2H6B.C3H8C.C4H10D.C5H12思考:在120O C下,将某烃充分燃烧后,恢复原温度和压强,气体体积不变则,如果该烃是烷烃则化学式为:如果该烃为烯烃,则化学式为:3.将a mol氢气和b mol乙烯混合,在一定条件下使它们部分反应生成c mol乙烷,将反应后的混合气体完全燃烧,消耗氧气的物质的量为()A.(3b+0.5a) mol B.(4b+0.5a) mol C.(3b+1.5a) mol D.无法判断重要题型4、某烃0.1mol,在氧气中完全燃烧,生成13.2g CO2、7.2gH2O,则该烃的分子式为5、某有机物A 3.0 g,完全燃烧后生成3.6 g水和3.36 L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为30,①求该有机物的分子式;6、0.94 g某有机物在纯氧中充分燃烧,可生成CO2 2.64 g,H2O 0.54 g,消耗O2 2.24 g。
又知此有机物的式量为氢气的47倍,求该有机物的分子式。
7、将乙烯和甲烷的混合气体完全燃烧时,所消耗的氧气的体积是混合气体体积的 2.4倍,则甲烷和乙烯的体积比是()A、1:2B、2:1C、2:3D、3:28、实验室测得乙烯和氧气混合气体密度是氢气的14.5倍, 可知其中乙烯的体积分数为()A.25%B.27.6%C.72.4%D.75%9、将0.2mol两种气态烃组成的混合气体完全燃烧,得到6.72LCO2(标准状况)和7.2g水,下列说法中正确的是()A、一定有甲烷B、一定有乙烯C、一定没有甲烷D、一定没有乙烯10、0.1mol两种气态烃组成的混合气体完全燃烧,得到0.16 mol CO2和3.6 g水。
2024年高考化学有机物知识点总结(二篇)
2024年高考化学有机物知识点总结一、有机物的基本概念和性质1. 有机物的定义:由碳和氢元素组成的化合物。
2. 有机物的性质:(1) 燃烧性:绝大多数有机物能燃烧,产生二氧化碳和水。
(2) 不良导电性:有机物大多是非导体。
(3) 溶解性:有机物既能溶解于有机溶剂,也能溶解于水。
二、有机物的分类1. 饱和和不饱和有机物:饱和有机物的碳原子给定的键数与其最大可能的键数相等,不饱和有机物的碳原子给定的键数少于最大可能的键数。
2. 脂肪族和芳香族:脂肪族有机物的分子中只包含单键,芳香族有机物中有一个或多个苯环。
3. 同分异构体:指相同分子式但结构不同的有机物。
4. 环状和链状有机物:根据分子结构的形状进行分类的有机物。
三、有机化合物的命名方法1. 碳原子链的编号:根据主链上第一个碳原子与它连接的官能团的位置进行编号。
2. 简并命名法:用群号来表示官能团的位置。
3. 交叉编号:用两个交叉的直线表示不知道位置的官能团。
四、有机物的官能团1. 烃:只含碳氢成键的有机物。
(1) 饱和烃:仅包含碳碳单键,如烷烃。
(2) 不饱和烃:含有碳碳双键或三键,如烯烃和炔烃。
2. 卤代烃:用卤素取代一个或几个氢原子的烃类。
3. 醇:以羟基作为官能团的有机化合物。
4. 酚:以苯环上的一个或多个氢原子被羟基取代的化合物。
5. 醛:以羰基作为官能团的有机化合物。
6. 酮:以羰基作为官能团,且羰基位置不在分子两端的有机化合物。
7. 酸:以羧基作为官能团的有机化合物。
五、有机反应与机构1. 叠氮化合物:苯胺与亚硝酸反应生成的产物。
2. 羧酸的衍生物:酸氯、酸酐、酯和酰胺。
3. 醇的衍生物:烷基卤化物、烯醇和烷基硫醚。
4. 醛和酮的衍生物:醇、酯和胺。
5. 脂肪酸的酯和脂肪酰卤代物。
六、合成有机物的方法1. 醇的合成:水合法和醇酸法。
2. 和酚的合成:合成酚的方法有加热脱水法、苯酚的加氢脱氧和脱碳方法、两酚的合成等。
3. 酮的合成:羰基化合物和羰基化合物的加氢还原、烯烃加氧化生成酮等方法。
高考化学二轮专题十三常见有机物及其应用
[考纲要求] 1.常见有机物的组成与结构:(1)能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
(2)了解有机化合物分子中基团的概念,了解官能团与性质的关系。
(3)了解同系物的概念,了解饱和烃和不饱和烃的概念。
(4)了解同分异构体的概念。
掌握简单烷烃的系统命名及同分异构体的书写。
(5)了解典型有机物的分子组成及结构特征。
2.常见有机物的性质与应用:(1)了解典型有机物的主要性质及其应用。
(2)从官能团变化的角度分析有机反响,掌握不同有机物之间的相互转化关系。
(3)了解反响条件对有机反响产物的影响。
了解有机反响的主要类型。
(4)了解化石燃料的主要成分,了解石油的分馏、裂化、裂解以及煤的气化、液化和干馏的主要原理及产物。
(5)了解有机物的平安使用,了解有机物对人类社会及生活的影响。
3.糖类、油脂、氨基酸和蛋白质:(1)了解葡萄糖的检验方法。
了解几种常见糖类物质的组成及相互关系。
(2)了解油脂的组成及主要性质。
了解皂化反响。
(3)了解蛋白质的组成和主要性质。
了解氨基酸的结构和主要性质。
(4)了解糖类、油脂、蛋白质在生活中的应用。
4.有机物的人工合成:(1)以乙烯制备乙酸乙酯为例,了解简单有机物合成路线的设计。
(2)了解高分子化合物的组成、结构特点及其应用,能依据简单高分子化合物的结构分析其链节和单体。
(3)了解加聚反响和缩聚反响,正确书写合成典型高分子化合物的反响式。
5.以上各局部知识的综合应用。
考点一有机物的结构与同分异构现象烷烃命名近几年高考中频频涉及有机物分子的结构,碳原子的成键特征及同分异构体数目的判断,题目难度一般较小。
复习时要注意以下几点:1.教材中典型有机物的分子结构特征,识记典型有机物的球棍模型、比例模型,会“分拆〞比对结构模板,“合成〞确定共线、共面原子数目。
(1)明确三类结构模板需要结合相关的几何知识进行分析:如不共线的任意三点可确定一个平面、一条直线与某平面有两个交点时,那么这条直线上的所有点都在该相应的平面内;同时要注意问题中的限定性词语(如最多、至少)。
2018年高考化学二轮专题复习课件:常见有机物及其应用 (共32张PPT)
②香味添加剂
判断下列描述的正误(正确的打“√”,错误的打“×”)。 1.乙醇不能发生取代反应 ( × )
解析:因不理解取代反应的实质而造成判断错误;乙醇
与乙酸的酯化反应是取代反应。 2.乙烯和苯都能使溴水褪色,褪色的原因相同 (× ) 解析:不清楚实验现象的本质原因造成判断错误;乙烯
与Br2发生加成反应而使溴水褪色;而苯能萃取溴水中的
3.结构呈正四面体的为 ① ,为平面形的为 ③、⑤ 。 4.能与水互溶的是 ⑥、⑦ ,不能溶于水且密度比水小 的液体为 ⑤、⑧ 。
5.能与Cl2在光照条件下发生取代反应的是 ①、② ,
⑤ 能与液溴在Fe催化作用发生取代反应的是 ③、⑤ 成反应的是 萃取褪色 。 。 ,能与H2发生加
6.能使溴水褪色的是 ③、⑤ ,原因分别是 加成反应 和
常见有机物及其应用
1.了解有机化合物中碳的成键特征。了解有机化合物的同 分异构现象。 2.了解甲烷、乙烯、苯等有机化合物的主要性质。 3.了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要 作用。 4.了解乙醇、乙酸的组成和主要性质及重要应用。 5.了解上述有机化合物发生反应的类型。 6.了解糖类、油脂、蛋白质的组成和主要性质及重要应用。 7.了解常见高分子材料的合成反应及重要应用。 8.以上各部分知识的综合应用。
7.生活中厨房里的两种有机物发生反应的化学方程式为
浓H2SO4 H3CH2OH+CH3COOH △
CH3COOCH2CH3+H2O ,
反应类型为 酯化反应,常用 饱和Na2CO3 溶液收集产物。
常见有机物的结构、性质与用途 有机物 结构简式 甲烷 CH4 主要性质 取代反应 ①加成反应 重要用途 燃料 合成高分子 化合物
乙烯
